一种与植物抗逆性相关蛋白及其编码基因GsCHX19与应用的制作方法
本发明属于生物技术领域,具体涉及一种与植物抗逆性相关蛋白及其编码基因GsCHX19与应用。
背景技术:
目前,土壤盐碱化严重制约我国东北地区乃至全国的农业生产、生态环境以及可持续发展,是我国乃至世界农业发展所面临的重大问题。据统计,全世界有1/3的土地是盐碱地,我国约有盐碱地9913万hm2,仅黑龙江省盐碱地面积就高达1740余万亩。随着经济的飞速发展和城市化进程的快速推进,优良耕地资源日益减少。为确保我国粮食安全,全国耕地面积必须保证在18亿亩以上,但耕地面积逐年减少,目前已逼近这一红线。因此,开发利用盐碱地越来越受到人们的重视。随着分子生物学的快速发展和基因工程技术的日臻成熟,通过转基因分子育种改良作物耐盐碱性、提高作物产量,已成为可能。然而,其实现的重要前提是挖掘耐盐碱关键调控基因。
技术实现要素:
本发明的一个目的是提供一种蛋白质。
本发明提供的蛋白质是如下a)或b)的蛋白质:
a)由序列表中序列2所示的氨基酸序列组成的蛋白质;
b)将序列表中序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的且与植物抗逆性相关的蛋白质。
本发明还提供了与上述蛋白质相关的生物材料,为下述B1)至B6)中的任一种:
B1)编码上述所述蛋白质的核酸分子;
B2)含有B1)所述核酸分子的表达盒;
B3)含有B1)所述核酸分子的重组载体、或含有B2)所述表达盒的重组载体;
B4)含有B1)所述核酸分子的重组质粒、或含有B2)所述表达盒的重组质粒;
B5)含有B1)所述核酸分子的重组菌、或含有B2)所述表达盒的重组菌、或含有B3)所述重组载体的重组菌;
B6)含有B1)所述核酸分子的转基因植物细胞系、或含有B2)所述表达盒的转基因植物细胞系、或含有B3)所述重组载体的转基因植物细胞系。
上述生物材料中,B1)所述核酸分子的核苷酸序列如序列表中序列1所示。
上述生物材料中,B6)所述转基因植物细胞系不包括繁殖材料。
本发明另一个目的是提供上述所述蛋白质或上述所述相关生物材料在提高植物抗逆性中的应用。
上述应用中,所述抗逆性为抗盐碱胁迫。
本发明最后一个目的是提供一种构建转基因植物的方法。
本发明提供的构建转基因植物的方法包括如下步骤:使上述所述蛋白质在出发植物中过表达,进而使植物的抗逆性提高。
上述方法中,所述使上述所述蛋白质在受体植物中过表达的方法为:向出发植物中导入上述所述蛋白质的编码基因,得到转基因植物;转基因植物与出发植物相比,抗逆性提高。
上述方法中,所述蛋白质的编码基因序列如序列表中序列1所示。
上述方法中,所述抗逆性为抗盐碱胁迫。
上述方法中,所述出发植物为单子叶植物或双子叶植物;所述双子叶植物具体为拟南芥。
本发明提供了一种与植物耐盐碱性相关蛋白及其编码基因GsCHX19与应用。本发明通过实验证明,本发明的蛋白具有提高植物抗逆性的功能,该蛋白在植物育种方面具有重要应用价值。
附图说明
图1为GsCHX19蛋白在植物细胞内的亚细胞定位分析。
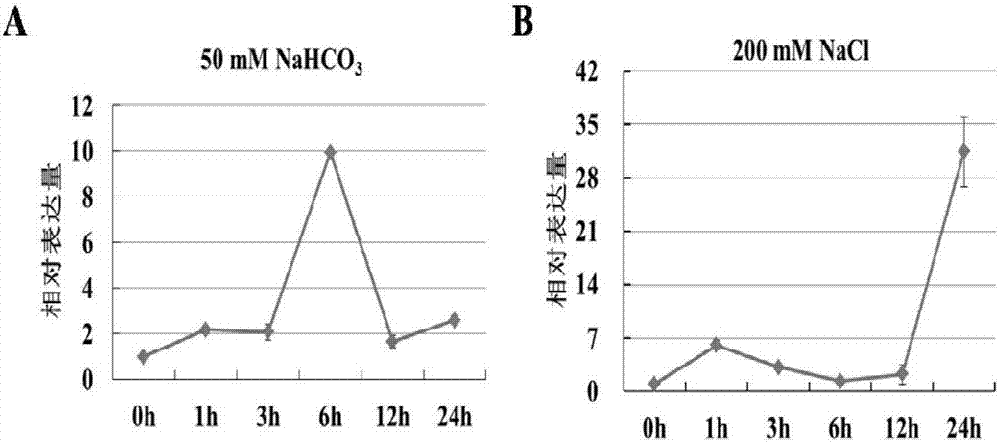
图2为GsCHX19基因在盐碱胁迫条件下的表达模式分析。图2A为碱胁迫表达模式;图2B为盐胁迫表达模式。
图3为转基因拟南芥与野生型拟南芥萌发期在盐胁迫下的生长情况比较。图3A为GsCHX19基因超量表达促进盐胁迫下种子的萌发;图3B为盐胁迫下种子的萌发率统计。其中,WT代表野生型植株;﹟2、﹟5和﹟6代表转基因拟南芥植株。
图4为转基因拟南芥与野生型拟南芥幼苗期在盐碱胁迫下的生长情况比较。图4A为GsCHX19基因超量表达增强幼苗期碱胁迫耐性;图4B为GsCHX19基因超量表达增强幼苗期盐胁迫耐性;图4C为碱胁迫下根长统计;图4D为盐胁迫下根长统计。其中,WT代表野生型植株;﹟2和﹟6代表转基因拟南芥植株。
图5为转基因拟南芥与野生型拟南芥成苗期在盐碱胁迫下的生长情况比较。其中,WT代表野生型植株;﹟2、﹟5和﹟6代表转基因拟南芥植株。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实验材料为野生大豆G07256种子,在文献“Mingzhe Sun,Xiaoli Sun,Yang Zhao,Hua Cai,Chaoyue Zhao,Wei Ji,Huizi DuanMu,Yang Yu,Yanming Zhu.Ectopic expression of GsPPCK3and SCMRP in Medicago sativa enhances plant alkaline stress tolerance and methionine content.PLOS ONE 20149(2):e89578”中公开过,公众可以从黑龙江八一农垦大学或东北农业大学获得。
pBSK-eGFP载体在文献“Xiaoli Sun,Wei Ji,Xiaodong Ding,Xi Bai,Hua Cai,Shanshan Yang,Xue Qian,Mingzhe Sun,Yanming Zhu.GsVAMP72,a novel Glycine soja R-SNARE protein,is involved in regulating plant salt tolerance and ABA sensitivity.Plant Cell Tiss Organ Cult 2013,113:199–215”中公开过,公众可以从黑龙江八一农垦大学或东北农业大学获得。
pCAMBIA330035Su载体在文献“Xiaoli Sun,Wei Ji,Xiaodong Ding,Xi Bai,Hua Cai,Shanshan Yang,Xue Qian,Mingzhe Sun,Yanming Zhu.GsVAMP72,a novel Glycine soja R-SNARE protein,is involved in regulating plant salt tolerance and ABA sensitivity.Plant Cell Tiss Organ Cult 2013,113:199–215”中公开过,公众可以从黑龙江八一农垦大学或东北农业大学获得。
实施例1、野生大豆中耐盐碱相关基因GsCHX19的获得
1、植物材料的处理
选取饱满的野生大豆G07256种子,用浓H2SO4处理10min,无菌水冲洗3~4次,25℃暗培养2-3d催芽。待芽长到1~2cm时,将其转移至1/4Hogland营养液中,置于人工气候箱中培养。
2、植物总RNA的提取
取3周龄野生大豆幼苗的根,采用RNAprep pure试剂盒(TIANGEN)提取总RNA。
3、cDNA第一链的合成
以OligodT为引物进行cDNA第一条链的合成,方法参见Invitrogen公司SuperScriptTMⅢReverse Transcriptase说明书。
4、目的基因GsCHX19的扩增
以野生大豆总cDNA为模板,采用GsCHX19-S和GsCHX19-AS引物PCR扩增目的基因GsCHX19。引物序列如下:
GsCHX19-S:5'-ATGATGGCGACGAGTAACAACGC-3';
GsCHX19-AS:5'-TTAACTCGTTGGTGTGTCTGGCATATC-3'。
将大小符合要求的目的基因电泳条带回收、克隆至pEASY-T载体,转化大肠杆菌DH5α(全式金,CD201-01)后送交测序,对测序结果进行DNAMAN分析。
实施例2、GsCHX19蛋白在植物细胞内的亚细胞定位分析
以野生大豆总cDNA为模板,采用F/R引物进行PCR扩增,得到GsCHX19基因,引物序列如下所示(下划线代表酶切位点):
F:5’-GTCATCGATATGATGGCGACGAGTAAC-3’;
R:5’-GGCTCTAGAACTCGTTGGTGTGTCTGG-3’。
用限制性内切酶ClaI和XbaI对GsCHX19基因和pBSK-eGFP载体进行双酶切,连接,构建GsCHX19-eGFP融合表达载体。通过PEG法将GsCHX19-eGFP融合表达载体转化拟南芥原生质体,通过激光共聚焦显微镜观察绿色荧光蛋白表达。
结果如图1所示,未转化GsCHX19-eGFP载体的原生质体细胞中没有观察到绿色荧光信号,而转化GsCHX19-eGFP载体的原生质体细胞中绿色荧光蛋白主要分布在细胞膜上,说明GsCHX19蛋白主要定位在细胞膜中。
实施例3、GsCHX19基因在盐碱胁迫条件下的表达模式分析
一、植物材料的处理
取3周龄的野生大豆幼苗,分别置于200mM NaCl(高盐胁迫)、50mM NaHCO3(pH8.5,模拟碱胁迫)条件下处理,分别取处理0h、1h、3h、6h、12h和24h后的根尖组织置于-80℃保存;同时取未处理0h、1h、3h、6h、12h和24h后的根尖组织作为对照。
二、野生大豆材料的cDNA的获得
取经上述不同方法处理后的野生大豆材料各约100mg,液氮研磨,用plant RNAprep Plant Kit(TIANGEN,cat no:DP402)试剂盒并参照试剂盒说明书提取RNA。采用反转录试剂盒SuperScriptTM III Reverse Transcriptase kit(Invitrogen,Carlsbad,CA,USA)反转录获得cDNA。
三、通过Real-time PCR对GsCHX19基因进行表达量检测
以上述获得的cDNA为模板,采用GsCHX19-F和GsCHX19-R引物序列,通过Real-time PCR对GsCHX19基因进行表达量检测。引物序列如下所示:
GsCHX19-F:5’-ACCCCTCAGACAACCCCG-3’;
GsCHX19-R:5’-TACGACGAATCGCACGCAT-3’。
Real-time PCR采用比较CT法(ΔΔCT)计算基因表达量,以野生大豆GAPDH基因为内参基因,以未经处理的样品作为对照。目标基因表达差异通过经过处理的样本相对于每个时间点未经处理的样本的倍数来表示。每个样品包括3次生物学重复和3次技术重复,数据取3次生物学重复的平均值,如果有一个数值的偏差比较大则取两个数据的平均值。原始数据经标准化处理。标准化处理后的数据经T-test进行差异显著性分析。相对表达量计算方法:2-ΔΔCT=2-(ΔCT处理-ΔCT对照)=2-[(CT处理目的基因-CT处理内参基因)-(CT对照目的基因-CT对照内参基因)]。内参基因引物序列如下所示:
GAPDH-F:5’-GACTGGTATGGCATTCCGTGT-3’;
GAPDH-R:5’-GCCCTCTGATTCCTCCTTGA-3’。
定量Real-time PCR结果表明:盐碱胁迫处理后,GsCHX19基因表达量呈上升趋势,并在碱胁迫处理6h、盐胁迫处理24h后达到顶峰(图2),表明GsCHX19基因的表达受盐、碱胁迫诱导。
实施例4、转基因拟南芥植株的获得及耐盐碱性分析
一、植物表达载体的构建及农杆菌的转化
1、以野生大豆RNA反转录的cDNA为模板,采用GsCHX19-F和GsCHX19-R引物PCR扩增GsCHX19基因的全长CDS区,得到GsCHX19基因。引物序列如下(下划线代表载体构建时所需的接头序列,其中U为USER酶切位点):
GsCHX19-F:5’-GGCTTAAUATGATGGCGACGAGTAAC-3’;
GsCHX19-R:5’-GGTTTAAUTTAACTCGTTGGTGTGTCTG-3’。
2、用限制性内切酶PacI和Nt.BbvCI对pCAMBIA330035Su载体进行酶切,将获得的载体酶切产物、USER酶(NEB,M5505S)和GsCHX19基因在37℃下孵育20min,利用USER酶对GsCHX19基因片段的尿嘧啶处进行切割,形成可与pCAMBIA330035Su载体双酶切后互补的粘性末端,得到的重组表达载体记作pCAMBIA330035Su-GsCHX19。将获得的重组表达载体pCAMBIA330035Su-GsCHX19在25℃下孵育20min,转化大肠杆菌感受态细胞DH5α(全式金,CD201-01),并送交测序。
测序结果表明:在pCAMBIA330035Su载体的两个PacI酶切位点之间插入了如序列表中序列1所示的GsCHX19基因。GsCHX19基因编码的蛋白的氨基酸序列如序列表中序列2所示。
采用冻融法,将pCAMBIA330035Su-GsCHX19载体转化至根癌农杆菌GV3101,获得重组农杆菌,并经PCR鉴定得到阳性转化子(含有序列表中序列1所示的GsCHX19基因的转化子),用于侵染拟南芥植株。
二、GsCHX19转基因拟南芥的获得及鉴定
将上述重组农杆菌通过Floral-dip法侵染野生型拟南芥(哥伦比亚生态型)。将T0代种子表面消毒后,播种于含25mg/L固杀草(glufosinate-ammonium,Sigma,45520)的1/2MS培养基上进行筛选。将T1代抗性苗移栽至营养钵中培养,提取基因组DNA,进行PCR鉴定。提取总RNA,采用半定量RT-PCR,以拟南芥ACTIN2基因为内参,分析GsCHX19基因在转基因植株中的表达量。将RT-PCR阳性的T1代转基因拟南芥单株收种子,并分别播种于含25mg/L固杀草的1/2MS培养基上进行筛选,观察T2代分离情况。如此重复,直至得到T3代转基因拟南芥纯合体株系。
三、GsCHX19转基因拟南芥耐盐碱性分析
选取饱满的野生型拟南芥、步骤二的T3代转基因拟南芥纯合体种子,用5%NaClO处理6-8min,灭菌ddH2O冲洗5-7次,4℃春化3d。一部分播种于正常的1/2MS培养基;一部分播种于含50mM、75mM、100mM和125mM NaCl的1/2MS培养基,22℃培养4d,观察拟南芥种子萌发状态。实验重复三次,每种处理各株系采用30株植株。结果如图3所示,盐胁迫严重抑制了野生型与转基因拟南芥种子的萌发,但GsCHX19转基因株系的种子萌发速率显著高于野生型(图3)。
选取饱满的野生型拟南芥、步骤二的T3代转基因拟南芥纯合体种子,用5%NaClO处理6-8min,灭菌ddH2O冲洗5-7次,4℃春化3d,播种于正常的1/2MS培养基,22℃培养11d。待拟南芥长至六叶期,将幼苗一部分移至正常的1/2MS培养基;一部分移至含85mM、100mM、115mM NaCl的1/2MS培养基;一部分移至含7mM、8mM、9mM NaHCO3的1/2MS培养基,竖直培养7d。实验重复三次,每种处理各株系采用30株植株。结果如图4A和图4B所示,盐、碱胁迫都严重抑制了野生型与转基因拟南芥根的伸长,但GsCHX19转基因株系的根长显著高于野生型(图4C和图4D)。
选取饱满的野生型拟南芥、步骤二的T3代拟南芥纯合体种子,春化后播种于营养钵中(营养土:君子兰土:蛭石1:1:1),置于人工气候培养箱中培养。选取长势一致的4周龄拟南芥植株,每3d浇灌1次150mM NaHCO3(pH 9.0)溶液进行盐碱胁迫处理,观察胁迫处理后植株长势。结果表明:盐碱胁迫处理后,野生型和转基因拟南芥都逐渐失绿变紫甚至死亡,但是转基因植株的长势明显优于野生型(图5)。
构建转空载体pCAMBIA330035Su的拟南芥,结果转空载体拟南芥的表型与野生型一致。
综合以上结果表明:GsCHX19基因超量表达显著提高了植物的盐、碱胁迫耐性。
- 还没有人留言评论。精彩留言会获得点赞!
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺