一种直接检测食源致病菌的高通量方法与流程
本发明涉及微生物检测领域,更具体地,本发明涉及基于16SrRNA和液相芯片的细菌高通量快检方法。
背景技术:
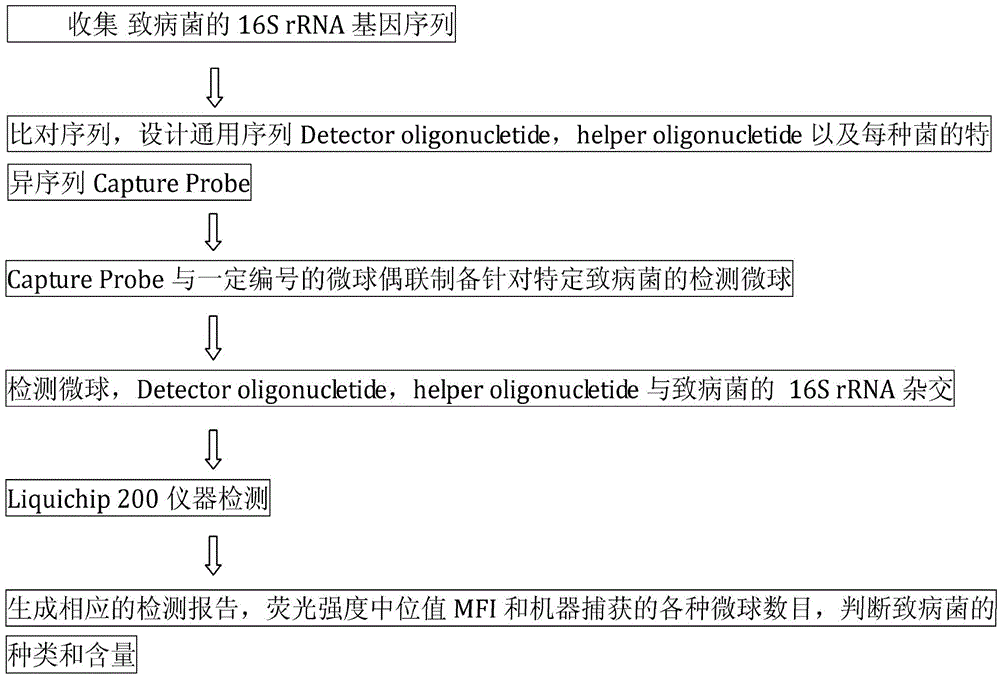
:目前,重大食品安全事件频发,引起人们的高度重视。要从根本上解决食品安全问题,就必须对食品的生产、加工、流通和销售等各环节实施全程管理和监控,这就需要大量能够满足这一要求的快速、方便、准确、灵敏的食品安全分析检测技术。随着科学技术的发展,食品安全快速分析检测方法在食品卫生检验方面的作用越来越重要。从长远发展来看,免疫学、分子生物学、计算机技术与自动化等学科的发展极大地推动了食品安全分析检测方法向更灵敏更便捷的方向发展,建立高效的食品安全快速分析检测方法,对食品生产、运输、销售过程中的质量控制具有十分重要的意义;同时一旦发生食源性致病微生物中毒事件,也需要在最短时间内完成检测以制定科学合理的治疗方案,赢得治疗时间。这些快速分析检测技术的推广应用,不仅是对传统的食品安全分析检测技术的一个改进和提高,也使食品质量安全有了进一步的保证,从而推动食品工业更加健康、快速地向前发展,不断满足人民提高健康水平的需要。目前现有的一些食源性致病菌快速检测技术大多是利用免疫学方法,该方法仪器操作简单、检测速度快、灵敏度较高、特异性较好且样品所需量少,但也存在着如致病菌单克隆抗体难以制备、使用多抗易产生交叉反应出现假阳性以及一次只能检测一种或几种致病菌等缺点和不足。因此,目前还需要开发可快速地、高效地检测致病菌的新技术。技术实现要素:本发明的目的在于提供基于16SrRNA或其PCR扩增产物和液相芯片的细菌高通量快检方法。在本发明的第一方面,提供一种细菌快速检测方法,所述方法包括:(1)以2-20种细菌的16SrRNA或其PCR扩增产物作为测定靶标,设计捕获探针和检测探针;所述的捕获探针是针对每种细菌的16SrRNA或其PCR扩增产物特异性的探针,且其分别附着于2-20种微球上;所述的检测探针是与各细菌的16SrRNA或其PCR扩增产物上共有序列互补的探针,且其包括一可检测标记物;所述的2-20种微球分别携带不同的微球识别信号;(2)将附着有特异性捕获探针的2-20种微球、检测探针以及经细胞裂解处理的待测样品混合;从而使待测样品中的特定细菌的16SrRNA或其PCR扩增产物,与该特定细菌相应的捕获探针和微球,以及检测探针形成“微球-捕获探针-特定细菌的16SrRNA或其PCR扩增产物-检测探针”复合物;(3)检测(2)形成的复合物中不同微球的微球识别信号以及可检测标记物,从而确定待测样品中各待测细菌的存在与否以及存在的量。在一个优选例中,所述方法用于鉴别16SrRNA或其PCR扩增产物序列不同的细菌。在另一优选例中,步骤(2)中,所述的待测样品仅进行细胞裂解处理,不包括PCR扩增或细胞增殖的步骤。在另一优选例中,步骤(1)中,还包括:针对各细菌16SrRNA或其PCR扩增产物上共有序列,设计辅助(Helper)序列,所述的辅助序列用于稳定打开的16SrRNA或其PCR扩增产物(在杂交过程中高温使16SrRNA或其PCR扩增产物变性,二级结构打开变为单链,此时helper与16SrRNA或其PCR扩增产物互补结合,起到稳定的作用),增强杂交检测信号。较佳地,所述的辅助序列的位置位于捕获探针和检测探针之间。在另一优选例中,检测探针的3’端连接可检测标记物;或捕获探针在5’端进行氨基修饰。在另一优选例中,所述的细菌是致病菌。在另一优选例中,作为测定靶标的致病菌包括:大肠杆菌(Escherichiacoli),小肠结肠炎耶尔森氏菌(Yersiniaenterocolitica),金黄色葡萄球菌(Staphylococcusaureus),蜡样芽孢杆菌(Bacilluscereus),单核细胞增生李斯特氏菌(Listeriamonocytogenes),志贺氏菌(Shigella),沙门氏菌(Salmonella),阪崎肠杆菌(Enterobactersakazakii),变形杆菌(Proteusvulgaris),副溶血弧菌(Vibrioparahaemolyticus),空肠弯曲菌(Campylobacterjejuni),创伤弧菌(Vibriovulnificus)的2种或2种以上。在另一优选例中,作为测定靶标的致病菌包括:大肠杆菌、志贺氏菌、沙门氏菌、阪崎肠杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、单核细胞增生李斯特氏菌、金黄色葡萄球菌、空肠弯曲菌、蜡样芽胞杆菌、创伤弧菌,针对各致病菌的捕获探针的序列依次是SEQIDNO:45~SEQIDNO:56,或其互补序列;检测探针的序列是SEQIDNO:57,或其互补序列;较佳地,还包括Helper序列SEQIDNO:58,或其互补序列。在另一优选例中,作为测定靶标的致病菌包括:大肠杆菌、小肠结肠炎耶尔森氏菌、金黄色葡萄球菌、蜡样芽孢杆菌、单核细胞增生李斯特氏菌,针对各致病菌的捕获探针的序列依次是SEQIDNO:59~SEQIDNO:63,或其互补序列;检测探针的序列是SEQIDNO:64和/或SEQIDNO:67,或其互补序列;较佳地,还包括Helper序列SEQIDNO:65和SEQIDNO:66,或其互补序列。在另一优选例中,作为测定靶标的致病菌包括:大肠杆菌、志贺氏菌、沙门氏菌、阪崎肠杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、创伤弧菌,针对各致病菌的捕获探针的序列依次是SEQIDNO:1~SEQIDNO:8,或其互补序列;检测探针的序列是SEQIDNO:9,或其互补序列;较佳地,还包括Helper序列SEQIDNO:10,或其互补序列。在另一优选例中,作为测定靶标的致病菌包括:阪崎肠杆菌、大肠杆菌及志贺氏菌、小肠结肠炎耶尔森氏菌、沙门氏菌、变形杆菌、副溶血弧菌、创伤弧菌,针对各致病菌的捕获探针的序列依次是SEQIDNO:68~SEQIDNO:74,或其互补序列;其中大肠杆菌与志贺氏菌共用捕获探针SEQIDNO:69,或其互补序列;检测探针的序列是SEQIDNO:75,或其互补序列。在另一优选例中,作为测定靶标的致病菌包括:大肠杆菌、志贺氏菌、沙门氏菌、阪崎肠杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、创伤弧菌,针对各致病菌的捕获探针的序列依次是SEQIDNO:11~SEQIDNO:18,或其互补序列;检测探针的序列是SEQIDNO:19,或其互补序列;较佳地,还包括Helper序列SEQIDNO:20,或其互补序列。在另一优选例中,作为测定靶标的致病菌包括:小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、单核细胞增生李斯特氏菌、金黄色葡萄球菌、空肠弯曲菌、蜡样芽胞杆菌、创伤弧菌,针对各致病菌的捕获探针的序列依次是SEQIDNO:21~SEQIDNO:28,或其互补序列;检测探针的序列是SEQIDNO:29,或其互补序列;较佳地,还包括Helper序列SEQIDNO:30,或其互补序列。在另一优选例中,作为测定靶标的致病菌包括:大肠杆菌、志贺氏菌、沙 门氏菌、阪崎肠杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、单核细胞增生李斯特氏菌、创伤弧菌、金黄色葡萄球菌、空肠弯曲菌、蜡样芽胞杆菌,针对各致病菌的捕获探针的序列依次是SEQIDNO:31~SEQIDNO:42,或其互补序列;检测探针的序列是SEQIDNO:43,或其互补序列;较佳地,还包括Helper序列SEQIDNO:44,或其互补序列。在另一优选例中,作为测定靶标的致病菌包括:单核细胞增生李斯特氏菌、蜡样芽胞杆菌、金黄色葡萄球菌、空肠弯曲菌,针对各致病菌的捕获探针的序列依次是SEQIDNO:78~SEQIDNO:81,或其互补序列;检测探针的序列是SEQIDNO:82~SEQIDNO:83,或其互补序列。在另一优选例中,当作为测定靶标的致病菌同时包括大肠杆菌和/或志贺氏菌及小肠结肠炎耶尔森氏菌时,还包括:采用SEQIDNO:77的捕获探针,或其互补序列;和SEQIDNO:76的检测探针,或其互补序列检测小肠结肠炎耶尔森氏菌,从而将小肠结肠炎耶尔森氏菌与大肠杆菌和/或志贺氏菌区分开。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述的致病菌包括:大肠杆菌、志贺氏菌、沙门氏菌、阪崎肠杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、单核细胞增生李斯特氏菌、金黄色葡萄球菌、空肠弯曲菌、蜡样芽胞杆菌、创伤弧菌;所述试剂盒中包括:针对各致病菌的捕获探针SEQIDNO:45~SEQIDNO:56,或其互补序列;检测探针SEQIDNO:57,或其互补序列;较佳地,还包括辅助序列SEQIDNO:58,或其互补序列。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述的致病菌包括:大肠杆菌、小肠结肠炎耶尔森氏菌、金黄色葡萄球菌、蜡样芽孢杆菌、单核细胞增生李斯特氏菌;所述试剂盒中包括:针对各致病菌的捕获探针SEQIDNO:59~SEQIDNO:63,或其互补序列;检测探针SEQIDNO:64和/或SEQIDNO:67,或其互补序列;较佳地,还包括辅助序列SEQIDNO:65和SEQIDNO:66,或其互补序列。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述的致病菌包括:大肠杆菌、志贺氏菌、沙门氏菌、阪崎肠杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、创伤弧菌;所述试剂盒中包括:针对各致病菌的捕获探针SEQIDNO:1~SEQIDNO:8,或其互补序列,检测探针SEQIDNO:9,或其互补序列;较佳地,还包括辅助序列SEQIDNO:10,或其互补序列。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述的致病菌包括:阪崎肠杆菌、大肠杆菌及志贺氏菌、小肠结肠炎耶尔森氏菌、沙门氏菌、 变形杆菌、副溶血弧菌、创伤弧菌;所述试剂盒中包括:针对各致病菌的捕获探针SEQIDNO:68~SEQIDNO:74,或其互补序列;检测探针SEQIDNO:75,或其互补序列。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述的致病菌包括:大肠杆菌、志贺氏菌、沙门氏菌、阪崎肠杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、创伤弧菌;所述试剂盒中包括:针对各致病菌的捕获探针SEQIDNO:11~SEQIDNO:18,或其互补序列;检测探针SEQIDNO:19,或其互补序列;较佳地,还包括辅助序列SEQIDNO:20,或其互补序列。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述的致病菌包括:小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、单核细胞增生李斯特氏菌、金黄色葡萄球菌、空肠弯曲菌、蜡样芽胞杆菌、创伤弧菌;所述试剂盒中包括:针对各致病菌的捕获探针SEQIDNO:21~SEQIDNO:28,或其互补序列;检测探针SEQIDNO:29,或其互补序列;较佳地,还包括辅助序列SEQIDNO:30,或其互补序列。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述的致病菌包括:大肠杆菌、志贺氏菌、沙门氏菌、阪崎肠杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、副溶血弧菌、单核细胞增生李斯特氏菌、创伤弧菌、金黄色葡萄球菌、空肠弯曲菌、蜡样芽胞杆菌;所述试剂盒中包括:针对各致病菌的捕获探针SEQIDNO:31~SEQIDNO:42,或其互补序列;检测探针的序列是SEQIDNO:43,或其互补序列;较佳地,还包括辅助序列SEQIDNO:44,或其互补序列。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述的致病菌包括:单核细胞增生李斯特氏菌、蜡样芽胞杆菌、金黄色葡萄球菌、空肠弯曲菌;所述试剂盒中包括:针对各致病菌的捕获探针SEQIDNO:78~SEQIDNO:81,或其互补序列;检测探针SEQIDNO:82、SEQIDNO:83,或其互补序列。在本发明的另一方面,提供用于检测致病菌的试剂盒,所述试剂盒中还包括:SEQIDNO:77的捕获探针,或其互补序列;,SEQIDNO:76的检测探针,或其互补序列;用于将小肠结肠炎耶尔森氏菌与大肠杆菌和/或志贺氏菌区分开。本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。附图说明图1、技术原理图。图2、探针设计以及本发明的方法的操作流程示意图。图3、检测方案设计示意图。图4、检测方案设计示意图。具体实施方式本发明人经过深入的研究,首次揭示了一种致病菌高通量快检技术,既不需要提取核酸,也无需PCR扩增,本发明的方法省略了传统分子生物学检测必须的PCR步骤,使检测变得更快、更简便、更合理,成本低廉。本发明人还基于所述的方法,优化了可同时检测多种菌株的探针套组,检测效果良好。这些探针而且可以作为16SrRNA基因扩增的PCR产物的特异性探针,亦可以取得良好的检测效果。如本文所用,“捕获探针”、“CaptureDNA”、“CaptureProbe”可互换使用,是指用于固定于微球上的、特异性结合一种细菌的16SrRNA或其PCR扩增产物而与该种细菌以外其它靶细菌的16SrRNA或其PCR扩增产物不发生结合的探针。如本文所用,“检测探针”、“DetectionDNA”、“Detectoroligonucletide”、“Detetor”可互换使用,是指与所有靶细菌的16SrRNA或其PCR扩增产物上共有序列互补的探针。如本文所用,所述的“微球识别信号”是指位于微球上的,用于区别不同的捕获探针的识别信号。为了方便起见,对于固定有同一种捕获探针的微球,微球识别信号优选是相同的。优选的,所述的微球识别信号是荧光信号,并且,对于固定有不同种捕获探针的微球,荧光的色彩是不同的,对于固定有同种捕获探针的微球,荧光的色彩优选是相同的。如本文所用,所述的“可检测标记物”是指与检测探针结合或耦联的、用于显示(或作为显示标志的)检测探针与相应的16SrRNA或其PCR扩增产物发生结合的信号。在本发明的优选方式中,所述的可检测标记物是生物素,该生物素作为显示标志,当与链霉菌亲和素偶联的藻红蛋白(链亲和素-藻红蛋白,又称为PE标记的链亲和素,SA-R-PE)结合后,通过激光激发产生荧光信号。如本文所用,所述的“靶细菌”是指作为测定靶标的细菌,例如一些食品中的致病菌。本发明的方法的检测原理如图1-2所示,基于多种作为测定靶标的细菌的16SrRNA或其PCR扩增产物的序列,设计捕获探针和检测探针;捕获探针是针对每种细菌的16SrRNA或其PCR扩增产物特异性的探针,且其分别附着于2-20种微球上;检测探针是与各细菌的16SrRNA或其PCR扩增产物上共有序列互补的探针,且其包括一可检测标记物;所述的2-20种微球分别携带不同的微球识别信号;将附着有特异性捕获探针的2-20种微球、检测探针以及经细胞裂解处理的待测样品混合;从而使待测样品中的特定细菌的16SrRNA或其PCR扩增产物,与该特定细菌相应的捕获探针和微球,以及检测探针形成“微球-捕获探针-特定细菌的16SrRNA或其PCR扩增产物-检测探针”复合物;检测形成的复合物中不同微球的微球识别信号以及可检测标记物,从而确定待测样品中各待测细菌的存在与否以及存在的量。本发明中,液相芯片系统中,包括具有不同微球识别信号的微球,也即微球识别信号的种类与靶细菌的种类相同或多余靶细菌的种类。所述的微球上固定有不同的捕获探针。本发明中,将捕获探针固定在微球上的详细操作程序可用常规方法,例如按照Luminex公司的产品说明书或网站:www.luminexcorp.com中所述的方法进行偶连,从而得到不同微球与相应捕获探针形成的耦连物。由于带有不同的微球识别信号,使不同微球之间可被区分。在本发明的优选方式中,所述的微球识别信号为荧光信号,并且,微球上的荧光信号因固定于微球上的相应的捕获探针的不同而不同。本发明所述的微球可以采用聚苯乙烯、聚氯乙烯、聚乙烯等材料制成的。 并且,所述的微球的平均直径为1-100μm;更优选的,所述的微球的平均直径为2-50μm,例如,所述的微球的平均直径为2-10μm。本发明还优化了针对多种致病菌的捕获探针和检测探针,以在检测多于一种致病菌时提高效率和准确性。本发明的技术优势是无需核酸提取、无需PCR扩增、高通量、快速地鉴定细菌,特别是一些食品中的常见致病菌的种类和相对数量。直接将得到的菌液煮沸处理后,上清与检测序列,偶联特异探针的微球做杂交后,即可上机检测。最后根据机器检测的信号值即可判断样本是否含有致病菌和致病菌含量的多少。本发明的方法同时还可以只检测活菌、不检测死菌。死菌体内的16SrRNA易被自身的核酸酶降解,理论上检测不到信号或信号值很弱。新鲜的活菌内有大量的16SrRNA,可以检测到很高的信号。在本发明的优选实施例中,针对常见的多种食源性致病菌:金黄色葡萄球菌、单核细胞增生李斯特氏菌、志贺氏菌、副溶血弧菌、蜡样芽胞杆菌、阪崎肠杆菌、空肠弯曲菌、沙门氏菌、致病性大肠杆菌群O157:H7、变形杆菌属、小肠结肠炎耶尔森氏菌以及创伤弧菌的快速检测技术。以这些致病菌为靶标物,以16SrRNA或其PCR扩增产物为靶基因,分别设计通用的检测序列及探针,将设计的探针与羧基化的聚苯乙烯微球偶联,通过一步法rRNA/DNA杂交,特异性地捕获致病菌16SrRNA片段,从而达到检测目标菌的目的。本发明的方法不但可以应用于食源性致病菌的检测,还可以用于环境检测,比如水源检测、企业生产环境、医院和学校等公共场合的卫生环境监测,以及人体微生态环境的研究等等。本发明的方法既具备了液相芯片的样本用量少、操作简单、快速、灵敏度高、灵活的个性化组装等优点,又克服了传统分子生物学检测必须的PCR步骤,使检测变得更快、更简便、更便宜、更合理。基于本发明的方法,针对所需测定的细菌种类所设计的捕获探针、检测探针(或还可包括Helper)可以被置于试剂盒中,制备成商品化的产品,便于人们进行精准、快速地细菌定性或定量分析。在试剂盒中,不同的捕获探针可以被连接或偶联于具有不同微球识别信号 的微球上。在试剂盒中,所述的检测探针可以连接有可检测标记物,例如生物素。本发明的试剂盒中还可包含使用说明书,说明所述试剂盒针对的细菌种类,以及指导人们按照正确的流程、条件、剂量来实施检测。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。I、材料和方法1、实验菌种创伤弧菌、大肠杆菌、沙门氏菌、蜡样芽孢杆菌、小肠结肠炎耶尔森氏菌、变形杆菌、阪崎肠杆菌、志贺氏菌、副溶血弧菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌和空肠弯曲菌属。表1、菌株信息2、实验试剂偶联探针用的微球:Bio-rad公司;LiquiChip200仪器校正微球:Qiagen公司;LiquiChip200仪器用的鞘液:Qiagen公司;Streptavidine-R-PE:Qiagen公司;0.02%Tween20(SigmaP9416),0.1%SDS(SigmaL4522),1×TE,pH8.0(SigmaT9285);检测缓冲液:5MTMAC(SigmaT3411),20%Sarkosyl溶液(SigmaL7414),1MTris-HCl,pH8.0(SigmaT3038),0.5MEDTA,pH8.0(Invitrogen15575-020);天根RNA提取试剂盒;DNAmarker:全士金Trans2KDNAMarker;培养细菌用的培养基:酵母提取物(LP0021)OXOID,蛋白胨(LP0042)OXOID,氯化钠10019318(分析纯)国药集团化学试剂有限公司;普通LB培养基(每100ml):酵母提取物0.5g,蛋白胨1.0g,氯化钠1.0g;加蒸馏水至体积100ml,121℃高压蒸汽灭菌20分钟。3%NaClLB培养基(每100ml):酵母提取物0.5g,蛋白胨1.0g,氯化钠3.0g,加蒸馏水至体积100ml,121℃高压蒸汽灭菌20分钟。3、实验仪器PCR扩增仪S1000:Bio-rad公司;LiquiChip200:Qiagen公司;凝胶成像系统:Bio-rad公司;NanoDrop1000Spectrophotometer。4、检测序列Detector和针对每种菌的特异探针Capture设计(理论设计)(1)从NCBInucleotide数据库下载特定菌属所有序列长度大于1000bp的16SrRNA基因。(2)进行多种菌和单个菌的序列比对多序列比对网址ClustalOmega(http://www.ebi.ac.uk/Tools/msa/clustalo/)(3)选定可能的保守序列,分析12种菌中的保守序列和可变序列。根据可变序列确定12种菌合适的探针区域。分析选定的探针序列在每种菌属中的保守率,最终确定探针序列。细菌的16SrRNA基因全长1500bp左右,本发明人经过大量分析,针对所需检测的各细菌的16SrRNA基因全序列设计获得了5个区域检测方案。每个区域包括几种菌通用的检测序列Detector和针对每种菌设计的特异探针Capture。设计的理论序列如表2-1,2-2,2-3,2-4,2-5所示。表2-1、区域1Detector,helper和Capture序列表2-2、区域2Detector,helper和Capture序列表2-3、区域3Detector,helper和Capture序列表2-4、区域4Detector,helper和Capture序列表2-5、区域5Detector和Capture序列5、细菌总RNA提取采用天根的细菌总RNA抽提试剂盒提取总RNA,验证探针检测的可行性。6、总RNA浓度检测使用NanoDrop1000Spectrophotometer对提取的部分菌株的总RNA的浓度和纯度进行鉴定。表3、部分菌株RNA定量表样品浓度(ng/ul)A260A280260/280致病性大肠杆菌O157:H748.981.2250.6431.9小肠结肠炎耶尔森氏菌290.857.2713.4942.08蜡样芽孢杆菌314.047.8513.8232.05金黄色葡萄球菌214.755.3692.622.057、设计探针序列、Detector,Helper序列合成部分菌种的探针序列,按照各个菌种的16SrRNA全长序列,合成检测各菌种的探针序列(表4),3’端氨基修饰后作为杂交探针,合成Detector序列,5’端生物素修饰后作为检测序列(表5)。所有序列交由生工生物(上海)有限公司合成。拿到探针后,按Bio-rad的微球偶联说明书进行了偶联实验。表4、设计探针序列注:表4中各探针与表2-5中设计的相应理论探针序列相应或碱基前后排列上略有差异,表4探针是表2-5中相应的理论设计的优化。表5、合成Detector,Helper序列名称序列(SEQIDNO:)Detector_H5’-(Biotin)-TTTTTTCGAGCTGACGACARCCATGCASCACCTGTCWC-3’(64)Helper+oligonucleotides5’-TTCACAACACGAGCTGACGACAGCCATGCAGCACCTGTCTC-3’(65)Helper-oligonucleotides5’-CTCACGACACGAGCTGACGACAACCATGCACCACCTGTCAC-3’(66)Detectoroligonucleotide-UD-10825’-(Biotin)-TTTTTTGGTTGCGCTCGTTGCGGGACTTAACCCAACAT-3’(67)注:表5中序列与表2-5中设计的理论序列基本处于一个区域内。Helper+oligonucleotides是在helper区域针对大肠、小肠结肠炎耶尔森氏菌探针设计的Helper序列;Helper-oligonucleotides是在helper区域针对蜡样、李斯特、金葡探针设计的Helper序列。Detectoroligonucleotide-UD-1082是针对大肠杆菌、小肠结肠炎耶尔森氏菌、蜡样、李斯特、金葡设计的通用检测序列。8、微球-探针偶联实验涡旋微球(微球的浓度为1.25×107个/mL)5min,将100μL微球转至1.5ml离心管中,避光,用0.1MMES洗涤微球。离心微球12000rpm,3min,弃上清,再用50μL0.1MMES重悬。将2μL100umol/L的一种探针试剂加入到每一个相应的微球(即不同编码的微球)悬浮液中。立即加入2.5μL10mg/mLEDC到每一个包含探针和微球的混合管中,涡旋10秒,室温下孵化混合液30分钟。第二次EDC的添加和孵化(步骤同上)。两次孵化分别加2.5μL0.1MMES溶解的EDC溶液(10mg/mL)至探针-微球的混合管中,涡旋10秒,孵化30分钟,在室温暗处放置。然后,用0.02%吐温20洗涤微球,加入1mL0.02%吐温20到每个偶联的微球的离心管中,涡旋10秒,以12000rpm离心3分钟,弃上清。加1mL0.1%SDS清洗,涡旋10秒,以12000rpm离心3分钟,弃上清。重新悬浮,用100μL1×TE涡旋5秒。避光4℃保存。如上述操作,将每一捕获探针与分别不同编号的微球进行偶联。II.实施例实施例1、5种探针的混合探针的特异性实验1、5种探针的特异性的检测合成了表4中致病性大肠杆菌O157:H7、小肠结肠炎耶尔森氏菌、单核细胞增生李斯特氏菌、金黄色葡萄球菌和蜡样芽胞杆菌探针的混合探针以及表5中的Detector、Helper序列。示意图如图3。利用表6的杂交体系进行杂交反应。表6、杂交体系微球混合体系(微球浓度:1.25×107/ml):500μL-30×N=M。30表示稀释倍数;N表示各种探针-微球溶液的体积(μL);M表示1×TE的体积(mol/L)。1×TE(10mMTris-HCl,pH=8.0,0.1mMEDTApH=8.0)的配制:1MTris-HClpH=8.0,1mL;0.5MEDTApH=8.0,0.2mL;用超纯水定容至100mL。菌液的处理方式(1)从-80℃冰箱取出甘油菌种,培养至OD600在0.6左右。收集800μL菌液到新的无RNase污染的1.5mlEP管中。(2)离心12000rpm,3min后弃上清,尽量吸尽上清,避免残留的培养基对后续实验的干扰。(3)每管菌液沉淀加600μL无RNase的水重悬沉淀,离心12000rpm,3min后弃上清,尽量吸尽上清。(4)每管沉淀加100ul无RNase的水重悬混匀,盖上盖子,做好相应标记。将管子放在浮漂上夹紧。(5)打开电磁炉,用锅装适量清水煮沸。待水开后,将夹住管子的浮漂放入锅中,沸水煮5-10min左右。(6)取出管子,离心12000rpm,3min后将上清转移到新的无Rnase污染的1.5mlEP管中,做好相应标记。放入-20℃或-80℃冰箱保存。杂交条件·50℃10min;·每管加1×S-PE10μL,混匀50℃孵育5min;·每管加120ul已预热至50℃的灭菌纯水,混匀,终止杂交;·上机检测。探针特异性的检测结果如表7。表7、探针特异性的检测结果(荧光强度中位值MFI)上述表7的结果可见:(1)金黄色葡萄球菌RNA可以被金葡探针捕获到信号。用酶裂解的菌液也可以捕获到信号。(2)蜡样芽孢杆菌RNA、菌液都可被蜡样探针捕获到信号。(3)小肠结肠炎耶尔森氏菌的RNA、菌液可以被耶尔森探针和大肠探针捕获到信号。(4)致病性大肠杆菌O157:H7的RNA、菌液可以被大肠探针、小肠结肠炎耶尔森氏菌探针捕获到信号。3、Helper对杂交信号的影响实验1、Helper影响的验证杂交体系如表8-1。表8-1、有Helper杂交体系无Helper杂交体系杂交条件如下:·50℃10min;·每管加1×S-PE10μL,混匀50℃孵育5min;·每管加120ul已预热至50℃的灭菌纯水,混匀,终止杂交;·上机检测。结果如表8-2。表8-2、Helper对杂交信号影响实验的结果(DetectorUD1082)结果显示,去掉Helper后,蜡样芽孢杆菌和小肠结肠炎耶尔森氏菌液的探针信号大约减少了一半,说明Helper对杂交信号的捕获具有显著的增强作用。4、不应用Helper时的改进在不需要Helper的前提下,改变Detector的位置,在原先是Helper的位置设计Detector,改为Detector_H。验证Detector,CaptureProbe与RNA或菌液直接一步杂交,是否检测到信号。示意图如图4。表9、杂交体系杂交条件:50℃10min;每管加1×S-PE10ul,混匀50℃孵育5min;每管加120ul已预热至50℃的灭菌纯水,混匀,终止杂交;上机检测。表10、不加Helper杂交时,部分菌株的检测结果(Detector采用Detector_H)从金黄色葡萄球菌和蜡样芽孢杆菌的RNA和菌液的检测结果看出,不加Helper的情况下,Detector,CaptureProbe与RNA或菌液直接一步杂交,可以检测到信号。实施例2、7种探针的混合探针的特异性实验1、7种探针的混合探针的特异性检测合成部分菌种的探针序列,按照已有菌种16SrRNA全长序列,合成以下菌种的探针序列,5’端氨基修饰后作为杂交探针,合成Detector_I-3T序列,3’端生物素修饰后作为检测序列。经过对大肠杆菌和志贺氏菌属各自不同菌株的16SrDNA全长序列分析,两种菌的16SrDNA完全一样,所以大肠杆菌和志贺氏菌属共用一种探针Ecoli_I。表11、捕获探针和通用Detector_I-3T序列信息注:表11合成的探针与表2-1设计的探针基本上是相同区域,是表2-1理论设计的优化。经过前面实验的验证,可以不加helper。1、探针特异性验证实验表12、杂交体系杂交条件:50℃10min;每管加1×S-PE10ul,混匀50℃孵育5min;每管加120ul已预热至50℃的灭菌纯水,混匀,终止杂交;上机检测。表13、部分菌株的检测结果以上结果表明:(1)大肠杆菌和志贺氏菌的共用探针Ecoli-I检测大肠杆菌和志贺氏菌的RNA和菌液时,信号都比较高,效果理想。(2)阪崎肠杆菌的探针E.sa-I检测阪崎肠杆菌的RNA和菌液时,信号都比较高,效果理想。(3)沙门氏菌的探针Salm-I检测沙门氏菌的RNA和菌液时,菌液信号可以,效果理想。(4)副溶血弧菌的探针VP-I检测副溶血弧菌的RNA和菌液时,信号都比较高,效果较理想。3、大肠杆菌探针对各种大肠杆菌菌株的通用性验证结果杂交体系和杂交条件的设置同前“1”。通用性验证结果如表14。表14大肠杆菌菌株处理菌液验证从14株大肠杆菌菌液的杂交信号来看,大肠杆菌探针可以检测到所有大肠菌液的信号。4、大肠杆菌探针对各种志贺氏菌株的通用性验证结果杂交体系和杂交条件的设置同前“1”。通用性验证结果如表15。表15、志贺氏菌株处理菌液验证从9株志贺氏菌液的杂交信号来看,大肠探针可以检测到所有志贺氏菌液的信号。5、副溶血弧菌,创伤弧菌及小肠结肠炎耶尔森氏菌处理菌液验证杂交体系和杂交条件的设置同前“1”。验证结果如表16。表16、副溶血弧菌,创伤弧菌及小肠结肠炎耶尔森氏菌处理菌液 验证从11株副溶血弧菌的杂交信号来看,11株副溶血弧菌都被副溶血弧菌的探针检测到信号。不过因为副溶血弧菌和创伤弧菌序列的同源性很高,所以副溶血弧菌菌液检测时,有的菌株中可能检测到弱的创伤探针的交叉信号。2株创伤弧菌的菌株都可以被创伤探针检测到信号。小肠耶尔森菌液的杂交信号来看,大肠探针的信号比耶尔森自身的探针信号强。两种探针都可以检测到耶尔森菌液的信号。所以当检测未知样品时,只有大肠探针有信号的样品可能是大肠杆菌或者志贺氏菌;如果有大肠探针和耶尔森探针的信号,可能是小肠耶尔森氏菌。6、沙门氏菌处理菌液通用性验证杂交体系和杂交条件的设置同前“1”。通用性验证结果如表17。表17、沙门氏菌处理菌液验证从13株沙门氏菌液的杂交结果来看,沙门氏菌探针可以特异性检测到沙门氏菌液的信号。7、本实施例中部分菌种的检测灵敏度实验采用表11的探针,表12的杂交体系和杂交条件,作为以下几组实验的共同实验方法。(1)以副溶血弧菌VP4F13来验证副溶探针的检测灵敏度副溶血弧菌VP4F13的RNA浓度经过测定为1514ng/μL。将此样品按照梯度稀释,当RNA浓度为4.73ng/μL时,可以检到信号。低于此浓度的样品,则可能检测不到信号。具体结果见表18。表18、副溶血弧菌检测灵敏度结果(2)以变形杆菌G1M1205来验证变形探针的检测灵敏度变形杆菌G1M1205的RNA浓度经过测定为1116ng/μl。将此样品按照梯度稀释,当RNA浓度为13.95ng/μl时,可以检到信号。低于此浓度的样品,则可能检测不到信号。具体结果见表19。表19、变形杆菌检测灵敏度结果(3)以大肠杆菌Ecoli35218来验证大肠探针的检测灵敏度大肠杆菌Ecoli35218的RNA浓度经过测定为1104.2ng/μL。将此样品按照梯度稀释,当RNA浓度为13.8ng/μL时,可以检到信号。低于此浓度的样品,则可能检测不到信号。具体结果见表20。表20、大肠杆菌检测灵敏度结果(4)以阪崎肠杆菌E.sa296来验证阪崎探针的检测灵敏度。阪崎肠杆菌E.sa296的RNA浓度经过测定为1273.04ng/μL。将此样品按照梯度稀释,当RNA浓度为31.83ng/μL时,可以检到信号。低于此浓度的样品,则可能检测不到信号。具体结果见表21。表21、阪崎肠杆菌检测灵敏度结果(5)以沙门氏菌21484来验证沙门探针的检测灵敏度沙门氏菌21484的RNA浓度经过测定为442ng/μL。将此样品按照梯度稀释,当RNA浓度为22.1ng/μL时,可以检到信号。低于此浓度的样品,则可能检测不到信号。具体结果见表22。表22沙门氏菌检测灵敏度结果(6)以创伤弧菌VV来验证创伤探针的检测灵敏度创伤弧菌VV的RNA浓度经过测定为438ng/μL。将此样品按照梯度稀释,当RNA浓度为21.9ng/μL时,可以检到信号。低于此浓度的样品,则可能检测不到信号。具体结果见表23。表23、创伤弧菌检测灵敏度结果8、进一步良好区分大肠杆菌和志贺氏菌的检测试剂在设计的探针表11中,大肠杆菌探针(与志贺氏菌共用)Ecoli_I在检测小肠结肠炎耶尔森氏菌菌液时,大肠杆菌探针Ecoli_I往往比小肠结肠炎耶尔森氏菌探针Yer_I的信号高。但是小肠结肠炎耶尔森氏菌探针Yer_I只会检测到小肠结肠炎耶尔森氏菌的信号。为了充分的区分大肠杆菌和小肠结肠炎耶尔森氏菌,本发明人又设计了一条针对小肠结肠炎耶尔森氏菌的检测探针和捕获探针,如表24。表24、小肠结肠炎耶尔森氏菌的检测detector和探针(1)小肠结肠炎耶尔森氏菌探针Yercapture特异性验证实验杂交体系如表25。表25小肠结肠炎耶尔森氏菌的杂交体系对于偶联小肠结肠炎耶尔森氏菌探针Yercapture的微球稀释到工作浓度后使用。取6μl偶联好探针的微球原液加94μlTE稀释后混匀,避光。杂交条件:;50℃10min;每管加1×S-PE10μl,混匀50℃孵育5min;每管加120μl已预热至50℃的灭菌纯水,混匀,终止杂交;上机检测。特异性验证结果如表26。表26、小肠结肠炎耶尔森氏菌探针Yercapture特异性验证结果Median样本耶尔森探针Yercapture小肠结肠炎耶尔森氏菌1742大肠杆菌O157CICC2153067.5空白10(2)小肠结肠炎耶尔森氏菌探针Yercapture排他性验证结果对各种大肠杆菌和志贺氏菌的菌株和小肠结肠炎耶尔森氏菌菌株共同检测,证明小肠结肠炎耶尔森氏菌的探针Yercapture可以特异的区分开大肠杆菌,志贺菌和小肠结肠炎耶尔森氏菌。按照表25的杂交体系和实验条件,对小肠结肠炎耶尔森氏菌探针Yercapture进行验证。结果如表27。表27、小肠结肠炎耶尔森氏菌探针Yercapture排他性验证结果对各种大肠杆菌和志贺氏菌的株菌和小肠结肠炎耶尔森氏菌菌株共同检测后,证明小肠结肠炎耶尔森氏菌的探针Yercapture可以特异的区分开大肠杆菌,志贺菌和小肠结肠炎耶尔森氏菌。所以当使用本试剂盒检测未知菌时,使用表37的探针和表38的杂交体系时。如果得到的样品信号是大肠杆菌探针Ecoli_I或者大肠杆菌探针Ecoli_I和小肠结肠炎耶尔森氏菌探针Yer_I的信号,可以把这样的样品再单独做一次小肠结肠炎耶尔森氏菌探针Yercapture的检测,根据表25小肠结肠炎耶尔森氏菌的杂交体系和杂交条件做一次验证。如果小肠结肠炎耶尔森氏菌探针Yercapture有信号,则可以肯定样品是小肠结肠炎耶尔森氏菌,如果小肠结肠炎耶尔森氏菌探针Yercapture没有信号,则说明该样品是大肠杆菌或者志贺氏菌。实施例3、针对4种菌的探针验证探针通用性和检测灵敏度合成以下4种菌的探针验证探针通用性和检测灵敏度。表28、4种菌探针和通用Detector通用Detector中Detector_II是单核细胞增生李斯特氏菌、蜡样芽胞杆菌和金黄色葡萄球菌这3种菌共用的Detector。Detector_H-3是空肠弯曲菌和实施例1中的表4中的单核细胞增生李斯特氏菌探针、金黄色葡萄球菌探针和蜡样芽胞杆菌探针通用的Detector。所以对于这4种菌:单核细胞增生李斯特氏菌、蜡样芽胞杆菌、金黄色葡萄球菌和空肠弯曲菌用4种探针和2种Detector:Detector_Ⅱ和Detector_H-3,同时杂交,达到检测4种菌的目的。1、4种探针的特异性验证实验4种菌的杂交体系如表29。表29、4种菌的杂交体系杂交条件如下:;50℃10min;每管加1×S-PE10ul,混匀50℃孵育5min;每管加120ul已预热至50℃的灭菌纯水,混匀,终止杂交;上机检测。4种菌探针特异性验证结果如表30。表30、4种菌探针特异性验证结果①对于挑选的2株金黄色葡萄球菌,金黄色葡萄球菌探针Sa_Ⅰ可以检测到较高的信号值,且与其它菌没有交叉,说明金黄色葡萄球菌探针Sa_Ⅰ特异性和排他性效果较好。②对于挑选的2株单核细胞增生李斯特氏菌,单核细胞增生李斯特氏菌的探针List_Ⅰ可以检测到较高的信号值,且与其它菌没有交叉,说明单核细胞增生李斯特氏菌的探针List_Ⅰ特异性和排他性效果较好。③对于蜡样芽胞杆菌,蜡样芽胞杆菌探针Bacc_Ⅰ可以检测到较高的信号值,且与其它菌没有交叉,说明蜡样芽胞杆菌探针Bacc_Ⅰ特异性和排他性效果较好。④对于3株空肠弯曲菌,空肠弯曲菌探针Cj可以检测到较高的信号值,且与其它菌没有交叉,说明空肠弯曲菌探针Cj特异性和排他性效果好。2、探针种内通用性验证实验(1)蜡样芽胞杆菌和空肠弯曲菌处理菌液验证结果蜡样芽胞杆菌和空肠弯曲菌处理菌液验证结果如表31。表31、蜡样芽胞杆菌和空肠弯曲菌处理菌液验证结果①从现有的3株空肠弯曲菌的杂交信号来看,空肠弯曲菌探针Cj可以检测到较高的信号值,且与其它菌没有交叉,说明空肠弯曲菌探针Cj特异性和排他性效果较好。②对于蜡样芽胞杆菌,蜡样芽胞杆菌探针Bacc_Ⅰ可以检测到较高的信号值,且与其它菌没有交叉,说明蜡样芽胞杆菌探针Bacc_Ⅰ特异性和排他性效果较好。(2)金黄色葡萄球菌处理菌液验证结果金黄色葡萄球菌处理菌液验证结果如表32所示。表32、金黄色葡萄球菌处理菌液验证结果从现有的11株金黄色葡萄球菌的杂交信号来看,金黄色葡萄球菌探针Sa- Ⅰ可以检测到较高的信号值,且与其它菌没有交叉,说明金黄色葡萄球菌探针Sa-Ⅰ特异性和排他性效果较好。(3)单核细胞增生李斯特氏菌处理菌液验证单核细胞增生李斯特氏菌处理菌液验证如表33所示。表33、单核细胞增生李斯特氏菌处理菌液验证从现有的10株单核细胞增生李斯特氏菌的杂交信号来看,单核细胞增生李斯特氏菌的探针List-Ⅰ可以检测到较高的信号值,且与其它菌没有交叉,说明单核细胞增生李斯特氏菌的探针List-Ⅰ特异性和排他性效果较好。3、部分菌种的探针检测灵敏度实验(1)空肠弯曲菌检测灵敏度实验以空肠弯曲菌Bb来验证空肠弯曲菌探针Cj的检测灵敏度。空肠弯曲菌Bb的RNA浓度经过测定为617ng/μL。将此样品按照梯度稀释,当RNA浓度为15.43ng/μL时,可以检到信号。 低于此浓度的样品,则可能检测不到信号。具体结果请见下表34。表34、空肠弯曲菌检测灵敏度结果(2)蜡样芽孢杆菌检测灵敏度实验以蜡样芽孢杆菌Bacc来验证蜡样芽孢杆菌探针Bacc-Ⅰ的检测灵敏度。蜡样芽孢杆菌Bacc的RNA浓度经过测定为516ng/μl。将此样品按照梯度稀释,当RNA浓度为25.8ng/μl时,可以检到信号。低于此浓度的样品,则可能检测不到信号。具体结果见表35。表35、蜡样芽孢杆菌检测灵敏度结果(3)金黄色葡萄球菌检测灵敏度实验以金黄色葡萄球菌SA29213来验证金黄色葡萄球菌探针Sa-Ⅰ的检测灵敏度。金黄色葡萄球菌SA29213的RNA浓度经过测定为1600ng/μL。将此样品按照梯度稀释,当RNA浓度为80ng/μL时,可以检到信号。低于此浓度的样品,则可能检测不到信号。具体结果见表36。表36、金黄色葡萄球菌检测灵敏度结果实施例4、对于实施例1、2、3中的探针和几种通用detector同时杂交探针和通用dector如表37。表37、探针和通用detector把上述11种探针和3种Detector同时杂交,检测未知菌,可以简化检测流程,省去单个杂交体系的分别配制。按照下述的实验方案来检验混合所有探针和Detector检测目标菌的效果如何。11种探针混合杂交体系如表38。表38、11种探针混合杂交体系Beadsmixture表示偶联了相应探针的微球混合液。微球混合体系(微球浓度:1.25×107/ml):500μL-30×N=M。30表示稀释倍数;N表示各种探针-微球溶液的体积(μL);M表示1×TE的体积(mol/L)。1×TE(10mMTris-HCl,pH=8.0,0.1mMEDTApH=8.0)的配制:1MTris-HClpH=8.0,1mL;0.5MEDTApH=8.0,0.2mL;用超纯水定容至100mL。杂交条件:50℃10min;每管加1×S-PE10μl,混匀50℃孵育5min;每管加120μl已预热至50℃的灭菌纯水,混匀,终止杂交;上机检测。11种混合探针特异性和排他性检测结果如表39。表39、11种混合探针特异性和排他性检测结果从混合所有可用的探针来看,12种待检的目标菌在混合所有探针的情况下,不会干扰目标菌的检测。并且所用的探针特异性很好,不会检测到其它杂菌。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1