一种Slit2D2-HSA重组蛋白及其在治疗脓毒症中的应用的制作方法
本发明涉及脓毒症治疗药物领域,尤其涉及融合蛋白Slit2D2-HSA在预防和/或治疗脓毒症药物中的应用。
背景技术:
脓毒症(sepsis)是指由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),其感染源包括细菌、真菌、病毒、寄生虫等。脓毒症也常常发生在有严重疾病的患者中,如严重烧伤、多发伤、外科手术后等患者。脓毒症按严重程度可分脓毒症、严重脓毒症(severe sepsis)和脓毒性休克(septic shock)。脓毒症发生率高,全球每年有超过1800万严重脓毒症病例,美国每年有75万例脓毒症患者,并且这一数字还以每年1.5%~8.0%的速度上升。脓毒症的病情凶险,病死率高,全球每天约14,000人死于其并发症,美国每年约21.5万人死亡。据国外流行病学调查显示,脓毒症的病死率已经超过心肌梗死,成为重症监护病房内非心脏病人死亡的主要原因。近年来,尽管抗感染治疗和器官功能支持技术取得了长足的进步,脓毒症的病死率仍高达30%~70%。脓毒症治疗花费高,医疗资源消耗大,严重影响人类的生活质量,已经对人类健康造成巨大威胁。
中性粒细胞在抵抗感染中具有重要作用,机体发生感染后,中性粒细胞会被快速从骨髓中动员和;募集到炎症部位,它可以释放包括蛋白水解酶、活性氧、细胞因子等物质,用于清除病原微生物,在该过程中如果反应过激则会造成机体损伤,严重情况下会引起组织器官功能损伤或衰亡,进而出现严重脓毒症(severe sepsis)或脓毒性休克(septic shock)。
神经迁移蛋白Slit是一种在进化上高度保守的分泌型细胞外基质糖蛋白,分子量约为200kD,对轴突生长和神经元迁移起导向作用,哺乳类动物中克隆到的Slit基因有三个,分别命名为Slit1,Slit2和Slit3,其结构由N端的胞外分泌信号肽,4个富含亮氨酸的重复序列(leucine-rich repeat,LRRs),也被命名为D1-D4结构域,多个EGF(epidermal growth factor)样的重复序列(在果蝇中是7个,在脊椎动物中是9个),一个laminin G样结构域和一个富含半胱氨酸的C端结构域组成,其中以Slit2最为重要。Robo蛋白家族是Slit的受体家族,是一种单通道的跨膜受体,Slit蛋白通过结合受体Robo发挥功能,LRRs是Slit蛋白和受体Robo的结合区域。目前已有文献表明,Slit2蛋白可能会抑制中性粒细胞的迁移。
研究发现Slit蛋白在血管生成、肿瘤细胞迁移、白细胞趋化等方面发挥重要作用,美国专利US8399404B2使用Slit蛋白和核酸用于治疗血小板凝血和其他相应障碍,并公开了一种使用Slit蛋白包衣的血管装置和可表达Slit蛋白的细胞。专利WO2009105457公开了一种癌症诊断、研究和治疗的方法和组合物,涉及以Slit2蛋白作为肿瘤标记物有效用作诊断标记物和前列腺癌的临床目标。
Tole等通过研究发现Slit2蛋白通过抑制趋化因子引起的肌动蛋白刺端形成和细胞极化来抑制中性粒细胞的迁移(The axonal repellent,Slit2,inhibits directional migration of circulating neutrophils.J Leukoc Biol.2009,86(6):1403-15)。
Hohenester发现Slit与其受体Robo相结合是通过前者的D2域与后者的IG1的结合实现的(Structural insight into Slit-Robo signaling.Biochemical Society Transactions.2008,36:251-256),因此D2域对Slit蛋白发挥其生理活性非常重要。
中国专利CN201310150884.4利用基因重组技术制备了一种Slit2蛋白的D1-2序列的融合蛋白,该融合蛋白有助于LRR正确折叠,形成有活性的功能多肽,用于Slit2蛋白的研究和应用。
分子量小于20kD的蛋白类的药物在代谢过程中易被肾小球滤过,导致其体内半衰期较短,为了达到治疗效果,往往需要频繁或大剂量给药,给患者带来极大的不便。人血清白蛋白(HSA)是一个稳定的“惰性”蛋白,在正常生理状况下不易透过肾小球,在血清中的半衰期达14-21天,可以作为一种载体与血液中的其他因子,包括生物活性蛋白结合,从而保持或延长其他因子在体内的生物活性。将一些小分子肽或蛋白质药物与HSA进行融合是改进小分子肽或蛋白质药物半衰期的有效方法。与其他方法相比,构建长效白蛋白融合蛋白药物可以避免复杂的化学修饰和处理过程,因而具有容易操作和更好的经济性优势。
因此,为克服现有技术的缺陷,本发明提供一种预防和/或治疗脓毒症的融合蛋白及其应用。
技术实现要素:
本发明的一个目的是提供一种预防和/或治疗脓毒症的融合蛋白,解决了现有生物药物分子量大、半衰期短、不利于药物开发的缺陷。
本发明的另一目的是提供一种预防和/或治疗脓毒症的药物,具有良好的治疗效果,能够提高患者的存活率。
因此,本发明的第一方面提供了一种融合蛋白,由Slit2蛋白D2结构域和HSA蛋白融合形成。
本发明所述的Slit2蛋白D2结构域,简称Slit2D2,具有:
a)如SEQ ID No:1所示的氨基酸序列,或
b)将a)经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由其衍生的氨基酸序列;
本发明所述的HSA蛋白具有:
c)如SEQ ID NO:2所示的氨基酸序列,或
d)将c)经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由其衍生的氨基酸序列。
优选的,所述的融合蛋白中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超10个氨基酸残基的取代和/或缺失和/或添加。
本发明所述的Slit2蛋白D2结构域通过C末端与HSA蛋白的N末端直接连接,或Slit2蛋白D2结构域通过其N末端与HSA蛋白的C末端直接连接,即Slit2蛋白D2结构域与HSA蛋白直接连接,中间没有任何连接肽。
本发明所述的融合蛋白Slit2D2-HSA的氨基酸序列如SEQ ID NO:3所示,或者,是将SEQ ID NO:3所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由其衍生的氨基酸序列。
本发明还提供一种编码所述的融合蛋白Slit2D2-HSA的基因,其中所述的Slit2蛋白D2结构域的基因序列如SEQ ID NO:4所示,所述的HSA蛋白的基因序列如SEQ ID NO:5所示,所述的融合蛋白Slit2D2-HSA的基因序列如SEQ ID NO:6所示。
或者,在严格条件下与SEQ ID NO:6所示的序列杂交且编码具有预防和/或治疗脓毒症功能的相关蛋白的DNA分子;或者,与SEQ ID NO:6所示的序列具有至少90%以上,优选为95%以上,更优选为98%以上同源性且编码具有预防和/或治疗脓毒症功能的相关蛋白的DNA分子。
本发明还提供了一种与融合蛋白Slit2D2-HSA相关的生物材料,包括含有本发明所述融合蛋白Slit2D2-HSA编码基因的重组载体、表达盒、重组细胞、重组菌、重组病毒。优选的,本发明所述的重组载体为重组表达载体或重组克隆载体。
本发明所述的融合蛋白可人工合成,也可先合成其编码基因,再进行生物表达得到。
本发明的第二方面是提供一种融合蛋白的制备方法,其具体步骤包括:
(1)重组载体的构建;
(2)转化体的制备和发酵;
(3)融合蛋白的分离和纯化;
任选的,(4)融合蛋白的鉴定。
所述的步骤(1)包括以下具体步骤:
通过全基因合成得到slit2D2的基因片段,以其为模板,通过引物T62F(序列为SEQ ID NO:7)和T62R(序列为SEQ ID NO:8)PCR扩增,得到如SEQ ID No:4所示的Slit2D2基因序列,长度为674bp;
通过全基因合成得到HSA的基因片段,以其为模板,通过引物T60F3(序列为SEQ ID NO:9)和T59R(序列为SEQ ID NO:10)PCR扩增,得到如SEQ ID No:5所示的HSA基因序列,长度为1783bp;
纯化回收PCR扩增得到的如SEQ ID No:4所示的Slit2D2基因序列和如SEQ ID No:5所示的HSA基因序列;
将含CMV启动子的载体质粒用限制性内切酶BssH II、EcoR I双酶切后,与纯化回收后的Slit2D2基因、HSA基因利用一步定向克隆试剂盒进行无缝连接反应;
将连接得到的重组载体转化到第一宿主细胞后转种到含有氨苄青霉素(AMP)的固体培养基中进行繁殖、筛选阳性克隆、通过测序确认载体构建成功并保种;
所述的载体质粒为pZD质粒;
所述的第一宿主细胞包括但不限于大肠杆菌菌株;
所述的步骤(2)包括以下具体步骤:
在第一宿主细胞中提取重组载体;
培养第二宿主细胞,当细胞密度达到2.5×106细胞/毫升时转染已提取的重组载体,成功转染目标基因的第二宿主细胞为转化体,筛选转化体,进行转化体的发酵,5天后收集上清;
所述的重组载体为质粒pZD-Slit2D2-HSA;
所述的第二宿主细胞包括但不限于EXPI293细胞。
所述的步骤(3)包括以下具体步骤:
取步骤(2)收集的培养液上清,高速离心,分离并纯化Slit2D2-HSA融合蛋白;
所述的纯化为通过离子交换层析纯化蛋白。
所述的步骤(4)包括以下具体步骤:
鉴定融合蛋白的分子量、纯度和生物活性。
所述的融合蛋白的分子量鉴定可以通过一般的蛋白生化手段检测,包括但不限于:SDS-PAGE、Western blotting、质谱MS等。
所述融合蛋白的纯度通过SEC-HPLC检测蛋白。
所述融合蛋白的生物活性通过测定融合蛋白对受体Robo1的亲和力来评估。
所述的融合蛋白对受体Robo1的亲和力通过表面等离子体共振技术(SPR)测定。
本发明的第三方面提供了一种药物组合物,包括由Slit2蛋白D2结构域和HSA蛋白融合形成的融合蛋白Slit2D2-HSA,以及药学上可接受的辅料。
本发明所述的药物组合物可以为片剂(包括糖衣片剂,膜包衣片剂,舌下片剂,口腔崩解片,口腔片剂等等),丸剂,粉剂,颗粒剂,胶囊剂(包括软胶囊,微胶囊),锭剂,糖浆剂,液体,乳剂,混悬剂,控制释放制剂(例如,瞬时释放制剂,缓释制剂,缓释微囊),气雾剂,膜剂(例如,口服崩解膜剂,口腔粘膜-粘附膜剂),注射剂(例如,皮下注射,静脉注射,肌内注射,腹膜内注射),静脉滴注剂,透皮吸收制剂,软膏剂,洗剂,粘附制剂,栓剂(例如,直肠栓剂,阴道栓剂),小药丸,鼻制剂,肺制剂(吸入剂),眼睛滴剂等等,口服或胃肠外制剂(例如,静脉内,肌内,皮下,器官内,鼻内,皮内,滴注,脑内,直肠内等给药形式,给药至肿瘤的附近和直接给药至病变处)。优选的,所述的药物组合物为注射剂。
本发明所述的药学上可接受的辅料优选为药学上可接受的注射剂辅料,例如等渗的无菌盐溶液(磷酸二氢钠、磷酸氢二钠、氯化钠、氯化钾、氯化钙、氯化镁等,或上述盐的混合物),或干燥的例如是冷冻干燥的组合物,其适当地通过加入无菌水或生理盐水形成可注射溶质。
本发明第四方面提供一种由Slit2蛋白D2结构域和HSA蛋白融合形成的融合蛋白Slit2D2-HSA在预防和/或治疗脓毒症中的应用。
本发明第五方面提供一种由Slit2蛋白D2结构域和HSA蛋白融合形成的融合蛋白Slit2D2-HSA在制备预防和/或治疗脓毒症药物中的应用。所述的脓毒症可以为重症脓毒症、脓毒症休克。
本发明中术语“结构域”是指是生物大分子中具有特异结构和独立功能的区域,例如Slit2蛋白D2结构域是指Slit2蛋白中4个富含亮氨酸的重复序列中的第二结构域。
本发明中术语“预防”或“治疗”包括治疗性或预防性处理或措施,目标是预防或减慢靶向的病理性状况或病症。如果根据本发明的方法接收治疗量的本发明所述融合蛋白后,对象表现出可观察和/或可测量的特定疾病一个或多个体征和症状的减少或消失,则该对象被成功“预防”或“治疗”。
本发明采用基因工程手段,将Slit2的第二个亮氨酸重复序列Slit2D2多肽与HSA融合,得到融合蛋白Slit2D2-HSA,在保持Slit2抑制中性粒细胞迁移、治疗脓毒症的药理活性的基础上,可增加其在体内的稳定性,延长半衰期,提高其对脓毒症的治疗效果;本发明使用的Slit2D2多肽与Slit2蛋白相比,分子量小,在制备时易于纯化和分离,更容易用于药物的开发;本发明提供的融合蛋白Slit2D2-HSA具有较高的针对脓毒症的治疗效果,在小鼠CLP模型中,高剂量组动物存活率可达到90%。
附图说明
图1:含有融合蛋白Slit2D2-HSA的重组质粒pZD-Slit2D2-HSA图谱;
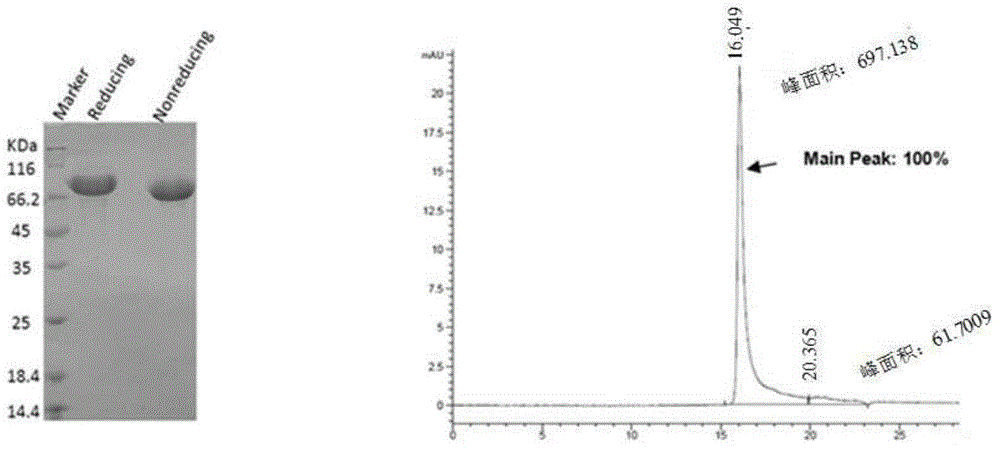
图2:融合蛋白Slit2D2-HSA表达鉴定结果图;左图为融合蛋白Slit2D2-HSA的12%SDS-PAGE电泳图;右图为融合蛋白Slit2D2-HSA的SEC-HPLC谱图,谱图中从左到右计,左峰的保留时间和峰面积分别为16.049,697.138;右峰的保留时间和峰面积分别为20.365,61.7009;G3000swxl凝胶色谱柱;流速为0.5ml/min;时间为40min;检测器为UV280;
图3:融合蛋白Slit2D2-HSA抑制大鼠中性粒细胞迁移体外实验结果;
图4:融合蛋白Slit2D2-HSA抑制LPS诱导的大鼠急性肺损伤的细胞迁移实验结果;A为细胞总数的结果;B为嗜酸性粒细胞(EOS)、巨噬细胞(Mac)、中性粒细胞(Neu)和淋巴细胞(Lym)数量的结果,图B中每组结果从左至右分别为正常对照组、溶剂组、地塞米松组、融合蛋白Slit2D2-HAS 1mg/kg、融合蛋白Slit2D2-HAS 5mg/kg;
图5:融合蛋白Slit2D2-HSA的CLP脓毒症模型药效检测结果,**表示与G2:CLP+溶剂组相比p<0.01(wilcoxon检验);
图6:融合蛋白Slit2D2-HSA的安全性评价结果。
具体实施方式
以下所提供的实施例,可以更详细地解释本发明内容。但是,本发明的内容并不限于以下实施例所阐述的内容。
实施例1融合蛋白Slit2D2-HSA的制备
根据已知的Slit2序列[GenBank:EAW92793.1]分析设计构建Slit2的第二个结构域Slit2D2(Hohenester2008)和HSA的融合表达载体。
通过全基因合成得到slit2D2的基因片段,以其为模板,通过引物T62F(序列为SEQ ID NO:7)和T62R(序列为SEQ ID NO:8)PCR扩增,得到如SEQ ID No:4所示的Slit2D2基因序列,长度为674bp;
通过全基因合成得到HSA的基因片段,以其为模板,通过引物T60F3(序列为SEQ ID NO:9)和T59R(序列为SEQ ID NO:10)PCR扩增,得到如SEQ ID No:5所示的HSA基因序列,长度为1783bp;
纯化回收PCR扩增得到的如SEQ ID No:4所示的Slit2D2基因序列和如SEQ ID No:5所示的HSA基因序列;
将包含CMV启动子的载体质粒pZD用限制性内切酶BssHII、EcoRI双酶切后,与纯化回收后的Slit2D2基因片段、HSA基因片段利用一步定向克隆试剂盒进行无缝连接反应。将重组载体转化到大肠杆菌TOP10后转种到含有氨苄青霉素(AMP)的固体培养基中进行繁殖、筛选阳性克隆、通过测序确认载体构建成功及保种。
用无内毒素质粒提取试剂盒提取大肠杆菌TOP10中的重组质粒,用于转染EXPI293细胞使用。培养EXPI293细胞,当细胞密度达到2.5×106细胞/毫升时进行重组质粒的转染,转染后培养5天,收集上清,高速离心,通过利用HiTrap Q HP强阴离子柱纯化SlitD2-HSA融合蛋白,并通过SDS-PAGE方法检测融合蛋白的分子量,通过SEC-HPLC检测融合蛋白纯度。
其中,SDS-PAGE结果和SEC-HPLC谱图如图2所示。由图2可知,已成功构建表达融合蛋白Slit2D2-HSA的重组表达载体,并实现了在宿主细胞中表达和纯化融合蛋白Slit2D2-HSA。
实施例2通过SPR测定融合蛋白Slit2D2-HSA对靶蛋白Robo1的亲和力
利用SPR(Surface Plasmon resonance BIAcore200)方法检测制备的蛋白与Robo1蛋白之间的亲和常数,将Robo1(ORIGEN公司,货号:TP327713)蛋白结合在CM5芯片上,分析融合蛋白Slit2D2-HSA和受体蛋白Robo1之间的相互作用。根据Canziani等人的方案(2004,Anal.Biochem.325:301-307)进行动力学测量。同时也用相同方法测定Slit2N蛋白(Slit2N为slit2蛋白N端的分子量约为120KDa的蛋白)与Robo1蛋白的亲和力。结果如下表所示。
表1 SPR测定融合蛋白Slit2D2-HSA与受体Robo1的亲和力的结果
实验结果表明,设计构建的融合蛋白Slit2D2-HSA与受体Robo1蛋白具有较好的亲和能力,该能力与Slit2N蛋白具有相近的特性。
实施例3融合蛋白Slit2D2-HSA抑制大鼠中性粒细胞迁移体外实验
提取大鼠中性粒细胞
取16ml新鲜大鼠抗凝血,与16ml组织稀释液混合,然后每2ml上述混合液加在一个10ml EP管中,该EP管中已含有2ml中性粒细胞提取试剂盒A液。500g离心25min,使细胞分层。弃去第一和第二层细胞,收集第三和第四层细胞,放入含10ml细胞洗涤液的试管中,混匀,500g离心30min。弃上清,加入3-5倍细胞体积的红细胞裂解液,混匀,裂解1-2min。500g离心5min,弃上清。重复裂解一次。洗涤1-2次:加入适量PBS溶液重悬沉淀,500g离心3min,弃上清。用1640完全培养基重悬沉淀,加入到6cm皿中,成功提取出大鼠中性粒细胞并放入培养箱培养。
将大鼠中性粒细胞离心后重悬,取1×106个细胞加入transwell小室上层,总体积为100ul,不含血清,加入10mg/ml的BSA,按照图3所示加入相应的药物,下层中加入600ul含有血清和10mg/ml的BSA的培养基,除PBS组外其它组下层还要加入终浓度为100uM的fMLP。3小时后将小室取出,将下层培养液中的细胞离心收集后用100ul的PBS重悬以浓缩6倍,然后加入到血球计数板中进行计数,取左上、右上、左下和右下四个大方格的细胞数目总和进行统计。
实验结果表明,如图3所示,融合蛋白Slit2D2-HSA在体外能显著抑制大鼠中性粒细胞的迁移(P<0.01),具有较好的抑制中性粒细胞迁移的活性。
实施例4融合蛋白Slit2D2-HSA抑制LPS诱导的大鼠急性肺损伤中性粒细胞迁移实验
急性肺损伤(Acutelunginjury,ALI)是各种直接和间接致伤因素导致的全身失控性炎症反应,伴有肺泡上皮细胞及毛细血管内皮细胞损伤,其发病机制尚不清楚,目前尚缺乏有效的治疗手段。大鼠气道内灌注脂多糖(LPS)是一种常用的动物模型,在本研究中,气管内灌注LPS诱导大鼠急性肺损伤。化合物尾静脉注射到动物,四小时后,收集肺灌洗和支气管肺泡灌洗液,差分细胞计数测量,以代表测试化合物在预防脂多糖致肺损伤的疗效。动物分组的实验设计如表2所示。
除1组外,其他各组动物均接受脂多糖肺部灌注,将动物用3-5%异氟烷麻醉,用微型喷雾器插管将100μlLPS溶液(1mg/ml)导入大鼠气管,4h后用水合氯醛(750mg/kg)处死动物。用PBS+1%白蛋白4毫升原位轻轻灌洗肺部三次。灌洗后支气管肺泡灌洗液BALF被保存在冰中,之后进行嗜酸性粒细胞(EOS)、巨噬细胞(Mac)、中性粒细胞(Neu)、淋巴细胞(Lym)和细胞总量的计数。5组实验的细胞总数结果如图4所示,EOS、Mac、Neu和Lym结果如图5所示。在这项研究中,第2组为LPS模型组,其细胞总数升高,阳性对照地塞米松在10mg/kg的剂量条件下可显著降低中性粒细胞数目和总细胞数目。融合蛋白Slit2D2-HSA在1毫克/千克和5毫克/千克测试剂量下,与模型组相比,均可以显著抑制细胞数量的增加,中性粒细胞数目也得到明显的控制。
表2融合蛋白Slit2D2-HSA抑制中性粒细胞迁移实验
实施例5CLP脓毒症模型药效检测
啮齿类动物盲肠结扎穿刺实验(Cecalligation-peferation,CLP)是使用非常广泛的实验性败血症模型,本实验评估测试药物在诱导的C57BL/6小鼠CLP脓毒症疗效。
采用C57BL/6SDF级小鼠,雄性,6~8周,18~22克为实验动物,进行CLP手术,将小鼠腹腔注射氯胺酮(50毫克/公斤体重)麻醉,腹正中线做一1cm长的切口,游离肠系膜和盲肠,距盲肠末端1.2cm处以4号丝线结扎其根部。随后用无菌21号针头刺穿末端盲肠两次,挤压少许排泄物入腹腔后还纳肠段,依次缝合腹膜和皮肤。动物分组和给药按如下表进行,观察和记录各组动物死亡情况。
表3融合蛋白Slit2D2-HSA的CLP脓毒症模型药效检测实验
实验结果如图5所示,由图可知,尾静脉注射给药融合蛋白Slit2D2-HSA,能显著提高CLP模型动物的生存率,在5mg/kg给药剂量下,CLP模型动物存活率达到90%,而对照组仅为20%,表明融合蛋白Slit2D2-HSA对脓毒症具有较好的疗效,是一种有效的脓毒症预防和治疗类药物。
实施例6融合蛋白Slit2D2-HSA的安全性评价
为了更好的评价融合蛋白Slit2D2-HSA在动物体内的安全性,持续对小鼠进行给药,观察小鼠体重变化和生存状态,评估药物对小鼠的影响。
表3融合蛋白Slit2D2-HSA的安全性评价实验
4组小鼠的体重随时间变化结果如图6所示,由图可知,经过持续30天小鼠尾静脉注射给药,三个剂量组动物体重均未出现明显改变,动物状态良好,融合蛋白Slit2D2-HSA表现出良好的药物安全性。
- 还没有人留言评论。精彩留言会获得点赞!