高效特异i-DC/CIK细胞培养方法与流程
本发明涉及免疫技术领域,具体涉及运用L-半胱氨酸以及个体化特异性肿瘤抗原,加入到细胞培养基中,将DC和CIK细胞共刺激培养,诱导高效特异的个体化DC/CIK(individual DC/CIK,i-DC/CIK)细胞的增殖分化,使i-DC/CIK细胞具有更有效和更特异的杀瘤活性。
背景技术:
目前,全球肿瘤发病率和死亡率居高不下,目前中国每分钟就有6人被诊断为癌症,平均每5位肿瘤患者有3人死亡,并逐年呈总体上升趋势[1]。手术、化疗和放疗是传统的三大治疗技术,对治愈肿瘤的贡献各占49%、40%和11%,但均存在一些副作用和应用限制,主要表现在:
1.手术治疗:手术重创可导致患者机体大范围免疫损伤,恢复期长;晚期肿瘤患者因肿瘤细胞转移而不能完全清除癌细胞,原发灶虽被切除,但转移灶可能快速增长;对医生水平和医疗装备依赖性极大,不同的医疗环境会造成手术结果的差异。
2.化疗:目前无法清晰鉴定何种药物适合何种疾病;化疗可使机体免疫功能破坏和下降,产生毒副作用较大(如疲劳、疼痛、脱发、皮损、贫血等),降低药物剂量又可能导致疗效不明显。
3.放疗:放疗仅为局部治疗,不能完全根除周边的病灶及残余癌细胞,也可导致机体免疫功能破坏和下降,毒副作用也较大(如脱发、虚弱、皮肤干燥等)。
随着科技的进步,学者们提出了通过提高机体内在的免疫系统功能来治疗肿瘤的新策略,并明确指出“生物治疗是目前知道的唯一有望消灭癌细胞的治疗手段,21世纪是肿瘤生物治疗的世纪。”(美国2000年“国际肿瘤生物治疗及基因治疗年会”),肿瘤生物治疗被誉为继手术、放疗、化疗之后的第四种治疗模式。
肿瘤生物治疗是指运用免疫细胞、免疫因子、靶向抗体和基因改造细胞等来治疗肿瘤,其中,运用免疫细胞来治疗肿瘤的“肿瘤免疫细胞治疗技术”,因其具有安全性高、几乎无毒副作用等优点,更是被称为肿瘤学科的“绿色生物疗法”,并被医学顶级杂志《Science》评为“2013年度十大突破性科学成就之首”[2],得到医学权威的充分肯定。
肿瘤免疫细胞治疗技术指的是运用生物学技术,对从肿瘤病人体内采集的免疫细胞进行体外诱导培养和扩增,然后回输到病人体内的方法,通过激发和增强机体免疫系统对肿瘤细胞的识别和杀伤力,抵抗癌症的发生和扩散,从而达到治疗肿瘤的目的[3-4]。据统计,大约有三分之一的早期肿瘤可以通过免疫细胞治疗达到治愈,部分晚期肿瘤病人通过免疫细胞治疗后也能达到部分或完全缓解。对于那些年龄较大,机体免疫较差,惧怕放化疗毒副作用的患者,对放化疗不敏感或无法耐受放化疗的肿瘤患者,以及部分不适宜手术治疗、介入治疗和其他治疗的晚期肿瘤病人,开展免疫细胞治疗也是最佳的选择。通过免疫细胞治疗可以提高患者的免疫功能,改善生活质量,减少肿瘤的负荷,延长带瘤生存期,争取手术或其他治疗机会。
到目前为止,肿瘤免疫细胞治疗技术应用大致经历了四代发展,依次为TIL/LAK/NK(第一代)、CIK(第二代)、DC+CIK(第三代)和个体化DC/CIK(第四代)。目前国内外应用最广泛的是第三代技术(DC+CIK技术),另外,一些新的免疫细胞技术如CAR-T技术等还处于研发之中。
树突状细胞(dendritic cells,DC)是正常人体内存在的一种具有强大抗原递呈功能的特殊细胞,它能高效地摄取、加工处理和递呈抗原,刺激体内的初始型T细胞活化,是机体免疫应答的“启动者”[5],加拿大医学家Ralph M.Steinman因其“发现树突状细胞及其在获得性免疫中的作用”获得了2011年诺贝尔生理学或医学奖。
DC细胞与肿瘤的发生、发展有着密切关系,是特异性激活机体免疫系统、激发抵御肿瘤侵袭最有效的途径之一[6-8]。临床验证,大部分实体瘤内浸润的DC数量多则患者预后好。在肿瘤免疫中,DC可通过主动识别肿瘤细胞,并把抗原信息传递给免疫活性细胞(NK、CIK、T细胞),促进其激活和大量增殖,同时活化天然免疫反应和获得性免疫反应来达到监测、杀灭肿瘤的功能,提升抗肿瘤免疫能力[9-11]。
CIK细胞(cytokine-induced killer,CIK)是将人外周血单个核细胞(PBMC)在体外用多种细胞因子(如抗CD3McAb、IL-2、IFN-γ、IL-1α等)共同培养一段时间后获得的一群异质细胞,因同时表达CD3、CD56膜蛋白分子,故又被称为NK细胞样T淋巴细胞(NKT cell) [12]。CIK细胞兼具有T淋巴细胞强大的抗瘤活性和NK细胞的非MHC限制性杀瘤优点,对肿瘤细胞具有很强的杀伤能力,CIK细胞能像“导弹”样精确杀伤肿瘤细胞,而不损伤任何正常细胞。
目前广泛使用的DC+CIK技术是将患者外周血单个核细胞收集后,将DC和CIK细胞分 开来单独培养7天,再合并培养7天~14天后回输给病人。研究发现,DC单独培养,细胞扩增速度慢、数量少,多为非成熟的DC,递呈抗原能力弱,不能有效地诱发抗原特异性T细胞的免疫应答,协同抗癌功效不明显。并且,CIK细胞扩增速度慢,总共约需要14~21天才能获得足够的细胞数量回输给病人,且在治疗过程中常出现发热等副作用。
另外,在DC培养体系中,一部分是没有添加任何肿瘤抗原,另一部分是添加有限的几种商品化特异性肿瘤抗原、或肿瘤细胞株裂解产物、或肿瘤标本裂解产物。前者由于无肿瘤抗原致敏DC,所诱导生成的CIK细胞缺乏肿瘤特异性,只能发挥非特异性杀伤,杀瘤活性有限;后者存在几种可能性:1)虽然有抗原致敏,但由于能获取的肿瘤细胞株以及商品化非自身肿瘤抗原的种类是非常有限的,而患者即使是患同样的肿瘤如胃癌、肺癌或肝癌,其所产生的肿瘤抗原也可能大不相同,存在明显的个体差异,仅用几种已知肿瘤抗原去应对成千上万种不同肿瘤类型的个体,明显缺乏特异性;2)患者在不同病程中,肿瘤容易发生突变,且肿瘤细胞株在培养过程中,表面抗原也通常会发生改变,由于患者肿瘤抗原的动态变化,导致应用人工合成的肿瘤抗原或肿瘤细胞株培养获得的DC+CIK针对患者个体的肿瘤缺乏特异性,最终临床治疗效果不佳,使得广泛应用受到限制。3)若使用肿瘤标本裂解产物,除去成本高,患者承受的经济压力大之外,患者通常在手术后才接受细胞免疫治疗,新鲜手术标本难以获得,而那些不能手术的患者也无法获得肿瘤组织,这些都大大限制了其使用,导致DC+CIK的临床效果欠佳。
CIK细胞高效杀伤肿瘤的效应细胞主要是CD3+/CD56+的NKT细胞以及CD3+/CD8+的细胞毒性T细胞。他们的数量和活性直接关系到肿瘤治疗的效果,获得高比率和高活性的NKT细胞和CD3+/CD8+细胞是CIK培养的目标。目前文献报道的结果显示[13-14],最终得到的有效杀伤细胞存在很大差异,分别为CD3+/CD56+-NKT细胞百分率在11%到38%之间,CD3+/CD8+-T细胞百分率在10%到40%之间,因此临床疗效也显现出较大差异。
高效特异的CIK培养技术和方法成为这一技术能否得到大量应用的关键因素,极大地影响着该技术的深入发展。针对以上的不足,我们找到了切实可行的解决办法,通过细胞培养方案和流程的改进,即可获得高效特异的i-DC/CIK细胞,显著提高杀瘤活性,得到较好的临床效果,为肿瘤的治疗提供了一种更为有效的方法和手段。
参考文献:
1.陈万青,张思维,曾红梅,郑荣寿,邹小农,赵平,吴良有,李光琳,赫捷.中国2010年恶性肿瘤发病与死亡.中国肿瘤,2014;23(1):1-10.
2.Couzin-Frankel J.Breakthrough of the year 2013.Cancer immunotherapy.Science,2013;342(6165):1432-1433.
3.Yajing Zhang,Jin Wang,Yao Wang,Xue-Chun Lu,Hui Fan,Yang Liu,Yan Zhang,Kai-Chao Feng,Wen-Ying Zhang,Mei-Xia Chen,Xiaobing Fu,and Wei-Dong Han.Autologous CIK Cell Immunotherapy in Patients with Renal Cell Carcinoma after Radical Nephrectomy.Clinical and Developmental Immunology,2013;1-15.
4.Ginna G.Laport,Kevin Sheehan,Jeanette Baker,Ruby M.Wong,Robert Lowsky,Laura J.Johnston,Judith A.Shizuru,David Miklos,Sally Arai,Jonathan E.Benjamin,Wen-Kai Weng,and Robert S Negrin.Adoptive immunotherapy with cytokine induced killer cells for patients with relapsed hematologic malignancies after allogeneic hematopoietic cell transplantation.Biol Blood Marrow Transplant,2011;17(11):679-1687.
5.Banchereau J,Steinman RM.Dendritic cells and the control of immunity[J].Nature,1998,392(6673):245-252.
6.Marten A,Ziske C,Schottker B,et al.Interactions between dendritic cells and cytokine-induced killer cells lead to an activation of both populations[J].J Immunother,2001,24(6):502-510.
7.周昌菊,马薇,周建大等.自体宫颈癌-树突细胞疫苗激活的CTL杀伤效应[J].癌症杂志,2006,25(2):143-147.
8.Schmidt J,Eisold S,Buchler MW,et al.Dendritic cells reduce number and function of CD4+CD25+cells in cytokine-induced killer cells derived from patients with pancreatic carcinoma[J].Cancer Immunol Immunother,2004,53(11):1018-1026.Yam aguchi Y,Ohshit aA,Kawabuchi Y,et al.Adoptive immunotherapy of cancer using activated autologous lymphocytes current status and new strategies[J].Hum Cell,2003,16(4):183-189.
9.Wang H,Zhou FJ,Wang QJ,et al.Efficacy of autologous renal tumor cell lysate-loaded dendritic cell vaccine in combination with cytokine-induced killer cells on advanced renal cell carcinoma-a report of ten cases[J].Chin J Cancer,2006,25(5):625-630.[in Chinese]
10.Yamazaki S,Patel M,Harper A,et al.Effective expansion of alloantigen-specific Foxp3+CD25+CD4+regulatory T cells by dendritic cells during the mixed leukocyte reaction[J].Proc Natl Acad Sci U S A,2006,103(8):2758-2763.
11.Sangiolo D,Martinuzzi E,Todorovic M,Vitaggio K,Vallario A,Jordaney N,Carnevale-Schianca F,Capaldi A,Geuna M,Casorzo L,et al:Alloreactivity and anti-tumor activity segregate within two distinct subsets of cytokine-induced killer(CIK)cells:implications for their infusion across major HLA barriers.Int Immunol 2008,20:841-848.
12.Danzer SG,Kirchner H,Rink L.Cytokine interactions in human mixed lymphocyte culture[J].Transplantation,1994,57(11):1638-1642.
13.张阳,张连生,曾鹏云,吴重阳,易良才,白俊.DC-CIK对急性髓细胞白血病干细胞的杀伤作用.中国肿瘤生物治疗杂志,2011;18(4):404-408.
14.Pan K,Wang QJ,Liu Q,Zheng HX,Li YQ,Weng DS,Li JJ,Huang LX,He J,Chen SP,Ke ML,Zeng YX,Xia JC.The phenotype of ex vivo generated cytokine-induced killer cells is associated with overall survival in patients with cancer.Tumour Biol.2014;35(1):701-7.
技术实现要素:
本发明的目的在于增强CIK细胞的靶向性,提升细胞的杀瘤活性。首先,采用患者自体血浆肿瘤抗原致敏DC细胞,提供特异性靶向。其次,改良CIK细胞诱导培养方法,一是不用分离DC细胞单独培养,而是将DC和CIK细胞混合在一起共刺激培养;二是加入适量L-半胱氨酸(2-Amino-3-mercaptopropionic acid,L-Cys,分子式:C3H7NO2S)。利用L-Cys具有促细胞生长的特性,在细胞生长中,在一定浓度(0~160μmol/L)范围内,其浓度与细胞生长活性呈正相关,并且L-Cys是安全的,其在200μmol/L浓度下,对细胞的细胞状态、增殖率、代谢能力等均无影响。在i-DC/CIK细胞培养过程中,在不抑制细胞生长的前提下,向培养基中添加适当浓度的L-Cys。经过不断的摸索和优化,最终确定了最佳血浆使用方案以及L-Cys的最适浓度,成功研制出一种高效诱导特异性i-DC/CIK的培养方法。
经流式细胞检测仪分析发现,通过该方法诱导培养的i-DC/CIK细胞培养物中,目前大家公认的具有高效抗瘤活性的效应性细胞组分NKT细胞(CD3+/CD16CD56+)数量显著增高,比例可高达80%以上;具有肿瘤杀伤作用的效应性细胞毒性T细胞(CD3+/CD8+)数量也明显增高,比例高达50%以上,均高于国内外文献报道的百分率(NKT的11%-38%和CD3+/CD8+的10%~40%)。
通过体外实验研究,发现i-DC/CIK细胞杀伤肿瘤的活性明显大于常规诱导培养的DC+CIK细胞,其杀瘤活性达到了97%以上,效果显著。临床应用发现,经该法制备的i-DC/CIK 细胞治疗肿瘤患者均不同程度的改善了患者的生活质量,延长了生存期,部分病人病情得到缓解甚至治愈,得到广大医务工作者以及肿瘤病患者的认可和重视,为肿瘤的治疗提供了一种更为有效的方法和手段。
附图说明
图1是i-DC/CIK细胞制备及治疗流程简图
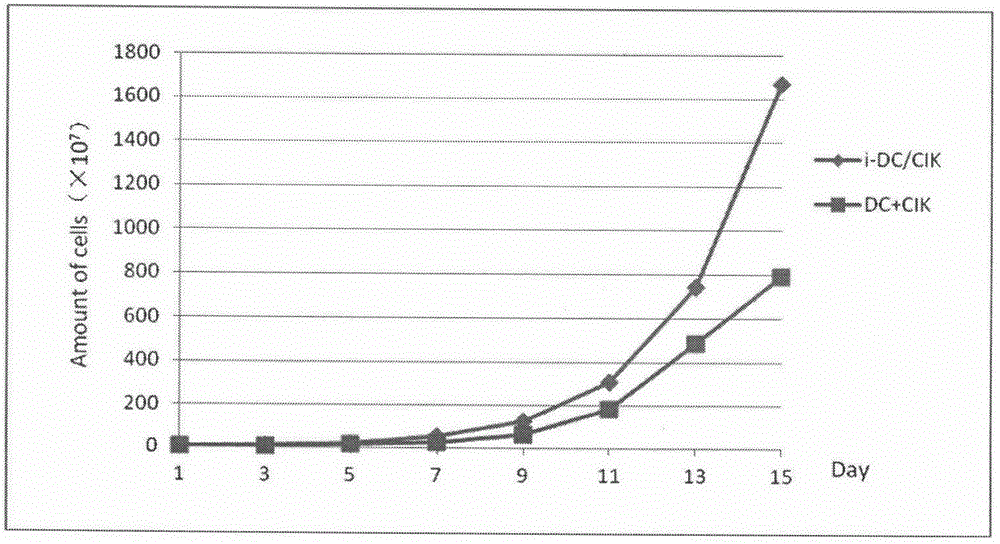
图2是i-DC/CIK细胞和常规DC+CIK细胞增殖曲线图
图3是i-DC/CIK细胞流式检测结果图
图4是DC+CIK细胞流式检测结果图
图5是i-DC/CIK和DC+CIK细胞杀伤肿瘤细胞活性图
具体实施方式
实施例一、i-DC/CIK细胞细胞的诱导和培养
1.外周血采集:病人空腹或清淡饮食30分钟内,无菌采集静脉血50ml,用肝素钠抗凝,立即送GMP实验室处理;
2.血浆收集:将肝素抗凝血室温离心1000g×10min,收集上层血浆;
3.将自体血浆按2%~5%的比例加入到自配专用i-DC/CIK细胞培养基中,并添加L-Cys(终浓度100μmol/L),用于i-DC/CIK细胞的培养;
4.单个核细胞分离:用相同体积生理盐水重悬“步骤2”沉淀细胞,用密度梯度离心法分离单个核细胞,经洗涤后用专用i-DC/CIK细胞培养基重悬。
5.i-DC/CIK细胞培养:用i-DC/CIK细胞培养液调细胞浓度约为1×106/ml,移入细胞培养瓶中,置37℃、5%CO2孵箱中培养,适时补充新鲜培养液或分瓶扩增,培养至约10~14天,经检测合格即可用于回输病人。
实施例二、i-DC/CIK细胞细胞的回输
1.预计细胞总数达到要求前2天取样进行微生物学检测、细胞标志物检测(CD3、CD3/CD4、CD3/CD8及CD3/CD16/56),质量检查合格后通知病人回输;
2.回输前进行细胞成活率检测,当细胞成活率>90%即为合格;
3.将i-DC/CIK细胞用生理盐水洗涤3次,制成混悬液,用输血器静脉滴注;
4.一个疗程回输2~4次,回输细胞总量约为2~5×109。
实施例三、L-Cys诱导的i-DC/CIK细胞和常规培养DC+CIK细胞的增殖特性研究
1.抽取自愿者外周血100ml,肝素抗凝,常规分离单个核细胞,平均分成两份;
2.一份按照前述方法“实施例一、i-DC/CIK细胞的诱导和培养”进行细胞培养,另一份按照文献报道常规方法进行DC+CIK细胞培养:DC、CIK细胞分别培养7天后合并培养至第15天;
3.分别于第1、3、5、7、9、11、13和15天分别计数两种方法培养的细胞总数,绘制细胞增殖曲线图。
实施例四、用流式细胞仪分析培养细胞表面标志
1.收集培养至第15天的i-DC/CIK细胞和DC+CIK细胞,按照美国BD Bioscience公司的CD3/4/8试剂盒说明书进行染色(单抗:CD4-FITC、CD8-PE、CD3-Per CP)和CD3/16/56试剂盒(单抗:CD3-FITC、CD16/CD56-PE);
2.用美国BD Bioscience公司的FACSCanto(Franklin Lakes,NJ,USA)流式细胞仪分析细胞的表面标志;
3.用BD FACSDiva software(Becton-Dickinson Inc.,San Jose,USA)进行数据分析。
实施例五、i-DC/CIK细胞和DC+CIK细胞杀伤肿瘤细胞活性检测
1.复苏小鼠黑色素瘤B16细胞株,传代培养一次。
2.接种1×105/ml于96孔细胞培养板,每孔100μl,每板8孔,共三板。
3.分别取“实施例三”培养至第3、7、13、15天的i-DC/CIK细胞和DC+CIK细胞,洗涤3次后用RPMI-1640重悬细胞,调细胞浓度为1×106/ml。
4.在接种了小鼠黑色素瘤B16细胞的96孔细胞培养板中,分别加入培养的i-DC/CIK细胞和DC+CIK细胞100μl,对照组加入RPMI-1640培养液100μl,做3复孔。
5.置37℃、5%CO2的饱和湿度的二氧化碳培养箱中培养12h,用MTT法检测,在570nm处测定其OD值,并绘制直方图。
- 还没有人留言评论。精彩留言会获得点赞!