接枝聚合物及其制造方法与流程
本发明涉及导入成本低,能够以简便的操作安全且稳定地制造的接枝聚合物及其制造方法。
背景技术:
作为用于对聚合物、高分子化合物赋予期望性质的合适手段,广泛使用在高分子主链接枝具有官能团的侧链的接枝聚合及由此而得的接枝聚合物。
例如,作为以烯丙基胺系聚合物为主链的接枝聚合物的制造方法,已知基于化学修饰的方法、利用辐射线的方法。
作为基于化学修饰的方法,已知如下方法:在作为接枝链的高分子末端修饰具有与氨基反应的官能团(例如醛基、羧基、酰卤基、异氰酸酯基、环氧基、丙烯酰基等)的高分子的方法(参照例如专利文献1及专利文献2);对高分子主链修饰具有自由基聚合性官能团且具有与氨基反应的官能团的化合物,然后进行聚合的方法(参照例如专利文献3);使具有自由基聚合性官能团且具有与氨基反应的官能团的化合物聚合到作为接枝链的高分子末端,然后与具有氨基的高分子反应的方法(参照例如专利文献4)等。
就使用辐射线的方法而言,已知如下方法:对基材(例如聚烯烃、纤维素等)照射电子束,对高分子主链引发自由基而作为聚合起点,使作为接枝链的单体聚合的方法(参照例如专利文献5)。
需要说明的是,含有烯丙基胺系聚合物的接枝聚合物是已知的。另一方面,使环氧化合物与烯丙基胺系聚合物反应而得的衍生物也是已知的,但该衍生物的接枝聚合物并非已知。
现有技术文献
专利文献
专利文献1:日本特开2004-89787号公报
专利文献2:美国公开专利申请US2010-0029544公报
专利文献3:日本特开2006-36830号公报
专利文献4:日本特开2004-225181号公报
专利文献5:日本特开2005-154973号公报
技术实现要素:
发明要解决的课题
但是,醛、酰卤化合物等的反应性官能团的反应性高,因此担忧其潜在的毒性,此外,由于容易水解,因此作为原料是难以处理的。此外,与羧基的反应是脱水反应,因此需要130℃以上的高温。进一步,该方法中需要分别制造干聚合物和接枝链的高分子,成本高。而且与氨基的反应会发生官能团转换,因此接枝链的导入率越高则氨基变得越少。因此存在作为烯丙基胺系聚合物所需的胺特性丧失等课题。
使用辐射线的方法不需要上述那样的高温,能够一步(one-pot)制造,但辐射线照射装置非常昂贵,此外,需要形成处理辐射线的设备等,导入成本高。进一步,辐射线需要高能量,因此成本高。而且担心辐射线等电子束对人体有影响,还存在制造中确保安全性的课题。
本发明人为了解决现有技术中存在的上述课题,进行了深入研究,结果发现与以往相比导入成本低、能够以简便的操作安全且稳定地制造的接枝聚合方法及通过该方法获得的接枝聚合物,从而完成了本发明。需要说明的是,本发明特别适合用于烯丙基胺系聚合物的接枝聚合。
用于解决课题的手段
即,本申请的第1发明涉及:
[1]一种多胺接枝聚合物,其是使多胺衍生物与烯属不饱和单体(c)聚合而得的,所述多胺衍生物是使具有至少1个氨基的高分子化合物(a)与具有至少1个环氧基的化合物(b)反应而得的。
下述[2]为本发明的优选方式之一。
[2]根据上述[1]所述的多胺接枝聚合物,其中,上述具有至少1个氨基的高分子化合物(a)选自由含有由通式(1)所示的结构的乙撑亚胺系(共)聚合物、含有由通式(2)所示的结构的乙烯基胺系(共)聚合物、含有由通式(3)所示的结构的烯丙基胺系(共)聚合物、含有由通式(4)所示的结构的二烯丙基胺系(共)聚合物及含有由通式(5)所示的结构的丙烯酰基胺系(共)聚合物组成的组,(其中,下述通式中,n为10~200000的整数,m为5~18000的整数,l为5~15000的整数,o为10~10000的整数,p为1~100的整数。)。
[化学式1]
[化学式2]
[化学式3]
[化学式4]
[化学式5]
此外,本申请的第2发明涉及:
[3]一种多胺接枝聚合物,其是使多胺衍生物与烯属不饱和单体(c)聚合而得的,所述多胺衍生物是使具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应而得的改性烯丙基胺系单体聚合获得的。
下述[4]~[7]也均为本发明的优选实施方式之一。
[4]根据上述[3]所述的多胺接枝聚合物,其中,上述烯丙基胺系单体(a’)为二烯丙基胺。
[5]根据上述[1]~[4]中任一项所述的多胺接枝聚合物,其中,上述具有至少1个环氧基的化合物(b)为通式(6)所示的化合物(其中,通式(6)中的R为取代或未取代的烃基。)。
[化学式6]
[6]根据上述[1]~[4]中任一项所述的多胺接枝聚合物,其中,上述具有至少1个环氧基的化合物(b)为通式(7)所示的化合物且选自由下述(1)~(14)组成的组:(1)式中R1、R2、R3及R4为氢原子的环氧乙烷;(2)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羟基的碳数1~8的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(3)式中R1、R2、R3及R4分别独立地为氢原子或碳数1~18的线型或支化的烷基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(4)式中R1、R2、R3及R4分别独立地为氢原子或链中含有醚键的碳数1~8的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(5)式中R1、R2、R3及R4分别独立地为氢原子或卤素(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(6)式中R1、R2、R3及R4分别独立地为氢原子或不饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(7)式中R1、R2、R3及R4分别独立地为氢原子或含有脂环式烃基或具有不饱和键的环式烃基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(8)式中R1、R2、R3及R4分别独立地为氢原子或含有芳香环或杂环的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(9)式中R1、R2、R3及R4分别独立地为氢原子或含有环氧环的烃基(其中,R1、R2、R3及R4不全部为氢原子)的多官能环氧化合物;(10)式中R1、R2、R3及R4分别独立地为氢原子或链中含有烷氧基甲硅烷基的碳数3~12的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(11)式中R1、R2、R3及R4分别独立地为氢原子或链中含有氟的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(12)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羧基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(13)式中R1、R2、R3及R4分别独立地为氢原子或链中含有酯键或酰胺键的碳数1~12的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;以及(14)式中R1、R2、R3及R4分别独立地为氢原子或链中具有磺酸酯基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物。
[化学式7]
[7]根据上述[1]~[6]中任一项所述的多胺接枝聚合物,其中,上述乙烯系不饱和单体(c)选自由乙烯基系单体、苯乙烯系单体、甲基丙烯酸酯系单体、丙烯酸酯系单体、丙烯酰胺系单体、烯丙基系单体、二烯丙基系单体及不饱和羧酸组成的组。
此外,本申请的第3发明涉及:
[8]一种多胺接枝聚合物的制造方法,具有在多胺衍生物中加入烯属不饱和单体(c)及自由基聚合引发剂进行聚合的工序,所述多胺衍生物是在极性溶剂中使具有至少1个氨基的高分子化合物(a)与具有至少1个环氧基的化合物(b)反应而得的。
此外,本申请的第4发明涉及:
[9]一种多胺接枝聚合物的制造方法,具有在多胺衍生物中加入烯属不饱和单体(c)及自由基聚合引发剂进行聚合的工序,所述多胺衍生物是使在极性溶剂中具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应而得的改性烯丙基胺系单体聚合获得的。
下述[10]~[14]也均为本发明的优选的实施方式之一。
[10]根据上述[9]所述的多胺接枝聚合物,其中,上述烯丙基胺系单体(a’)为二烯丙基胺。
[11]根据上述[8]~[10]中任一项所述的多胺接枝聚合物的制造方法,其中,上述自由基聚合引发剂选自由通式(8)所示的偶氮系引发剂、由通式(9)所示的有机化氧化物系引发剂及由通式(10)所示的无机过硫酸盐系引发剂组成的组(其中,下述通式中,R5及R6分别独立地为碳数1~20的有机基,R7及R8分别独立地为氢或碳数1~20的有机基,M为碱金属或铵。)。
[化学式8]
R5-N=N-R6 -(8)
[化学式9]
R7-O-O-R8 -(9)
[化学式10]
[12]根据上述[8]~[11]中任一项所述的多胺接枝聚合物的制造方法,其中,在上述聚合工序中使用温度为0~100℃的多胺衍生物溶液。
[13]根据上述[8]~[12]中任一项所述的多胺接枝聚合物的制造方法,在上述聚合工序中,使用pH为0以上的多胺衍生物溶液。
[14]根据上述[8]~[13]中任一项所述的多胺接枝聚合物的制造方法,其中,上述具有至少1个环氧基的化合物(b)为由通式(7)所示的化合物且选自由下述(1)~(14)组成的组:(1)式中R1、R2、R3及R4为氢原子的环氧乙烷;(2)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羟基的碳数1~8的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(3)式中R1、R2、R3及R4分别独立地为氢原子或碳数1~18的线型或支化的烷基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(4)式中R1、R2、R3及R4分别独立地为氢原子或链中含有醚键的碳数1~8的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(5)式中R1、R2、R3及R4分别独立地为氢原子或卤素(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(6)式中R1、R2、R3及R4分别独立地为氢原子或不饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(7)式中R1、R2、R3及R4分别独立地为氢原子或含有脂环式烃基或具有不饱和键的环式烃基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(8)式中R1、R2、R3及R4分别独立地为氢原子或含有芳香环或杂环的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(9)式中R1、R2、R3及R4分别独立地为氢原子或含有环氧环的烃基(其中,R1、R2、R3及R4不全部为氢原子)的多官能环氧化合物;(10)式中R1、R2、R3及R4分别独立地为氢原子或链中含有烷氧基甲硅烷基的碳数3~12的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(11)式中R1、R2、R3及R4分别独立地为氢原子或链中含有氟的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(12)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羧基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(13)式中R1、R2、R3及R4分别独立地为氢原子或链中含有酯键或酰胺键的碳数1~12的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;以及(14)式中R1、R2、R3及R4分别独立地为氢原子或链中具有磺酸酯基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物。
[化学式11]
发明效果
根据本申请的第1发明及第3发明,能够提供与以往相比导入成本低,能够以简便的操作在保持胺的特性的条件下安全且稳定地制造的接枝共聚物及其制造方法。本申请的第1发明及第3发明能够特别优选在烯丙基胺系接枝共聚物中使用。
根据本申请的第2发明及第4发明,能够提供与以往相比导入成本低,能够以简便的操作高效且控制性良好地进行反应、在保持胺的特性的条件下安全且稳定地制造的接枝共聚物及其制造方法。
附图说明
图1:本发明的一实施例中的环氧丙烷改性聚烯丙基胺的红外分光光谱。
图2:本发明的一实施例中的环氧丙烷改性聚烯丙基胺的GPC谱图。
图3:本发明的一实施例中的接枝聚合物的GPC谱图。
图4:本发明的一实施例中的纯化后的接枝聚合物的GPC谱图。
图5:本发明的一实施例中的纯化后的接枝聚合物的红外分光光谱。
图6:本发明的一实施例中的纯化后的接枝聚合物的1H NMR谱图。
图7:本发明的另一实施例中的接枝聚合物的GPC谱图。
图8:本发明的另一实施例中的纯化后的接枝聚合物的GPC谱图。
图9:本发明的另一实施例中的纯化后的接枝聚合物的红外分光光谱。
图10:本发明的另一实施例中的纯化后的接枝聚合物的1H NMR谱图。
图11:本发明的一实施例中的接枝聚合物的红外分光光谱。
图12:本发明的一实施例中的接枝聚合物的GPC谱图。
图13:本发明的一实施例中的接枝聚合物的红外分光光谱。
图14:本发明的一实施例中的环氧辛烷改性聚烯丙基胺的红外分光光谱。
图15:本发明的一实施例中的接枝聚合物的红外分光光谱。
图16:本发明的一实施例中的乙二醇二缩水甘油醚改性聚烯丙基胺的红外分光光谱。
图17:本发明的一实施例中的接枝聚合物的红外分光光谱。
图18:本发明的一实施例中的环氧苯乙烷改性聚烯丙基胺的红外分光光谱。
图19:本发明的一实施例中的接枝聚合物的红外分光光谱。
图20:本发明的一实施例中的丁酸缩水甘油酯改性聚烯丙基胺的红外分光光谱。
图21:本发明的一实施例中的接枝聚合物的红外分光光谱。
图22:本发明的一实施例中的接枝聚合物的红外分光光谱。
图23:本发明的一实施例中的接枝聚合物的红外分光光谱。
图24:本发明的一实施例中的缩水甘油改性聚二烯丙基胺的红外分光光谱。
图25:本发明的一实施例中的缩水甘油改性聚二烯丙基胺的GPC谱图。
图26:本发明的一实施例中的接枝聚合物的GPC谱图。
图27:本发明的一实施例中的接枝聚合物的红外分光光谱。
图28:本发明的一实施例中的环氧丙烷改性聚乙撑亚胺的红外分光光谱。
图29:本发明的一实施例中的接枝聚合物的红外分光光谱。
图30:本发明的一实施例中的环氧丙烷改性聚乙烯基胺的红外分光光谱。
图31:本发明的一实施例中的接枝聚合物的红外分光光谱。
图32:本发明的一实施例中的环氧丙烷改性聚二烯丙基胺的红外分光光谱。
图33:本发明的一实施例中的环氧丙烷改性聚二烯丙基胺的GPC谱图。
图34:本发明的一实施例中的接枝聚合物的GPC谱图。
图35:本发明的一实施例中的接枝聚合物的红外分光光谱。
图36:本发明的一实施例中的环氧丙烷改性聚烯丙基胺的GPC谱图。
图37:本发明的一实施例中的接枝聚合物的GPC谱图。
图38:本发明的一实施例中的接枝聚合物的红外分光光谱。
具体实施方式
本申请的第1发明为一种多胺接枝聚合物,其是使多胺衍生物与烯属不饱和单体(c)聚合而得的,所述多胺衍生物是使具有至少1个氨基的高分子化合物(a)与具有至少1个环氧基的化合物(b)反应而得的。
[具有至少1个氨基的高分子化合物(a)]
作为本申请的第1发明中使用的具有至少1个氨基的高分子化合物(a),只要是其结构中具有至少1个氨基的高分子化合物,则所有化合物均可以使用,优选使用含有由通式(1)所示的结构的乙撑亚胺系(共)聚合物、含有由通式(2)所示的结构的乙烯基胺系(共)聚合物、含有由通式(3)所示的结构的烯丙基胺系(共)聚合物、含有由通式(4)所示的结构的二烯丙基胺系(共)聚合物及含有由通式(5)所示的结构的丙烯酰基胺系(共)聚合物。需要说明的是,下述通式中,n为10~200000的整数,m为5~18000的整数,l为5~15000的整数,o为10~10000的整数,p为1~100的整数。
[化学式12]
[化学式13]
[化学式14]
[化学式15]
[化学式16]
作为本申请的第1发明中使用的具有至少1个氨基的高分子化合物(a),特别优选使用由通式(3)所示的烯丙基胺系聚合物。
由通式(3)所示的烯丙基胺系聚合物由于接枝后也兼具作为胺的性质,因此实用上的价值高,此外,由于利用现有技术难以在温和条件下进行接枝,因此应用本发明的技术意义高。
需要说明的是,本申请的第1发明中使用的具有至少1个氨基的高分子化合物(a)具有至少1个氨基即可,其构成单元中也可以含有不具有氨基的构成单元。因此,具有上述通式(1)~(5)所示的结构的各聚合物除了上述通式(1)~(5)所示的结构的各构成单元以外还可以含有不具有氨基的构成单元,此外,也可以不含不具有氨基的构成单元。作为不具有氨基的构成单元,可以列举二氧化硫、丙烯酰胺、烯丙基醇、丙烯酸等,但不限于这些。
本申请的第1发明中使用的具有至少1个氨基的高分子化合物(a)中的氨基可以是伯氨基、仲氨基及叔氨基中的任一种,特别优选伯氨基或仲氨基。
对具有至少1个氨基的高分子化合物(a)中的氨基的数量没有特别限制,从反应性、使用容易性等观点出发,优选每1个高分子中为5~15000个,特别优选8~3000个。此外,换算成高分子化合物的每单位分子量的个数时,优选每10000分子量中为5个~230个,特别优选10个~130个。氨基的数量不过度少则成为接枝起点的环氧烷烃的导入率不过度变小,接枝效率的恶化受到抑制。
对本申请的第1发明中使用的具有至少1个氨基的高分子化合物(a)的分子量没有特别限制,从反应性、粘度、操作性、成品率等观点出发,以数均分子量计优选500~10000000,特别优选500~1000000。
此外,对本申请的第1发明中使用的具有至少1个氨基的高分子化合物(a)所具有的重复单元的数量也没有特别限制,从反应性、粘度、操作性、成品率等观点出发,优选10~150000个,特别优选10~3000个。
本申请的第2发明为一种多胺接枝聚合物,其是使多胺衍生物与烯属不饱和单体(c)聚合而得的,所述多胺衍生物是使具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应而得的改性烯丙基胺系单体聚合而得的。
[具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)]
作为本申请的第2发明中使用的具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’),只要是其结构中具有至少1个烯丙基与至少1个氨基的聚合性化合物,则所有的化合物均可以使用,优选具有由通式(a1)所示的结构的烯丙基胺系化合物。
[化学式17]
通式(a1)中,R9及R10中的至少一个是氢原子,另一个是氢或碳数1~8的烃基,优选氢原子或碳数1~3的烷基。
此外,从聚合性等观点出发,特别优选通式(a1)中R9及R10任一者均为烯丙基、即具有2个烯丙基的二烯丙基胺系单体。
从获得高聚合性的观点出发,优选在进行本申请的第2发明的制造时使用的烯丙基胺系单体(a’)中的至少一部分为具有2个烯丙基的二烯丙基胺系单体,更优选该烯丙基胺系单体(a’)的30摩尔%以上为二烯丙基胺系单体,特别优选50摩尔%以上为二烯丙基胺系单体。
通式(a1)中,在R9及R10中的一个(例如R9)为氢原子时,另一个(此时为R10)优选氢原子、甲基、乙基、烯丙基、或苄基。即,具有由通式(a1)所示的结构的烯丙基胺系化合物优选烯丙基胺、甲基烯丙基胺、乙基烯丙基胺、二烯丙基胺、或苄基烯丙基胺。
此外,在本申请的第1发明中,具有由通式(a1)所示的结构的烯丙基胺系化合物的有机酸盐或无机酸盐也可以优选作为具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)使用。作为上述有机酸盐或无机酸盐中的抗衡离子,优选卤素离子(进一步优选Cl-、Br-、或I-)、甲基硫酸根离子、乙基硫酸根离子、甲磺酸根离子、2-羟基-1-乙磺酸根离子、乙酸根离子或羟乙酸根离子。
[具有至少1个环氧基的化合物(b)]
作为本申请的第1发明及第2发明中使用的具有至少1个环氧基的化合物(b),只要是其结构中具有至少1个环氧基的化合物,则所有化合物均可以使用。在制造本申请的第1发明的多胺接枝聚合物时,该具有至少1个环氧基的化合物(b)与上述具有至少1个氨基的高分子化合物(a)中的氨基反应,生成具有在末端具有羟基的侧链的多胺衍生物(以下也称为“干聚合物1(trunk polymer 1)”。)。干聚合物1由于侧链具有羟基,因此与烯属不饱和单体(c)中的碳-碳双键的反应性高,能够在较温和的条件下以与该羟基邻接的碳为起点在干聚合物1上接枝由烯属不饱和单体(c)衍生的结构、基团。
在制造本申请的第2发明的多胺接枝聚合物时,该具有至少1个环氧基的化合物(b)与具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)中的氨基反应而生成改性烯丙基胺系单体,该改性烯丙基胺系单体被供于此后的工序。本申请的第2发明在这一点与本申请的第1发明、即具有至少1个环氧基的化合物(b)与高分子化合物(a)反应是不同的。由于这样的差异,本申请的第2发明的多胺接枝聚合物能够高效且控制性高地进行制造,此外,通过导入共聚成分等,能够以高自由度实现期望的结构。
作为本申请的第1发明及第2发明中使用的具有至少1个环氧基的化合物(b),优选由下述通式(6)所示的化合物。需要说明的是,通式(6)中的R为取代或未取代的烃基。
[化学式18]
由通式(6)所示的化合物与具有至少1个氨基的高分子化合物(a)或烯丙基胺系单体(a’)中的氨基的反应性高,不需要高温、辐射线,能够在较温和的条件下以简便的操作安全且稳定地将末端具有羟基的侧链连接到高分子化合物上,因此是优选的。
此外,作为本申请的第1发明及第2发明中使用的具有至少1个环氧基的化合物(b),还优选由下述通式(7)所示的R1~R4为特定基团的组合的化合物。
[化学式19]
更具体而言,由通式(7)所示的R1~R4为特定基团的组合的化合物为选自由下述(1)~(14)组成的组的化合物:(1)式中R1、R2、R3及R4为氢原子的环氧乙烷;(2)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羟基的碳数1~8的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(3)式中R1、R2、R3及R4分别独立地为氢原子或碳数1~18的线型或支化的烷基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(4)式中R1、R2、R3及R4分别独立地为氢原子或链中含有醚键的碳数1~8的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(5)式中R1、R2、R3及R4分别独立地为氢原子或卤素(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(6)式中R1、R2、R3及R4分别独立地为氢原子或不饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(7)式中R1、R2、R3及R4分别独立地为氢原子或含有脂环式烃基或具有不饱和键的环式烃基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(8)式中R1、R2、R3及R4分别独立地为氢原子或含有芳香环或杂环的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(9)式中R1、R2、R3及R4分别独立地为氢原子或含有环氧环的烃基(其中,R1、R2、R3及R4不全部为氢原子)的多官能环氧化合物;(10)式中R1、R2、R3及R4分别独立地为氢原子或链中含有烷氧基甲硅烷基的碳数3~12的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(11)式中R1、R2、R3及R4分别独立地为氢原子或链中含有氟的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(12)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羧基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;(13)式中R1、R2、R3及R4分别独立地为氢原子或链中含有酯键或酰胺键的碳数1~12的线型或支化的饱和烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物;以及(14)式中R1、R2、R3及R4分别独立地为氢原子或链中具有磺酸酯基的烃基(其中,R1、R2、R3及R4不全部为氢原子)的环氧化合物。
这些化合物与具有至少1个氨基的高分子化合物(a)或烯丙基胺系单体(a’)中的氨基的反应性高,不需要高温、辐射线,能够在较温和的条件下以简便的操作安全且稳定地将末端具有羟基的侧链连接到高分子化合物上,因此是优选的。
此外,作为具体的化合物,可以列举环氧乙烷(结构参照下式);
[化学式20]
缩水甘油(结构参照下式);
[化学式21]
环氧丙烷(结构参照下式)、
[化学式22]
环氧丁烷、2,3-环氧丁烷、1,2-环氧己烷及1,2-环氧十六烷;
缩水甘油基甲基醚(结构参照下式)、
[化学式23]
乙基缩水甘油醚、缩水甘油基异丙基醚及三缩水甘油基异氰脲酸酯
表氯醇(结构参照下式)、
[化学式24]
表溴醇及2-(氯甲基)-1,2-环氧丁烷
1,3-丁二烯一氧化物(结构参照下式)、
[化学式25]
1,2-环氧-5-己烯及烯丙基缩水甘油醚
1,2-环氧环戊烷(结构参照下式)、
[化学式26]
1,2-环氧环己烷及1,2-环氧-4-乙烯基环己烷3,4-环氧四氢呋喃;
环氧苯乙烷(结构参照下式)、
[化学式27]
缩水甘油基苯基醚及4-环氧丙氧基咔唑
1,2:3,4-二环氧丁烷(结构参照下式)、
[化学式28]
1,4-丁二醇二缩水甘油醚及乙二醇二缩水甘油醚;
3-环氧丙氧基丙基三甲氧基硅烷(结构参照下式)、
[化学式29]
及3-缩水甘油醚氧基丙基(二甲氧基)甲基硅烷;
1,2-环氧-1H,1H,2H,3H,3H十七氟十一烷(结构参照下式);
[化学式30]
环氧琥珀酸(结构参照下式);
[化学式31]
丁酸缩水甘油酯(结构参照下式)、
[化学式32]
及N-缩水甘油基邻苯二甲酰亚胺;以及
硝基苯磺酸缩水甘油酯(结构参照下式)、
[化学式33]
及对甲苯磺酸缩水甘油酯等,但不限于这些。
(干聚合物1)
在制造本申请的第1发明的多胺接枝聚合物时,通过使上述具有至少1个环氧基的化合物(b)与上述具有至少1个氨基的高分子化合物(a)反应而形成干聚合物1。干聚合物1的侧链具有羟基,因此与烯属不饱和单体(c)中的碳-碳双键的反应性高,能够以与该羟基邻接的碳为起点在干聚合物1上接枝来自烯属不饱和单体(c)的侧链结构、官能团。
干聚合物1只要是通过使上述具有至少1个环氧基的化合物(b)与上述具有至少1个氨基的高分子化合物(a)反应而得的多胺衍生物即可,对其不特别施加除此以外的限制,作为特别优选的干聚合物1,可以列举:(A)使含有由通式(3)所示的结构的烯丙基胺系(共)聚合物与环氧丙烷反应而得的多胺衍生物;(B)使含有由通式(3)所示的结构的烯丙基胺系(共)聚合物与缩水甘油反应而得的多胺聚合物;(C)使含有由通式(4)所示的结构的二烯丙基胺系(共)聚合物与缩水甘油反应而得的多胺聚合物;及(D)使含有由通式(3)所示的结构的烯丙基胺系(共)聚合物与1,2-环氧辛烷反应而得的多胺聚合物等。
对上述具有至少1个环氧基的化合物(b)与上述具有至少1个氨基的高分子化合物(a)的反应比例没有特别限制,相对于具有至少1个氨基的高分子化合物中(a)的氨基,环氧基优选0.01~2当量,特别优选0.1~2当量。
需要说明的是,在氨基为伯氨基时,相对于氨基,环氧基特别优选0.1~2当量,在氨基为仲氨基时,相对于氨基,环氧基特别优选0.1~1当量。
上述优选的作为干聚合物1之一的、(A)使含有由通式(3)所示的结构的烯丙基胺系(共)聚合物与环氧丙烷反应而得的多胺衍生物中,优选以环氧基相对于含有由通式(3)所示的结构的烯丙基胺系(共)聚合物中的氨基为约2当量的比例进行反应,此时,获得的干聚合物1含有由下述式(A)所示的结构。
[化学式34]
此外,上述优选的作为干聚合物1之一的、(B)使含有由通式(3)所示的结构的烯丙基胺系(共)聚合物与缩水甘油反应而得的多胺聚合物中,优选以环氧基相对于含有由通式(3)所示的结构的烯丙基胺系(共)聚合物中的氨基为约2当量的比例进行反应,此时,获得的干聚合物1含有由下述式(B)所示的结构。
[化学式35]
此外,上述优选的作为干聚合物1之一的、(C)使含有由通式(4)所示的结构的二烯丙基胺系(共)聚合物与缩水甘油反应而得的多胺聚合物中,优选以环氧基相对于含有由通式(4)所示的结构的二烯丙基胺系(共)聚合物中的氨基为约1当量的比例进行反应,此时,获得的干聚合物1含有由下述式(C)所示的结构。
[化学式36]
此外,上述优选的作为干聚合物1之一的、(D)使含有由通式(3)所示的结构的烯丙基胺系(共)聚合物与1,2-环氧辛烷反应而得的多胺聚合物中,优选以环氧基相对于含有由通式(3)所示的结构的烯丙基胺系(共)聚合物中的氨基为约0.1当量的比例进行反应,此时,获得的干聚合物1含有由下述式(D)所示的结构。
[化学式37]
对干聚合物1的分子量没有特别限制,从反应性、粘度、操作性、成品率等观点出发,以数均分子量计优选500~10000000,特别优选500~1000000。通常,干聚合物1的分子量大致由上述具有至少1个氨基的化合物(a)的分子量决定,因此通过将具有至少1个氨基的化合物(a)的分子量设定在上述优选范围内,可以获得具有优选的分子量的干聚合物1。
对干聚合物1的重复单元数没有特别限制,从反应性、粘度、操作性、成品率等观点出发,优选10~150000,特别优选10~3000。通常,干聚合物1的重复单元数与上述具有至少1个氨基的化合物(a)的重复单元数大致相同,因此通过将具有至少1个氨基的化合物(a)的重复单元数设定在上述优选的范围内,可以获得具有优选的重复单元数的干聚合物1。
(改性烯丙基胺系单体)
与本申请的第1发明时不同,在制造本申请的第2发明的多胺接枝聚合物时,首先,通过使具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应而获得改性烯丙基胺系单体。烯丙基胺系单体(a’)通常与高分子化合物相比成为位阻的结构少,因此与具有至少1个环氧基的化合物(b)的反应性高,能够高效地进行反应,并且反应的控制性高,能够合适地控制接枝化率等,此外,根据需要进行共聚成分等的导入等,能够容易地获得期望结构的多胺接枝聚合物。由于这样的反应性、接枝化率、共聚成分等的影响,本申请的第2发明的多胺接枝聚合物的结构与本申请的第1发明的多胺接枝聚合物的结构不同。
具体而言,例如,在本申请的第1发明中选择聚烯丙基胺作为具有至少1个氨基的高分子化合物(a)、选择环氧丙烷作为具有至少1个环氧基的化合物(b)时,干聚合物1为含有由式(A)所示的结构的聚合物,由于位阻,难以使环氧化合物与全部氨基反应,因此,此时的干聚合物1还含有未反应的氨基。而本申请的第2发明中,例如选择烯丙基胺作为具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)、选择环氧丙烷作为具有至少1个环氧基的化合物(b)时,使烯丙基胺单体与环氧丙烷反应而获得改性烯丙基胺系单体,由于位阻少,因此能够使全部氨基进行反应,能够获得单一种类的改性烯丙基胺。此外,即使在反应未顺利推进时,也可以通过精馏操作除去未反应物,从而获得单一种类的改性烯丙基胺。通过使用这样获得的单一种类的改性烯丙基胺进行聚合,此时的多胺衍生物(以下也称为“干聚合物2”。)实质上仅含式(A)所示的结构。此外,由于干聚合物结构的这种差异,本申请的第1发明的多胺接枝聚合物与本申请的第2发明的多胺接枝聚合物具有明显不同的结构。
上述改性烯丙基胺系单体的制造方法只要是使具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应的方法则没有特别限制,例如,可以通过下述方法制造:将上述烯丙基胺系单体(a’)溶解于水等极性溶剂中,一边冷却及搅拌一边滴加具有至少1个环氧基的化合物(b),然后在温度0~100℃反应0.1~24小时。
(干聚合物2)
在制造本申请的第2发明的多胺接枝聚合物时,通过使利用上述工序获得的改性烯丙基胺系单体聚合,从而获得侧链具有羟基的多胺衍生物(“干聚合物2”)。该多胺衍生物(干聚合物2)虽然是与制造本申请的第1发明的多胺接枝聚合物时所制造的多胺接枝聚合物(干聚合物1)具有类似结构的聚合物,但由于反应性、接枝化率、共聚成分等的影响而具有实质上不同的结构。
需要说明的是,在进行干聚合物2的聚合时,还可以将除了使具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应而得的改性烯丙基胺系单体以外的单体作为共聚成分而进行共聚。共聚成分只要能够与上述改性烯丙基胺系单体共聚即可,对其种类没有特别限制,作为优选的共聚成分,可以例示出丙烯酰胺、甲基丙烯酰胺、二氧化硫、丙烯酸等。
对共聚成分的量没有特别限制,相对于改性烯丙基胺系单体100摩尔,优选使用1~10000摩尔的共聚成分,特别优选使用10~1000摩尔的共聚成分。
干聚合物2的侧链具有羟基,因此与烯属不饱和单体(c)中的碳-碳双键的反应性高,能够以与该羟基邻接的碳为起点在干聚合物上接枝来自烯属不饱和单体(c)的侧链结构、官能团。
对干聚合物2的分子量、重复单元数没有特别限制,通常优选具有与干聚合物1同样的分子量、重复单元数。
[乙烯系不饱和单体(c)]
通过使乙烯系不饱和单体(c)与干聚合物1或干聚合物2接枝聚合,从而能够获得本申请的第1发明或第2发明的多胺接枝聚合物。乙烯系不饱和单体(c)只要为具有至少1个乙烯系不饱和双键的化合物即可,没有除此以外的限制,优选选自由乙烯基系单体、苯乙烯系单体、甲基丙烯酸酯系单体、丙烯酸酯系单体、丙烯酰胺系单体、烯丙基系单体、二烯丙基系单体及不饱和羧酸组成的组中的单体。
对乙烯系不饱和单体(c)的分子量没有特别限制,从接枝效率等观点出发,分子量优选28~1100,特别优选28~500。
对乙烯系不饱和单体(c)的碳原子数也没有特别限制,优选2个~50个,特别优选2个~30个。
乙烯系不饱和单体(c)中,作为本发明中优选使用的单体的更具体的例子,可以列举苯乙烯、二乙烯基苯、对苯乙烯磺酸钠水合物、乙烯基苄基三甲基氯化铵、乙酸乙烯酯、1-乙烯基咪唑、2-乙烯基吡啶、丙烯腈、烯丙基胺盐酸盐、二烯丙基胺盐酸盐、二甲基二胺盐酸盐(dimethyl diamine hydrochloride)、二烯丙基二甲基氯化铵(特别是其60%水溶液)、二甲基丙烯酰胺、羟乙基丙烯酰胺、二甲基氨基丙基丙烯酰胺、二甲基氨基丙基丙烯酰胺氯甲基鎓盐、N-(3-二甲基氨基丙基)甲基丙烯酰胺、甲基丙烯酸3-(三甲氧基甲硅烷基)丙酯、丙烯酸甲酯、丙烯酸丁酯等。这些之中,从与干聚合物上的与羟基邻接的碳的反应性、接枝后的侧链末端基团的有用性等观点出发,特别优选二甲基丙烯酰胺、二烯丙基二甲基氯化铵、苯乙烯、丙烯腈等。
这些单体的化学结构、CAS号等是本领域技术人员显而易见的,因此将其记载省略。
乙烯系不饱和单体(c)根据本发明的目的可以单独仅使用1种,也可以将2种以上组合使用。在将2种以上的乙烯系不饱和单体(c)组合使用时,可以是这些的全部均为上述优选例子,也可以是仅其一部分为上述优选例子。
本申请的第1发明及第2发明的多胺接枝聚合物能够在具有比较稳定的主链的高分子化合物的侧链末端导入期望的基团,因此能够优选用于各种用途。特别是,容易合适地控制与特定物质的反应性及在特定介质中的分散/凝集性,可以优选用于印刷用墨、涂料、颜料等的分散剂、药物/药剂递送用物质、金属离子捕捉剂、血中微量物质的分离、浓缩等用途。
此外,本申请的第1发明及第2发明的多胺接枝聚合物根据期望可以维持具有至少1个氨基的高分子化合物(a)或烯丙基胺系单体(a’)的部分氨基,因此能够兼有反应性、碱性、带电性等作为多胺的性质以及作为上述多胺接枝聚合物的性质,适合用于各种用途、特别是需要控制反应性、分散/凝集性的各种用途。
进一步,本申请的第1发明及第2发明的多胺接枝聚合物的导入成本低,能够以简便的操作安全且稳定地制造,具有较高实用价值。
并且,本申请的第2发明的多胺接枝聚合物的接枝化率比较容易控制,能够容易地获得期望结构的多胺接枝聚合物。
本申请的第1发明的多胺接枝聚合物优选通过后述本申请的第3发明的制造方法来制造,但并不限于该方法,也可以通过该方法以外的制造方法来制造。
本申请的第2发明的多胺接枝聚合物优选通过后述本申请的第4发明的制造方法来制造,但并不限于该方法,也可以通过该方法以外的制造方法来制造。
[多胺接枝聚合物的制造方法]
本申请的第3发明的多胺接枝聚合物的制造方法具有在多胺衍生物中加入烯属不饱和单体(c)及自由基聚合引发剂进行聚合的工序,所述多胺衍生物是在极性溶剂中使具有至少1个氨基的高分子化合物(a)与具有至少1个环氧基的化合物(b)反应而得的。
本申请的第2发明的制造方法中使用的具有至少1个氨基的高分子化合物(a)、具有至少1个环氧基的化合物(b)、干聚合物1(使具有至少1个氨基的高分子化合物(a)与具有至少1个环氧基的化合物(b)反应而得的多胺衍生物)、及烯属不饱和单体(c)与本申请的第1发明中使用的物质相同,其细节已经在本申请的第1发明的相关部分进行了描述。
本申请的第4发明的多胺接枝聚合物的制造方法具有在多胺衍生物中加入烯属不饱和单体(c)及自由基聚合引发剂进行聚合的工序,所述多胺衍生物是使在极性溶剂中具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应而得的改性烯丙基胺系单体聚合获得的。具有至少1个环氧基的化合物(b)不是与高分子化合物(a)、而是与单体(a’)反应,这一点与本申请的第3发明的方法不同。
本申请的第4发明的制造方法中使用的具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)、具有至少1个环氧基的化合物(b)、使该烯丙基胺系单体(a’)与该化合物(b)反应而得的改性烯丙基胺系单体、干聚合物2(使该改性烯丙基胺系单体聚合而得的多胺衍生物)、及烯属不饱和单体(c)与本申请的第2发明中使用的物质相同,其细节已经在本申请的第2发明的相关部分进行了描述。
[极性溶剂]
对本申请的第3发明及第4发明中使用的极性溶剂没有特别限制,可以根据聚合中使用的单体、聚合条件等适当选择,例如,可以使用介电常数为5以上的溶剂。此外,作为极性溶剂,可以使用水、乙醇、乙酸等质子性极性溶剂;乙腈、丙酮等非质子性极性溶剂中的任一种。这些中,从反应的容易性、安全性、成本等观点出发,优选使用水。
[自由基聚合引发剂]
本申请的第3发明及第4发明中使用的自由基聚合引发剂只要是可在接枝聚合条件下通过热、光、氧化-还原等刺激产生自由基的化合物即可,不受此外的限制。本申请的第3发明及第4发明中,作为自由基聚合引发剂,优选使用选自由下述物质组成的组中的聚合引发剂,因为是廉价的且容易操作,所述物质为:由通式(8)所示的偶氮系引发剂(式中,R5及R6分别独立地为碳数1~20的有机基,优选碳数4~7的有机基团。此外,优选具有氨基、脒基、或咪唑啉基的基团。)、由通式(9)所示的过氧化物系引发剂(式中,R7及R8分别独立地为氢或碳数1~20的有机基,优选碳数4~7的有机基团。)及由通式(10)所示的无机过硫酸盐系引发剂(式中,M为碱金属或铵,优选钾、钠或铵。)。
[化学式38]
R5-N=N-R6 -(8)
[化学式39]
R7-O-O-R8 -(9)
[化学式40]
自由基聚合引发剂中,作为本申请的第3发明及第4发明中优选使用的引发剂的更具体的例子,可以列举过氧化氢(化学结构参照下述式(11)。)、叔丁基过氧化氢(TBHP、化学结构参照下述式(12)。)、过氧化苯甲酰(BPO、化学结构参照下述式(13)。)、2,2’-偶氮双(2-甲基丙脒)2盐酸盐(和光纯药工业株式会社制,商品名:V-50。化学结构参照下述式(14)。)、2,2’-偶氮双[N-(2-羧乙基)-2-甲基丙脒]水合物(和光纯药工业株式会社制,商品名:VA-057。化学结构参照下述式(15)。)、2,2’-偶氮双[2-(2-咪唑啉-2-基)丙烷]2盐酸盐(和光纯药工业株式会社制,商品名:VA-044。化学结构参照下述式(16)。)、2,2’-偶氮双[2-(2-咪唑啉-2-基)丙烷]2硫酸盐2水合物(和光纯药工业株式会社制,商品名:VA-046B。化学结构参照下述式(17)。)、2,2’-偶氮双[2-(2-咪唑啉-2-基)丙烷](和光纯药工业株式会社制,商品名:VA-061。化学结构参照下述式(18)。)、2,2’-偶氮双(2-甲基丙酸甲酯)(和光纯药工业株式会社制,商品名:V-601。化学结构参照下述式(19)。)、过硫酸铵(APS。化学结构参照下述式(20)))、过硫酸钾(KPS。化学结构参照下述式(21)))、过硫酸钠(SPS。化学结构参照下述式(22)))等。这些中,过硫酸铵、过硫酸钾、过硫酸钠廉价且容易操作,因此最优选。
[化学式41]
HO-OH
-(11)
[化学式42]
[化学式43]
[化学式44]
[化学式45]
[化学式46]
[化学式47]
[化学式48]
[化学式49]
[化学式50]
[化学式51]
[化学式52]
本申请的第3发明及第4发明的制造方法中,对在干聚合物中加入烯属不饱和单体(c)及自由基聚合引发剂进行聚合的工序中的聚合温度没有特别限制,优选使用0~100℃的温度范围的多胺衍生物溶液。更优选5~80℃的温度范围的多胺衍生物溶液,特别优选10~60℃的温度范围的多胺衍生物溶液。
如此较低温的温和条件下的接枝聚合是现有技术无论如何也无法实现的,获得了超过本领域技术人员预期的显著技术效果,并且与以往相比导入成本低,能够以简便的操作安全且稳定地进行接枝聚合,这也是实用上具有较高价值的技术效果。
此外,本申请的第3发明及第4发明的制造方法中,对在干聚合物中加入烯属不饱和单体(c)及自由基聚合引发剂进行聚合的工序中的反应溶液(多胺衍生物溶液)的(依赖于各成分的pKa)pH没有特别限制,从高效地推进接枝聚合的观点出发,pH优选0以上。pH更优选4以上,特别优选7以上。
实施例
以下参照实施例对本发明进行更详细的说明。需要说明的是,本发明的范围在任何意义之下均不受这些实施例限定。
〈共聚物的重均分子量的测定〉
共聚物的重均分子量(Mw)使用日立制高效液相色谱利用凝胶渗透色谱(GPC)来测定。洗脱液流路泵使用日立L-2130惰性泵(イナートポンプ),检测器使用日立Chromaster(注册商标)5450,柱使用将Asahi Pack的水系凝胶过滤型GS-220HQ(排阻极限分子量3,000)与GS-620HQ(排除限界分子量200万)二者连接而成的柱。样品用洗脱液调节到0.5g/100ml的浓度,使用20μl。洗脱液使用0.4mol/L的氯化钠水溶液。在柱温30℃、流速1.0ml/分钟的条件下实施。使用分子量为106、194、420、615、1010、1970、3930、7920、12140、18380、21300、25240、50630、77360、116300、199800、278000、454000及895500的聚乙二醇作为标准样品,求出校正曲线,基于该校正曲线求出共聚物的重均分子量(Mw)。
〈反应溶液pH的测定〉
反应溶液的pH用pH计(株式会社堀场制作所制,B-212)来测定。在传感器上滴加25℃的反应溶液,采用1分钟后的数值。
(实施例1)环氧丙烷改性聚烯丙基胺与二甲基丙烯酰胺的接枝聚合物的制造
将20质量%的聚烯丙基胺(重均分子量3000)一边用冰水冷却和搅拌一边滴加环氧丙烷(相对于胺为2当量)。在20℃反应24小时后,将溶液浓缩,以水溶液形式获得环氧丙烷改性聚烯丙基胺。
取所获得的溶液的一部分,加入35质量%的盐酸中和而形成加成盐后,用四氢呋喃再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体的红外分光光谱示于图1。在IR测定中,在2969cm-1附近观察到起因于甲基的峰,1637cm-1附近的起因于氨基的峰减少。这些结果支持生成了环氧丙烷改性聚烯丙基胺。
此外,通过GPC测定的重均分子量为3800。将本测定中获得的GPC谱图示于图2。
在如上制备的42质量%的环氧丙烷改性聚烯丙基胺中加入水而使其成为14质量%,在20℃进行搅拌。反应溶液的pH为10。然后将65质量%的二甲基丙烯酰胺(相对于胺为3当量)和28.5质量%的APS水溶液12.01g(相对于单体为10摩尔%)分别分次加入,聚合24小时,以水溶液形式获得环氧丙烷改性聚烯丙基胺与二甲基丙烯酰胺的接枝聚合物。
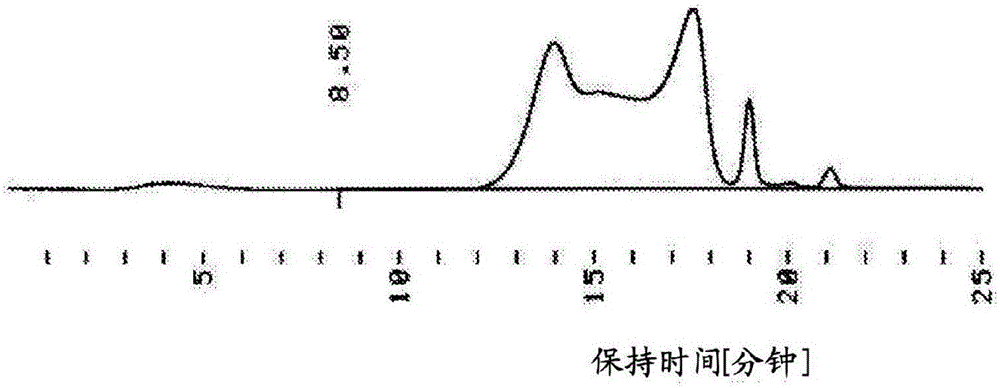
通过GPC测定,重均分子量为120000。将本测定中获得的GPC谱图示于图3。
此外,在获得的溶液的一部分中加入25质量%的氢氧化钠后,用四氢呋喃再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体溶解于水,加入35质量%的盐酸中和而形成加成盐后,用丙酮再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色固体用水溶解,加入25质量%的氢氧化钠,将所得溶液浓缩后,在40℃真空干燥24小时。将获得的白色固体的GPC谱图、红外分光光谱及1H NMR分别示于图4、图5及图6。
GPC测定的结果是,重均分子量为322000。此外,通过红外分光光谱,在1617cm-1观察到起因于酰胺基的吸收。进一步,1H NMR测定的结果是,在1.2ppm附近获得起因于环氧丙烷改性聚烯丙基胺结构中的甲基的峰,在2.9~3.1ppm附近获得起因于二甲基丙烯酰胺结构中的甲基的峰。此外,其积分比为1.00:11.50。这些结果支持生成了环氧丙烷改性聚烯丙基胺与二甲基丙烯酰胺的接枝聚合物。
(实施例2)环氧丙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
在与实施例1同样制备的50质量%的环氧丙烷改性聚烯丙基胺中加入水而使其成为30质量%,在20℃进行搅拌。反应溶液的pH为10。然后加入65质量%二烯丙基二甲基氯化铵(相对于胺为3当量)。进一步将28.5质量%的APS水溶液96.08g(相对于单体为20摩尔%)分次加入,聚合72小时,以水溶液形式获得环氧丙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
通过GPC测定的重均分子量为24000。将本测定中获得的GPC谱图示于图7。
取所获得的溶液的一部分,用乙醇再沉淀,通过过滤回收滤液后,将溶液浓缩,在40℃真空干燥24小时。将获得的淡黄色固体溶解于水后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体的GPC谱图、红外分光光谱及1H NMR分别示于图8、图9及图10。
GPC测定的结果是,重均分子量为4800。此外,通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。进一步,1H NMR测定的结果是,在1.2ppm附近获得起因于环氧丙烷改性聚烯丙基胺结构中的甲基的峰,在3.15~3.33ppm观测到来自二烯丙基二甲基氯化铵结构中的甲基的峰。这些结果支持生成了环氧丙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例3)环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物的制造
将20质量%的聚烯丙基胺一边用冰水冷却和搅拌一边滴加环氧丙烷(相对于胺为0.1当量)。在20℃反应24小时后,将溶液浓缩,以水溶液形式获得环氧丙烷改性聚烯丙基胺。
在环氧丙烷改性聚烯丙基胺中加入水而使其成为20质量%,然后加入苯乙烯(相对于胺为0.3当量),在20℃进行搅拌。反应溶液的pH为12。然后,滴加28.5质量%的APS水溶液12.01g(相对于单体为20摩尔%),聚合24小时。然后,在70℃加热24小时,获得环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物。平均粒径为120nm。
取所获得的乳白色溶液的一部分,用四氢呋喃再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的淡黄色固体用水洗涤后,滤出固体,在40℃真空干燥24小时。将获得的白色粉末状固体分散在水中后,添加水杨醛,用2-丙醇沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图11。
通过红外分光光谱,在696cm-1附近观察到起因于芳香环的吸收。此外,在1627cm-1观察到来自环氧丙烷改性聚烯丙基胺与水杨醛的反应物结构中的亚氨基的吸收。这些结果支持生成了环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物。
由起始原料及上述分析结果等推定,获得的接枝聚合物具有下式的结构(q、r、s、t、u及w分别独立地为正整数。)。
[化学式53]
(实施例4)环氧丙烷改性聚烯丙基胺与二甲基丙烯酰胺的接枝聚合物的制造(pH7下的制造)
在与实施例1同样制备的42质量%的环氧丙烷改性聚烯丙基胺中加入水而使其成为14质量%,在20℃进行搅拌。然后加入35质量%的盐酸,将pH调整为7,将二甲基丙烯酰胺(相对于胺为3当量)与28.5质量%的APS水溶液12.01g(相对于单体为10摩尔%)分别分次加入,聚合24小时,以水溶液形式获得环氧丙烷改性聚烯丙基胺与二甲基丙烯酰胺的接枝聚合物。
通过GPC测定,重均分子量为210000。将本测定中获得的GPC谱图示于图12。
此外,在获得的溶液的一部分中加入25质量%的氢氧化钠后,用四氢呋喃再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体溶解于水,加入35质量%的盐酸中和而形成加成盐后,用丙酮再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色个体的红外分光光谱示于图13。
通过红外分光光谱,在1617cm-1观察到起因于酰胺基的吸收。进一步通过电位差滴定,在pH3及pH8附近获得起因于环氧丙烷改性聚烯丙基胺的拐点。这些结果支持生成了环氧丙烷改性聚烯丙基胺与二甲基丙烯酰胺的接枝聚合物。
(实施例5)环氧辛烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
在20质量%的聚烯丙基胺中加入水而使其成为13质量%,一边用冰水冷却和搅拌一边滴加环氧辛烷(相对于胺为0.1当量)。滴加结束后,在40℃反应24小时,然后将溶液浓缩,以水溶液形式获得环氧辛烷改性聚烯丙基胺。
取所获得的溶液的一部分,加入35质量%的盐酸中和而形成加成盐后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体的红外分光光谱示于图14。在IR测定中,在1120cm-1附近观察到起因于羟基的峰。这些结果支持生成了环氧辛烷改性聚烯丙基胺。
在如上制备的30质量%的环氧辛烷改性聚烯丙基胺中加入水而使其成为19质量%,在20℃进行搅拌。反应溶液的pH为12。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分别分次加入,聚合24小时。然后,将28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分次进一步追加,以水溶液形式获得环氧辛烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
取所获得的溶液的一部分,用25质量%的氢氧化钠水溶液中和后,用乙醇再沉淀,通过过滤回收滤液后浓缩,在40℃真空干燥24小时。将获得的淡黄色固体溶解于水后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体溶解于水后,添加水杨醛,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图15。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。此外,在1627cm-1观察到来自环氧辛烷改性聚烯丙基胺与水杨醛的反应物结构中的亚氨基的吸收。这些结果支持生成了环氧辛烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例6)乙二醇二缩水甘油醚改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
在20质量%的聚烯丙基胺中加入水而使其成为13质量%,一边用冰水冷却和搅拌一边滴加乙二醇二缩水甘油醚(相对于胺为0.05当量)。滴加结束后,在40℃反应24小时,然后将溶液浓缩,以水溶液形式获得乙二醇二缩水甘油醚改性聚烯丙基胺。
取所获得的溶液的一部分,加入35质量%的盐酸中和而形成加成盐后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体的红外分光光谱示于图16。在IR测定中,在1120cm-1附近观察到起因于羟基的峰。这些结果支持生成了乙二醇二缩水甘油醚改性聚烯丙基胺。
在如上制备的30质量%的乙二醇二缩水甘油醚改性聚烯丙基胺中加入水而使其成为19质量%,在20℃进行搅拌。反应溶液的pH为12。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分别分次加入,聚合24小时,以黄色凝胶形式获得乙二醇二缩水甘油醚改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
取所获得的凝胶的一部分,用水洗涤后滤出凝胶,在40℃真空干燥24小时。将获得的淡黄色固体分散在水中后,添加水杨醛,用2-丙醇沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图17。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。此外,在1627cm-1观察到来自乙二醇二缩水甘油醚改性聚烯丙基胺与水杨醛的反应物结构中的亚氨基的吸收。这些结果支持生成了乙二醇二缩水甘油醚改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例7)环氧苯乙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
在20质量%的聚烯丙基胺中加入水而使其成为13质量%,一边用冰水冷却和搅拌一边滴加环氧苯乙烷(相对于胺为0.1当量)。滴加结束后,在40℃反应24小时,然后将溶液浓缩,以水溶液形式获得环氧苯乙烷改性聚烯丙基胺。
取所获得的溶液的一部分,加入35质量%的盐酸中和而形成加成盐后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体的红外分光光谱示于图18。在IR测定中,在1120cm-1附近观察到起因于羟基的峰。这些结果支持生成了环氧苯乙烷改性聚烯丙基胺。
在如上制备的30质量%的环氧苯乙烷改性聚烯丙基胺中加入水而使其成为19质量%,在20℃进行搅拌。反应溶液的pH为12。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分别分次加入,聚合24小时。然后,将28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分次进一步追加,以水溶液形式获得环氧苯乙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
取所获得的溶液的一部分,用25质量%的氢氧化钠水溶液中和后,用乙醇再沉淀,通过过滤回收滤液后浓缩,在40℃真空干燥24小时。将获得的淡黄色固体溶解于水后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体溶解于水后,添加水杨醛,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图19。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。此外,在1627cm-1观察到来自环氧苯乙烷改性聚烯丙基胺与水杨醛的反应物结构中的亚氨基的吸收。这些结果支持生成了环氧苯乙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例8)丁酸缩水甘油酯改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
在20质量%的聚烯丙基胺中加入水而使其成为13质量%,一边用冰水冷却和搅拌一边滴加丁酸缩水甘油酯(相对于胺为0.1当量)。滴加结束后,在40℃反应24小时,然后将溶液浓缩,以水溶液形式获得丁酸缩水甘油酯改性聚烯丙基胺。
取所获得的溶液的一部分,加入35质量%的盐酸中和而形成加成盐后、用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体的红外分光光谱示于图20。在IR测定中,在1120cm-1附近观察到起因于羟基的峰。这些结果支持生成了丁酸缩水甘油酯改性聚烯丙基胺。
在如上制备的30质量%的丁酸缩水甘油酯改性聚烯丙基胺中加入水而使其成为19质量%,在20℃进行搅拌。反应溶液的pH为12。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分别分次加入,聚合24小时。然后,将28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分次进一步追加,以水溶液形式获得丁酸缩水甘油酯改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
取所获得的溶液的一部分,用25质量%的氢氧化钠水溶液中和后,用乙醇再沉淀,通过过滤回收滤液后,将溶液浓缩,在40℃真空干燥24小时。将获得的淡黄色固体溶解于水后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体溶解于水后,添加水杨醛,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图21。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。此外,在1627cm-1观察到来自丁酸缩水甘油酯改性聚烯丙基胺与水杨醛的反应物结构中的亚氨基的吸收。这些结果支持生成了丁酸缩水甘油酯改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例9)环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物的制造
在与实施例3同样制备的环氧丙烷改性聚烯丙基胺中加入水而使其成为20质量%,然后加入苯乙烯(相对于胺为0.3当量),在20℃进行搅拌。反应溶液的pH为12。然后,滴加28.5质量%的SPS水溶液12.53g(相对于单体为20摩尔%),聚合24小时。然后,在70℃加热24小时,获得环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物。平均粒径为135nm。
取所获得的乳白色溶液的一部分,用四氢呋喃再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的淡黄色固体用水洗涤后,滤出固体,在40℃真空干燥24小时。将获得的白色粉末状固体分散在水中后,添加水杨醛,用2-丙醇沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图22。
通过红外分光光谱,在696cm-1附近观察到起因于芳香环的吸收。此外,在1627cm-1观察到来自环氧丙烷改性聚烯丙基胺与水杨醛的反应物结构中的亚氨基的吸收。这些结果支持生成了环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物。
(实施例10)环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物的制造
在与实施例3同样制备的环氧丙烷改性聚烯丙基胺中加入水而使其成为20质量%,然后加入苯乙烯(相对于胺为0.3当量),在80℃进行搅拌。反应溶液的pH为12。然后,滴加28.5质量%的APS水溶液12.01g(相对于单体为20摩尔%),聚合24小时,获得环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物。平均粒径为144nm。
取所获得的乳白色溶液的一部分,用四氢呋喃再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的淡黄色固体用水洗涤后,滤出固体,在40℃真空干燥24小时。将获得的白色粉末状固体分散在水中后,添加水杨醛,用2-丙醇沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图23。
通过红外分光光谱,在696cm-1附近观察到起因于芳香环的吸收。此外,在1627cm-1观察到来自环氧丙烷改性聚烯丙基胺与水杨醛的反应物结构中的亚氨基的吸收。这些结果支持生成了环氧丙烷改性聚烯丙基胺与苯乙烯的接枝聚合物。
(实施例11)缩水甘油改性聚二烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
在二烯丙基胺中加入水使其成为79质量%,一边用冰水冷却和搅拌一边滴加缩水甘油(相对于胺为1当量)。滴加结束后,在45℃反应24小时后,将溶液浓缩,以水溶液形式获得缩水甘油改性二烯丙基胺。
在78质量%的缩水甘油改性二烯丙基胺中加入35质量%的盐酸(相对于胺为1当量)。然后,加入水使其成为50质量%,加热到60℃,将2,2’-偶氮双(2-甲基丙脒)2盐酸盐(相对于单体为6摩尔%)分次加入,聚合24小时。将获得的溶液通过电透析而纯化,以水溶液形式获得缩水甘油改性聚二烯丙基胺。
取所获得的溶液的一部分,用丙酮再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体的红外分光光谱示于图24。在IR测定中,在1035cm-1附近观察到起因于羟基的峰。这些结果支持生成了缩水甘油改性聚二烯丙基胺。
此外,通过GPC测定的重均分子量为20000。将本测定中获得的GPC谱图示于图25。
在如上制备的43质量%的缩水甘油改性聚二烯丙基胺中加入水而使其成为30质量%,在20℃进行搅拌。反应溶液的pH为11。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液36.04g(相对于单体为10摩尔%)分别分次加入,聚合24小时。然后,将28.5质量%的APS水溶液36.04g(相对于单体为10摩尔%)分次进一步追加,在50℃聚合24小时,以水溶液形式获得缩水甘油改性聚二烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
通过GPC测定的重均分子量为84000。将本测定中获得的GPC谱图示于图26。
取所获得的溶液的一部分,用25质量%的氢氧化钠水溶液中和后,添加十二酸,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的淡黄色固体溶解于水后,用乙醇再沉淀,通过过滤回收滤液后,将溶液浓缩,在40℃真空干燥24小时。将获得的白色粉末状固体的红外分光光谱示于图27。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。进一步,通过电位差滴定在pH4及pH9附近获得起因于缩水甘油改性聚二烯丙基胺的拐点。这些结果支持生成了缩水甘油改性聚二烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例12)环氧丙烷改性聚乙撑亚胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
一边搅拌47质量%的聚乙撑亚胺(重均分子量2000),一边滴加环氧丙烷(相对于胺为0.1当量)。在20℃反应24小时,获得环氧丙烷改性聚乙撑亚胺水溶液。
取所获得的溶液的一部分实施IR测定。将获得的红外分光光谱示于图28。在IR测定中,在2930cm-1附近观察到起因于甲基的峰,观察到1580cm-1附近的起因于氨基的峰。这些结果支持生成了环氧丙烷改性聚乙撑亚胺。
在如上制备的50质量%的环氧丙烷改性聚乙撑亚胺中加入水而使其成为14质量%,在20℃进行搅拌。反应溶液的pH为12。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液31.23g(相对于单体为10摩尔%)分别分次加入,聚合24小时,以水溶液形式获得环氧丙烷改性聚乙撑亚胺与二烯丙基二甲基氯化铵的接枝聚合物。
取所获得的溶液的一部分,用25质量%的氢氧化钠水溶液中和后,用乙醇再沉淀,通过过滤回收滤液后,将溶液减压干燥,在40℃真空干燥24小时。将获得的黄色固体溶解于水后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色固体的红外分光光谱示于图29。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。进一步,通过电位差滴定在pH10、pH7、pH6、pH4附近观察到起因于环氧丙烷改性聚乙撑亚胺的拐点。这些结果支持生成了环氧丙烷改性聚乙撑亚胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例13)环氧丙烷改性聚乙烯基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
一边搅拌15质量%的聚乙烯基胺(重均分子量150000)一边滴加环氧丙烷(相对于胺为0.1当量)。在20℃反应24小时后,将溶液浓缩,获得23质量%的环氧丙烷改性聚乙烯基胺水溶液。
取所获得的溶液的一部分实施IR测定。将获得的红外分光光谱示于图30。在IR测定中,在2930cm-1附近观察到起因于甲基的峰,观察到1580cm-1附近的起因于氨基的峰。这些结果支持生成了环氧丙烷改性聚乙烯基胺。
在如上制备的23质量%的环氧丙烷改性聚乙烯基胺中加入水而使其成为15质量%,在20℃进行搅拌。反应溶液的pH为12。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液31.23g(相对于单体为10摩尔%)分别分次加入,聚合24小时,以水溶液形式获得环氧丙烷改性聚乙烯基胺与二烯丙基二甲基氯化铵的接枝聚合物。
取所获得的溶液的一部分,用25质量%的氢氧化钠水溶液中和后,用乙醇再沉淀,通过过滤回收滤液后,将溶液减压干燥,在40℃真空干燥24小时。将获得的黄色固体溶解于水后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色固体的红外分光光谱示于图31。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。进一步,通过电位差滴定在pH7、pH4附近观察到起因于环氧丙烷改性聚乙撑亚胺的拐点。这些结果支持生成了环氧丙烷改性聚乙烯基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例14)环氧丙烷改性聚二烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造
在二烯丙基胺中加入水而使其成为78质量%,一边用冰水冷却和搅拌一边滴加环氧丙烷(相对于胺为0.1当量)。在20℃反应24小时,以水溶液形式获得环氧丙烷改性二烯丙基胺。
在79质量%的环氧丙烷改性二烯丙基胺中加入35质量%的盐酸(相对于胺为1当量),以水溶液形式获得59质量%的环氧丙烷改性二烯丙基胺盐酸盐。在获得的59质量%的环氧丙烷改性二烯丙基胺盐酸盐41.33g中加入水而使其成为7质量%,加热到60℃。然后,将59质量%的环氧丙烷改性二烯丙基胺盐酸盐123.99g与2,2’-偶氮双(2-甲基丙脒)2盐酸盐(相对于单体为5.6摩尔%)分次加入,聚合24小时。将获得的溶液通过电透析而纯化,以水溶液形式获得环氧丙烷改性聚二烯丙基胺。
取所获得的溶液的一部分,用四氢呋喃再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的白色粉末状固体的红外分光光谱示于图32。在IR测定中,在1060cm-1附近观察到起因于羟基的峰。这些结果支持生成了环氧丙烷改性聚二烯丙基胺。
此外,通过GPC测定的重均分子量为3000。将本测定中获得的GPC谱图示于图33。
在如上制备的30质量%的环氧丙烷改性聚二烯丙基胺中加入水而使其成为24质量%,在20℃进行搅拌。反应溶液的pH为12。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分别分次加入,聚合24小时。然后,将28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分次进一步追加,在60℃聚合24小时,以水溶液形式获得环氧丙烷改性聚二烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
通过GPC测定的重均分子量为19000。将本测定中获得的GPC谱图示于图34。
取所获得的溶液的一部分,用25质量%的氢氧化钠水溶液中和后,用乙醇再沉淀,通过过滤回收滤液后,将溶液浓缩,在40℃真空干燥24小时。将获得的淡黄色固体分散在水中后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图35。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。进一步,通过电位差滴定在pH4及pH10附近获得起因于环氧丙烷改性聚二烯丙基胺的拐点。这些结果支持生成了环氧丙烷改性聚二烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例15)环氧丙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物的制造(使用重均分子量为2000、相对于胺添加0.1当量的环氧丙烷的环氧丙烷改性聚烯丙基胺的制造)
将15质量%的聚烯丙基胺(重均分子量1600)一边用冰水冷却和搅拌一边滴加环氧丙烷(相对于胺为0.1当量)。在20℃反应24小时后,将溶液浓缩,以水溶液形式获得环氧丙烷改性聚烯丙基胺。
通过GPC测定的重均分子量为2000。将本测定中获得的GPC谱图示于图36。
在如上制备的30质量%的环氧丙烷改性聚烯丙基胺中加入水而使其成为18质量%,在20℃进行搅拌。反应溶液的pH为10。然后将65质量%的二烯丙基二甲基氯化铵(相对于胺为3当量)与28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分别分次加入,聚合24小时。然后,将28.5质量%的APS水溶液14.42g(相对于单体为10摩尔%)分次进一步追加,在60℃聚合24小时,以水溶液形式获得环氧丙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
通过GPC测定的重均分子量为16000。将本测定中获得的GPC谱图示于图37。
取所获得的溶液的一部分,用25质量%的氢氧化钠水溶液中和后,用乙醇再沉淀,通过过滤回收滤液后浓缩,在40℃真空干燥24小时。将获得的淡黄色固体分散在水中后,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体分散在水中后,添加水杨醛,用2-丙醇再沉淀,滤出沉淀物,在40℃真空干燥24小时。将获得的黄色粉末状固体的红外分光光谱示于图38。
通过红外分光光谱,在3010cm-1附近观察到起因于二烯丙基二甲基氯化铵结构中的甲基的吸收。此外,在1627cm-1观察到来自环氧丙烷改性聚烯丙基胺与水杨醛的反应物结构中的亚氨基的吸收。这些结果支持生成了环氧丙烷改性聚烯丙基胺与二烯丙基二甲基氯化铵的接枝聚合物。
(实施例16)环氧丙烷改性聚烯丙基胺与2-乙烯基吡啶的接枝聚合物的制造
在与实施例3同样制备的环氧丙烷改性聚烯丙基胺中加入水而使其成为20质量%。然后加入2-乙烯基吡啶(相对于胺为0.3当量),在20℃进行搅拌。反应溶液的pH为12。然后,滴加28.5质量%的APS水溶液12.01g(相对于单体为20摩尔%),聚合24小时,获得环氧丙烷改性聚烯丙基胺与2-乙烯基吡啶的接枝聚合物。平均粒径为225nm。
由起始原料等推定,获得的接枝聚合物具有下式的结构(q、r、s、t、u及w分别独立地为正整数。)。
[化学式54]
产业上的可利用性
本申请的第1及第3发明的接枝聚合物及其制造方法,与以往相比导入成本低,能够以简便的操作在保持胺的特性的条件下安全且稳定地制造,因此在各种产业中具有高利用价值及高可利用性。
本申请的第2及第4发明的接枝聚合物及其制造方法,与以往相比导入成本低,能够以简便的操作高效且控制性良好地进行反应,在保持胺的特性的条件下安全且稳定地制造,因此在各种产业中具有高利用价值及高可利用性。
权利要求书(按照条约第19条的修改)
1.多胺接枝聚合物,其是使多胺衍生物与烯属不饱和单体(c)聚合而得的,所述多胺衍生物是使具有至少1个氨基的高分子化合物(a)与具有至少1个环氧基的化合物(b)反应而得的。
2.根据权利要求1所述的多胺接枝聚合物,其中,所述具有至少1个氨基的高分子化合物(a)选自由含有由通式(1)所示的结构的乙撑亚胺系(共)聚合物、含有由通式(2)所示的结构的乙烯基胺系(共)聚合物、含有由通式(3)所示的结构的烯丙基胺系(共)聚合物、含有由通式(4)所示的结构的二烯丙基胺系(共)聚合物及含有由通式(5)所示的结构的丙烯酰基胺系(共)聚合物组成的组,其中,下述通式中,n为10~200000的整数,m为5~18000的整数,l为5~15000的整数,o为10~10000的整数,p为1~100的整数,
3.多胺接枝聚合物,其是使多胺衍生物与烯属不饱和单体(c)聚合而得的,所述多胺衍生物是使具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应而得的改性烯丙基胺系单体聚合获得的。
4.根据权利要求3所述的多胺接枝聚合物,其中,所述烯丙基胺系单体(a’)为二烯丙基胺。
5.根据权利要求1~4中任一项所述的多胺接枝聚合物,其中,所述具有至少1个环氧基的化合物(b)为由通式(6)所示的化合物,其中,通式(6)中的R为取代或未取代的烃基,
6.根据权利要求1~4中任一项所述的多胺接枝聚合物,其中,所述具有至少1个环氧基的化合物(b)为由通式(7)所示的化合物且选自由下述(1)~(14)组成的组:(1)式中R1、R2、R3及R4为氢原子的环氧乙烷;(2)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羟基的碳数1~8的线型或支化的饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(3)式中R1、R2、R3及R4分别独立地为氢原子或碳数1~18的线型或支化的烷基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(4)式中R1、R2、R3及R4分别独立地为氢原子或链中含有醚键的碳数1~8的线型或支化的饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(5)式中R1、R2、R3及R4分别独立地为氢原子或卤素的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(6)式中R1、R2、R3及R4分别独立地为氢原子或不饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(7)式中R1、R2、R3及R4分别独立地为氢原子或含有脂环式烃基或具有不饱和键的环式烃基的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(8)式中R1、R2、R3及R4分别独立地为氢原子或含有芳香环或杂环的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(9)式中R1、R2、R3及R4分别独立地为氢原子或含有环氧环的烃基的多官能环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(10)式中R1、R2、R3及R4分别独立地为氢原子或链中含有烷氧基甲硅烷基的碳数3~12的线型或支化的饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(11)式中R1、R2、R3及R4分别独立地为氢原子或链中含有氟的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(12)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羧基的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(13)式中R1、R2、R3及R4分别独立地为氢原子或链中含有酯键或酰胺键的碳数1~12的线型或支化的饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;以及(14)式中R1、R2、R3及R4分别独立地为氢原子或链中具有磺酸酯基的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子,
7.根据权利要求1~6中任一项所述的多胺接枝聚合物,其中,所述乙烯系不饱和单体(c)选自由乙烯基系单体、苯乙烯系单体、甲基丙烯酸酯系单体、丙烯酸酯系单体、丙烯酰胺系单体、烯丙基系单体、二烯丙基系单体及不饱和羧酸组成的组。
8.多胺接枝聚合物的制造方法,具有在多胺衍生物中加入烯属不饱和单体(c)及自由基聚合引发剂使其聚合的工序,所述多胺衍生物是在极性溶剂中使具有至少1个氨基的高分子化合物(a)与具有至少1个环氧基的化合物(b)反应而得的。
9.多胺接枝聚合物的制造方法,具有在多胺衍生物中加入烯属不饱和单体(c)及自由基聚合引发剂使其聚合的工序,所述多胺衍生物是使在极性溶剂中具有至少1个烯丙基和至少1个氨基的烯丙基胺系单体(a’)与具有至少1个环氧基的化合物(b)反应而得的改性烯丙基胺系单体聚合获得的。
10.(修改后)根据权利要求9所述的多胺接枝聚合物的制造方法,其中,所述烯丙基胺系单体(a’)为二烯丙基胺。
11.根据权利要求8~10中任一项所述的多胺接枝聚合物的制造方法,其中,所述自由基聚合引发剂选自由通式(8)所示的偶氮系引发剂、由通式(9)所示的过氧化物系引发剂及由通式(10)所示的无机过硫酸盐系引发剂组成的组,其中,下述通式中,R5及R6分别独立地为碳数1~20的有机基团,R7及R8分别独立地为氢或碳数1~20的有机基团,M为碱金属或铵,
R5-N=N-R6 -(8)
R7-O-O-R8 -(9)
12.根据权利要求8~11中任一项所述的多胺接枝聚合物的制造方法,其中,在所述聚合工序中使用温度为0~100℃的多胺衍生物溶液。
13.根据权利要求8~12中任一项所述的多胺接枝聚合物的制造方法,在所述聚合工序中,使用pH为0以上的多胺衍生物溶液。
14.根据权利要求8~13中任一项所述的多胺接枝聚合物的制造方法,其中,所述具有至少1个环氧基的化合物(b)为由通式(7)所示的化合物且选自由下述(1)~(14)组成的组:(1)式中R1、R2、R3及R4为氢原子的环氧乙烷;(2)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羟基的碳数1~8的线型或支化的饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(3)式中R1、R2、R3及R4分别独立地为氢原子或碳数1~18的线型或支化的烷基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(4)式中R1、R2、R3及R4分别独立地为氢原子或链中含有醚键的碳数1~8的线型或支化的饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(5)式中R1、R2、R3及R4分别独立地为氢原子或卤素的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(6)式中R1、R2、R3及R4分别独立地为氢原子或不饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(7)式中R1、R2、R3及R4分别独立地为氢原子或含有脂环式烃基或具有不饱和键的环式烃基的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(8)式中R1、R2、R3及R4分别独立地为氢原子或含有芳香环或杂环的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(9)式中R1、R2、R3及R4分别独立地为氢原子或含有环氧环的烃基的多官能环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(10)式中R1、R2、R3及R4分别独立地为氢原子或链中含有烷氧基甲硅烷基的碳数3~12的线型或支化的饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(11)式中R1、R2、R3及R4分别独立地为氢原子或链中含有氟的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(12)式中R1、R2、R3及R4分别独立地为氢原子或链中含有羧基的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;(13)式中R1、R2、R3及R4分别独立地为氢原子或链中含有酯键或酰胺键的碳数1~12的线型或支化的饱和烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子;以及(14)式中R1、R2、R3及R4分别独立地为氢原子或链中具有磺酸酯基的烃基的环氧化合物,其中,R1、R2、R3及R4不全部为氢原子,
- 还没有人留言评论。精彩留言会获得点赞!
- 一种HDPE多单体接枝聚合物及其制备方法与制造工艺
- 接枝用的夹具的制作方法
- 一种两嵌段低分子聚合物接枝纳米二氧化硅粒子、制备方法和聚酯的制作方法
- 基于聚醚接枝改性的热增黏聚合物及其制备方法
- 以马铃薯淀粉为原料一锅法接枝聚合合成含钾高吸水树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Ni<sup>2+</sup>离子树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Co<sup>2+</sup>离子树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Ag<sup>+</sup>离子树脂的方法
- 一种合成温敏含糖聚合物接枝的纳米金胶束的方法
- 一种基于点击化学的超支化聚合物接枝碳纳米管的制备方法
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 使用新颖的阳离子性接枝聚合物的目标物分离浓缩方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 一种原位制备黑磷混杂聚合物的制备方法与流程
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 一种高接枝率聚烯烃接枝物的制备方法及该高接枝率聚烯烃接枝物的应用与流程
- 一种接枝视黄醇聚合物及采用其作为载体的喜树碱化合物的制作方法与工艺
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 棉织物用聚合物/Ag掺杂纳米ZnO长效抗菌防霉整理剂及其制备方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 一种抗菌纳米碳溶胶、纳米石墨辐照接枝改性锦纶单丝滤布及其制备方法与流程
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 一种高接枝率聚烯烃接枝物的制备方法及该高接枝率聚烯烃接枝物的应用与流程
- 一种高抗冲聚丙烯接枝聚合物及其制备方法与流程
- 非硫化硅烷改性聚合物锌粉膏及其用于悬索桥主缆的复合防护结构的制作方法与工艺