星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
本发明属于生物材料技术领域,特别是涉及基因治疗领域,具体地涉及一种选择性粘附内皮细胞的基于星形聚合物的基因载体及制备方法。
技术背景
在冠状动脉硬化的临床治疗中,人工血管移植是一种重要的治疗手段,而原位快速内皮化是解决人工血管移植后再狭窄问题的关键一步。在这一过程中,血液中的内皮细胞在移植的人工血管材料内壁上的吸附、迁移和增殖对于在植入体中形成新的内皮层十分重要。为了实现人工血管的快速内皮化,许多学者致力于提高材料表面对内皮细胞的选择性粘附能力。一种方法是将能促进内皮细胞粘附的抗体(如CD34、CD133等)修饰或固定在人工血管的材料表面,另一种方法是将一些能够选择性粘附内皮细胞的活性多肽引入到材料表面促进原位快速内皮化。和抗体相比,活性多肽具有更简单的结构,高生物活性和更稳定的性质。
三肽精氨酸(Arg)-谷氨酸(Gly)-天冬氨酸(Asp)(RGD)是一种序列最短的细胞吸附活性多肽,也是目前应用最为广泛的活性多肽,用来修饰合成材料的表面以促进材料对细胞的吸附和增殖。然而RGD是一种普适性细胞吸附多肽,在吸附内皮细胞的同时还会吸附血小板、平滑肌细胞等其他一些细胞,容易造成人工血管的再狭窄。因此选择一种能对内皮细胞特异性吸附的活性多肽,对实现人工血管材料的快速内皮化至关重要。四肽精氨酸(Arg)-谷氨酸(Gly)-天冬氨酸(Asp)-缬氨酸(Val)(REDV)是纤维粘连蛋白CS5区的多肽片段,能特异性识别整合素α4β1,而整合素α4β1大量存在于内皮细胞表面,在平滑肌细胞中含量很低,因此REDV可以特异性吸附内皮细胞,同时能够抑制平滑肌细胞的吸附、增殖和迁移。
近年来,基因治疗作为一种实现人工血管快速内皮化的新型手段受到了学者们越来越多的关注。与病毒基因载体不同,聚阳离子型的非病毒载体的安全性较高,容易被修饰到聚合物主链上,受到了人们较多的关注。其中聚乙烯亚胺(PEI)在体内和体外都是应用最为成功的一种聚阳离子基因载体。由于PEI含有大量的氨基,正电荷较多,进入细胞后可以通过“质子海绵作用”促使载体实现内涵体逃逸过程,大大增加了转染效率。但是由于较高的电荷密度,PEI在具有高的细胞转染效率的同时也具有一定的细胞毒性,并且PEI的分子量越大,表现出来的细胞毒性越高。因此,如何获得低毒高效的靶向性基因载体仍然是研究者们的努力方向。
为降低PEI的毒性,获得低毒高效的基因载体,本发明采用星形可降解聚合物接枝多肽和PEI,形成多肽修饰的两亲性聚合物,在水相中自组装形成基因载体,有利于内涵体逃逸。而且,在基因载体表面引入活性多肽CREDVW,形成核-壳-冠型结构,作为基因载体,能够获得更低的毒性和更高的转染效果。
此外,和相同分子量的线性聚合物相比,本发明制备的基于星型聚合物的基因载体在选择性溶剂中自组装形成的胶束一般会相对较小,有利于在体内的长循环,避免被体内网状内皮系统捕获并排出;同时,由于多条亲水链段连接在同一疏水节点上,两亲性星型共聚物在水溶液中形成基因载体后,亲水链段的活动受到限制,会使基因载体的结构更加稳定,增加基因载体在体内的循环时间。
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种具有可降解性、低毒性、高效性及对内皮细胞靶向性的星形聚合物接枝多肽和聚乙烯亚胺的基因载体。
本发明的第二个目的是提供星形聚合物接枝多肽和聚乙烯亚胺的基因载体的制备方法。
本发明的第三个目的是提供星形聚合物接枝多肽和聚乙烯亚胺的基因载体的应用。
本发明的技术方案概述如下:
星形聚合物接枝多肽和聚乙烯亚胺的基因载体的制备方法,包括如下步骤:
(1)将山梨醇、LA和MMD放入干燥的聚合管中,再加入辛酸亚锡作催化剂,密封;
所述山梨醇、LA、MMD和辛酸亚锡的摩尔比为33-66:616:62-616:20-25;
所述LA为丙交酯的简称,所述MMD为3(S)-甲基-吗啉-2,5-二酮的简称;
(2)对聚合管抽真空,通氮气;
(3)重复步骤(2)8-12次,于140-150℃反应24-28小时,得到P(LA-co-MMD)粗品;
(4)将P(LA-co-MMD)粗品用三氯甲烷溶解得到溶液1,将溶液1滴加入搅拌下的正己烷中,有沉淀生成;固液分离,所述三氯甲烷和正己烷的体积比为1:8-12;
(5)重复步骤(4)2-3次,得到的沉淀在真空干燥箱中干燥至恒重,得到P(LA-co-MMD);
(6)按摩尔比为1:15-30:15-30的比例,将P(LA-co-MMD)、丁二酸酐和二甲氨基吡啶,以及三乙胺溶解在干燥的1,4-二氧六环中,在25-30℃、氮气保护下反应20-25小时,得到溶液2,将溶液2滴加入搅拌下的0-10℃的乙醇中,有沉淀生成;固液分离,固体溶解于三氯甲烷中,依次用饱和NaHCO3水溶液洗涤2-3次,稀盐酸洗涤3-4次,饱和NaCl水溶液洗涤4-5次,得到的溶液加入无水硫酸钠干燥,抽滤,滤液滴加入搅拌下的正己烷中,有沉淀生成,固液分离,固体真空干燥至恒重,得端基为羧基的P(LA-co-MMD);所述三乙胺为P(LA-co-MMD)质量的1-3倍;
(7)按摩尔比为1:15-30:15-30的比例,将端基为羧基的P(LA-co-MMD)、EDC和NHS溶解在DMSO中,室温搅拌1-2小时,加入PEI的二甲基亚砜溶液中,使端基为羧基的P(LA-co-MMD)和PEI的摩尔比为1:15-30,室温搅拌反应20-24小时,置于截留分子量为1.4万的透析袋中,用超纯水透析2-3天,透析液冷冻干燥得P(LA-co-MMD)-g-PEI;
所述EDC为(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)的简称;
所述NHS为(N-羟基丁二酰亚胺)的简称;
所述PEI为(聚乙烯亚胺)的简称;
所述DMSO为二甲基亚砜的简称;
(8)将P(LA-co-MMD)-g-PEI溶解于二甲基亚砜中得溶液3,向溶液3中逐滴加入MAL-PEG-NHS的DMSO溶液和CREDVW多肽的DMSO溶液;在25℃下搅拌10-15小时,置于截留分子量为7000的透析袋中,用超纯水透析2-3天,透析液冷冻干燥得P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽;
所述P(LA-co-MMD)-g-PEI、MAL-PEG-NHS和CREDVW多肽的摩尔比为1:6-12:9-18;
(9)以DMSO为溶剂,配制浓度为2-5毫克/毫升的P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽溶液为溶液4,将溶液4以10秒一滴的速度滴入搅拌的pH=7.4的PBS缓冲溶液中,密封、静置10-14小时,移入截留分子量为3500的透析袋中,透析2-3天,得到星形聚合物接枝多肽和聚乙烯亚胺的基因载体;
溶液4与pH=7.4的PBS缓冲溶液的体积比为1:5-20。
上述方法制备的星形聚合物接枝多肽和聚乙烯亚胺的基因载体。
上述星形聚合物接枝多肽和聚乙烯亚胺的基因载体在制备促进内皮细胞迁移和增殖药物的应用。
本发明的优点是:
(1)本发明的星形聚合物接枝多肽和聚乙烯亚胺的基因载体具有核-壳-冠结构,相对于其它基因载体,更加稳定,更有利于其内涵体逃逸,且引入可降解的疏水段,能够降低其毒性,更有利于提高其细胞内在化和转染效率。
(2)采用山梨醇作为引发剂,制备星形聚合物,相对于同分子量线形聚合物来说,能够形成更小粒径的基因载体,有利于进入细胞,从而提高内在化效率。
(3)本发明的基因载体具有对内皮细胞的靶向性,有利于在内皮细胞与平滑肌细胞共存条件下,选择性的促进内皮细胞的增殖和迁移,从而达到快速内皮化的目的。
附图说明
图1为核磁图,其中:
(a)为P(LA-co-MMD)的核磁图,其特征峰为:δa=5.18ppm(OCHCH3CO)、δb=4.70ppm(COCHCH3NH)、δc=1.55(OCHCH3CO)、δd=1.34(COCHCH3NH)。由δa和δb这两个特征峰的积分峰面积计算可得聚合物中LA含量为83.7%。
(b)为端基为羧基的P(LA-co-MMD)的核磁图,新出现的特征峰为:δe=2.73ppm(COCH2CH2COOH)。
(c)为P(LA-co-MMD)-g-PEI的核磁图,δf=2.65ppm(CH2CH2)为聚合中PEI的特征峰。
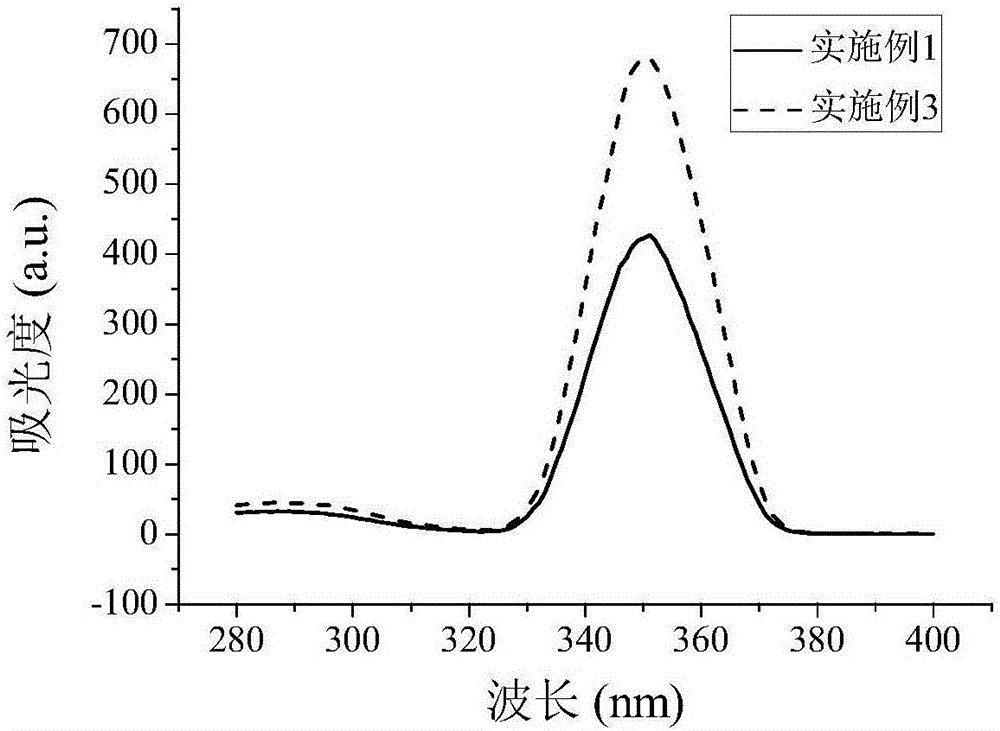
图2为实施例1和实施例3制备的星形聚合物接枝多肽和聚乙烯亚胺的基因载体溶液的荧光吸收图。
图3为星形聚合物接枝多肽和聚乙烯亚胺的基因载体及其基因复合物的粒径电位图。
图4星形聚合物接枝多肽和聚乙烯亚胺的基因载体及其基因复合物的细胞相对活性图。
图5内皮细胞划痕图。
具体实施方式
下面结合具体实施例进一步阐述本发明。应理解,该实施例仅用于说明本发明而不用于限制本发明的范围。此外,在阅读本发明讲授的内容之后,本领域技术人员可以对本发明做改动或修改,该等价形式同样落于本申请的权利要求所限定的范围。
MAL-PEG-NHS购于北京键凯科技有限公司;
EA.hy926细胞购于中国科学院细胞库(上海研发公共服务平台);
CREDVW多肽序列为半胱氨酸-精氨酸-谷氨酸-天冬氨酸-缬氨酸-色氨酸
各实施例中:
LA为丙交酯的简称,MMD为3(S)-甲基-吗啉-2,5-二酮的简称;
EDC为(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)的简称;
NHS为(N-羟基丁二酰亚胺)的简称;
PEI为(聚乙烯亚胺)的简称;
DMSO为二甲基亚砜的简称;
实施例1
星形聚合物接枝多肽和聚乙烯亚胺的基因载体的制备方法,包括如下步骤:
(1)将山梨醇、LA和MMD放入干燥的聚合管中,再加入辛酸亚锡作催化剂,密封;
所述山梨醇、LA、MMD和辛酸亚锡的摩尔比为33:616:62:20;
(2)对聚合管抽真空,通氮气;
(3)重复步骤(2)8次,于140℃反应28小时,得到P(LA-co-MMD)粗品;
(4)将P(LA-co-MMD)粗品用三氯甲烷溶解得到溶液1,将溶液1滴加入搅拌下的正己烷中,有沉淀生成;固液分离,所述三氯甲烷和正己烷的体积比为1:8;
(5)重复步骤(4)2次,得到的沉淀在真空干燥箱中干燥至恒重,得到P(LA-co-MMD),见图1(a);
(6)按摩尔比为1:15:15的比例,将P(LA-co-MMD)、丁二酸酐和二甲氨基吡啶,以及三乙胺溶解在干燥的1,4-二氧六环中,在25℃、氮气保护下反应25小时,得到溶液2,将溶液2滴加入搅拌下的0℃的乙醇中,有沉淀生成;固液分离,固体溶解于三氯甲烷中,依次用饱和NaHCO3水溶液洗涤2次,稀盐酸洗涤3次,饱和NaCl水溶液洗涤4次,得到的溶液加入无水硫酸钠干燥,抽滤,滤液滴加入搅拌下的正己烷中,有沉淀生成,固液分离,固体真空干燥至恒重,得端基为羧基的P(LA-co-MMD),见图1(b);所述三乙胺为P(LA-co-MMD)质量的1倍;
(7)按摩尔比为1:15:15的比例,将端基为羧基的P(LA-co-MMD)、EDC和NHS溶解在DMSO中,室温搅拌1小时,加入PEI的二甲基亚砜溶液中,使端基为羧基的P(LA-co-MMD)和PEI的摩尔比为1:15,室温搅拌反应20小时,置于截留分子量为1.4万的透析袋中,用超纯水透析2天,透析液冷冻干燥得P(LA-co-MMD)-g-PEI,见图1(c);
(8)将P(LA-co-MMD)-g-PEI溶解于二甲基亚砜中得溶液3,向溶液3中逐滴加入MAL-PEG-NHS的DMSO溶液和CREDVW多肽的DMSO溶液;在25℃下搅拌10小时,置于截留分子量为7000的透析袋中,用超纯水透析2天,透析液冷冻干燥得P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽;
所述P(LA-co-MMD)-g-PEI、MAL-PEG-NHS和CREDVW多肽的摩尔比为1:6:9;
(9)以DMSO为溶剂,配制浓度为2毫克/毫升的P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽溶液为溶液4,将溶液4以10秒一滴的速度滴入搅拌的pH=7.4的PBS缓冲溶液中,密封、静置10小时,移入截留分子量为3500的透析袋中,透析2天,得到星形聚合物接枝多肽和聚乙烯亚胺的基因载体;
溶液4与pH=7.4的PBS缓冲溶液的体积比为1:5。
实施例2
星形聚合物接枝多肽和聚乙烯亚胺的基因载体的制备方法,包括如下步骤:
(1)将山梨醇、LA和MMD放入干燥的聚合管中,再加入辛酸亚锡作催化剂,密封;
所述山梨醇、LA、MMD和辛酸亚锡的摩尔比为44:616:83:20;
(2)对聚合管抽真空,通氮气;
(3)重复步骤(2)10次,于145℃反应26小时,得到P(LA-co-MMD)粗品;
(4)将P(LA-co-MMD)粗品用三氯甲烷溶解得到溶液1,将溶液1滴加入搅拌下的正己烷中,有沉淀生成;固液分离,所述三氯甲烷和正己烷的体积比为1:10;
(5)重复步骤(4)3次,得到的沉淀在真空干燥箱中干燥至恒重,得到P(LA-co-MMD);
(6)按摩尔比为1:20:20的比例,将P(LA-co-MMD)、丁二酸酐和二甲氨基吡啶,以及三乙胺溶解在干燥的1,4-二氧六环中,在28℃、氮气保护下反应23小时,得到溶液2,将溶液2滴加入搅拌下的5℃的乙醇中,有沉淀生成;固液分离,固体溶解于三氯甲烷中,依次用饱和NaHCO3水溶液洗涤3次,稀盐酸洗涤4次,饱和NaCl水溶液洗涤5次,得到的溶液加入无水硫酸钠干燥,抽滤,滤液滴加入搅拌下的正己烷中,有沉淀生成,固液分离,固体真空干燥至恒重,得端基为羧基的P(LA-co-MMD);所述三乙胺为P(LA-co-MMD)质量的2倍;
(7)按摩尔比为1:20:20的比例,将端基为羧基的P(LA-co-MMD)、EDC和NHS溶解在DMSO中,室温搅拌2小时,加入PEI的二甲基亚砜溶液中,使端基为羧基的P(LA-co-MMD)和PEI的摩尔比为1:25,室温搅拌反应22小时,置于截留分子量为1.4万的透析袋中,用超纯水透析3天,透析液冷冻干燥得P(LA-co-MMD)-g-PEI;
(8)将P(LA-co-MMD)-g-PEI溶解于二甲基亚砜中得溶液3,向溶液3中逐滴加入MAL-PEG-NHS的DMSO溶液和CREDVW多肽的DMSO溶液;在25℃下搅拌13小时,置于截留分子量为7000的透析袋中,用超纯水透析3天,透析液冷冻干燥得P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽;
所述P(LA-co-MMD)-g-PEI、MAL-PEG-NHS和CREDVW多肽的摩尔比为1:8:12;
(9)以DMSO为溶剂,配制浓度为4毫克/毫升的P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽溶液为溶液4,将溶液4以10秒一滴的速度滴入搅拌的pH=7.4的PBS缓冲溶液中,密封、静置12小时,移入截留分子量为3500的透析袋中,透析3天,得到星形聚合物接枝多肽和聚乙烯亚胺的基因载体;
溶液4与pH=7.4的PBS缓冲溶液的体积比为1:10。
实施例3
星形聚合物接枝多肽和聚乙烯亚胺的基因载体的制备方法,包括如下步骤:
(1)将山梨醇、LA和MMD放入干燥的聚合管中,再加入辛酸亚锡作催化剂,密封;
所述山梨醇、LA、MMD和辛酸亚锡的摩尔比为66:616:616:25;
(2)对聚合管抽真空,通氮气;
(3)重复步骤(2)12次,于150℃反应24小时,得到P(LA-co-MMD)粗品;
(4)将P(LA-co-MMD)粗品用三氯甲烷溶解得到溶液1,将溶液1滴加入搅拌下的正己烷中,有沉淀生成;固液分离,所述三氯甲烷和正己烷的体积比为1:12;
(5)重复步骤(4)3次,得到的沉淀在真空干燥箱中干燥至恒重,得到P(LA-co-MMD);
(6)按摩尔比为1:30:30的比例,将P(LA-co-MMD)、丁二酸酐和二甲氨基吡啶,以及三乙胺溶解在干燥的1,4-二氧六环中,在30℃、氮气保护下反应20小时,得到溶液2,将溶液2滴加入搅拌下的10℃的乙醇中,有沉淀生成;固液分离,固体溶解于三氯甲烷中,依次用饱和NaHCO3水溶液洗涤3次,稀盐酸洗涤4次,饱和NaCl水溶液洗涤5次,得到的溶液加入无水硫酸钠干燥,抽滤,滤液滴加入搅拌下的正己烷中,有沉淀生成,固液分离,固体真空干燥至恒重,得端基为羧基的P(LA-co-MMD);所述三乙胺为P(LA-co-MMD)质量的3倍;
(7)按摩尔比为1:30:30的比例,将端基为羧基的P(LA-co-MMD)、EDC和NHS溶解在DMSO中,室温搅拌2小时,加入PEI的二甲基亚砜溶液中,使端基为羧基的P(LA-co-MMD)和PEI的摩尔比为1:30,室温搅拌反应24小时,置于截留分子量为1.4万的透析袋中,用超纯水透析3天,透析液冷冻干燥得P(LA-co-MMD)-g-PEI;
(8)将P(LA-co-MMD)-g-PEI溶解于二甲基亚砜中得溶液3,向溶液3中逐滴加入MAL-PEG-NHS的DMSO溶液和CREDVW多肽的DMSO溶液;在25℃下搅拌15小时,置于截留分子量为7000的透析袋中,用超纯水透析3天,透析液冷冻干燥得P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽;
所述P(LA-co-MMD)-g-PEI、MAL-PEG-NHS和CREDVW多肽的摩尔比为1:12:18;
(9)以DMSO为溶剂,配制浓度为5毫克/毫升的P(LA-co-MMD)-g-PEI-g-PEG-CREDVW多肽溶液为溶液4,将溶液4以10秒一滴的速度滴入搅拌的pH=7.4的PBS缓冲溶液中,密封、静置14小时,移入截留分子量为3500的透析袋中,透析3天,得到星形聚合物接枝多肽和聚乙烯亚胺的基因载体;
溶液4与pH=7.4的PBS缓冲溶液的体积比为1:20。
实施例4
星形聚合物接枝多肽和聚乙烯亚胺的基因载体(简称基因载体)与ZNF580基因(SEQ ID NO.1)制备N/P摩尔比为5的基因复合物:
步骤为:将浓度为0.10毫克/毫升的ZNF580基因水溶液在搅拌条件下,按N/P(PEI中的氮/DNA中的磷摩尔比)=5滴加到基因载体水溶液中,搅拌1小时,得到基因复合物。
对照:
星形聚合物接枝多肽(其中多肽序列为CREVDW,没有活性)和聚乙烯亚胺的基因载体(简称对照基因载体)与ZNF580基因制备N/P摩尔比为5的对照基因复合物1:
步骤为:将浓度为0.10毫克/毫升的ZNF580基因水溶液在搅拌条件下,按N/P(PEI中的氮/DNA中的磷摩尔比)=5滴加到对照基因载体水溶液中,搅拌1小时,得到对照基因复合物1。
用聚乙烯亚胺(分子量为1万)和ZNF580基因制备N/P摩尔比为5的对照基因复合物2:
步骤为:将浓度为0.10毫克/毫升的ZNF580基因水溶液在搅拌条件下,按N/P(PEI中的氮/DNA中的磷摩尔比)=5滴加到聚乙烯亚胺水溶液中,搅拌1小时,得到对照基因复合物2。
基因载体、基因复合物、对照基因载体、对照基因复合物1和对照基因复合物2的细胞毒性由MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)比色法进行评价。
步骤如下:EA.hy926细胞接种到96孔板(1×104细胞/孔)细胞培养基中,细胞生长到90%后,将细胞培养基换为无血清培养基,进行饥饿处理12小时。之后培养基换为新鲜的生长培养基(10%FBS DMEM)。将不同浓度的基因载体、基因复合物、对照基因载体、对照基因复合物1和对照基因复合物2水溶液加入到生长培养基中,混合均匀,24小时后弃去上层清液,向每个孔中加入5毫克/毫升的MTT溶液20微升,继续培养4小时,使甲瓒充分结晶。培养,小心弃去孔内培养基,而后向孔内加入150微升DMSO,置摇床上低速振荡10分钟,使结晶物充分溶解。用酶联免疫检测仪在490纳米波长处测量各孔的光密度值(OD)。利用如下公式计算相对细胞活性(%):
其中,OD490’:实验组减去调零组的吸光度值,avg(OD490C’):矫正后的对照组吸光度平均值。
分析结果:聚阳离子PEI由于具有高的正电荷密度,容易在细胞表面产生聚集而使细胞死亡,具有一定的细胞毒性,而基因治疗则要求载体具有较低的细胞毒性。
图4为细胞毒性,分别测定了对照基因复合物2、实施例1、实施例3制备的基因载体及其基因复合物、按实施例1、实施例3方法制备的对照基因载体及其对照基因复合物1。相同浓度下,基因载体及其基因复合物细胞毒性远远低于对照基因复合物2的细胞毒性,另外,与相同浓度下的对照基因复合物1的细胞毒性相比,可以看出基因复合物的细胞毒性低,这说明基因载体中接枝的活性多肽CREDVW明显降低基因载体的细胞毒性。
实施例5
利用划痕实验来评价EA.hy926细胞经基因复合物、对照基因复合物1和对照基因复合物2转染后的迁移能力。
在24孔板内利用基因复合物、对照基因复合物1和对照基因复合物2(N/P=5)转染EA.hy926细胞,转染48小时后,利用200微升移液器枪头在每个孔内轻轻地划出一条连续的细胞层断面。用D-hanks缓冲液(pH=7.4)洗掉孔内的细胞碎屑。利用倒置显微镜(Olympus CKX41)观察划痕处细胞的迁移过程,在确定的时间间隔0、12、24小时对其拍照。利用Image J 2.1软件计算照片中细胞的迁移面积。划痕处细胞的迁移面积百分比按照如下公式计算:
分析结果:图5为不同时间点EA.hy926细胞的迁移过程(A)和由Image-Pro Plus(6.0)计算的24小时后的细胞迁移面积(B)。其中,
a为对照基因复合物2转染细胞的迁移面积;
b为实施例1制备的基因复合物转染细胞的迁移面积;
c为实施例3制备的基因复合物转染细胞的迁移面积;
d为按照实施例1方法制备的对照基因复合物1转染细胞的迁移面积;
e为按照实施例3方法制备的对照基因复合物1转染细胞的迁移面积。
经基因复合物转染的细胞的迁移能力(76.2%(实施例1)和78.5%(实施例3))明显高于经对照基因复合物1(58.9%(实施例1)和57.7%(实施例3))和对照基因复合物2(48%)转染的细胞的迁移能力,这说明基因载体携带ZNF580基因转染内皮细胞,可以大大提高内皮细胞的增殖和迁移能力。
实施例6
用星形聚合物接枝多肽和聚乙烯亚胺的基因载体(简称基因载体)和ZNF580基因制备N/P摩尔比为5,10,15和20的基因复合物:
将浓度为0.10毫克/毫升的ZNF580基因水溶液在搅拌条件下,按N/P(PEI中的氮/DNA中的磷摩尔比)=5,10,15和20分别滴加到基因载体水溶液中,搅拌1小时。用动态光散射测定基因载体及基因复合物的流体力学直径和电位。
见图3,从图3中可以看出:
(a)为实施例1制备的基因载体和基因复合物的粒径电位;
(b)为实施例3制备的基因载体和基因复合物的粒径电位;
实施例1制备的基因载体及其基因复合物、实施例3制备的基因载体及其基因复合物的粒径依次为232纳米和209纳米,电位依次为16.4毫伏和14.2毫伏。
粒径和电位测试结果表明,基因载体及其基因复合物的粒径较小(小于250纳米)且电位为正,适合细胞摄取,有利于基因复合物对细胞的转染。
SEQ ID NO.1,人工合成
SEQUENCE LISTING
<110> 天津大学
<120> 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法
<130>
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 519
<212> DNA
<213> 人工合成
<400> 1
atgctgctgc tgcctccgcg cccaccgcat ccgcgttctt cttctccaga agcaatggac 60
ccgccgcctc cgaaagcccc accgttcccg aaagctgaag gcccgtcctc tactccgtct 120
agcgccgctg gcccgcgtcc gccacgcctg ggtcgtcacc tgctgatcga tgccaacggt 180
gtaccgtaca cctacactgt tcagctggaa gaggaaccac gtggcccgcc gcaacgtgaa 240
gcacctccgg gtgaaccggg ccctcgtaaa ggttattcct gcccggaatg tgcacgtgtg 300
ttcgcatctc cgctgcgtct gcagagccac cgcgttagcc actccgacct gaagccgttc 360
acctgcggcg cgtgcggtaa agctttcaaa cgtagctccc acctgtctcg tcaccgtgcg 420
acccaccgcg ctcgtgcggg tccgccgcat acgtgcccgc tgtgtccacg tcgctttcag 480
gatgctgcgg agctggcgca gcacgtccgc ctgcattaa 519
- 还没有人留言评论。精彩留言会获得点赞!
- 一种HDPE多单体接枝聚合物及其制备方法与制造工艺
- 接枝用的夹具的制作方法
- 一种两嵌段低分子聚合物接枝纳米二氧化硅粒子、制备方法和聚酯的制作方法
- 基于聚醚接枝改性的热增黏聚合物及其制备方法
- 以马铃薯淀粉为原料一锅法接枝聚合合成含钾高吸水树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Ni<sup>2+</sup>离子树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Co<sup>2+</sup>离子树脂的方法
- 以马铃薯淀粉为原料氧化、碱糊化及接枝聚合一锅法制备吸附Ag<sup>+</sup>离子树脂的方法
- 一种合成温敏含糖聚合物接枝的纳米金胶束的方法
- 一种基于点击化学的超支化聚合物接枝碳纳米管的制备方法
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 使用新颖的阳离子性接枝聚合物的目标物分离浓缩方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 一种原位制备黑磷混杂聚合物的制备方法与流程
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 一种高接枝率聚烯烃接枝物的制备方法及该高接枝率聚烯烃接枝物的应用与流程
- 一种接枝视黄醇聚合物及采用其作为载体的喜树碱化合物的制作方法与工艺
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 棉织物用聚合物/Ag掺杂纳米ZnO长效抗菌防霉整理剂及其制备方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 一种抗菌纳米碳溶胶、纳米石墨辐照接枝改性锦纶单丝滤布及其制备方法与流程
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 星形聚合物接枝多肽和聚乙烯亚胺的基因载体及制备方法与流程
- 一种木质纤维接枝丙烯酰胺聚合物及其制备方法与流程
- 含橡胶接枝聚合物粉体、以及含有其的太阳能电池用密封材料和夹层玻璃用中间膜的制作方法与工艺
- 附接到可降解的聚合物区的支撑件的制作方法与工艺
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 接枝聚合物、树脂着色物、该树脂着色物的制造方法和包含该树脂着色物的树脂组合物与流程
- 角蛋白接枝水性聚氨酯聚合物皮革复鞣填充材料的制备方法与流程
- 一种高接枝率聚烯烃接枝物的制备方法及该高接枝率聚烯烃接枝物的应用与流程
- 一种高抗冲聚丙烯接枝聚合物及其制备方法与流程
- 非硫化硅烷改性聚合物锌粉膏及其用于悬索桥主缆的复合防护结构的制作方法与工艺