微生物生长培养基和使用其的方法与流程
一般而言,本发明涉及微生物生长培养基和它们的使用方法。
背景
在许多产业中,尤其是食品、饮料、医疗保健、电子和制药产业,快速分析样本的微生物(例如细菌、酵母或霉菌)的污染程度是必不可少的。尤其是,制药公司和生物制品公司必须检测无菌产品是否存在微生物污染物。传统的检测,如在美国药典专论<71>中所描述的,是基于生长的化验,该化验在22.5℃使用胰酶解酪蛋白大豆肉汤(TSB)和在32.5℃使用巯基乙酸盐液体培养基(FTM)。TSB是通用生长培养基,用于检测酵母、霉菌和好氧菌。FTM具有好氧性层和厌氧性层,并用于检测专性厌氧菌以及好氧菌。这种生长条件的组合的目的是生长尽可能多的有机体。尽管FTM具有生长厌氧菌的能力,但是其是弱通用性培养基,对于许多物种具有有限的生长促进的性质。此外,FTM支持微生物(尤其是厌氧微生物)在表面上的生长的能力有限。
其它已知的生长培养基,例如Schaedler培养基,专门支持一些微生物的生长。例如,Schaedler培养基被优化来支持人类病原体的生长,然而检测无菌产品需要能支持尽可能多的微生物的生长的通用培养基。
仍需要一种通用生长培养基,其能支持好氧菌和厌氧菌尤其在膜上的生长。
技术实现要素:
本发明的特征是一种通用微生物生长培养基,其相比于其它培养基可支持厌氧菌、霉菌、受损孢子和一般好氧菌更大程度地生长。本发明的特征是一种组合物,其包含酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如,磷酸钾缓冲液)、血晶素和L-胱氨酸。
在第一方面,所述组合物在22℃是固体,例如粉末。所述第一方面的组合物的实施方式概述于表1中。以各组分的克数相对于所述总组合物的千克数的方式提供量,且本领域技术人员会理解每一种单一组分的总量将不超过1kg。
表1
在所述第一方面的具体实施方式中,在表1中描述的所述组合物进一步包括磷酸盐缓冲液,例如磷酸氢二钾或其水合物和磷酸二氢钾或其水合物的混合物。在其它实施方式中,在所述第一方面的所述组合物中存在的磷酸盐缓冲液(例如磷酸钾缓冲液)的量足以在通过表1的所述组合物和所述磷酸缓冲液溶于或悬浮于含水介质(例如纯水、绵羊血(例如去纤维蛋白绵羊血或血球溶解(laked)绵羊血(laked sheep blood))、或这两者)产生的培养基中提供0.1mmol/(pH单位)至100mmol/(pH单位),例如1mmol/(pH单位)至50mmol/(pH单位)、2mmol/(pH单位)至20mmol/(pH单位)、或3mmol/(pH单位)至10mmol/(pH单位)的缓冲容量。在其它实施方式中,磷酸盐缓冲液(例如,磷酸钾缓冲液)以足以在液态或凝胶组合物中产生7.3±0.5的pH的量存在(例如pH 7.3±0.2)。
在所述第一方面的一些实施方式中,所述组合物进一步含有胶凝剂。当所述组合物包含所述胶凝剂时,所述组合物包含约10g/kg至约800g/kg、优选约100g/kg至约600g/kg、和更优选约250g/kg至约450g/kg的所述胶凝剂(例如琼脂)(例如,约350g/kg的胶凝剂)。在一些实施方式中,所述胶凝剂是琼脂。在其它实施方式中,所述胶凝剂是结冷胶(gellan)、海藻酸钠、黄原胶、瓜尔胶、聚丙烯酰胺或EladiumTM。
在所述第一方面的一些实施方式中,所述组合物进一步包含表面活性剂。所述第一方面的所述组合物可包含约0g/kg至约190g/kg的所述表面活性剂,例如表1所示的所述组合物的约1g/kg至约60g/kg,约4g/kg至约40g/kg,或约20g/kg。所述表面活性剂优选是聚山梨酯(例如聚山梨酯20,又称为20)。
在第二方面,所述组合物在22℃是液体,以及在第三方面,所述组合物在22℃是凝胶。所述液体或凝胶将包含充足的水或其它水溶液或悬浮液以形成液体或凝胶。在一些实施方式中,所述液体或凝胶组合物具有的pH是7.3±0.5(例如pH为7.3±0.2)。
在表2中提供第二或第三方面的组合物的实例。以各组分的克数相对于所述总组合物(如果存在的话,包括溶剂和胶凝剂)的千克数的方式提供量,且本领域技术人员会理解所有组分的总量将不超过1kg。
表2
在一些实施方式中,所述第二或第三方面的所述组合物包含5g至100g表1的所述组合物每千克含水介质(例如纯水、绵羊血(例如去纤维蛋白绵羊血或血球溶解绵羊血)、或这两者),例如10g至50g、20g至30g、或约23g的表1中的所述组合物。
在第二或第三方面的其它实施方式中,表2中描述的所述组合物进一步包含磷酸盐缓冲液,例如,磷酸钾缓冲液。在其它实施方式中,在所述第二或第三方面的所述组合物中存在的所述磷酸盐缓冲液,例如磷酸钾缓冲液的量足以提供0.1mmol/(pH单位)至100mmol/(pH单位),例如1mmol/(pH单位)至50mmol/(pH单位)、2mmol/(pH单位)至20mmol/(pH单位)或3mmol/(pH单位)至10mmol/(pH单位)的缓冲容量。
在第二或第三方面的具体实施方式中,所述组合物进一步包含绵羊血(例如去纤维蛋白绵羊血或血球溶解绵羊血)。在所述组合物中的绵羊血的浓度可以是小于约200mL/kg,优选小于约100mL/kg(例如,约50mL/kg)。在具体的实施方式中,在绵羊血中的红血细胞是裂解的(例如血球溶解绵羊血或去纤维蛋白绵羊血被处理成裂解红血细胞)。
在第二或第三方面的具体实施方式中,所述组合物进一步包含表面活性剂。所述第二或第三方面的组合物可包含0g/kg至19g/kg的所述表面活性剂,例如,表2中所示组合物的约0.05g/kg至约6g/kg,约0.1g/kg至约4g/kg,或约0.5g/kg。所述表面活性剂优选是聚山梨酯(例如,聚山梨酯20,又称为20)。
在第二方面和第三方面的一些实施方式中,所述组合物包含胶凝剂。应理解的是液体可包含其量不足以发生胶凝的胶凝剂。胶凝剂的实例包括琼脂、结冷胶、海藻酸钠、黄原胶、瓜尔胶、聚丙烯酰胺和EladiumTM。在所述组合物中的琼脂或EladiumTM的浓度是例如约5g/kg至约25g/kg(例如约13.5g/kg);在所述组合物中的结冷胶的浓度是例如约1.0g/kg至约13g/kg(例如约6.8g/kg);在所述组合物中的黄原胶或海藻酸钠的浓度是例如约3.4g/kg至约17g/kg(例如约9g/kg);在所述组合物中的聚丙烯酰胺的浓度是例如约50g/kg至约200g/kg(例如约150g/kg);以及在所述组合物中的瓜尔胶的浓度是例如约10g/kg至约40g/kg(例如约21g/kg)。
在第一至第三方面的一些实施方式中,所述培养基可进一步包含抗生素,例如用于敏感性试验或耐药试验或者用于选择耐药细胞。在所述第一至第三方面的其它实施方式中,所述生长培养基进一步包括消毒剂中和剂。有待中和的消毒剂的实例包括醇、次氯酸盐、过氧化氢、乙酸、过氧乙酸、季铵化合物、酚类、碘、氯制剂、汞制剂、甲醛和戊二醛。中和剂的实例包括组氨酸、硫代硫酸盐、聚山梨酯80和/或卵磷脂。其它中和剂包括亚硫酸氢盐、甘氨酸、二价阳离子(例如Mg2+或Ca2+)和巯基乙酸盐。
在第四方面,本发明的特征是通过在支持所述细胞群生长的条件下使所述细胞群与根据本发明的所述第二或第三方面的所述组合物接触来培养细胞群的方法。
在所述第四方面的一些实施方式中,所述细胞群被布置在可渗透膜的一侧,且所述可渗透膜的另一侧接触根据本发明的所述第二或第三方面的所述组合物。可渗透膜将是多孔的或者以其他方式能允许将生长培养基从一侧输送至另一侧。
在第四方面的一些实施方式中,所述细胞群包括好氧微生物。在其它实施方式中,所述细胞群包括厌氧微生物(例如专性厌氧微生物)。在第四方面的具体实施方式中,所述细胞群包括属于选自以下的属的细胞:不动杆菌属(例如洛菲不动杆菌)、曲霉菌属(例如巴西曲霉菌或烟曲霉菌)、芽孢杆菌属(例如克劳氏芽孢杆菌、病研所芽孢杆菌(Bacillus idriensis)、地衣芽孢杆菌或枯草芽孢杆菌)、棒杆菌属(例如结核硬脂酸棒杆菌或干燥棒杆菌)、皮生球菌属(例如西宫皮生球菌)、埃希氏菌属(例如大肠杆菌)、突脐蠕孢属(例如嘴突脐孢种真菌(Exserohilum rostratum))、考克氏菌属(例如嗜根考克氏菌)、甲基杆菌属(例如耐辐射甲基杆菌)、微球菌属(例如藤黄微球菌)、类芽孢杆菌属(例如解葡聚糖类芽胞杆菌)、青霉菌属(例如产黄青霉菌或特异青霉菌)、丙酸杆菌属(例如痤疮丙酸杆菌)、假单胞菌属(例如铜绿假单胞菌)、葡萄球菌属(例如金黄色葡萄球菌、表皮葡萄球菌或人葡萄球菌)、链球菌属(例如酿脓链球菌)和链霉菌属(例如霍耳斯特德氏链霉菌)。在一些实施方式中,所述芽孢杆菌是氧化应激的。
在第四方面的一些实施方式中,所述细胞群在一个样本中。所述样本可包含从多细胞有机体获得的液体或组织(例如动物(例如人或非人脊椎动物)的体液或组织)。所述样本可获自所述呼吸道、泌尿生殖道、消化道或生殖道、中枢神经系统、尿液、皮肤、粘液、血液、血浆、血清、淋巴液、脑脊髓液、唾液、创伤组织、伤口渗出液、活体组织检查、粪便或实体组织,或其衍生物。在一些实施方式中,所述样本是血液或尿液样本。所述样本还可得自植物或真菌。所述样本可通过对环境的空气、土壤或水、暴露至所述环境的表面、物体或有机体进行取样来获得。所述样本可从以下获得:在供人类或动物局部使用或内服的药物、美容产品、血液或其它产品的制造中的原材料、成品材料或中间材料;在食品、饮料或营养补充剂(例如维生素或植物提取物)的制造中的原材料、中间材料或成品材料;在医疗设备或体外诊断设备的制造中的原材料、中间材料或成品材料;化学产品;工业表面;检测仪表;和机械装置。可在所述接触步骤之前处理所述样本以液化和/或均质化所述样本。另外或替代地,在所述接触步骤之前,可处理所述样本以通过例如过滤或沉淀除去非所述细胞群的物质或物体。
在一具体的实施方式中,所述方法是无菌试验,其用三种独立等分的所述培养基接触所述样本,一种是在室温(例如约22℃)需氧培养,一种是在升高的温度(例如约32.5℃)需氧培养,以及一种是在升高的温度(例如约32.5℃)厌氧培养。
在第五方面,本发明的特征是制备根据本发明的第二方面的所述组合物的方法。所述方法包括:
i)对包含纯水、酪蛋白消化物、大豆消化物、磷酸盐缓冲液、右旋糖、动物组织消化物、酵母提取物、血晶素和L-胱氨酸的混合物进行高压灭菌;
ii)任选地冷却所述混合物至室温;
iii)任选地通过添加无菌氢氧化钾或氯化氢至所述混合物来调节pH至7.3±0.2;以及
iv)添加绵羊血至所述混合物。
在所述第五方面的一些实施方式中,在步骤iv)之后,所述方法进一步包括步骤v)将所述混合物的温度保持在约65℃,直至所述混合物的颜色从红色变成棕色(例如在绵羊血是去纤维蛋白的绵羊血时)。当使用血球溶解绵羊血时,步骤iv)可在45℃或低于45℃实施。
在所述第五方面的具体实施方式中,所述酪蛋白消化物、大豆消化物、磷酸盐缓冲液、右旋糖、动物组织消化物、酵母提取物、血晶素和L-胱氨酸成分的量是在本发明的所述第一方面描述的那些量。在所述第五方面的一些实施方式中,绵羊血的量与在本发明的所述第二或第三方面描述的量相同。
在所述第五方面的一些实施方式中,在步骤i)中的所述混合物进一步包括胶凝剂,例如琼脂、结冷胶、海藻酸钠、黄原胶、瓜尔胶、聚丙烯酰胺或EladiumTM。
在所述第五方面的一些实施方式中,在步骤i)中的所述混合物进一步包括表面活性剂,例如聚山梨酯(例如聚山梨酯20)。替代地,所述表面活性剂可在步骤i)之后(例如在步骤iv)或v)之后)添加。
在所述第五方面的其它实施方式中,所述最终组合物被转移至储存容器(例如,瓶,罐,小瓶、安瓿或盒(例如盒,例如在WO 2013/070730中描述的所述盒))。填充的无菌储存容器可经γ-照射以对所述培养基进行灭菌。灭菌的γ-照射的剂量可以大于10kGy,例如10kGy至50kGy,10kGy至40kGy,10kGy至30kGy,或10kGy至20kGy(例如,12kGy至19kGy)。
在本发明的任一方面的一些实施方式中,所述组合物不包含三(羟甲基)氨基甲烷。在本发明的任一方面的具体实施方式中,所述组合物不包含添加的钠。例如,右旋糖、磷酸盐缓冲液、血晶素和L-胱氨酸均不含钠。
在本发明的任一方面的一些其它实施方式中,所述磷酸盐缓冲液包含磷酸三钾或其水合物、磷酸氢二钾或其水合物和磷酸二氢钾或其水合物中的一或更多种。在具体的实施方式中,所述磷酸盐缓冲液包含磷酸氢二钾或其水合物和磷酸二氢钾或其水合物中的一或更多种。在其它实施方式中,所述磷酸盐缓冲液是磷酸氢二钾或其水合物和磷酸二氢钾或其水合物的混合物。
在本发明的所述第一方面的一些实施方式中,所述组合物由酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如磷酸钾缓冲液)、血晶素、L-胱氨酸和任选的消毒剂中和剂组成。在本发明的所述第一方面的具体实施方式中,所述组合物由酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如磷酸钾缓冲液)、血晶素、L-胱氨酸、胶凝剂和任选的消毒剂中和剂组成。在本发明的所述第二方面的具体实施方式中,所述组合物由酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如磷酸钾缓冲液)、血晶素、L-胱氨酸、纯水和任选的消毒剂中和剂组成。在本发明的所述第二方面的其它实施方式中,所述组合物由酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如磷酸钾缓冲液)、血晶素、L-胱氨酸、纯水、绵羊血(例如去纤维蛋白的绵羊血或血球溶解的绵羊血)和任选的消毒剂中和剂组成。在本发明的所述第二方面的其它实施方式中,所述组合物由酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如磷酸钾缓冲液)、血晶素、L-胱氨酸、纯水、绵羊血(例如去纤维蛋白的绵羊血或血球溶解的绵羊血)、表面活性剂(例如聚山梨酯20)和任选的消毒剂中和剂组成。在本发明的所述第三方面的一些实施方式中,所述组合物由酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如磷酸钾缓冲液)、血晶素、L-胱氨酸、纯水、胶凝剂和任选的消毒剂中和剂组成。在本发明的所述第三方面的其它实施方式中,所述组合物由酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如磷酸钾缓冲液)、血晶素、L-胱氨酸、纯水、绵羊血(例如去纤维蛋白的绵羊血或血球溶解的绵羊血)、胶凝剂和任选的消毒剂中和剂组成。在本发明的所述第三方面的其它实施方式中,所述组合物由酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液(例如磷酸钾缓冲液)、血晶素、L-胱氨酸、纯水、绵羊血(例如去纤维蛋白的绵羊血或血球溶解的绵羊血)、表面活性剂(例如聚山梨酯20)、胶凝剂和任选的消毒剂中和剂组成。在这些实施方式的任一个中,可省略所述消毒剂中和剂。在这些实施方式的任一个中,所述组分的量可如表1或2中所示。
本发明的任意方面的所述组合物还可包括染料或染色剂,尤其是用于活细胞的染色剂,例如5-溴-4-氯-3-吲哚基-β-D-半乳吡喃糖苷(又称为X-Gal;所述试剂是β-内酰胺酶存在的指示剂)。该试剂可与四氮唑盐(例如氮蓝四唑或四氮唑红)结合使用。可在本发明的任意方面的所述组合物中使用的其它染料包括Salmon-Gal、Magenta-Gal和Green-Gal。
如在本文中使用的术语“约”是指所记载的数值的±10%的数值。
如在本文中使用的术语“缓冲容量”是指要求将液体或凝胶组合物的pH改变1.0的强一元酸或强一元碱的毫摩尔数。
单位“g/kg”、“mol/kg”和“mL/kg”指示所述成分的量与所述组合物的总质量的比。
如在本文中使用的术语“纯水”满足或高于United States Pharmacopeia and National Formulary(USF 37-NF32),专论<1231>,2014中所述的纯化水的标准的水。
“基本上不含钠”的组合物包含小于50g/kg的钠离子,例如小于10g/kg或小于1g/kg。
附图说明
图1A是漂白剂应激的枯草芽孢杆菌孢子在具有不同的培养基变化的Growth DirectTM无菌盒中的回收率的图。标记为(1)的柱表示根据原始配方制备的Schaedler肉汤的数据。标记为(2)的柱表示根据Schaedler肉汤的原始配方制备的但不添加三(羟甲基)氨基甲烷的生长培养基的数据。标记为(3)的柱表示根据Schaedler肉汤的原始配方制备的但不添加氯化钠的生长培养基的数据。标记为(4)的柱表示根据Schaedler肉汤的原始配方制备的但添加钾源的生长培养基的数据。标记为(5)的柱表示本发明的生长培养基的数据。标记为(6)的柱表示Schaedler巧克力琼脂培养基的数据。所述数据经归一化处理到在Schaedler巧克力琼脂上观察到的回收率。
图1B是漂白剂应激的枯草芽孢杆菌的孢子在Growth DirectTM无菌盒中的回收率的图。标记为(1)的柱表示Schaedler血肉汤的数据。标记为(2)的柱表示本发明的所述生长培养基的数据。所述生长培养基用全新的许多个体成分制备。所述数据经归一化处理到在Schaedler巧克力琼脂上观察到的回收率。
图2是在Growth DirectTM无菌盒中的耐辐射甲基杆菌的回收率的图。标记为(1)的柱表示Schaedler血肉汤的数据。标记为(2)的柱表示本发明的所述生长培养基的数据。在陪替氏平皿上的TSA的数据被标记为(3)。所述数据不能被归一化处理到来自陪替氏平皿上的胰酶解酪蛋白大豆琼脂的耐辐射甲基杆菌的回收率,因为在该培养基上未观察到耐辐射甲基杆菌的生长。
图3是在液体培养基上生长的九种不同的微生物的回收率的图。标记为(a)的柱表示TSB的数据。标记为(b)的柱表示Schaedler血肉汤的数据。标记为(c)的柱表示本发明的所述生长培养基的数据。所述数据经归一化处理到在本发明的所述生长培养基上观察到的回收率。与本发明的所述生长培养基相比,70%截断显示指示更差的生长。与本发明的所述生长培养基相比,142%截断显示指示更佳的生长。由于100%比142%的比率得到70%,因此选择142%截断。
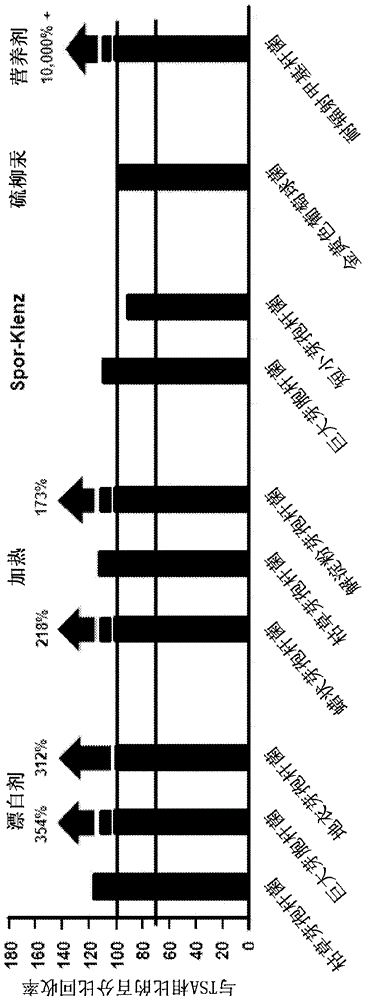
图4是在本发明的所述生长培养基上生长的十种不同的应激微生物的回收相对于所述相同微生物在TSA上的回收的图。所述应激源在所述图中被鉴定为漂白剂、加热、(过氧化氢、过乙酸和乙酸的混合物)、硫柳汞和营养剂。在本发明的所述生长培养基上的回收率以所述对应的应激微生物在TSA上的回收率的百分比来表示。
图5是显示如通过菌落计数比对从FTM培养基的MPN分析确定的在本发明的所述生长培养基上厌氧菌产芽孢梭菌和痤疮棒状杆菌的回收率的图。
图6是显示具有(左柱)或不具有(中间柱)聚山梨酯20的本发明的所述生长培养基上漂白剂应激的枯草芽孢杆菌、日本鞘氨醇单胞菌和西宫皮生球菌的回收率的图。将本发明的所述生长培养基的数据与所述相同的微生物在TSA上的回收率进行比较。
详述
生长培养基
本发明提供改善的生长培养基,其促进来自许多属的多种微生物的生长,包括与人相关的有机体,厌氧微生物,水有机体,环境有机体和霉菌。因此,所述培养基可用作为用于化验和细胞培养的通用培养基。所述培养基的多功能性允许其用于在无菌试验中替代胰酶解酪蛋白大豆肉汤(TSB)和液体巯基乙酸盐培养基(FTM)。本发明的所述生长培养基的使用领域的实例包括一般细胞培养基和试验液体、空气、土壤、表面、工业或临床样本、药物产品(无菌或非无菌)、食品、饮料产品或微生物生物负荷的营养补充剂。所述生长培养基还可应用于其它化验,例如临床化验,例如关于血液或其它传染的化验,以及关于抗生素耐药性的化验。本发明的特征是包含酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液、血晶素和L-胱氨酸的组合物。所述组合物可以是固体,其可与液体(例如水和/或绵羊血(例如去纤维蛋白的绵羊血或血球溶解的绵羊血))混合以根据本发明的所述方法制备本发明的所述生长培养基。组合物还可包括表面活性剂。优选地,所述所述组合物不含三(羟甲基)氨基甲烷和/或添加的钠。所述组合物不是无钠的,因为生物衍生的成分可包含钠。本发明的所述组合物是有利的,因为相比于氧化应激的枯草芽孢杆菌在Schaedler肉汤上的生长,低钠含量提供所述氧化应激的枯草芽孢杆菌的优越的生长。此外,例如来自磷酸钾缓冲液而不是Tris的使用的较高的钾含量导致与例如氧化应激的枯草芽孢杆菌在Schaedler肉汤上的生长相比所述氧化应激的枯草芽孢杆菌的优越的生长。
本领域技术人员可通过常规计算,例如通过使用在亨德森-哈塞尔巴尔赫方程中期望的pH值和相关共轭酸的水溶液pKa值,构建磷酸钾或其水合物、磷酸氢钾或其水合物和磷酸二氢钾或其水合物中的一或更多种在所述磷酸盐缓冲液中的最终比例。对于本发明所述培养基而言,期望pH为约7.3(例如,7.3±0.5,例如7.3±0.2)。
在表3中提供本发明的组合物的非限制性实例。
表3
在表3中的该组合物还可包含约12至约15g的琼脂(例如约13.5g的琼脂)。该组合物可进一步溶于或悬浮于约1L的含水介质中,例如约950mL的纯水和约50mL的绵羊血(例如去纤维蛋白绵羊血或血球溶解绵羊血)。所述组合物可进一步包含0.05%(w/v)的聚山梨酯20。在非限制性实例中,在表3中描述的所述组合物与950mL的纯水组合,其可进一步包括50mL的绵羊血(例如血球溶解绵羊血)以及可加入10mL的5%(w/v)聚山梨酯20溶液。
本发明的固态组合物包含酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液、血晶素和L-胱氨酸。本发明的一些固态组合物包含小于约60g/kg(例如小于约55g/kg或小于约50g/kg)的钠离子。本发明的固态组合物还可包含胶凝剂。包含胶凝剂的本发明的固态组合物在与水、绵羊血或这两者混合之后产生凝胶。胶凝剂的非限制性实例包括琼脂、结冷胶、海藻酸钠、黄原胶、瓜尔胶、明胶、琼脂糖、EladiumTM(由根瘤菌属(CNCM号:I-1809)生产的多糖)及其组合。本领域技术人员可确定制备适合用作为生长培养基的凝胶所需的液体(例如纯水和/或绵羊血)的量。在本发明所述固态组合物中所述胶凝剂的量取决于所述胶凝剂的特性。例如,当存在于本发明的干固体中的胶凝剂是结冷胶时,其浓度可以是约50g/kg至约300g/kg,和优选约130g/kg至约230g/kg(例如,约180g/kg)。当存在于本发明的凝胶或液体中的胶凝剂是结冷胶时,其浓度可以是约2.5g/kg至约13g/kg(例如,约6.8g/kg)。在另一实例中,当存在于本发明的干固体中的胶凝剂是黄原胶或海藻酸钠时,其浓度可以是约70g/kg至约400g/kg,和优选约160g/kg至约300g/kg(例如,约220g/kg)。当存在于本发明的凝胶中的胶凝剂是黄原胶或海藻酸钠时,其浓度可以是约3.4g/kg至约13g/kg(例如,约6.8g/kg)。还在另一实例中,当存在于本发明的凝胶中的胶凝剂是聚丙烯酰胺时,其浓度可以是约50g/kg至约200g/kg(例如,约150g/kg)。在一些实例中,当存在于本发明的干固体中的胶凝剂是瓜尔胶时,其浓度可以是约400g/kg至约800g/kg(例如,约650g/kg)。当存在于本发明的凝胶中的胶凝剂是瓜尔胶时,其浓度可以是约10g/kg至约40g/kg(例如,约21g/kg)。
本发明的液体组合物包含纯水或绵羊血或这两者。液体组合物还可包含胶凝剂,所述胶凝剂的浓度过低而不会形成凝胶。在本发明的液体组合物中的成分的浓度为如本文中所描述的。
在本发明的所述组合物中使用的酪蛋白消化物可根据本领域已知的方法通过水解来自牛乳的酪蛋白来制备。在本发明的所述组合物中使用的大豆消化物可根据本领域已知的方法来制备,例如通过对经热处理以除去不耐热的蛋白酶抑制剂的脱脂大豆粉进行酶消化来制备。在本发明的所述组合物中使用的动物组织消化物可根据本领域已知的方法来制备,例如通过对来自肌肉组织或内脏的肉和明胶进行水解来制备。酵母提取物在所述USP中被定义为“酵母细胞(例如酵母属)的水溶性、胨状衍生物”且容易作为喷雾干燥粉末得到。在本发明的所述组合物中可使用商购的酪蛋白消化物、大豆消化物、动物组织消化物和酵母提取物。这些成分可获自例如BD Biosciences(San Jose,CA)。这些成分的每一种包含小于15%(w/w)的钠。
去纤维蛋白的绵羊血可根据本领域已知的方法通过从绵羊无菌采集血且随后在不存在抗凝血剂的情况下采集的血凝结的过程中机械除去纤维蛋白来制备。在本发明的所述组合物中可使用商购的去纤维蛋白的绵羊血(例如购自Rockland Immunochemicals Inc.,Gilbertsville,PA)。已知绵羊血包含钠(多达3.48±0.02g/100mL;参见,例如Long等人,J.Anim.Sci.,24:145-150,1965)。可通过使所述去纤维蛋白的绵羊血发生溶血来制备血球溶解的绵羊血。在本发明的所述组合物中可使用商购的血球溶解的绵羊血(例如购自Cedarlane,Burlington,NC)。
在本发明的所述组合物中可使用表面活性剂(例如非离子型表面活性剂)以控制在本发明的液体和凝胶组合物中的沉淀物的形成。所述表面活性剂可以是泊洛沙姆、聚山梨酯或TritonTM。这些表面活性剂可商购自各个化学品供应商,例如Dow Chemical、Midland、MI和Sigma Aldrich、St.Louis、MO。优选的表面活性剂是聚山梨酯20。
本发明的生长培养基还可包括抗生素,如本领域中已知的。所述生长培养基可进一步包括消毒剂中和剂。待中和的消毒剂的实例包括醇、次氯酸盐、过氧化氢、乙酸、过氧乙酸、季铵化合物、酚类、碘、氯制剂、汞制剂、甲醛和戊二醛。中和剂的实例包括组氨酸、硫代硫酸盐、聚山梨酯80和/或卵磷脂。其它中和剂包括亚硫酸氢盐、甘氨酸、二价阳离子(例如Mg2+或Ca2+)和巯基乙酸盐。如上所述,本发明的所述组合物优选包括基本上无钠的非生物衍生的成分,即,本发明的所述组合物包含比Schaedler肉汤较少的钠。优选地,本发明的所述组合物不含三(羟甲基)氨基甲烷(Tris)。不存在这种成分是有利的,因为Tris的特性易受到批与批之间的差异的影响,其可导致在包含该成分的培养基上生长的微生物的回收的重现性差。因此,在本发明的所述组合物中使用磷酸盐缓冲液,例如磷酸钾缓冲液。
培养细胞群的方法
本发明的所述生长培养基可用作为用于化验和细胞培养的多用途培养基。本发明的所述生长培养基的用途在基于生长的无菌化验中尤其有利,例如包括使用采用渗透膜的细胞培养设备用于微生物(例如细菌或真菌)的生长。这样的细胞培养设备详细描述于国际申请公布号WO 2007/038478、WO 2013/070730和WO 2013/158666中,其公开内容通过引用的方式整体并入本发明中。尤其是,本发明的所述生长培养基可与根据WO 2013/070730中描述的方法的Growth DirectTM无菌盒一起使用。该具体的优点包括快速获得可靠的无菌试验结果,从而允许医疗保健和制造业中有效的成本控制。
尤其是,可在采用TSA和FTM的药典试验的模拟中采用本发明的所述生长培养基。例如,所述培养基可应用于三个化验的组,其中一个针对在32.5℃孵育的好氧微生物,一个针对在32.5℃孵育的厌氧微生物,以及一个针对在22℃孵育的好氧微生物。所述生长培养基的其它用途包括环境监测,生物负载测试,临床和诊断用途,抗生素抗药性测试和抗生素筛选。为测试抗生素敏感性或选择具有抗生素抗药性的细胞(例如在转染之后),所述生长培养基可包括抗生素,如在本领域中已知的。
本发明的所述生长培养基的用途不限于涉及在渗透膜上生长微生物的装置。例如,本发明的所述生长培养基可用于在试管、陪替氏平皿、Rodac板、微流体细胞培养装置(例如在例如美国专利申请公开号US 2013/0090268和US2013/0171679中描述的那些)、生物反应器(例如Eppendorf生物反应器或在例如美国专利申请公开号US 2013/0196375和US2014/0024105中描述的那些),以及其它细胞培养容器中培养微生物(例如细菌或真菌)。
可使用本发明的所述生长培养基化验的样本不受限制且包括工业样本(例如,在食品、饮料或营养补充剂的制造中的原材料、中间材料或成品材料;在医疗设备或体外诊断设备的制造中的原材料、中间材料或成品材料;化学产品;工业表面;检测仪表;或机械装置),在制备药品中使用的药物或试剂(例如,在供人类或动物局部使用或内服的药物、美容产品、血液或其它产品的制造中的原材料、成品材料或中间材料),生物样本,环境样本(例如水样本(例如天然水体(例如河流、湖、池塘和海洋),废水,和处理的水源(例如市政供水)),空气样本,土壤样本,和表面样本)。可测试的表面包括在货物(例如药品)的制造、包装或储存中使用的设备、材料和设施;在研究中使用的设备、材料和设施;衣服,寝具和其它编织物(例如用于医疗服务提供者或患者);以及在治疗(例如医院、诊所和医生办公室)中使用的设备、材料和设施。
可使用本发明的所述生长培养基培养的微生物(例如细菌或真菌)的属的非限制性实例包括不动杆菌属(例如洛菲不动杆菌)、曲霉菌属(例如巴西曲霉菌或烟曲霉菌)、芽孢杆菌属(例如克劳氏芽孢杆菌、病研所芽孢杆菌(Bacillus idriensis)、地衣芽孢杆菌或枯草芽孢杆菌)、念珠菌属(例如白色念珠菌),梭菌属(例如生孢梭菌),棒杆菌属(例如结核硬脂酸棒杆菌或干燥棒杆菌)、皮生球菌属(例如西宫皮生球菌)、埃希氏菌属(例如大肠杆菌)、突脐蠕孢属(例如嘴突脐孢种真菌)、考克氏菌属(例如嗜根考克氏菌)、甲基杆菌属(例如耐辐射甲基杆菌)、微球菌属(例如藤黄微球菌)、类芽孢杆菌属(例如解葡聚糖类芽胞杆菌)、青霉菌属(例如产黄青霉菌或特异青霉菌)、假单胞菌属(例如铜绿假单胞菌或荧光假单胞菌)、鞘氨醇单胞菌属(例如日本鞘氨醇单胞菌(Sphingomonas japonica))、葡萄球菌属(例如金黄色葡萄球菌、表皮葡萄球菌或溶血性葡萄球菌)、链球菌属(例如酿脓链球菌)和链霉菌属(例如霍耳斯特德氏链霉菌)。尤其是,本发明的所述生长培养基允许多种微生物(包括漂白剂应激的枯草芽孢杆菌)的回收的重现性良好。
本发明的试剂盒
本发明的特征还在于包含上述本发明的所述组合物的试剂盒。本发明的所述组合物可作为干的物品(例如粉末)、凝胶或液体被包含在本发明的所述试剂盒中。所述固体(例如粉末)可被包装成在单一容器(例如瓶、安瓿或罐)中的混合物。替代地,所述固体(例如粉末)可被包装在独立的容器(例如袋、罐头、小袋、瓶、小瓶、安瓿、罐或其组合)中。所述混合物可包含酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液、血晶素、L-胱氨酸和胶凝剂(例如琼脂、结冷胶、海藻酸钠、黄原胶、瓜尔胶、明胶、琼脂糖、EladiumTM或其组合)中的一或更多种。这些成分的相对量如上所述。
以下的实施例旨在举例说明本发明,且并不打算以任何方式限制本发明。
实施例
实施例1:本发明的所述生长培养基的制备
对包含纯水(950mL)、酪蛋白消化物(5.6g,Neogen或BD Biosciences)、大豆消化物(1g,Neogen)、磷酸氢二钾(2.5g,Sigma-Aldrich)、右旋糖(5.82g,Sigma-Aldrich)、动物组织消化物(5g,BD Biosciences或Neogen)、酵母提取物(5g,BD Biosciences或Neogen)、磷酸二氢钾(0.31g,Sigma-Aldrich)、血晶素(0.01g,Sigma-Aldrich)和L-胱氨酸(0.4g,Sigma-Aldrich)的组合物进行高压灭菌。将所述组合物冷却至室温,使用KOH或HCl水溶液调节pH值至7.3(±0.2)。然后将所述组合物加热至65℃,并添加50mL的去纤维蛋白的绵羊血(Northeast Laboratories或Thermo Scientific)。保持所述温度不变,直至颜色从红色变成棕色,此时允许所述组合物冷却至环境温度(室温,约22℃)。
实施例2:在各种生长培养基上微生物的生长的比较
该实施例举例说明了与在美国药典专论<71>中描述的基于生长的无菌化验中使用的标准培养基相比,本发明的所述生长培养基在支持各种微生物的生长方面的多用性。所述标准培养基是TSB和FTM。
针对各种有机体测试本发明的所述生长培养基。还将本发明的所述培养基与本领域已知的其它生长培养基相比较。所有测试在Growth DirectTM无菌盒(Rapid Micro Biosystems,Bedford,MA)或陪替氏平皿中进行。
将修改的Schaedler肉汤与其原始配方、Schaedler巧克力琼脂和本发明的生长培养基进行比较
在图1A中显示了在根据原始配方制备的Schaedler肉汤(1)、不含有Tris的Schaedler肉汤(2)、包含基本上无钠的非生物衍生的成分的Schaedler肉汤(3)、高钾Schaedler肉汤(4)、本发明的生长培养基(5)和Schaedler巧克力琼脂(6)上的漂白剂应激的枯草芽孢杆菌的回收率。所述实验一式三份进行,采用两个不同批次的各培养基。所述结果归一化至Schaedler巧克力培养基上的回收率。如在图1B中显示的,所述结果是可重现的,即使采用不同潜在堆的粉末成分和/或血液。
在Growth DirectTM无菌盒中使用本发明的生长培养基的回收率与在陪替氏平皿上使用TSA的回收率的比较
将在Growth DirectTM无菌盒中在本发明的生长培养基上的23种不同的有机体的生长与在陪替氏平皿上相同有机体的生长进行比较。所述结果归一化至在陪替氏平皿上观察到的在TSA上生长。仅三种有机体显示出回收率低于良好生长的70%截断(USP标准)。对于两种有机体,西宫皮生球菌和耐辐射甲基杆菌,在本发明的生长培养基上的无菌盒中的生长是一贯地优良的。图2显示了耐辐射甲基杆菌的数据;然而,所述生长不能归一化至TSA,因为在TSA上未观察到生长。
在使用TSB、Schaedler血肉汤和本发明的生长培养基的Growth DirectTM无菌盒中的微生物的生长的比较
考察在所述无菌盒的范围内不同培养基上的生长,以消除琼脂的变化差异。本次研究的焦点在有问题的有机体上。图3显示了该比较,其中数据被归一化至在本发明的生长培养基上的生长。对于五种有机体,在所有的培养基中不存在有显著差异。所有的生长均落入70%至142%截断的范围内。对于两种有机体,干燥棒状杆菌和嘴突脐孢种真菌,在本发明的生长培养基上的生长是优异的。对于霍耳斯特德氏链霉菌和产黄青霉菌,在TSB上生长是优异的,然而在所有情况下,检测到生长。未鉴定到可以在TSA、TSB或Schaedler血液或巧克力琼脂上生长但不能在本发明的生长培养基上生长的有机体。
在本发明的生长培养基上微生物的生长与在FTM上相同微生物的生长的比较
设计FTM用于在液体形式中生长厌氧微生物。所述培养基具有需氧层和厌氧层,因此其也旨在是通用型培养基。由于其是液体生长培养基但是不支持在过滤膜的表面上生长,因此仅可通过混浊度的存在来监测生长。使用最大可能数量(MPN)将该信息的存在/不存在特性转化成定量数据,其中监测重复10-倍稀释的低水平接种物的生长,且生长/不生长的模式可被转化成最高浓度接种的最大可能的接种物。
该方法用于将在具有本发明的生长培养基的厌氧无菌盒中痤疮丙酸杆菌的生长与采用MPN方法的FTM中的生长进行比较。如表4中所示的,在厌氧盒中的计数类似于在采用MPN方法的FTM中那些。然而,痤疮丙酸杆菌在本发明的生长培养基上的生长相比于在FTM中的生长显著较快。
表4在Growth DirectTM盒和FTM中痤疮丙酸杆菌的回收
将在FTM中一些好氧有机体的生长与它们在本发明的生长培养基上的生长相比较。该试验的焦点在霉菌上,当与在TSA上的生长相比较时,其在具有本发明的生长培养基的Growth DirectTM无菌盒中的回收率被观察到为低于70%。进行MPN分析,以从FTM的生长/不生长信息获得定量数据。如在表5中显示的,相比于所述霉菌在TSA或甚至Schaedler巧克力琼脂(SCA)上的生长,所述霉菌在FTM中很难生长。在本发明的培养基上的无菌盒中的生长是显著更佳的。(将第6栏(在FTM中的%生长)与最后一栏(在盒中的%生长)进行比较。生长被归一化至TSA对照)。
表5在TSA、SCA、FTM和本发明的生长培养基上的霉菌的回收
实施例3
采用包含以下的生长培养基组合物:纯水(950mL),酪蛋白消化物(5.6g),大豆消化物(1g)、磷酸氢二钾(2.5g)、右旋糖(5.82g)、动物组织消化物(5g)、酵母提取物(5g)、磷酸二氢钾(0.31g)、血晶素(0.01g)、L-胱氨酸(0.4g)和血球溶解的绵羊血(50mL)或去纤维蛋白的绵羊血(50mL),pH为7.3±0.2。根据实施例1所描述的制备包含血球溶解的绵羊血的组合物,不同的是在45℃或更冷的温度将血球溶解的绵羊血添加至根据实施例1所描述的制备的所述混合物。
在肉汤浸渍垫上放置膜过滤器。采用一组实验有机体,包括与人类相关的菌株、水有机体、酵母、USP微生物、霉菌和一些形成孢子的芽孢杆菌,来比较所述组合物和胰酶解酪蛋白大豆琼脂(TSA)的生长促进作用(表6)。在表6中,%回收率表示在本发明的生长培养基(不含聚山梨酯20)上微生物的回收作为在TSA上的回收的百分比。
表6
进一步地,通过以下的如上所述的程序将在本发明的生长培养基上的应激微生物的回收与在TSA上的回收进行比较。如图4中所示,相比于TSA,所有的漂白剂应激的、加热应激的以及营养剂应激的微生物在本发明的所述生长培养基上的回收是更优的。将-应激的和硫柳汞-应激的微生物在本发明的所述生长培养基上的回收可与它们在TSA上的回收相媲美。在该试验中使用的本发明的所述生长培养基使用去纤维蛋白的绵羊血制备且不具有聚山梨酯20。
在任何情况下,对于所有测试的菌株,本发明的生长培养基显示出的生长促进作用与TSA相当或比其更好。在任何情况下,在本发明的生长培养基上的试验株的回收均不会相当多地劣于在TSA上的回收。
此外,将本发明的培养基的生长与来自根据药典无菌实验所描述的掺入FTM且在其中生长的有机体的计算的MPN进行比较。测试厌氧有机体痤疮丙酸杆菌和生孢梭菌,以观察本发明的生长培养基在厌氧条件下是否显示与FTM相同的生长促进作用。如所示的,两种菌株在具有本发明的生长培养基的纤维素垫上厌氧孵育的膜过滤器上显示出和从FTM中孵育获得的MPN相比相当的回收。
实施例4
采用包含以下的生长培养基组合物:纯水(950mL),酪蛋白消化物(5.6g),大豆消化物(1g)、磷酸氢二钾(2.5g)、右旋糖(5.82g)、动物组织消化物(5g)、酵母提取物(5g)、磷酸二氢钾(0.31g)、血晶素(0.01g)、L-胱氨酸(0.4g)、血球溶解的绵羊血(50mL)和10mL 5%(w/v)的聚山梨酯20,pH为7.3±0.2。根据实施例1所描述的制备所述组合物,不同的是在45℃或更冷的温度将血球溶解的绵羊血添加至根据实施例1所描述的制备的所述混合物。
将漂白剂应激的枯草芽孢杆菌、日本鞘氨醇单胞菌和西宫皮生球菌在包含聚山梨酯20的本发明的所述培养基上的生长与在不含聚山梨酯20的本发明的所述培养基上的生长以及在TSA上的生长进行比较。在图6中显示了所述结果。也测试包含聚山梨酯20的本发明的生长培养基的支持厌氧微生物(例如痤疮丙酸杆菌)生长的能力。痤疮丙酸杆菌在使用本发明的生长培养基的Growth DirectTM厌氧无菌盒上生长,并将所述回收与在BD厌氧GasPakTM小袋中的血液琼脂平板上的生长进行比较。痤疮丙酸杆菌在本发明的生长培养基上的回收是平均13.2CFU,相比之下,血液琼脂对照的是18CFU。
还通过以下编号的实施方式描述本发明。
1.一种组合物,其包含酪蛋白消化物、大豆消化物、动物组织消化物、酵母提取物、右旋糖、磷酸盐缓冲液、血晶素和L-胱氨酸。
2.如实施方式1所述的组合物,其中所述组合物在22℃是固态的。
3.如实施方式2所述的组合物,其中所述组合物是粉末。
4.如实施方式2或3所述的组合物,其中从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约1g/kg至约500g/kg的酪蛋白消化物。
5.如实施方式4所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约50g/kg至约400g/kg的酪蛋白消化物。
6.如实施方式5所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约100g/kg至约300g/kg的酪蛋白消化物。
7.如实施方式6所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约245.3g/kg的酪蛋白消化物。
8.如实施方式2至7中任一项所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约0.5g/kg至约300g/kg的大豆消化物。
9.如实施方式8所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约10g/kg至约200g/kg的大豆消化物。
10.如实施方式9所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约10g/kg至约100g/kg的大豆消化物。
11.如实施方式10所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约43.8g/kg的大豆消化物。
12.如实施方式2至11中任一项所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约1g/kg至约500g/kg的动物组织消化物。
13.如实施方式12所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约50g/kg至约400g/kg的动物组织消化物。
14.如实施方式13所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约100g/kg至约300g/kg的动物组织消化物。
15.如实施方式14所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约219g/kg的动物组织消化物。
16.如实施方式2至15中任一项所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约1g/kg至约500g/kg的酵母提取物。
17.如实施方式16所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约50g/kg至约400g/kg的酵母提取物。
18.如实施方式17所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约100g/kg至约300g/kg的酵母提取物。
19.如实施方式18所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约219g/kg的酵母提取物。
20.如实施方式2至19中任一项所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约1g/kg至约500g/kg的右旋糖。
21.如实施方式20所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约50g/kg至约400g/kg的的右旋糖。
22.如实施方式21所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约100g/kg至约300g/kg的的右旋糖。
23.如实施方式22所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约255g/kg的的右旋糖。
24.如实施方式2至23中任一项所述的组合物,其中,所述组合物包含一定量的磷酸盐缓冲液,以在溶解于含水介质之后足以提供0.1mmol/(pH单位)至100mmol/(pH单位)的缓冲容量。
25.如实施方式24所述的组合物,其中,所述组合物包含一定量的磷酸盐缓冲液,以在溶解于含水介质之后足以提供1mmol/(pH单位)至50mmol/(pH单位)的缓冲容量。
26.如实施方式25所述的组合物,其中,所述组合物包含一定量的磷酸盐缓冲液,以在溶解于含水介质之后足以提供2mmol/(pH单位)至20mmol/(pH单位)的缓冲容量。
27.如实施方式26所述的组合物,其中,所述组合物包含一定量的磷酸盐缓冲液,以在溶解于含水介质之后足以提供3mmol/(pH单位)至10mmol/(pH单位)的缓冲容量。
28.如实施方式2至27中任一项所述的组合物,其中,所述组合物包含约0.2g/kg至约1g/kg的血晶素。
29.如实施方式28所述的组合物,其中,所述组合物包含约0.4g/kg的血晶素。
30.如实施方式2至29中任一项所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约8g/kg至约40g/kg的L-胱氨酸。
31.如实施方式30所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约12g/kg至约20g/kg的L-胱氨酸。
32.如实施方式31所述的组合物,其中,从所述组合物的总质量排除所述磷酸盐缓冲液,所述组合物包含约17.5g/kg的L-胱氨酸。
33.如实施方式2至32中任一项所述的组合物,其中,所述组合物进一步包括胶凝剂。
34.如实施方式33所述的组合物,其中,所述胶凝剂选自琼脂、结冷胶、海藻酸钠、黄原胶、瓜尔胶、明胶、琼脂糖和由根瘤菌属(CNCM号:I-1809)生产的多糖。
35.如实施方式34所述的组合物,其中,所述胶凝剂是琼脂。
36.如实施方式33至35中任一项所述的组合物,其中,所述组合物包含约10g/kg至约800g/kg的所述胶凝剂。
37.如实施方式36所述的组合物,其中,所述组合物包含约100g/kg至约600g/kg的所述胶凝剂。
38.如实施方式37所述的组合物,其中,所述组合物包含约250g/kg至约450g/kg的所述胶凝剂。
39.如实施方式38所述的组合物,其中,所述组合物包含约350g/kg的所述胶凝剂。
40.如实施方式2至39中任一项所述的组合物,其中,所述组合物进一步包括表面活性剂。
41.如实施方式40所述的组合物,其中,所述表面活性剂是聚山梨酯。
42.如实施方式40或41所述的组合物,其中,所述组合物包含约0.4g/kg至约190g/kg的所述表面活性剂。
43.如实施方式42所述的组合物,其中,所述组合物包含约4g/kg至约80g/kg的所述表面活性剂。
44.如实施方式43所述的组合物,其中,所述组合物包含约4g/kg至约40g/kg的所述表面活性剂。
45.如实施方式44所述的组合物,其中,所述组合物包含约20g/kg的所述表面活性剂。
46.如实施方式1所述的组合物,其中,所述组合物在22℃是液体或凝胶。
47.如实施方式1或46所述的组合物,其进一步包括纯水。
48.如实施方式1、46和47中任一项所述的组合物,其进一步包括绵羊血。
49.如实施方式48所述的组合物,其中在所述组合物中的所述绵羊血的浓度是约5mL/kg至约200mL/kg。
50.如实施方式49所述的组合物,其中在所述组合物中的所述绵羊血的浓度是约5mL/kg至约100mL/kg。
51.如实施方式50所述的组合物,其中在所述组合物中的所述绵羊血的浓度是约50mL/kg。
52.如实施方式48至51中任一项所述的组合物,其中在所述绵羊血中的血红细胞已溶解。
53.如实施方式48至52中任一项所述的组合物,其中所述绵羊血是血球溶解绵羊血。
54.如实施方式48至52中任一项所述的组合物,其中所述绵羊血是去纤维蛋白的绵羊血。
55.如实施方式46至54中任一项所述的组合物,其中在所述组合物中的所述酪蛋白消化物的浓度是约0.1g/kg至约50g/kg。
56.如实施方式55所述的组合物,其中在所述组合物中的所述酪蛋白消化物的浓度是约1g/kg至约20g/kg。
57.如实施方式56所述的组合物,其中在所述组合物中的所述酪蛋白消化物的浓度是约2g/kg至约10g/kg。
58.如实施方式57所述的组合物,其中在所述组合物中的所述酪蛋白消化物的浓度是约5.6g/kg。
59.如实施方式46至58中任一项所述的组合物,其中在所述组合物中所述大豆消化物的浓度是约0.05g/kg至约30g/kg。
60.如实施方式59所述的组合物,其中在所述组合物中所述大豆消化物的浓度是约0.1g/kg至约10g/kg。
61.如实施方式60所述的组合物,其中在所述组合物中所述大豆消化物的浓度是约0.2g/kg至约3g/kg。
62.如实施方式61所述的组合物,其中在所述组合物中所述大豆消化物的浓度是约1g/kg。
63.如实施方式46至62中任一项所述的组合物,其中在所述组合物中动物组织消化物的浓度是约0.1g/kg至约50g/kg。
64.如实施方式63所述的组合物,其中在所述组合物中动物组织消化物的浓度是约1g/kg至约20g/kg。
65.如实施方式64所述的组合物,其中在所述组合物中动物组织消化物的浓度是约2g/kg至约10g/kg。
66.如实施方式65所述的组合物,其中在所述组合物中动物组织消化物的浓度是约5g/kg。
67.如实施方式46至66中任一项所述的组合物,其中在所述组合物中酵母提取物的浓度是约0.1g/kg至约50g/kg。
68.如实施方式67所述的组合物,其中在所述组合物中酵母提取物的浓度是约1g/kg至约20g/kg。
69.如实施方式68所述的组合物,其中在所述组合物中酵母提取物的浓度是约2g/kg至约10g/kg。
70.如实施方式69所述的组合物,其中在所述组合物中酵母提取物的浓度是约5g/kg。
71.如实施方式46至70中任一项所述的组合物,其中在所述组合物中右旋糖的浓度是约0.1g/kg至约50g/kg。
72.如实施方式71所述的组合物,其中在所述组合物中右旋糖的浓度是约1g/kg至约20g/kg。
73.如实施方式72所述的组合物,其中在所述组合物中右旋糖的浓度是约2g/kg至约10g/kg。
74.如实施方式73所述的组合物,其中在所述组合物中右旋糖的浓度是5.8g/kg。
75.如实施方式46至74中任一项所述的组合物,其中所述组合物包含一定量的磷酸盐缓冲液,以足够提供0.1mmol/(pH单位)至100mmol/pH的缓冲容量。
76.如实施方式75所述的组合物,其中所述组合物包含一定量的磷酸盐缓冲液,以在溶解于含水介质后足够提供1mmol/(pH单位)至50mmol/(pH单位)的缓冲容量。
77.如实施方式76所述的组合物,其中所述组合物包含一定量的磷酸盐缓冲液,以在溶解于含水介质后足够提供2mmol/(pH单位)至20mmol/(pH单位)的缓冲容量。
78.如实施方式77所述的组合物,其中所述组合物包含一定量的磷酸盐缓冲液,以在溶解于含水介质后足够提供3mmol/(pH单位)至10mmol/(pH单位)的缓冲容量。
79.如实施方式46至78中任一项所述的组合物,其中在所述组合物中所述血晶素的浓度是约0.01g/kg。
80.如实施方式46至79中任一项所述的组合物,其中在所述组合物中L-胱氨酸的浓度是约0.01g/kg至约0.5g/kg。
81.如实施方式80所述的组合物,其中在所述组合物中L-胱氨酸的浓度是约0.4g/kg。
82.如实施方式46至81中任一项所述的组合物,其进一步包含表面活性剂。
83.如实施方式82所述的组合物,其中所述表面活性剂是聚山梨酯。
84.如实施方式83所述的组合物,其中所述组合物包含约0.01g/kg至约5g/kg的所述表面活性剂。
85.如实施方式84所述的组合物,其中所述组合物包含约0.1g/kg至约2g/kg的所述表面活性剂。
86.如实施方式85所述的组合物,其中所述组合物包含约0.1g/kg至约1g/kg的所述表面活性剂。
87.如实施方式86所述的组合物,其中所述组合物包含约0.5g/kg的所述表面活性剂。
88.如实施方式46至87中任一项所述的组合物,其进一步包含胶凝剂。
89.如实施方式88所述的组合物,其中所述胶凝剂选自琼脂、结冷胶、海藻酸钠、黄原胶、瓜尔胶、明胶、琼脂糖、聚丙烯酰胺和由根瘤菌属(CNCM号:I-1809)生产的多糖。
90.如实施方式89所述的组合物,其中所述胶凝剂是琼脂。
91.如实施方式90所述的组合物,其中所述胶凝剂是由根瘤菌属生产的多糖。
92.如实施方式90或91所述的组合物,其中在所述组合物中所述胶凝剂的浓度是约5g/kg至约25g/kg。
93.如实施方式92所述的组合物,其中在所述组合物中所述胶凝剂的浓度是约13.5g/kg。
94.如实施方式93所述的组合物,其中所述胶凝剂是结冷胶。
95.如实施方式94所述的组合物,其中在所述组合物中结冷胶的浓度是约1.0g/kg至约13g/kg。
96.如实施方式95所述的组合物,其中在所述组合物中结冷胶的浓度是约6.8g/kg。
97.如实施方式89所述的组合物,其中所述胶凝剂是黄原胶或海藻酸钠。
98.如实施方式97所述的组合物,其中在所述组合物中所述胶凝剂的浓度是约3.4g/kg至约17g/kg。
99.如实施方式98所述的组合物,其中在所述组合物中所述胶凝剂的浓度是约9g/kg。
100.如实施方式89所述的组合物,其中所述胶凝剂是聚丙烯酰胺。
101.如实施方式100所述的组合物,其中在所述组合物中聚丙烯酰胺的浓度是约50g/kg至约200g/kg。
102.如实施方式101所述的组合物,其中在所述组合物中聚丙烯酰胺的浓度是约150g/kg。
103.如实施方式89所述的组合物,其中所述胶凝剂是瓜尔胶。
104.如实施方式103所述的组合物,其中在所述组合物中瓜尔胶的浓度是约10g/kg至约40g/kg。
105.如实施方式104所述的组合物,其中在所述组合物中瓜尔胶的浓度是约21g/kg。
106.如实施方式46-87中任一项所述的组合物,其中所述组合物是液体。
107.如实施方式46-105中任一项所述的组合物,其中所述组合物是凝胶。
108.如实施方式1和46-107中任一项所述的组合物,其中所述组合物具有的pH为7.3±0.5。
109.如实施方式1-108中任一项所述的组合物,其中所述组合物不含三(羟甲基)氨基甲烷。
110.如实施方式1-109中任一项所述的组合物,其中所述组合物不含添加的钠。
111.一种培养细胞群的方法,其包括在支持所述细胞群生长的条件下使所述细胞群与实施方式46-110中任一项所述的组合物接触。
112.如实施方式111所述的方法,其中所述细胞群被布置在膜的第一侧,且所述膜的第二侧接触实施方式46-110中任一项所述的组合物。
113.如实施方式112所述的方法,其中所述膜是可渗透的。
114.如实施方式111-113中任一项所述的方法,其中在所述细胞群内的一种或更多种细胞是好氧微生物。
115.如实施方式111-113中任一项所述的方法,其中在所述细胞群内的一种或更多种细胞是厌氧微生物。
116.如实施方式115所述的方法,其中所述厌氧微生物是专性厌氧微生物。
117.如实施方式111-113中任一项所述的方法,其中在所述细胞群内的一种或更多种细胞属于选自以下的属:不动杆菌属、曲霉菌属、芽孢杆菌属、棒杆菌属、皮生球菌属、埃希氏菌属、突脐蠕孢属、考克氏菌属、甲基杆菌属、微球菌属、类芽孢杆菌属、青霉菌属、丙酸杆菌属、假单胞菌属、葡萄球菌属、链球菌属和链霉菌属。
118.如实施方式117所述的方法,其中所述葡萄球菌是金黄色葡萄球菌、表皮葡萄球菌或人葡萄球菌。
119.如实施方式117所述的方法,其中所述甲基杆菌是耐辐射甲基杆菌。
120.如实施方式117所述的方法,其中所述芽孢杆菌是克劳氏芽孢杆菌、病研所芽孢杆菌、地衣芽孢杆菌或枯草芽孢杆菌。
121.如实施方式117或120所述的方法,其中所述芽孢杆菌是氧化应激的。
122.如实施方式117所述的方法,其中所述曲霉菌是巴西曲霉菌或烟曲霉菌。
123.如实施方式117所述的方法,其中所述棒杆菌是结核硬脂酸棒杆菌或干燥棒杆菌。
124.如实施方式117所述的方法,其中所述皮生球菌是西宫皮生球菌。
125.如实施方式117所述的方法,其中所述埃希氏菌是大肠杆菌。
126.如实施方式117所述的方法,其中所述考克氏菌是嗜根考克氏菌。
127.如实施方式117所述的方法,其中所述微球菌是藤黄微球菌。
128.如实施方式117所述的方法,其中所述类芽孢杆菌是解葡聚糖类芽胞杆菌。
129.如实施方式117所述的方法,其中所述青霉菌是产黄青霉菌或特异青霉菌。
130.如实施方式117所述的方法,其中所述假单胞菌是铜绿假单胞菌。
131.如实施方式117所述的方法,其中所述链球菌是酿脓链球菌。
132.如实施方式117所述的方法,其中所述链霉菌是霍耳斯特德氏链霉菌。
133.如实施方式117所述的方法,其中所述不动杆菌是洛菲不动杆菌。
134.如实施方式117所述的方法,其中所述丙酸杆菌是痤疮丙酸杆菌。
135.如实施方式117所述的方法,其中所述突脐蠕孢是嘴突脐孢种真菌。
136.如实施方式111-135中任一项所述的方法,其中所述细胞群来自样本。
137.如实施方式136所述的方法,其中所述样本包括从多细胞有机体获得的流体或组织。
138.如实施方式137所述的方法,其中所述样本包括动物的体液或组织。
139.如实施方式138所述的方法,其中所述样本衍生自人。
140.如实施方式138所述的方法,其中所述样本衍生自非人脊椎动物。
141.如实施方式137-140中任一项所述的方法,其中所述样本选自呼吸道、泌尿生殖道、生殖道、中枢神经系统、尿液、血液、皮肤、血浆、血清、唾液、创伤组织、伤口渗出液、活体组织检查、粪便、生殖道和实体组织样本,或其衍生物。
142.如实施方式141所述的方法,其中所述样本是血液或尿液样本。
143.如实施方式137所述的方法,其中所述样本衍生自植物。
144.如实施方式136-143中任一项所述的方法,其中所述样本通过对环境空气、土壤或水、或暴露至所述环境的表面、物体或有机体进行取样来获得。
145.如实施方式136所述的方法,其中所述样本可从选自以下的材料获得:在供人类或动物局部使用或内服的药物、美容产品、血液或其它产品的制造中的原材料、成品材料或中间材料;在食品、饮料或营养补充剂的制造中的原材料、中间材料或成品材料;在医疗设备或体外诊断设备的制造中的原材料、中间材料或成品材料;化学产品;工业表面;检测仪表;和机械装置。
146.如实施方式136-145中任一项所述的方法,其中在所述接触步骤之前处理所述样本以液化和/或均质化所述样本。
147.如实施方式136-146中任一项所述的方法,其中在所述接触步骤之前,处理所述样本以除去非所述细胞群的物质或物体。
148.一种制备实施方式46-110中任一项的所述组合物的方法,其包括:
i)对包含纯水、酪蛋白消化物、大豆消化物、磷酸盐缓冲液、右旋糖、动物组织消化物、酵母提取物、血晶素和L-胱氨酸的混合物进行高压灭菌;
ii)任选地冷却所述混合物;
iii)任选地通过添加无菌氢氧化钾或氯化氢至所述混合物来调节pH至7.3±0.5;以及
iv)添加绵羊血至所述混合物。
149.如实施方式148所述的方法,其进一步包括vi)将所述混合物的温度保持在约65℃,直至所述混合物的颜色从红色变成棕色。
150.如实施方式148或149所述的方法,其中在步骤ii)中的所述冷却是冷却至室温。
151.如实施方式148或149所述的方法,其中在步骤ii)中的所述冷却是冷却至约42℃。
152.如实施方式148-151中的任一项所述的方法,其中步骤i)的所述混合物进一步包括胶凝剂。
153.如实施方式148-152中的任一项所述的方法,其中步骤i)的所述混合物进一步包括表面活性剂。
154.如实施方式148-152中的任一项所述的方法,其进一步包括在步骤i)之后将表面活性剂添加至所述混合物。
155.如实施方式153或154所述的方法,其中所述表面活性剂是聚山梨酯。
156.如实施方式153-155中的任一项所述的方法,其中所述表面活性剂作为包含5%(w/v)的所述表面活性剂的水溶液来提供。
157.如实施方式148-156中的任一项所述的方法,其进一步包括在制备步骤完成之后将所述组合物转移入储存容器。
158.如实施方式157所述的方法,其中所述储存容器是瓶,罐,小瓶、安瓿或盒。
159.如实施方式157或158所述的方法,其进一步包括在所述转移之后γ-照射所述储存容器。
160.如实施方式159所述的方法,其中所述γ-照射的剂量大于10kGy。
161.如实施方式160所述的方法,其中所述γ-照射的剂量是约10kGy至约50kGy。
162.如实施方式161所述的方法,其中所述γ-照射的剂量是约10kGy至约40kGy。
163.如实施方式162所述的方法,其中所述γ-照射的剂量是约10kGy至约20kGy。
164.如实施方式163所述的方法,其中所述γ-照射的剂量是约12kGy至约19kGy。
165.如实施方式1-164中任一项所述的组合物或方法,其中所述组合物进一步包括消毒剂中和剂。
166.如实施方式165所述的组合物或方法,其中所述中和剂是组氨酸、硫代硫酸盐、聚山梨酯80和/或卵磷脂。
其它实施方式
在不背离本发明的范围和精神的前提下,本发明的所述组合物和使用的方法的各种修饰和变化对于本领域技术人员来说将是显而易见的。虽然已结合具体实施方式描述本发明,应理解的是不应不适当地将所要求保护的本发明限制至此类具体实施方式。实际上,对用于实施本发明的所描述的模式的各种修饰对于本领域技术人员而言是显而易见的,且旨在落入本发明的范围之内。
其它实施方式在权利要求书中。
- 还没有人留言评论。精彩留言会获得点赞!