甲烷硅基化亚胺和氨基甲酸酯聚合的苯甲酸酯化合物、其用途及组合物的制作方法
本发明涉及含有颗粒形式的苯甲酸酯的有机硅聚合物,其拟用在局部制剂中,用于提供针对日光或其它辐射的保护作用。
背景技术:
在暴露于递增量的损伤性日光的群体中,对防晒保护剂的需求不断增长。损伤可以是即刻的及长期的,效果从晒伤、皮疹和细胞及组织损伤到过早起皱和皮肤癌不等。在这种意义上,在过去已经开发了许多防晒化学品,针对UV-A和/或UV-B波长乃至更短波长的有害影响起保护作用。通常将这些化学品单独或彼此组合地掺入到广泛已知和使用的化妆品或药物制剂里。
用在防晒组合物中的大多数UV过滤剂为具有内在危险的单体性化合物,即这类化合物可穿透皮肤屏障,这是非常不利的效果。因此,由使用常见防晒品而来的主要缺点是包括皮肤问题的不良反应,如过敏性接触反应、光接触反应和皮肤的干燥或绷紧。与没有客观性红斑的烧灼感或刺痛相关的主观性刺激是防晒品中最常见的敏感性投诉。最经常在眼部区域中观察到这种刺激。然而,持续客观性刺激性接触性皮炎是更常见的副作用。先前存在湿疹病状的个体对与其受损的皮肤屏障相关的敏化具有显著的易感性。此外,某些抗生素、避孕药、利尿剂、抗组胺药和抗抑郁药属于可增加对太阳光线的敏感性的常用药物。而且,这些皮肤问题中的一些是由防晒品经暴露于日光而形成的降解产物诱导的。
已经尝试通过包封存在于防晒制剂中的至少一种类型的UV过滤剂来解决皮肤穿透的风险。例如,WO93/04665、WO94/06404、EP538431、EP392883和EP358584中已经描述了基于可以是直链或环状的聚硅氧烷的UV过滤剂。采用这些聚硅氧烷,皮肤穿透的风险较低,但有时由于不相容性问题,难以将聚硅氧烷掺入到防晒组合物里。专利申请WO2005/053631涉及具有UV过滤活性的微胶囊,其中使至少一种类型的具有UV-A和/或UV-B和/或UV-C过滤活性的可交联发色团和任选至少一种类型的没有UV-A和/或UV-B和/或UV-C过滤活性的可交联单体在不存在具有UV-A和/或UV-B和/或UV-C过滤活性的非可交联发色团的情况下经历交联反应。本发明也涉及包含所述微胶囊的防晒组合物。
现有技术还描述了一些颗粒形式的UV吸收剂。在这种意义上,专利申请WO2005/120440涉及包含无机网络和经由间隔基团共价键合到所述网络的有机化合物的颗粒,其特征在于有机化合物存在于颗粒的内部中并且任选还存在于颗粒的表面上。本发明也涉及包含所述颗粒的制剂和组合物。
专利申请WO2009/101016和Walenzyk,T.等人,International Journal of Cosmetic Science(2005),27(3),177-189涉及可通过无机纳米颗粒与含有官能团的有机分子反应得到的颗粒,及其在化妆品或皮肤病学应用中作为UV吸收剂的用途。
WO2006/100225中已发现和公开了一些苯甲酸酯化合物,以及它们作为紫外吸收剂的光化学前体的用途、与其有关的方法、化妆品或药物组合物、个人护理组合物及工业组合物。US4328346中也已经公开了一些硅烷官能化紫外屏蔽剂前体。这些化合物在日光存在下经历光化学转化,这增强了它们的UV屏蔽能力。
文献WO2011/045389描述了一些颗粒形式的甲硅烷基聚合的苯甲酸酯化合物,其光稳定性提高且在皮肤上的持久性提高,因为它们具有基本上密封的相关物理性质,因此避免了苯甲酸酯化合物及其光转化产物的释放,对防晒品使用者以及对环境而言都具有较安全的特性。然而,在实际太阳辐照条件下的典型光剂量下,转化速率没有快到足以给使用者提供最佳的保护作用。此外,这些化合物中的一些的合成需要使用有害的起始化合物以及昂贵且持续时间长的纯化步骤,并且产率没有好到足以能够在产业规模上进行其生产。不仅如此,在防晒制剂中存在标准的UV过滤剂导致这些化合物的转化率低,这进一步减低了它们的保护效率。
因此,期望能开发出具有更高的UV屏蔽能力、更快的转化速率、能够在另外的UV过滤剂存在下转化并且可通过有成本效益且更容易的合成路线得到的新型防晒化合物。
技术实现要素:
本发明的作者已开发出颗粒形式的新型单甲硅烷基化聚合的苯甲酸酯化合物,其适用于作为针对UV辐射的渐进性光保护剂,其即使在最终防晒制剂中存在标准UV过滤剂的情况下也呈现出更快且更有效转化的特殊优点。这使得它们尽管在由常规过滤剂提供内滤效应的情况下也能够发挥其渐进性作用,并因此补偿通常影响标准UV过滤剂的保护效率的损失。
与现有技术的其它单甲硅烷基化聚合的苯甲酸酯化合物相反,本发明的化合物特征在于具有的甲硅烷基化链连接于苯甲酸基团的酰基环而不是连接于酯基团的苯基环,并且存在亚胺或氨基甲酸酯基团作为苯甲酸酯与所述甲硅烷基化链之间的连接基。
除此之外,可用也是实惠且便宜的无毒起始化合物,借助于短合成路线由醛化合物合成这些化合物。这种合成以较低的制造成本提供纯度较高且产率也较高的化合物。
本发明的聚合物还显示出取决于太阳暴露的时间和太阳辐射的程度的渐进性UV保护作用。因此,含有这类化合物的组合物构成了比采用常规防晒产品更安全的日光浴方法,因为保护作用随着太阳暴露的时间和辐射的强度而增强。
本发明的聚合物本身表现出紫外吸收性质,并且易于被原位光化学转化成具有更高的UV保护作用的另一种屏蔽化合物。
在第一方面,本发明涉及制备有机硅渐进性光保护聚合物的方法,其包括使式(I)的单体:
其中:
R选自(i)、(ii)和(iii):
其中:
R1、R2、R3、R4和R5独立地选自H、直链或支链(C1-C6)烷基、(C3-C6)环烷基、OR10、NH2、NHR11、NR12R13、COOH、COOR14、CONH2、CONHR15、CONR16R17、SO2NH2、SO2NHR18和SO2NR19R20,其限制条件是R1、R2、R3、R4和R5中的至少一者不是H,条件是R1和R5中的至少一者是H;
R6、R7、R8和R9独立地选自氢、直链或支链(C1-C6)烷基、(C3-C6)环烷基、OR'1、NH2、NHR2'和NR3'R4';
R10是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R11是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R12是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R13是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R12和R13与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
R14是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R15是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R16是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R17是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R16和R17与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
R18是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R19是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R20是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R19和R20与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
L是选自以下的连接基:
-CH=N-
–(CH2)-O-C(O)-NH-
Ra是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
Rb是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
Rc是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
R'1是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R'2是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R'3是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R'4是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R'3和R'4与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
p是选自2、3和4的整数;
s是选自0和1的整数;
t是选自0和1的整数;
与式(IV)的化合物:
其中:
Rd是直链或支链(C1-C6)烷基;
Re、Rf和Rg独立地是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基,
w1和w2独立地是0或1,
在烷醇/水混合物中反应。
在第二方面,本发明涉及可通过如上定义的方法得到的有机硅渐进性光保护聚合物,特征在于其呈微颗粒或纳米颗粒的形式。
在第三方面,本发明涉及如上定义的有机硅渐进性光保护聚合物在制备用于保护人或动物活体免受UV辐射的化妆品或皮肤病学组合物中的用途。
在第四方面,本发明涉及如上定义的光保护聚合物作为UV吸收剂的光化学前体的用途。
在第五方面,本发明涉及如上定义的光保护聚合物在制备拟应用于人或动物活体的化妆品或皮肤病学组合物中的用途,其特征是取决于太阳暴露的时间和太阳辐射的程度的渐进性UV保护作用。
在第六方面,本发明涉及如上定义的光保护聚合物,其用于保护人或动物活体免受UV辐射。
在第七方面,本发明涉及包含如上定义的有机硅渐进性光保护聚合物的化妆品或皮肤病学组合物。
在第八方面,本发明涉及式(I)的单体:
其中:
R选自(i)、(ii)和(iii):
其中:
R1、R2、R3、R4和R5独立地选自H、直链或支链(C1-C6)烷基、(C3-C6)环烷基、OR10、NH2、NHR11、NR12R13、COOH、COOR14、CONH2、CONHR15、CONR16R17、SO2NH2、SO2NHR18和SO2NR19R20,其限制条件是R1、R2、R3、R4和R5中的至少一者不是H,条件是R1和R5中的至少一者是H;
R6、R7、R8和R9独立地选自氢、直链或支链(C1-C6)烷基、(C3-C6)环烷基、OR'1、NH2、NHR2'和NR3'R4';
R10是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R11是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R12是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R13是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R12和R13与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
R14是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R15是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R16是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R17是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R16和R17与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
R18是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R19是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R20是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R19和R20与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
L是选自以下的连接基:
-CH=N-
–(CH2)-O-C(O)-NH-
Ra是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
Rb是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
Rc是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
R'1是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R'2是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R'3是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R'4是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R'3和R'4与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
p是选自2、3和4的整数;
s是选自0和1的整数;
t是选自0和1的整数;
或其对映体形式或化妆品方面或皮肤病学上可接受的盐。
在第九方面,本发明涉及制备如上定义的当L是基团–CH=N-时的式(I)的单体的方法,其包括使式(II)的化合物:
其中:
R1、R2、R3、R4和R5独立地选自H、直链或支链(C1-C6)烷基、(C3-C6)环烷基、OR10、NH2、NHR11、NR12R13、COOH、COOR14、CONH2、CONHR15、CONR16R17、SO2NH2、SO2NHR18和SO2NR19R20,其限制条件是R1、R2、R3、R4和R5中的至少一者不是H,条件是R1和R5中的至少一者是H;
R10是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R11是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R12是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R13是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R12和R13与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
R14是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R15是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R16是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R17是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R16和R17与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
R18是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R19是直链或支链(C1-C6)烷基或(C3-C6)环烷基;
R20是直链或支链(C1-C6)烷基或(C3-C6)环烷基;或者R19和R20与它们所连接的氮原子合起来形成吡咯烷、哌啶或吗啉环;
且
R'选自(i')、(ii')和(iii'):
其中:
R6、R7、R8和R9独立地选自氢、直链或支链(C1-C6)烷基、(C3-C6)环烷基、OR'1、NH2、NHR2'和NR3'R4';
与式(III)的化合物反应:
其中:
Ra是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
Rb是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
Rc是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
p是选自2、3和4的整数;
s是选自0和1的整数;
t是选自0和1的整数。
在第十方面,本发明涉及制备如上定义的当L是–CH2-O-C(O)-NH-时的式(I)的单体的方法,其包括:
a)使如上定义的式(II)的化合物在还原剂的存在下发生还原反应以产生式(V)的化合物:
其中:
R1-R5如以上所定义;且
R”选自(I”)、(ii”)和(iii'):
以及
b)使如上定义的式(V)的化合物与式(VI)的化合物反应:
其中:
Ra是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
Rb是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
Rc是直链或支链(C1-C6)烷基、直链或支链(C2-C6)烯基、(C3-C6)环烷基或苯基;
p是选自2、3和4的整数;
s是选自0和1的整数;
t是选自0和1的整数。
附图说明
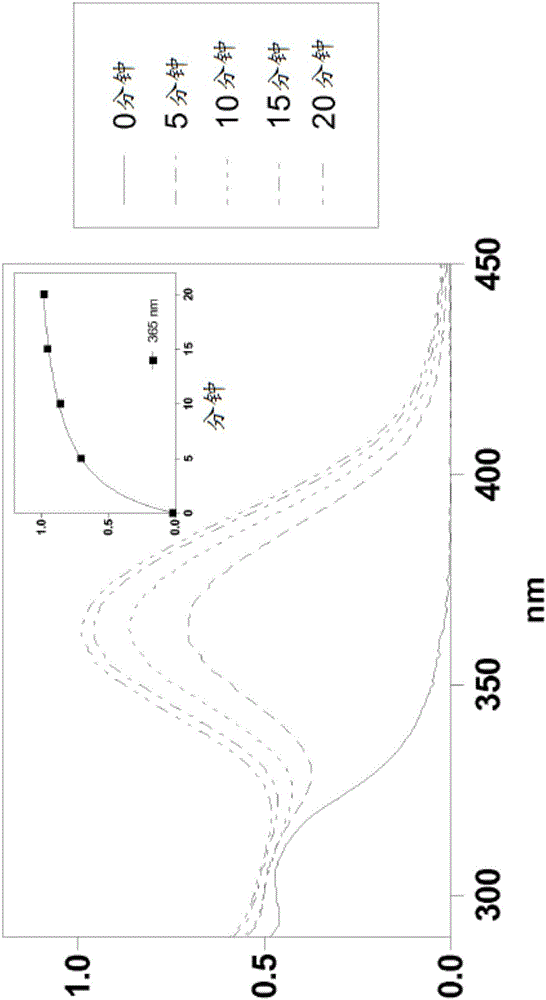
图1显示4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二乙基氨基)苯酯颗粒的UV-Vis光谱。
图2显示4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯颗粒的UV-Vis光谱。
图3显示4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二甲基氨基)苯酯颗粒的UV-Vis光谱。
图4显示4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-甲氧基苯酯颗粒的UV-Vis光谱。
图5显示4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二甲基氨基)苯酯颗粒的UV-Vis光谱。
图6显示4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯颗粒的UV-Vis光谱。
图7显示前体4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯(化合物6)的光转化动力学。
图8显示前体苯甲酸3-(3-(三乙氧基甲硅烷基)丙基氧基)苯酯(比较化合物A)的光转化动力学。
图9显示前体4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯(化合物1)的光转化动力学。
图10显示前体苯甲酸3-(双(3-(三乙氧基甲硅烷基)丙基)氨基)苯酯(比较化合物B)的光转化动力学。
图11显示前体4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯(化合物6)在另外的UV过滤剂存在下的光转化动力学。
图12显示前体苯甲酸3-(3-(三乙氧基甲硅烷基)丙基氧基)苯酯(比较化合物A)在另外的UV过滤剂存在下的光转化动力学。
图13显示前体4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯(化合物1)在另外的UV过滤剂存在下的光转化动力学。
图14显示前体苯甲酸3-(双(3-(三乙氧基甲硅烷基)丙基)氨基)苯酯(比较化合物B)在另外的UV过滤剂存在下的光转化动力学。
在所有的图中,纵坐标轴表示吸光度或消光度1%,且横坐标轴表示以nm为单位的波长。附图中的小图描绘如所示在选定波长处的吸光动力学测量值。
具体实施方式
在本发明的上下文中,以下术语具有下面详述的含义。
“C1-C6烷基”是指由1至6个碳组成、没有不饱和且通过单键与分子的其余部分连接的直链或支链烃链基团,例如甲基、乙基、1-丙基、2-丙基、1-丁基、叔丁基、1-戊基等。烷基基团可任选被一个或多个诸如芳基、卤代基、羟基、烷氧基、羧基、氰基、羰基、酰基、氨基、硝基、巯基、烷硫基等的取代基取代,条件是它们不影响聚合过程。
“C2-C6烯基”是指由2至6个碳组成且具有一个或多个不饱和键的如上定义的烷基基团。
“C3-C6环烷基”是指饱和或部分饱和且仅由碳和氢原子组成的稳定的3至6元单环基团,如环己基或金刚烷基。环烷基基团可任选被一个或多个诸如烷基、卤代基、羟基、氨基、氰基、硝基、烷氧基、羧基等的取代基取代,条件是它们不影响聚合过程。
术语“烷醇”是指具有1至6个碳原子且含有羟基的直链或支链烃链基团。
本发明上下文中的术语“化妆品方面或皮肤病学上可接受的盐”必须被理解为当特别是在人和/或哺乳动物中应用或使用时生理上耐受(通常意味着其无毒,特别是作为抗衡离子的结果)的任何盐。这些盐的实例包括酸加成盐和碱加成盐。酸加成盐包括矿物酸加成盐,举例如盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硝酸盐、磷酸盐;和有机酸加成盐,举例如乙酸盐、马来酸盐、富马酸盐、柠檬酸盐、草酸盐、琥珀酸盐、酒石酸盐、苹果酸盐、扁桃酸盐、甲磺酸盐和对甲苯磺酸盐。碱加成盐的实例包括无机盐,举例如钠、钾、钙、铵、镁、铝和锂盐;及有机碱盐,举例如乙二胺、乙醇胺、N,N-二亚烷基乙醇胺、三乙醇胺、葡糖胺和碱性氨基酸盐。
在第一方面,本发明涉及制备有机硅渐进性光保护聚合物的方法(从现在起称为方法1),其包括使如上定义的式(I)的单体与如上定义的式(IV)的化合物在烷醇/水混合物中反应。
在优选的实施方案中,在本发明的方法1中使用的式(I)的单体中,R1、R3、R4和R5是H。
在另一优选的实施方案中,R2选自OR10、NH2、NHR11和NR12R13,其中R10、R11、R12和R13是直链(C1-C6)烷基。甚至更优选地,R2选自OR10和NR12R13,其中R10、R12和R13也是直链(C1-C6)烷基,更优选为甲基或乙基。
甚至更优选地,在方法(1)中使用的式(I)的单体中,R1、R3、R4和R5是H,且R2选自OR10、NH2、NHR11和NR12R13,其中R10、R11、R12和R13是直链(C1-C6)烷基。甚至更优选地,R2选自OR10和NR12R13,其中R10、R12和R13也是直链(C1-C6)烷基,更优选为甲基或乙基。
在另一优选的实施方案中,R6-R9均是H。
在另外优选的实施方案中,p是3。
在另一优选的实施方案中,s和t均是1。
在另一优选的实施方案中,Ra、Rb和Rc是直链(C1-C6)烷基,更优选为乙基。
甚至在另一优选的实施方案中,R是(i)。
在另一优选的实施方案中,在本发明的方法1中使用的式(I)的单体中,R1、R3-R5是H;R6-R9是H;R2选自OR10、NH2、NHR11和NR12R13,更优选选自OR10和NR12R13,其中R10、R11、R12和R13是直链(C1-C6)烷基,更优选为甲基或乙基;p是3;s和t是1;且Ra、Rb和Rc是直链(C1-C6)烷基。在该优选实施方案的特定实施方案中,R是(i)。已经观察到这些化合物提供最佳的转化效率,并因此提供的光保护水平提高。
在另一优选的实施方案中,在本发明的方法1中使用的式(I)的单体选自:
—4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯
—4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二甲基氨基)苯酯
—4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-甲氧基苯酯
—4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二乙基氨基)苯酯
—4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二甲基氨基)苯酯
—4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯
在特定的实施方案中,在本发明的方法1中使用的式(IV)的硅烷中,Rd、Re、Rf和Rg独立地是直链或支链(C1-C6)烷基,更优选它们均是直链(C1-C6)烷基,甚至更优选它们是乙基。
在另一优选的实施方案中,在本发明的方法1中使用的式(IV)的硅烷中,w1和w2均是1。
甚至更优选地,式(IV)的硅烷是四乙氧基硅烷(TEOS)。
在本发明的特定实施方案中,在选自氨、单烷基胺、二烷基胺、三烷基胺、单烷醇胺、二烷醇胺和三烷醇胺的含氮碱性化合物存在下实施方法1。烷基和烷醇基团均是直链或支链的,具有1至6个碳原子。优选地,含氮碱性化合物是氨。
在第二方面,本发明涉及可通过本发明的方法1得到的有机硅渐进性光保护聚合物。
可如本说明书中所示得到的本发明的光保护聚合物呈微颗粒或纳米颗粒形式。而且,这类颗粒具有均匀和球形或准球形的形式,并且基本上是密封的。
在本发明的上下文中,所谓术语“微颗粒或纳米颗粒形式”被理解为平均粒径小于100微米的颗粒。通常,所述颗粒具有10nm至10微米、优选100至1500nm范围的平均粒径。
通过本发明的方法1制备颗粒具有的优点是,可按悬浮液的形式得到产物,所述悬浮液含有约1至25%的由密封的球形或准球形颗粒组成的固体,其可直接用在本发明的化妆品或皮肤病学组合物中。如前面所提到的那样,密封性是本发明的聚合物的相关物理性质,因为苯甲酸酯或其光转化产物的释放被减至最少。
光保护活性是由于通过苯甲酸酯片段向2-羟基二苯甲酮片段的光-弗瑞斯重排(photo-Fries rearrangement)而原位转化成防晒2-羟基二苯甲酮聚合物所致,如用于说明目的的方案1所示:
其中R1-R5,且n是构成聚合物的单体单元的数目。
这些光保护聚合物显示出取决于太阳暴露的时间和由聚合物吸收的太阳辐射的剂量的渐进性UV保护作用。这种渐进性UV保护性质在其UVB和UVA屏蔽能力中得到证明。光-弗瑞斯重排的程度指示接收的UVB辐射的量。
因此,含有这些光保护聚合物的组合物提供了比采用常规防晒产品更安全的日光浴方法,因为保护作用随着太阳暴露的时间和辐射的剂量而增强。
因此,在另一方面,本发明涉及如上定义的光保护聚合物在制备用于保护人或动物活体免受UV辐射的化妆品或皮肤病学组合物中的用途。
在另一方面,本发明涉及如上定义的光保护聚合物作为UV吸收剂的光化学前体的用途。
在另一方面,本发明涉及如上定义的光保护聚合物在制备拟应用于人或动物活体的化妆品或皮肤病学组合物中的用途,其特征是取决于太阳暴露的时间和太阳辐射的程度的渐进性UV保护作用。
在另一方面,本发明涉及如上定义的光保护聚合物,其用于保护人或动物活体免受UV辐射。
本发明的另一方面涉及包含如上定义的有机硅渐进性光保护聚合物或其混合物的化妆品或皮肤病学组合物。
本发明还涉及如之前提到的包含有效量的如上定义的聚合物或其混合物的化妆品或皮肤病学组合物,其易于被原位光化学转化成具有增强的UV保护能力的防晒化合物。
在本发明的特定实施方案中,基于组合物的总重量而言,光保护聚合物在化妆品或皮肤病学组合物中的含量范围在0.01重量%至40重量%。优选地,该量处于0.05至25重量%的范围内,更优选处于0.1至15重量%以内。
本发明的化妆品或皮肤病学组合物还可以含有至少一种用于过滤UVB或UVA射线的另外的有机防晒化合物。在优选的实施方案中,所述另外的防晒化合物选自亚佛苯酮(avobenzone)、对-甲氧基肉桂酸2-乙基己酯、氧苯酮(oxybenzone)、辛基二甲基对氨基苯甲酸、二氧苯酮、4-[双(羟丙基)]氨基苯甲酸乙酯、2-氰基-3,3-二苯基丙烯酸2-乙基己酯、水杨酸2-乙基己酯、对氨基苯甲酸甘油酯、水杨酸3,3,5-三甲基环己酯、蒽甲酸甲酯(methylanthranylate)、对二甲基氨基苯甲酸、对二甲基氨基苯甲酸2-乙基己酯、2-苯基苯并咪唑-5-磺酸、2-对二甲基氨基苯基-5-锍苯并噁唑酸、磺异苯酮(sulisobenzone)、2-(4-二乙基氨基-2-羟基苯甲酰基)苯甲酸己酯、2-(4-甲基亚苄基)-樟脑和4-异丙基二苯甲酰基甲烷。
此外,本发明的组合物可另外含有常用的佐剂和添加剂,如防腐剂、抗氧化剂、脂肪物质、油、水、有机溶剂、硅酮、增稠剂、软化剂、乳化剂、消泡剂、润湿剂、香料、表面活性剂、填料、掩蔽剂、阴离子、阳离子、非离子或两性聚合物或其混合物、推进剂酸化或碱化剂、染料、着色剂、颜料、纳米颜料或通常配制到化妆品中的任何其它成分,特别是用于生产防晒组合物的成分。
本领域技术人员可基于所需的产品而很容易地选择出化妆品和皮肤病学佐剂及添加剂的必要量,并且这将在实施例中加以说明,但不限于此。在本发明的优选实施方案中,基于组合物的总重量而言,佐剂和/或添加剂在化妆品或皮肤病学组合物中的含量范围在0.01重量%至40重量%。优选地,该量处于0.05至25重量%的范围内,更优选处于0.1至15重量%以内。
在另一特定的实施方案中,本发明的化妆品或皮肤病学组合物包含根据本发明的第二方面的聚合物或其混合物,其特征在于,基于组合物的总重量而言,所述聚合物的含量范围在0.01重量%至40重量%,优选为0.05重量%至25重量%,且更优选为0.01重量%至15重量%,以及防晒化合物,其选自亚佛苯酮、对-甲氧基肉桂酸2-乙基己酯、氧苯酮、辛基二甲基对氨基苯甲酸、二氧苯酮、4-[双(羟丙基)]氨基苯甲酸乙酯、2-氰基-3,3-二苯基丙烯酸2-乙基己酯、水杨酸2-乙基己酯、对氨基苯甲酸甘油酯、水杨酸3,3,5-三甲基环己酯、邻氨基苯甲酸甲酯、对二甲基氨基苯甲酸、对二甲基氨基苯甲酸2-乙基己酯、2-苯基苯并咪唑-5-磺酸、2-对二甲基氨基苯基-5-锍苯并噁唑酸、磺异苯酮、2-(4-二乙基氨基-2-羟基苯甲酰基)苯甲酸己酯、2-(4-甲基亚苄基)-樟脑和4-异丙基二苯甲酰基甲烷,基于组合物的总重量而言,拟施加于人或动物活体的防晒化合物的含量范围在0.01重量%至40重量%,优选为0.05重量%至25重量%,且更优选为0.01重量%至15重量%。
可特别地按如下的形式提供本发明的化妆品或皮肤病学组合物:乳膏、软膏、乳剂、混悬液、粉末、油、洗剂、凝胶、棒、泡沫、乳液、分散体、喷雾剂、气雾剂、唇膏、粉底、化妆物、散粉或压粉、眼胭脂、眼影、睫毛膏、指甲油、指甲漆和用于毛发的非永久性染色组合物。
在另一方面,本发明涉及根据本发明的第八方面的式(I)的单体。
在优选的实施方案中,R1、R3、R4和R5是H。
在另一优选的实施方案中,R2选自OR10、NH2、NHR11和NR12R13,其中R10、R11、R12和R13是直链(C1-C6)烷基。甚至更优选地,R2选自OR10和NR12R13,其中R10、R12和R13也是直链(C1-C6)烷基,更优选为甲基或乙基。
在另一优选的实施方案中,R6-R9均是H。
在另外优选的实施方案中,p是3。
在另一优选的实施方案中,s和t均是1。
在另一优选的实施方案中,Ra、Rb和Rc是直链(C1-C6)烷基,更优选为乙基。
甚至在另一优选的实施方案中,R是(i)。
在另一优选的实施方案中,R1、R3-R5是H;R6-R9是H;R2选自OR10、NH2、NHR11和NR12R13,更优选选自OR10和NR12R13,其中R10、R11、R12和R13是直链(C1-C6)烷基,更优选为甲基或乙基;p是3;s和t是1;且Ra、Rb和Rc是直链(C1-C6)烷基。在该优选实施方案的特定实施方案中,R是(i)。
在另一优选的实施方案中,式(I)的单体选自:
—4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯
—4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二甲基氨基)苯酯
—4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-甲氧基苯酯
—4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二乙基氨基)苯酯
—4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二甲基氨基)苯酯
—4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯。
在另一方面,本发明涉及制备如上定义的当连接基L是基团–CH=N-时的式(I)的单体的方法,其包括根据本发明的第九方面使式(II)的化合物与式(III)的化合物反应。
式(II)的化合物的醛基团与式(III)的化合物的胺基团之间的这种反应得到亚胺基团(-CH=N-)以及化学计量的水。为了消除水及防止反应的逆转,可以采用本领域技术人员已知的任何除水方法。在特定的实施方案中,此反应在除水剂的存在下进行,举例如无水硫酸镁。
本发明还涉及制备如上定义的当连接基L是基团-(CH2)-O-C(O)-NH-时的式(I)的单体的方法,其包括根据本发明的第十方面在还原剂的存在下使式(II)的化合物发生还原反应以产生式(V)的化合物,并使式(V)的化合物与式(VI)的化合物反应。
在式(I)的单体的合成中可使用技术人员已知用于这种类型反应的任何还原剂。在特定的实施方案中,还原剂是硼氢化钠。
通过如本说明书提供的实施例中描述的有机化学的常规已知方法,由市售的起始反应物制备式(II)和(III)的化合物。例如,可根据以下方案的反应[未显示取代基R1-R9]得到式(II)的化合物:
通过常规的化学方法由含有碱性或酸性部分的母体化合物合成式(I)的单体的化妆品方面或皮肤病学上可接受的盐。一般地,这类盐例如是通过使这些化合物的游离酸或碱形式与化学计量的适当的碱或酸在水中或在有机溶剂中或在两者的混合物中反应制备的。一般地,像醚、乙酸乙酯、乙醇、异丙醇或乙腈的非水介质是优选的。
提供以下实施例以进一步说明本发明的某些实施方案,但不能认为是以任何方式限制本发明的范围。
实施例
实施例1. 4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯(化合物1)的合成
步骤1:4-甲酰基苯甲酰氯的合成
将0.92g(6.13mmol)的4-甲酰基苯甲酸悬浮于50mL无水甲苯中。添加16mL亚硫酰氯(0.22mol)并在氮气氛下将所得悬浮液在130℃下加热3小时,然后冷却到室温并在减压下蒸发溶剂。额外添加50mL甲苯并在减压下蒸发以消除可能剩下的亚硫酰氯。重复此过程两次。将得到的固体不经进一步纯化而直接使用。
步骤2:4-甲酰基苯甲酸3-(二乙基氨基)苯酯的合成
将1.01g(6.13mmol)的3-(二乙基氨基)苯酚悬浮于50mL二氯甲烷中,并通过添加0.85mL(6.13mmol)三乙胺来溶解。将所得溶液搅拌30分钟,此后滴加在二氯甲烷中含4-甲酰基苯甲酰氯的溶液(在20mL溶剂中6.13mmol酰氯)。将所得溶液在室温下搅拌5小时,然后用碳酸钠的饱和水溶液(3×40mL)萃取,经硫酸镁干燥并在减压下蒸发溶剂。将得到的褐色固体用环己烷重结晶,产生淡黄色的固体(50%收率,通过HPLC评估纯度为95%)。
1H-NMR(CDCl3):10.15ppm(s,1H),8.37ppm(d,2H),8.02ppm(d,2H),7.24ppm(t,1H),6.57ppm(dd,1H),6.47ppm(m,2H),3.35ppm(q,4H),1.23ppm(t,6H)
步骤3:4-(羟甲基)苯甲酸3-(二乙基氨基)苯酯的合成
将2.00g(6.72mmol)的4-甲酰基苯甲酸3-(二乙基氨基)苯酯悬浮于50mL无水乙醇中,并在冰浴中分小份添加0.80g(3eq)硼氢化钠。添加完成后,将溶液在室温下搅拌30分钟。然后,添加30mL水并继续搅拌半小时。添加氯仿(3×50mL)并将有机相萃取,经硫酸镁干燥并在减压下蒸发溶剂,得到为黄色固体的所需产物(90%收率)。
1H-NMR(CDCl3):8.20ppm(d,2H),7.49ppm(d,2H),7.24ppm(t,1H),6.57ppm(dd,1H),6.47ppm(m,2H),4.80ppm(s,2H),3.35ppm(q,4H),1.23ppm(t,6H)
步骤4:4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯的合成
将1.15g(3.84mmol)的4-(羟甲基)苯甲酸3-(二乙基氨基)苯酯溶解在100mL氯仿中,并添加2.85mL(3eq)的异氰酸3-(三乙氧基甲硅烷基)丙酯和1.60mL(3eq)的三乙胺。将所得溶液回流48小时。一旦再次冷却到室温,在减压下蒸发溶剂,并在真空下蒸馏过量的反应物,产生为油状物的所需产物(定量收率)。
1H-NMR(CDCl3):8.20ppm(d,2H),7.49ppm(d,2H),7.24ppm(t,1H),6.57ppm(dd,1H),6.47ppm(m,2H),5.19ppm(s,1H),4.80ppm(s,2H),3.85ppm(q,6H),3.35ppm(q,4H),3.20ppm(t,2H),1.61ppm(m,2H),1.23ppm(t,9H),1.18ppm(t,6H),0.69ppm(m,2H)。
实施例2. 4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二甲基氨基)苯酯(化合物2)的合成
步骤1:4-甲酰基苯甲酰氯的合成
将0.92g(6.13mmol)的4-甲酰基苯甲酸悬浮于50mL无水甲苯中。添加16mL亚硫酰氯(0.22mol),并在氮气氛下将所得悬浮液在130℃下加热3小时,然后冷却到室温并在减压下蒸发溶剂。额外添加50mL甲苯并在减压下蒸发以消除可能剩下的亚硫酰氯。重复此过程两次。将得到的固体不经进一步纯化而直接使用。
步骤2:4-甲酰基苯甲酸3-(二甲基氨基)苯酯的合成
将0.84g(6.13mmol)的3-(二甲基氨基)苯酚悬浮于50mL二氯甲烷中,并通过添加0.85mL(6.13mmol)三乙胺来溶解。将所得溶液搅拌30分钟,此后滴加在二氯甲烷中含4-甲酰基苯甲酰氯的溶液(在20mL溶剂中6.13mmol酰氯)。将所得溶液在室温下搅拌5小时,然后用碳酸钠的饱和水溶液(3×40mL)萃取,经硫酸镁干燥并在减压下蒸发溶剂。将得到的褐色固体用环己烷重结晶,产生淡黄色的固体(60%收率,通过HPLC评估纯度为95%)。
1H-NMR(CDCl3):10.14ppm(s,1H),8.37ppm(d,2H),8.02ppm(d,2H),7.26ppm(t,1H),6.64ppm(dd,1H),6.54ppm(dd+t,2H),2.97ppm(s,6H)
步骤3:4-(羟甲基)苯甲酸3-(二甲基氨基)苯酯的合成
将2.00g(7.43mmol)的4-甲酰基苯甲酸3-(二甲基氨基)苯酯悬浮于50mL无水乙醇中,并在冰浴中分小份添加0.80g(3eq)硼氢化钠。添加完成后,将溶液在室温下搅拌30分钟。然后,添加30mL水并继续搅拌半小时。添加氯仿(3×50mL)并将有机相萃取,经硫酸镁干燥并在减压下蒸发溶剂,得到为黄色固体的所需产物(90%收率)。
1H-NMR(CDCl3):8.20ppm(d,2H),7.49ppm(d,2H),7.26ppm(t,1H),6.64ppm(dd,1H),6.54ppm(dd+t,2H),4.80ppm(s,2H),2.97ppm(s,6H)
步骤4:4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二甲基氨基)苯酯的合成
将1.03g(3.84mmol)的4-(羟甲基)苯甲酸3-(二甲基氨基)苯酯溶解在100mL氯仿中,并添加2.85mL(3eq)的异氰酸3-(三乙氧基甲硅烷基)丙酯和1.60mL(3eq)的三乙胺。将所得溶液回流48小时。一旦再次冷却到室温,在减压下蒸发溶剂,并在真空下蒸馏过量的反应物,产生为油状物的所需产物(定量收率)。
1H-NMR(CDCl3):8.20ppm(d,2H),7.49ppm(d,2H),7.26ppm(t,1H),6.64ppm(dd,1H),6.54ppm(dd+t,2H),4.80ppm(s,2H),3.20ppm(t,2H),2.97ppm(s,6H),1.61ppm(m,2H),1.23ppm(t,9H),0.69ppm(m,2H)
实施例3. 4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-甲氧基苯酯(化合物3)的合成
步骤1:4-甲酰基苯甲酰氯的合成
将0.92g(6.13mmol)的4-甲酰基苯甲酸悬浮于50mL无水甲苯中。添加16mL亚硫酰氯(0.22mol)并在氮气氛下将所得悬浮液在130℃下加热3小时,然后冷却到室温并在减压下蒸发溶剂。额外添加50mL甲苯并在减压下蒸发以消除可能剩下的亚硫酰氯。重复此过程两次。将得到的固体不经进一步纯化而直接使用。
步骤2:4-甲酰基苯甲酸3-甲氧基苯酯的合成
将0.76g(6.13mmol)的3-甲氧基苯酚悬浮于50mL二氯甲烷中,并通过添加0.85mL(6.13mmol)三乙胺来溶解。将所得溶液搅拌30分钟,此后滴加在二氯甲烷中含4-甲酰基苯甲酰氯的溶液(在20mL溶剂中6.13mmol酰氯)。将所得溶液在室温下搅拌5小时,然后用碳酸钠的饱和水溶液(3×40mL)萃取,经硫酸镁干燥并在减压下蒸发溶剂。得到白色固体,通过HPLC评估具有96%的纯度(90%收率)。
1H-NMR(CDCl3):10.14ppm(s,1H),8.37ppm(d,2H),8.02ppm(d,2H),7.34ppm(t,1H),6.84ppm(td,2H),6.78ppm(t,1H),3.83ppm(s,3H)
步骤3:4-(羟甲基)苯甲酸3-甲氧基苯酯的合成
将2.00g(7.75mmol)的4-甲酰基苯甲酸3-甲氧基苯酯悬浮于50mL无水乙醇中,并在冰浴中分小份添加0.80g(3eq)硼氢化钠。添加完成后,将溶液在室温下搅拌30分钟。然后,添加30mL水并继续搅拌半小时。添加氯仿(3×50mL)并将有机相萃取,经硫酸镁干燥并在减压下蒸发溶剂,得到为黄色固体的所需产物(90%收率)。
1H-NMR(CDCl3):8.20ppm(d,2H),7.50ppm(d,2H),7.34ppm(t,1H),6.84ppm(td,2H),6.78ppm(t,1H),4.8ppm(s,2H),3.83ppm(s,3H)
步骤4:4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-甲氧基苯酯的合成
将0.99g(3.84mmol)的4-(羟甲基)苯甲酸3-甲氧基苯酯溶解在100mL氯仿中,并添加2.85mL(3eq)的异氰酸3-(三乙氧基甲硅烷基)丙酯和1.60mL(3eq)的三乙胺。将所得溶液回流48小时。一旦再次冷却到室温,在减压下蒸发溶剂,并在真空下蒸馏过量的反应物,产生为油状物的所需产物(定量收率)。
1H-NMR(CDCl3):8.20ppm(d,2H),7.50ppm(d,2H),7.34ppm(t,1H),6.84ppm(td,2H),6.78ppm(t,1H),4.8ppm(s,2H),3.83ppm(s,3H),3.20ppm(t,2H),1.61ppm(m,2H),1.23ppm(t,9H),0.69ppm(m,2H)
实施例4. 4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二乙基氨基)苯酯(化合物4)的合成
步骤1:4-甲酰基苯甲酰氯的合成
将0.92g(6.13mmol)的4-甲酰基苯甲酸悬浮于50mL无水甲苯中。添加16mL亚硫酰氯(0.22mol)并在氮气氛下将所得悬浮液在130℃下加热3小时,然后冷却到室温并在减压下蒸发溶剂。额外添加50mL甲苯并在减压下蒸发以消除可能剩下的亚硫酰氯。重复此过程两次。将得到的固体不经进一步纯化而直接使用。
步骤2:4-甲酰基苯甲酸3-(二乙基氨基)苯酯的合成
将1.01g(6.13mmol)的3-(二乙基氨基)苯酚悬浮于50mL二氯甲烷中,并通过添加0.85mL(6.13mmol)三乙胺来溶解。将所得溶液搅拌30分钟,此后滴加在二氯甲烷中含4-甲酰基苯甲酰氯的溶液(在20mL溶剂中6.13mmol酰氯)。将所得溶液在室温下搅拌5小时,然后用碳酸钠的饱和水溶液(3×40mL)萃取,经硫酸镁干燥并在减压下蒸发溶剂。将得到的褐色固体用环己烷重结晶,产生淡黄色的固体(50%收率,通过HPLC评估纯度为95%)。
1H-NMR(CDCl3):10.15ppm(s,1H),8.37ppm(d,2H),8.02ppm(d,2H),7.24ppm(t,1H),6.57ppm(dd,1H),6.47ppm(m,2H),3.35ppm(q,4H),1.23ppm(t,6H)
步骤3:4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二乙基氨基)苯酯的合成
将50mg(0.17mmol)的4-甲酰基苯甲酸3-(二乙基氨基)苯酯悬浮于20mL氯仿中并添加37mg(0.17mmol)的3-(氨基丙基)三乙氧基硅烷,接着添加100mg无水硫酸镁。在氮气氛下将所得悬浮液在室温下搅拌24h。过滤粗物质并在减压下消除溶剂,产生橙色油状物(定量收率)。
1H-NMR(CDCl3):8.36ppm(s,1H),8.24ppm(d,2H),7.85ppm(d,2H),7.21ppm(t,1H),6.57ppm(dd,1H),6.47ppm(m,2H),3.84ppm(q,6H),3.67ppm(t,2H),3.35ppm(q,4H),1.86ppm(m,2H),1.23ppm(t,9H),1.17ppm(t,6H),0.69ppm(m,2H)。
实施例5. 4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二甲基氨基)苯酯(化合物5)的合成
步骤1:4-甲酰基苯甲酰氯的合成
将0.92g(6.13mmol)的4-甲酰基苯甲酸悬浮于50mL无水甲苯中。添加16mL亚硫酰氯(0.22mol)并在氮气氛下将所得悬浮液在130℃下加热3小时,然后冷却到室温并在减压下蒸发溶剂。额外添加50mL甲苯并在减压下蒸发以消除可能剩下的亚硫酰氯。重复此过程两次。将得到的固体不经进一步纯化而直接使用。
步骤2:4-甲酰基苯甲酸3-(二甲基氨基)苯酯的合成
将0.84g(6.13mmol)的3-(二甲基氨基)苯酚悬浮于50mL二氯甲烷中,并通过添加0.85mL(6.13mmol)三乙胺来溶解。将所得溶液搅拌30分钟,此后滴加在二氯甲烷中含4-甲酰基苯甲酰氯的溶液(在20mL溶剂中6.13mmol酰氯)。将所得溶液在室温下搅拌5小时,然后用碳酸钠的饱和水溶液(3×40mL)萃取,经硫酸镁干燥并在减压下蒸发溶剂。将得到的褐色固体用环己烷重结晶,产生淡黄色的固体(60%收率,通过HPLC评估纯度为95%)。
1H-NMR(CDCl3):10.14ppm(s,1H),8.37ppm(d,2H),8.02ppm(d,2H),7.26ppm(t,1H),6.64ppm(dd,1H),6.54ppm(dd+t,2H),2.97ppm(s,6H)
步骤3:4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二甲基氨基)苯酯的合成
将50mg(0.19mmol)的4-甲酰基苯甲酸3-(二甲基氨基)苯酯悬浮于20mL氯仿中并添加41mg(0.19mmol)的3-(氨基丙基)三乙氧基硅烷,接着添加100mg无水硫酸镁。在氮气氛下将所得悬浮液在室温下搅拌24h。过滤粗物质并在减压下消除溶剂,产生橙色油状物(定量收率)。
1H-NMR(CDCl3):8.36ppm(s,1H),8.24ppm(d,2H),7.85ppm(d,2H),7.27ppm(t,1H),6.63ppm(dd,1H),6.55ppm(m,2H),3.85ppm(q,6H),3.67ppm(t,2H),2.97(s,6H),1.86ppm(m,2H),1.23ppm(t,9H),0.70ppm(m,2H)。
实施例6. 4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯(化合物6)的合成
步骤1:4-甲酰基苯甲酰氯的合成
将0.92g(6.13mmol)的4-甲酰基苯甲酸悬浮于50mL无水甲苯中。添加16mL亚硫酰氯(0.22mol)并在氮气氛下将所得悬浮液在130℃下加热3小时,然后冷却到室温并在减压下蒸发溶剂。额外添加50mL甲苯并在减压下蒸发以消除可能剩下的亚硫酰氯。重复此过程两次。将得到的固体不经进一步纯化而直接使用。
步骤2:4-甲酰基苯甲酸3-甲氧基苯酯的合成
将0.76g(6.13mmol)的3-甲氧基苯酚悬浮于50mL二氯甲烷中,并通过添加0.85mL(6.13mmol)三乙胺来溶解。将所得溶液搅拌30分钟,此后滴加在二氯甲烷中含4-甲酰基苯甲酰氯的溶液(在20mL溶剂中6.13mmol酰氯)。将所得溶液在室温下搅拌5小时,然后用碳酸钠的饱和水溶液(3×40mL)萃取,经硫酸镁干燥并在减压下蒸发溶剂。得到白色固体,通过HPLC评估具有96%的纯度(90%收率)。
1H-NMR(CDCl3):10.14ppm(s,1H),8.37ppm(d,2H),8.02ppm(d,2H),7.34ppm(t,1H),6.84ppm(td,2H),6.78ppm(t,1H),3.83ppm(s,3H)
步骤3:4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯的合成
将50mg(0.20mmol)的4-甲酰基苯甲酸3-甲氧基苯酯悬浮于20mL氯仿中并添加43mg(0.20mmol)的3-(氨基丙基)三乙氧基硅烷,接着添加100mg无水硫酸镁。在氮气氛下将所得悬浮液在室温下搅拌24h。过滤粗物质并在减压下消除溶剂,产生橙色油状物(定量收率)。
1H-NMR(CDCl3):8.36ppm(s,1H),8.24ppm(d,2H),7.85ppm(d,2H),7.32ppm(t,1H),6.83ppm(m,2H),6.79ppm(t,1H),3.83ppm(q+s,6H+3H OMe),3.67ppm(t,2H),1.86ppm(m,2H),1.23ppm(t,9H),0.70ppm(m,2H)。
实施例7.颗粒的制备
7.1.颗粒表征
通过粒度分布、UV-Vis光谱法和HPLC色谱法表征根据下述方法得到的颗粒。
7.1.1.颗粒形态
粒度分布显示颗粒是单分散的,粒度为370±70nm。
7.1.2.UV-Vis光谱法
以1.3mg/cm2的速率将颗粒3%(30mg/mL)在PEG-300中的悬浮液添加到PMMA板中。当以漫透射率模式用积分球记录UV-Vis光谱时,颗粒显示出在UVB区中的强力吸收,队列转向UVA。
7.1.3.HPLC色谱法
通过在高温下用溶剂萃取来确定颗粒密封性,通过HPLC分析萃取物。将颗粒(200mg)及甲醇和水((80:20)的混合物100mL在索氏装置(Soxhlet)中回流5小时。在下列条件下通过HPLC分析溶剂样品:
—设备:HP 1090液相色谱仪
—柱:反相Kromasil C18 5μm 15x0.46
—流动相:乙腈/水80:20
—流量:1.0mL/min
—检测:吸收254nm
颗粒色谱图仅显示出溶剂死点时间,因此表明颗粒基本上是密封性的。
7.2.颗粒光转化
在设有16个UVB灯(辐照度70W/m2)的Luzchem ICH-2光反应器中在35℃下辐照悬浮于PEG-300中的颗粒。
7.2.1.UV-Vis光谱法
以1.3mg/cm2的速率将在PEG-300中的3%颗粒悬浮液添加到PMMA板中。通过测量样品在280nm与400nm之间的漫透射率来控制光转化的进展。
颗粒光谱显示经辐照的颗粒在UVB和UVA区中均有吸收。
7.2.2.HPLC色谱法
按与未经辐照的微胶囊(2.4)的情况相同的方式进行经辐照的微胶囊的HPLC色谱法。
颗粒色谱图仅显示出溶剂死点时间,因此表明颗粒基本上是密封性的。
7.3.颗粒的制备:
4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二乙基氨基)苯酯颗粒(P1);
4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯颗粒(P2);
4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二甲基氨基)苯酯颗粒(P3);
4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-甲氧基苯酯颗粒(P4);
4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二甲基氨基)苯酯颗粒(P5);
4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯颗粒(P6)
如下制备颗粒P1:在水浴中将乙醇(3.8mL,0.082mmol)和去离子水(1.4mL,0.078mmol)的混合物搅拌加热到40℃。在同一浴中不搅拌地加热四乙氧基硅烷(TEOS,396mg,1.903mmol)和4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-(二乙基氨基)苯酯(150mg,0.326mmol)的混合物。当乙醇/水混合物温度达到40℃时,添加1.7mL的30%的氨(0.011mmol)并增强搅拌以确保混合物均匀。当温度再次达到40℃时,添加TEOS和苯甲酸3-(3-(三乙氧基甲硅烷基)丙氧基)苯酯的溶液并搅拌15秒。将所产生的悬浮液在40℃下搁置1小时,如此离心并用水(25mL×3)洗涤。最后,将颗粒再悬浮于含有作为稳定剂的0.5%w/w的PVP k-90和HPMC的水溶液中。颗粒中的发色团的含量为50%w/w,表示为4-甲基苯甲酸3-(二乙基氨基)苯酯。
按照上述合成方式由适当的试剂制备颗粒P2-P6。评估所有化合物的HPLC密封性。制备和分析细节汇总于表1中。
表1
(1)表示为4-甲基苯甲酸3-(二乙基氨基)苯酯
(2)表示为4-甲基苯甲酸3-(二甲基氨基)苯酯
(3)表示为4-甲基苯甲酸3-甲氧基苯酯
(4)表示为4-甲基苯甲酸3-(二甲基氨基)苯酯
(5)表示为4-甲基苯甲酸3-甲氧基苯酯
实施例8.防晒组合物的制备
用颗粒P1作为活性成分制备防晒组合物。
组合物的组分示于下表中:
将B相成分合并。将混合物搅拌并加热到70-75℃。将A相成分合并。在搅拌的同时将混合物加热到70-75℃。在搅拌的同时将B相添加到A相中。添加防腐剂。搅拌混合物,使其冷却到室温。
实施例9比较.4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯(化合物6)和苯甲酸3-(3-(三乙氧基甲硅烷基)丙基氧基)苯酯的光转化的研究。
将前体4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯(本发明的化合物6)的光转化速率与现有技术中描述的前体苯甲酸3-(3-(三乙氧基甲硅烷基)丙基氧基)苯酯(比较化合物A)的光转化速率相比较。
将这些前体以1%w/v(10mg/L)的浓度溶解在乙醇中,并在装配有日光滤光器(290-800nm,765W/m2)的SUNTEST ATLAS XLS+中使之暴露于模拟太阳辐射。图7和图8分别显示本发明的化合物6和比较化合物A的光转化程度。每个图中的插图显示在335nm处的光转化动力学。
下表显示每种前体在暴露于模拟太阳辐射后的最终消光值以及转化的半衰期(t50,达到最终消光值的50%所需的MED数)。
可以观察到,化合物6的转化比比较化合物A的转化快3.3倍。因此,在酰基环上引入甲硅烷基化链加速了其光转化。
实施例10比较.4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯(化合物1)和苯甲酸3-(双(3-(三乙氧基甲硅烷基)丙基)氨基)苯酯(比较化合物B)的光转化的研究。
将前体4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯(本发明的化合物1)的光转化速率与现有技术中描述的前体苯甲酸3-(双(3-(三乙氧基甲硅烷基)丙基)氨基)苯酯(比较化合物B)的光转化速率相比较。
将这些前体以1%w/v(10mg/L)的浓度溶解在乙醇中,并在装配有日光滤光器(290-800nm,765W/m2)的SUNTEST ATLAS XLS+中使之暴露于模拟太阳辐射。图9和图10分别显示本发明的化合物1和比较化合物B的光转化程度。每个图中的插图显示在360nm处的光转化动力学。
下表显示每种前体在暴露于模拟太阳辐射后达到的最终消光值以及代表每种前体达到最终消光值的50%所需的辐照剂量的MED(最小红斑剂量)的参数t50。
从上面引用的结果可以推断,在酰基环上引入甲硅烷基化链提供了转化后高22%的消光度增加和快60%的转化速率。
实施例11比较.在另外的商业防晒品存在下的4-((3-(三乙氧基甲硅烷基)丙基亚氨基)甲基)苯甲酸3-甲氧基苯酯(化合物6)和苯甲酸3-(3-(三乙氧基甲硅烷基)丙基氧基)苯酯(比较化合物A)的光转化。
制备含有商业UV过滤剂Tinosorb-S(3.7mg/L)和4-MBC(4.9mg/L)及本发明的化合物6(10mg/L)的乙醇溶液(a)。为比较的目的,还制备了含有商业UV过滤剂Tinosorb-S(3.7mg/L)和4-MBC(4.9mg/L)及比较化合物A(10mg/L)的乙醇溶液(b)。
在装配有日光滤光器(290-800nm,765W/m2)的SUNTEST ATLAS XLS+中将两种溶液暴露于模拟太阳辐射。
图11和12分别显示两种溶液(a)和(b)的吸收光谱。可以观察到,含有化合物6的制剂在335nm处的最终消光值高于含有比较化合物A的制剂的情况。因此,可以推断,在酰基环上引入甲硅烷基化链提供了在另外的UV过滤剂存在下具有更好的提高其防晒作用的能力的前体。
实施例12比较.在另外的商业防晒品存在下的4-((3-(三乙氧基甲硅烷基)丙基氨基甲酰氧基)甲基)苯甲酸3-(二乙基氨基)苯酯(化合物1)和苯甲酸3-(双(3-(三乙氧基甲硅烷基)丙基)氨基)苯酯(比较化合物B)的光转化。
制备含有商业UV过滤剂Tinosorb-S(3.7mg/L)和4-MBC(4.9mg/L)及本发明的化合物1(10mg/L)的乙醇溶液(c)。为比较的目的,还制备了含有商业UV过滤剂Tinosorb-S(3.7mg/L)和4-MBC(4.9mg/L)及比较化合物B(10mg/L)的乙醇溶液(d)。
在装配有日光滤光器(290-800nm,765W/m2)的SUNTEST ATLAS XLS+中将两种溶液暴露于模拟太阳辐射。图13和14分别显示两种溶液(c)和(d)的吸收光谱。
可以观察到,含有化合物1的制剂在365nm处的最终消光值较高,而在含有比较化合物B的制剂中,在20个MED的辐照之后在365nm处的消光度保持几乎不变。因此,可以再次推断,在酰基环上引入甲硅烷基化链提供了在另外的UV过滤剂存在下具有更好的提高其在UV-A区中的保护作用的能力的前体。
- 还没有人留言评论。精彩留言会获得点赞!