芳香族二胺及其中间体和它们的制造方法与流程
本发明涉及作为用于以聚酰亚胺为代表的高功能性高分子和各种有机化合物的原料有用的二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物和其制造方法。而且,本发明涉及为该二胺化合物的前体的氨基硝基-2-邻苯二甲酰亚胺二苯基醚、二硝基-2-邻苯二甲酰亚胺二苯基醚、和它们的衍生物、以及这些化合物的制造方法。
背景技术:
近年来,需要可承受在太空等苛刻条件下使用的兼具高耐热性、高断裂韧性和易成形性的高分子材料。专利文献1中,作为在成形时保持良好的加工性,同时不会因热固化产生挥发成分而赋予高耐热性的方法,记载了在将聚酰亚胺低聚物加热并用苯基乙炔基邻苯二甲酸酐等密封剂密封并成形后,进一步加热,利用苯基乙炔基使其交联和固化的方法。特别是,作为在制造碳纤维等与聚酰亚胺的复合材料时用于提高低聚物的流动性而提高加工性的改良法,专利文献2中记载了使用不对称的四羧酸酐的方法,专利文献3中记载了使用cardo(カルド)型二胺的方法,专利文献4中记载了二胺成分为不对称的2-(4-氨基苯氧基)-5-氨基联苯。
特别是,专利文献4中记载的2-(4-氨基苯氧基)-5-氨基联苯为用于获得兼具高耐热性、高断裂韧性和易成形性的高分子的原料,是大幅扩展了不对称聚酰亚胺的可能性的化合物(非专利文献1)。另外,不对称聚酰亚胺大多具有在玻璃化转变温度的高温侧因活跃的链段运动而显示高溶融流动性的特征(非专利文献2)。因此,成为不对称聚酰亚胺原料的不对称系二胺的开发受到期待。
现有技术文献
专利文献
专利文献1:美国专利5,567,800号;
专利文献2:日本特开2000-219741号公报;
专利文献3:日本特开2006-104440号公报;
专利文献4:日本特开2011-1279号公报;
非专利文献
非专利文献1:最新聚酰亚胺-基础与应用−日本聚酰亚胺·芳香族系高分子研究会编,第222-230页;
非专利文献2:聚酰亚胺·芳香族高分子最新的进步2013年横田力男编,第20-25页。
技术实现要素:
发明所要解决的课题
因此,本发明的目的是提供适合于可溶性聚酰亚胺的制造的不对称二胺及其制造方法。
用于解决课题的手段
本发明人为了解决上述课题而进行刻苦研究,结果制造了为新颖的不对称二胺的二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物、以及为该化合物的前体的氨基硝基-2-邻苯二甲酰亚胺二苯基醚和二硝基-2-邻苯二甲酰亚胺二苯基醚和它们的衍生物。而且,本发明人发现:二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物具有与上述的2-(4-氨基苯氧基)-5-氨基联苯相匹敌的性能、而且制造较为容易,从而完成了本发明。
即,本发明提供下述式(1)所表示的化合物。
[化学式1]
式中,r1、r2、r3和r4相互独立地为氢原子、碳原子数1~6的烷基或碳原子数1~3的烷氧基,a和b相互独立地为硝基或氨基。
本发明还提供上述式(1)所表示的化合物的制造方法。
发明效果
二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物可适合地用作不对称系二胺,由该化合物衍生的聚酰亚胺的利用领域的可能性大幅扩展,提供了新的功能性材料。
附图说明
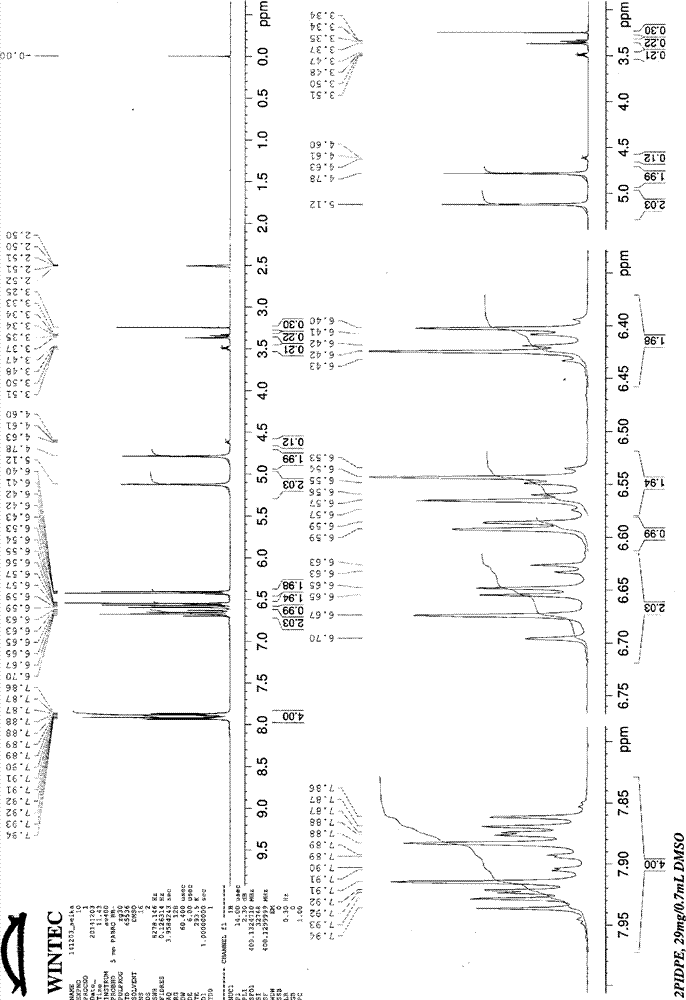
[图1]图1是实施例2所制造的化合物的1h-nmr光谱的图表。
[图2]图2是实施例2所制造的化合物的13c-nmr光谱的图表。
[图3]图3是实施例4所制造的化合物的1h-nmr光谱的图表。
[图4]图4是实施例4所制造的化合物的13c-nmr光谱的图表。
具体实施方式
[本发明的化合物]
本发明的化合物是下述式(1)所表示的具有氨基和/或硝基的邻苯二甲酰亚胺二苯基醚及其衍生物。
[化学式2]
式中,r1、r2、r3和r4相互独立地为氢原子、碳原子数1~6的烷基或碳原子数1~3的烷氧基,a和b相互独立地为硝基或氨基。
上述式(1)中,a所示的基团键合于苯环的3位、4位、5位和6位中任一处的碳原子上,b所示的基团键合于苯环的2'位、3'位和4'位中任一处的碳原子上。上述碳原子的位置如下所示。优选a和b同时为氨基、或a和b同时为硝基,特别优选a和b同时为氨基。
[化学式3]
上述式(1)中,碳原子数1~6的烷基可以是具有分支的烷基,可举出甲基、乙基、丙基、异丙基、丁基、戊基和己基等。其中优选碳原子数1~3的烷基。作为碳原子数1~3的烷氧基,可举出甲氧基、乙氧基、丙氧基、异丙氧基。特别优选的是,r1、r2、r3和r4相互独立地为氢原子或碳原子数1~3的烷基为宜,进一步优选r1、r2、r3和r4为氢原子为宜。
上述式(1)中a和b同时为氨基的化合物是指下述式(1-a)所表示的二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物。
[化学式4]
r1、r2、r3和r4与上述相同。
上述式(1-a)所表示的化合物特别优选由下述式所表示。
[化学式5]
r1、r2、r3和r4与上述相同,特别优选的是氢原子或碳原子数1~3的烷基,进一步优选为氢原子。
上述式(1)中a和b同时为硝基的化合物是指下述式(1-b)所表示的二硝基-2-邻苯二甲酰亚胺二苯基醚及其衍生物。该化合物如下文所述,可为上述二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物(式(1-a)的化合物)的前体。
[化学式6]
r1、r2、r3和r4与上述相同。
上述式(1)中a或b中任一方为氨基且另一方为硝基的化合物是指下述式(1-c)或式(1-d)所表示的氨基硝基-2-邻苯二甲酰亚胺二苯基醚及其衍生物。该化合物如下文所述,可为上述二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物(式(1-a)的化合物)的前体。
[化学式7]
[化学式8]
r1、r2、r3和r4与上述相同。
[制造方法]
上述式(1-a)所表示的化合物可通过将上述式(1-b)、式(1-c)或式(1-d)所表示的化合物的硝基还原而获得。该式(1-b)、式(1-c)和式(1-d)所表示的化合物可通过下文所述的方法制造。本发明中的上述式(1-a)所表示的化合物的制造方法可包括:在还原反应步骤之前,制造上述式(1-b)、式(1-c)或式(1-d)所表示的化合物的步骤。特别优选上述式(1-a)所表示的化合物是将上述式(1-b)所表示的化合物的硝基还原而制造为宜。
还原反应可以是催化氢化还原(加氢法)、bechamp还原、锌粉还原、氯化锡还原和肼还原等。特别优选的是催化氢化还原(加氢法)。
还原反应所用的溶剂例如可举出:甲醇、乙醇、1-丙醇、异丙醇、1-丁醇、2-甲氧基乙醇和2-乙氧基乙醇等的醇系溶剂,n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基吡咯烷酮、n,n'-二甲基咪唑烷酮等的酰胺系溶剂,四氢呋喃、二氧六环、乙二醇二甲基醚和二乙二醇等的醚系溶剂。溶剂的量可以适宜调整。
就还原反应所使用的催化剂而言,作为上述各还原反应的催化剂,只要使用公知的催化剂即可。例如,作为催化氢化还原(加氢法)所使用的催化剂,可举出负载于活性炭、碳黑、石墨、氧化铝等的钯、铂、铑等的贵金属催化剂、拉尼镍催化剂、海绵镍催化剂等。催化剂的量没有特别限制,通常为0.1~10wt%。
还原反应的反应温度和时间可适宜选择。例如,可以在50~150℃的范围内的温度、优选60~100℃的范围内的温度下反应1~10小时、优选3~5小时。反应结束后,例如,可以除去催化剂,在冷却后,将生成的固体进行过滤、水洗、干燥,由此获得上述式(1-a)所示的化合物。
上述式(1-b)所表示的化合物是使下述式(2)所表示的化合物(2-氨基-二硝基二苯基醚)与下述式(3)、(3’)、或(3’’)所表示的化合物反应而获得(酰亚胺化反应):
[化学式9]
[化学式10]
式中,r1、r2、r3和r4与上述相同,r6为氢原子或碳原子数1~4的烷基,可举出甲基和乙基等。x为卤素原子,可举出氯和溴等。
上述式(2)所表示的化合物是使下述式(a1)所表示的2-氨基-硝基苯酚盐与下述式(b1)所表示的卤化硝基苯反应而获得(醚化反应)。
[化学式11]
式中,z为碱金属或碱土类金属,x为卤素原子。
另外,上述式(2)所表示的化合物也可以是使下述式(a2)所表示的卤化硝基苯胺(nitroaniline)与下述式(b2)所表示的硝基苯酚或其金属盐反应而获得(醚化反应)。
[化学式12]
式(a2)中,x为卤素原子。
上述各式中,卤素原子可举出氯原子、氟原子、溴原子和碘原子等。
作为上述式(a1)所表示的2-氨基-硝基苯酚盐,可举出:2-氨基-3-硝基苯酚锂盐、2-氨基-3-硝基苯酚钠盐、2-氨基-3-硝基苯酚钾盐、2-氨基-3-硝基苯酚镁盐、2-氨基-3-硝基苯酚钙盐、2-氨基-4-硝基苯酚锂盐、2-氨基-4-硝基苯酚钠盐、2-氨基-4-硝基苯酚钾盐、2-氨基-4-硝基苯酚镁盐、2-氨基-4-硝基苯酚钙盐、2-氨基-5-硝基苯酚锂盐、2-氨基-5-硝基苯酚钠盐、2-氨基-5-硝基苯酚钾盐、2-氨基-5-硝基苯酚镁盐、2-氨基-5-硝基苯酚钙盐、2-氨基-6-硝基苯酚锂盐、2-氨基-6-硝基苯酚钠盐、2-氨基-6-硝基苯酚钾盐、2-氨基-6-硝基苯酚镁盐、和2-氨基-6-硝基苯酚钙盐等。这些盐可以添加相当于各自的2-氨基-硝基苯酚类的碱金属或碱土类金属的氢氧化物、碳酸盐、或碳酸氢盐,也可在反应体系中生成。
作为上述式(b1)所表示的卤化硝基苯,可举出:2-氟硝基苯、3-氟硝基苯、4-氟硝基苯、2-氯硝基苯、3-氯硝基苯、4-氯硝基苯、2-溴硝基苯、3-溴硝基苯、4-溴硝基苯、2-碘硝基苯、3-碘硝基苯、和4-碘硝基苯等。
作为上述式(a2)所表示的卤化硝基苯胺(nitroaniline),可举出:2-氯-4-硝基苯胺、2-氟-4-硝基苯胺、2-溴-4-硝基苯胺、2-氯-5-硝基苯胺、2-氟-5-硝基苯胺、和2-溴-5-硝基苯胺等。
作为上述式(b2)所示的硝基苯酚及其金属盐,可举出:2-硝基苯酚、3-硝基苯酚、4-硝基苯酚、2-硝基苯酚钠盐、3-硝基苯酚钠盐、4-硝基苯酚钠盐、2-硝基苯酚钾盐、3-硝基苯酚钾盐、4-硝基苯酚钾盐、2-硝基苯酚钙盐、3-硝基苯酚钙盐和4-硝基苯酚钙盐等。
上述式(3)所表示的邻苯二甲酸酐化合物例如为无取代的邻苯二甲酸酐、3-甲基邻苯二甲酸酐、4-甲基邻苯二甲酸酐、3-乙基邻苯二甲酸酐、4-乙基邻苯二甲酸酐、3-丙基邻苯二甲酸酐、4-丙基邻苯二甲酸酐、3-异丙基邻苯二甲酸酐、4-异丙基邻苯二甲酸酐、3,4-二甲基邻苯二甲酸酐、3,4-二乙基邻苯二甲酸酐、3,4-二丙基邻苯二甲酸酐、3,4-二异丙基邻苯二甲酸酐等。上述式(3’)所表示的邻苯二甲酸化合物为与上述邻苯二甲酸酐化合物对应的邻苯二甲酸、或、与上述邻苯二甲酸酐化合物对应的邻苯二甲酸二甲酯和邻苯二甲酸二乙酯等的邻苯二甲酸酯类。另外,作为上述式(3’’)所表示的邻苯二甲酸化合物,可举出邻苯二甲酰氯。
上述醚化反应中,各原料化合物的量比以如下的量比为宜:例如,相对于2-氨基-硝基苯酚盐(式(a1))1摩尔,优选卤化硝基苯(式(b1))为1.0~1.5摩尔、进一步优选为1.05~1.2摩尔。上述酰亚胺化反应中,各原料化合物的量比以如下的量比为宜:相对于2-氨基-二硝基二苯基醚(式(2))1摩尔,优选邻苯二甲酸酐化合物或邻苯二甲酸化合物为1.0~2.0摩尔、进一步优选为1.0~1.2摩尔。
上述式(1-c)所表示的化合物可通过使2-氨基-硝基苯酚盐(上述式(a1))与上述的邻苯二甲酸酐化合物或邻苯二甲酸化合物反应合成下述式(a’)所示的化合物(酰亚胺化反应)、使该式(a’)的化合物与卤化氨基苯(下述式(c))反应(醚化反应)而获得。
[化学式13]
式中,x为卤素原子。
作为上述式(c)所表示的卤化氨基苯,可举出:2-氟氨基苯、3-氟氨基苯、4-氟氨基苯、2-氯氨基苯、3-氯氨基苯、4-氯氨基苯、2-溴氨基苯、3-溴氨基苯、4-溴氨基苯、2-碘氨基苯、3-碘氨基苯、和4-碘氨基苯等。
上述式(1-d)所表示的化合物可以通过使将上述式(a’)的硝基还原所得的氨基邻苯二甲酰亚胺苯酚盐(下述式(d))与卤化硝基苯(上述式(b1))反应(醚化反应)而获得。
[化学式14]
上述式(a’)所表示的化合物的硝基的还原反应可以是催化氢化还原(加氢法)、bechamp还原、锌粉还原、氯化锡还原和肼还原等。特别优选的是催化氢化还原(加氢法)。可以使用上述(1-a)的制造方法所记载的还原反应中的溶剂、催化剂和反应条件等。
醚化和酰亚胺化可在溶剂存在下进行。该溶剂的种类和量可以按照公知的方法适宜选择。作为可使用的溶剂,可举出非质子性极性溶剂。例如可以使用:二甲基甲酰胺、二甲基乙酰胺、n-甲基吡咯烷酮、n,n'-二甲基咪唑烷酮、二甲基亚砜、环丁砜和六甲基磷酸三酰胺(hexamethylphosphortriamide,六甲基磷酰三胺)等。
酰亚胺化反应中,更优选在反应体系中使甲苯、二甲苯、正己烷等共存,将反应中生成的水通过共沸除去的方法。
酰亚胺化反应在酸催化剂的存在下进行。酸催化剂只要是以往公知的酰亚胺化反应催化剂即可,可以使用硫酸、膦酸、对甲苯磺酸、三氟甲磺酸和甲磺酸等。
醚化和酰亚胺化的反应温度和时间可以按照公知的方法适宜选择。例如,醚化可以在25~250℃的范围内的温度、优选50~200℃的范围内的温度下进行1~24小时、优选5~12小时。酰亚胺化例如可以在100~200℃的范围内的温度、优选120~160℃的范围内的温度下进行2~20小时、优选5~10小时。反应产物的处理方法没有特别限定。
实施例
以下,示出实施例和比较例,对本发明更详细地进行说明,但本发明不限于下述的实施例。
下述实施例中,hplc测定使用shimadzu制spd-10a,熔点测定使用yamato制mp-21。
[合成例1]
2-氨基-4,4’-二硝基二苯基醚的合成
在具备搅拌机、温度计的1l四颈烧瓶中,装入2-氨基-4-硝基苯酚钠88.0g、4-氟硝基苯53.6g、碳酸钾11.0g和n,n-二甲基乙酰胺400g,在60℃下反应20小时、在80℃下反应8小时之后,滴加离子交换水400g。将所析出的固体进行过滤、洗涤和干燥,获得2-氨基-4,4’-二硝基二苯基醚85.7g。用hplc测定的纯度为99.7%,熔点(mp.)为170~171℃。
[实施例1]
4,4’-二硝基-2-邻苯二甲酰亚胺二苯基醚的合成
在安装有温度计、冷却管、dean-stark、搅拌机的2l四颈烧瓶中,装入2-氨基-4,4’-二硝基二苯基醚50.0g、邻苯二甲酸酐28.7g、n-甲基吡咯烷酮500g、二甲苯400g、98%硫酸12.0g,在155℃下将与二甲苯的共沸水除去到体系外,同时进行5小时反应。然后,在减压下馏去二甲苯,将残液吹入到75%异丙醇水1,500g中,过滤分离所析出的固体。用水洗涤后、过滤、干燥,获得4,4’-二硝基-2-邻苯二甲酰亚胺二苯基醚的粗产物68.4g。用hplc测定的纯度为98.6%,熔点为130~135℃。使粗产物68.0g溶解于n-甲基吡咯烷酮200g、活性炭6.8g之后,除去活性炭,将滤液吹入到75%异丙醇水600g中,过滤分离所析出的固体。用水洗涤后、过滤、干燥,获得已纯化的4,4’-二硝基-2-邻苯二甲酰亚胺二苯基醚61.2g。用hplc测定的纯度为99.6%,熔点为132~134℃。
[实施例2]
4,4’-二氨基-2-邻苯二甲酰亚胺二苯基醚的合成
在300ml高压锅中,装入实施例1所得的4,4’-二硝基-2-邻苯二甲酰亚胺二苯基醚10.0g和n,n-二甲基甲酰胺100g、5%pd/c0.5g,在0.6mpa下保持75~80℃,同时进行催化氢化还原。反应结束后,除去催化剂之后,进行浓缩后,加水,获得固体7.7g。用hplc测定的纯度为99.5%,熔点为244~246℃。
对上述所得的固体进行(i)1h核磁共振光谱分析、(ii)13c核磁共振光谱分析和(iii)质谱分析。
・1h核磁共振光谱分析使用brukerbiospin制avance400型,在共振频率400mhz下测定。测定溶媒(溶剂)为二甲基亚砜-d6。
・13c核磁共振光谱分析使用jeol制jnm-eca600型,在共振频率600mhz下测定。测定溶媒(溶剂)为二甲基亚砜-d6。
・质谱分析使用shimadzu制aximaconfidence。
根据以下所示的结果,所得的固体产物为4,4’-二氨基-2-邻苯二甲酰亚胺二苯基醚。
(i)1h核磁共振光谱分析结果如下。1h-nmr光谱的图表示于图1。
确认了如下的峰:δ4.8ppm(2h)和5.1ppm(2h)处氨基的质子的单峰,δ6.4ppm(2h)和6.6ppm(2h)处苯核的质子的双峰,δ6.5ppm(1h)、6.6ppm(1h)和6.7ppm(1h)处邻苯二甲酰亚氨基相关的苯核的双峰、四峰、双峰,δ7.9ppm(2h)、8.0ppm(2h)处邻苯二甲酰亚氨基的苯核的多峰。
(ii)13c核磁共振光谱分析的结果是确认了14个峰。13c-nmr光谱的图表示于图2。
(iii)质谱分析的结果是确认了在345的主峰。
[合成例2]
2-氨基-3,4’-二硝基二苯基醚的合成
在具备搅拌机、温度计的200ml四颈烧瓶中,装入2-氟-5-硝基苯胺10.0g、3-硝基苯酚9.8g、碳酸钾4.9g和n,n-二甲基乙酰胺100g,在130℃下反应5小时之后,滴加离子交换水70g。将所析出的固体进行过滤、洗涤和干燥,获得2-氨基-3,4’-二硝基二苯基醚14.6g。用hplc测定的纯度为99.6%,熔点为175~176℃。
[实施例3]
3,4’-二硝基-2-邻苯二甲酰亚胺二苯基醚的合成
在安装有温度计、冷却管、dean-stark、搅拌机的200ml四颈烧瓶中,装入2-氨基-3,4’-二硝基二苯基醚5.0g、邻苯二甲酸酐2.9g、n-甲基吡咯烷酮50g、二甲苯40g、98%硫酸1.2g,在155℃下将与二甲苯的共沸水除去到体系外,同时进行2小时反应。然后,在减压下馏去二甲苯,将残液吹入到75%异丙醇水150g中,过滤分离所析出的固体。用水洗涤后、过滤、干燥,获得3,4’-二硝基-2-邻苯二甲酰亚胺二苯基醚的粗产物6.9g。使粗产物6.5g溶解于n-甲基吡咯烷酮40g、活性炭0.7g之后,除去活性炭,将滤液吹入到75%异丙醇水150g中,过滤分离所析出的固体。用水洗涤后、过滤、干燥,获得已纯化的3,4’-二硝基-2-邻苯二甲酰亚胺二苯基醚6.1g。用hplc测定的纯度为99.5%,熔点为163~164℃。
[实施例4]
3,4’-二氨基-2-邻苯二甲酰亚胺二苯基醚的合成
将上述实施例3再重复1次。
在300ml高压锅中,装入上述所得的3,4’-二硝基-2-邻苯二甲酰亚胺二苯基醚10.0g和n,n-二甲基甲酰胺100g、5%pd/c0.5g,在0.6mpa下保持75~80℃,同时进行催化氢化还原。反应结束后,除去催化剂之后,进行浓缩后,加水,获得固体6.9g。用hplc测定的纯度为98.2%,熔点为200~203℃。
对上述所得的固体,进行(i)1h核磁共振光谱分析、(ii)13c核磁共振光谱分析和(iii)质谱分析。
・1h核磁共振光谱分析和13c核磁共振光谱分析使用brukerbiospin制avance400型,在共振频率400mhz下测定。测定溶媒(溶剂)为二甲基亚砜-d6。
・质谱分析使用shimadzu制lcms-2020。
根据以下所示的结果,所得的固体产物为3,4’-二氨基-2-邻苯二甲酰亚胺二苯基醚。
(i)1h核磁共振光谱分析结果如下。1h-nmr光谱的图表示于图3。
确认了如下的峰:δ5.1ppm(2h)和5.2ppm(2h)处氨基的质子的单峰,δ5.9ppm(1h)、6.0ppm(1h)、6.1ppm(1h)和6.7ppm(1h)处苯核的质子的四峰、三峰、四峰、三峰,δ6.6ppm(1h)、δ6.7ppm(1h)、δ6.8ppm(1h)处邻苯二甲酰亚氨基相关的苯核的双峰、四峰、双峰,δ7.8ppm~8.0ppm(4h)处邻苯二甲酰亚氨基的苯核的多峰。
(ii)13c核磁共振光谱分析的结果是确认了16个峰。13c-nmr光谱的图表示于图4。
(iii)作为质谱分析的lcms测定的结果是确认了在346的正的主峰。
工业上的可利用性
根据本发明提供的二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物可适合地用作新的不对称系二胺,大幅扩展由该化合物衍生的聚酰亚胺分野的可能性,可期待作为新的功能性材料的可能性。另外,二硝基-2-邻苯二甲酰亚胺二苯基醚和氨基硝基-2-邻苯二甲酰亚胺二苯基醚、以及它们的衍生物可以用作上述二氨基-2-邻苯二甲酰亚胺二苯基醚及其衍生物的前体,与上述不对称二胺化合物同样,可期待将聚酰亚胺分野的可能性大幅扩展。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于二(二乙基次磷酸)锌的全芳香族聚酰胺人造革阻燃组合物及制造方法与流程
- 一种基于三(二乙基次磷酸)铝的全芳香族聚酰胺人造革阻燃组合物及制造方法与流程
- 一种基于二(二叔丁基次磷酸)锌的全芳香族聚酰胺人造革阻燃组合物及制造方法与流程
- 一种基于三(二叔丁基次磷酸)铝的全芳香族聚酰胺人造革阻燃组合物及制造方法与流程
- 一种基于四(二异丙基次磷酸)钛的全芳香族聚酰胺人造革阻燃组合物及制造方法与流程
- 一种基于二(二异丙基次磷酸)锌的全芳香族聚酰胺人造革阻燃组合物及制造方法与流程
- 一种基于四(二乙基次磷酸)钛的全芳香族聚酰胺人造革阻燃组合物及制造方法与流程
- 一种基于三(二乙基次磷酸)铝的全芳香族聚酰胺人造革阻燃组合物及制造方法与流程
- 一种生物基半芳香族聚酰胺纤维及其制备方法与制造工艺
- 用于电镀处理的芳香族聚酰胺复合物及其制备方法