一种海洋链霉菌及其在制备那西肽中的应用的制作方法
本发明属于微生物技术领域,具体涉及一种海洋链霉菌(Streptomyces sp.)SCSIO 1682及其在制备那西肽中的应用。
背景技术:
:
近年来,动物养殖领域对抗生素的无节制添加以及临床领域对抗生素长期、反复、大剂量的滥用,加剧了各大类耐药致病菌迅速产生和蔓延,如耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)、耐万古霉素肠球菌(vancomycin-resistant Enterococcus,VRE)、多耐药结核分枝杆菌(multidrug-resistant tuberculosis,MDRMT),以及近年来新出现的被称为“超级细菌”的“产NDM-1耐药细菌(新德里-金属-β-内酰胺酶,New Delhi metallo-β-lactamase)”。与此形成鲜明对比,新型抗菌抗生素的发现数量却急剧下降,近10年来,只有达托霉素和替加环素等几个新抗生素上市,远远不能满足人类对感染性疾病防治的需要。因此,开发新型抗生素显得尤为紧迫。
那西肽(nosiheptide)属于硫肽类(thiopeptide)抗生素,那西肽最早由法国学者在链霉菌Streptomyces actuosus 40037中发现,其结构式如式(I)所示。那西肽具有出色的抗感染活性,其对革兰氏阳性菌有显著的抑制作用,最小抑菌浓度(MIC)平均值为0.008μg/mL,其中对金黄色葡萄球菌、四联球菌的抑菌浓度为0.001μg/mL,对小球菌属(Micrococcus)、八叠球菌属(Sarcina)、梭菌属(Clostridium)、链球菌属(Streptococcus)、双球菌属(Pneumococcus)、乳杆菌属(Lactobacillus)、杆菌属(Bacillus)细菌的MIC为0.0001~0.01μg/mL;此外,那西肽还具有抗病毒活性,对乙肝病毒HBSAg和HBEAg的50%抑菌浓度(IC50)分别小于12.5μg/mL和41.6μg/mL,治疗指数分别大于16和4.8,在12.5μg/mL浓度下对细胞内HBV DNA的抑制率为26.4%。因此,那西肽有望开发成为新一代抗感染抗生素,在抗感染药物研究开发中极具研究开发价值。
技术实现要素:
:
本发明的第一个目的是提供一种能够产生那西肽的海洋链霉菌(Streptomyces sp.)SCSIO 1682,该菌于2016年6月6日保藏于中国典型培养物保藏中心(CCTCC),地址:中国武汉市武汉大学,其保藏编号为:CCTCC NO:M 2016307。
本发明的第二个目的是提供海洋链霉菌(Streptomyces sp.)SCSIO 1682在制备那西肽中的应用。
本发明的第三个目的是提供那西肽的制备方法,所述的那西肽是从海洋链霉菌(Streptomyces sp.)SCSIO 1682的发酵培养物中制备得到的。
优选,所述的那西肽是从海洋链霉菌(Streptomyces sp.)SCSIO 1682的发酵培养物中制备得到的,具体包括以下步骤:
(a)制备海洋链霉菌(Streptomyces sp.)SCSIO 1682的发酵培养物,将该发酵培养物的发酵上清液和菌丝体分开,发酵上清液用丁酮萃取,丁酮相经浓缩后得到浸膏A,菌丝体用丙酮浸泡萃取,丙酮浸提液经浓缩后得到浸膏B;
(b)将浸膏A和浸膏B合并,采用硅胶柱层析,以氯仿-甲醇作为洗脱剂,从体积比100:0、95:5进行梯度洗脱,收集氯仿-甲醇体积比为95:5洗脱的馏分Fr2;馏分Fr2经纯化后得到那西肽。
所述的制备海洋链霉菌(Streptomyces sp.)SCSIO 1682的发酵培养物是通过以下方法制备:
将海洋链霉菌(Streptomyces sp.)SCSIO 1682接入种子培养基中,发酵得种子培养液,将种子培养液接入到发酵培养基,发酵得到发酵培养物,所述的种子培养基和发酵培养基的配方均为:大豆粉10g/L,淀粉5g/L,细菌学蛋白胨2g/L,葡萄糖20g/L,酵母膏2g/L,K2HPO4 0.5g/L,MgSO4·7H2O 0.5g/L,CaCO3 2g/L,海盐30g/L,余量为水。
本发明提供了一株能够产生那西肽的海洋链霉菌(Streptomyces sp.)SCSIO 1682,利用该菌可以制备那西肽,从而为那西肽的生产制备提供了生物制备方法,具有广阔的应用前景。
本发明的海洋链霉菌(Streptomyces sp.)SCSIO 1682于2016年6月6日保藏于中国典型培养物保藏中心(CCTCC),地址:中国武汉市武汉大学,保藏编号为:CCTCC NO:M 2016307。
附图说明:
图1是海洋链霉菌(Streptomyces sp.)SCSIO 1682的系统进化树,其中SCSIO 1682代表海洋链霉菌(Streptomyces sp.)SCSIO 1682;
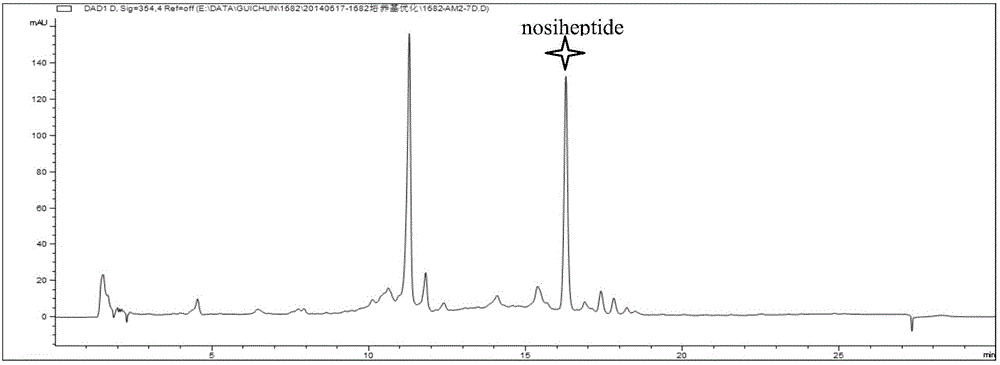
图2是海洋链霉菌(Streptomyces sp.)SCSIO 1682发酵生产那西肽的HPLC图谱。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:海洋链霉菌(Streptomyces sp.)SCSIO 1682的分离与鉴定
本发明的海洋链霉菌(Streptomyces sp.)SCSIO 1682是从我国三亚鹿回头海域(109°48'E,18°23′N)水深45m的沉积物样品中分离得到的。
该菌株的分类学特征是:
1、形态学特征:
菌落干燥,单菌落一般呈圆形,较小,较紧密,不易扩散,中间凸起,基内菌丝与气生菌丝结合紧密不易挑起,末期产孢子后,孢子易刮取。在ISP4培养基上形成浅褐色的气生菌丝和黄色的基质菌丝。
2、分子生物学分离特征:
提取上述分离的菌株的基因组DNA,通过常规方法PCR扩增其16S rDNA序列,并测序分析,其16S rDNA序列如SEQ ID NO.1所示,构建基于16S rDNA序列的系统进化树(如图1所示),显示菌株SCSIO 1682与Streptomyces wuyuanensis FX61T 16S rDNA的序列相似性为99%,表明菌株SCSIO 1682属于链霉菌属(Streptomyces)的一个种。
综上所述,鉴定菌株SCSIO 1682属于链霉菌属的一个种,命名为海洋链霉菌(Streptomyces sp.)SCSIO 1682,该菌于2016年6月6日保藏于中国典型培养物保藏中心(CCTCC),地址为中国武汉市武汉大学,保藏编号为:CCTCC NO:M 2016307。
实施例2:那西肽的分离鉴定
1、制备海洋链霉菌(Streptomyces sp.)SCSIO 1682的发酵培养物:
(1)种子培养基和发酵培养基的配制:
a)种子培养基的配制:每升种子培养基中含有10g大豆粉,5g淀粉,2g细菌学蛋白胨,20g葡萄糖,2g酵母膏,0.5g K2HPO4,0.5g MgSO4·7H2O,2g CaCO3,30g海盐,余量为自来水,将上述组份混合均匀,调节pH至7.0。配制1L种子培养基,然后平均分装于20个250mL锥形瓶中,每个装有50mL种子培养基,121℃灭菌30min备用。
b)发酵培养基的配制:每升发酵培养基中含有10g大豆粉,5g淀粉,2g细菌学蛋白胨,20g葡萄糖,2g酵母膏,0.5g K2HPO4,0.5g MgSO4·7H2O,2g CaCO3,30g海盐,余量为自来水,将上述组份混合均匀,调节pH至7.0。配制1L发酵培养基,然后平均分装于5个1000mL锥形瓶中,121℃灭菌30min备用。
(2)种子的培养:
将活化的海洋链霉菌(Streptomyces sp.)SCSIO 1682(保藏编号为:CCTCC NO:M 2016307)接入到装有50mL种子培养基的250mL锥形瓶中,于28℃、200rpm的摇床上培养24h,得到种子培养液。
(3)规模发酵培养:
将上述锥形瓶中的50mL种子培养液转接到装有200mL发酵培养基的1L锥形瓶中,于28℃、200r/min的摇床上培养7天,获得海洋链霉菌(Streptomyces sp.)SCSIO 1682的发酵培养物。
2、海洋链霉菌(Streptomyces sp.)SCSIO 1682所产那西肽的分离
(1)发酵培养物的萃取
将海洋链霉菌(Streptomyces sp.)SCSIO 1682的发酵培养物进行离心分离(3800~4000r/min,10~15min)使发酵上清液与菌丝体分开;发酵上清液使用丁酮进行等体积萃取3次,丁酮相经旋蒸冷凝浓缩之后得到浸膏A;菌丝体使用丙酮(2L)浸泡萃取,超声处理得到丙酮浸提液,丙酮浸提液经旋蒸冷凝浓缩后得到浸膏B。
(2)那西肽的提取
经HPLC分析,浸膏A和浸膏B的成分类似,将浸膏A和浸膏B合并,经正相硅胶柱层析,用氯仿-甲醇作为流动相,从体积比100:0、95:5、92:8、90:10、8:2、7:3、1:1、0:100进行梯度洗脱,100%氯仿梯度下洗脱下来的馏分记为Fr1,氯仿-甲醇体积比为95:5梯度下洗脱下来的馏分记为Fr2,氯仿-甲醇体积比为92:8梯度下洗脱下来的馏分记为Fr3,氯仿-甲醇体积比为90:10梯度下洗脱下来的馏分记为Fr4,氯仿-甲醇体积比为8:2梯度下洗脱下来的馏分记为Fr5,氯仿-甲醇体积比为7:3梯度下洗脱下来的馏分记为Fr6,氯仿-甲醇体积比为1:1梯度下洗脱下来的馏分记为Fr7,100%甲醇梯度下洗脱下来的馏分记为Fr8。
对上述馏分Fr1-8进行高效液相分析,发现Fr2馏分中含有那西肽,Fr2馏分经反相ODS(YMC-Pack ODS-A column,250×20mm,5μm)半制备高效液相色谱分离纯化(CH3CN/H2O体积分数60%~100%梯度洗脱30min,流速2.5mL/min)(如图2所示),得到30mg化合物1(保留时间15.3min),即为那西肽。
(3)那西肽的鉴定
通过结构分析,对本发明的从海洋链霉菌(Streptomyces sp.)SCSIO 1682的发酵培养物中制备的化合物1鉴定结果如下:
化合物1为浅黄色粉末,分子式C51H44N13O12S6,ESIHRMS m/z 1222.1565([M+H]+)。1H NMR谱中低场中显示五个单峰烯氢质子信号δ8.65,8.59,8.30,8.17和7.91;两个端烯质子信号δ6.36和5.75,对应的碳信号为δ103.6;一个烯氢质子信号δ6.45;δ7.61,7.28和7.13为苯环上相邻的三个质子氢信号。高场区存在三个甲基氢信号δ0.90,1.72,2.63。其NMR数据为:1H NMR(500MHz,DMSO-d6)δ8.65(Thz(1)5,s);8.59(Thz(5)5,s);8.30(Thz(3)5,s);8.17(Thz(2)5,s);7.91(Thz(4)5,s);7.83(Pyr 4,s);7.61(Ind 7,d);7.28(Ind 6,dd,J=7.16,8.32);7.13(Ind 5,d,J=7.15);6.45(But 3,q,J=6.79);6.36(Deala 3,E(s)),5.75(Deala 3,Z(s));5.86(Cys 2,m);5.70(Glu2,dd);5.57,5.42(Ind4');4.58(Thz 2,m);4.08(Glu 4,dd,J=2.24,11.89);4.00(Thr 3,m);3.83(Cys 3,dd,J=4.89,13.86),3.51(Cys 3,dd,J=5.49,13.95);2.63(Ind CH3,s);2.44S(Glu 3,m),1.90R(Glu 3,m);1.72(But CH3,d,J=6.74);0.90(Thr CH3,d,J=6.43);13C NMR(125MHz,DMSO-d6)δ181.8,172.6,170,169,167.7,167.1,166.3,165,163.9,159,159.6,159.5,158.2,153.1,150.8,149.8,149.6,148.7,147.6,142.5,137.6,135,134.3,130.4,129.9,129.3,129.2,128.9,127.1,126.8,126,125.3,124.9,124.7,124.5,123.2,120,118.4,114.4,103.6,66.5,66.4,65.9,56.6,49.1,45.2,37.6,29.5,18.3,13.5,12.2。查阅文献,化合物1的NMR数据与文献[Mocek U,Chen L C,Keller P J,et al.1H and 13C NMR assignments of the thlopeptide antibiotic nosiheptide[J].J Antibiot,1986,42(11):1643-1648.]报道的那西肽NMR数据一致,故鉴定化合物1为那西肽,其结构如式(I)所示。
- 还没有人留言评论。精彩留言会获得点赞!