一种三环苯并吗啉衍生物及其制备方法与流程
本发明属于药物化学领域,具体涉及一种三环苯并吗啉衍生物及其制备方法。
背景技术:
光催化氧化反应是利用光催化剂在光照作用下催化底物发生氧化反应,这类催化剂自身不发生反应,却能够将光能转换成化学反应所需的能量,产生催化作用,使周围的氧气或水分子被激发形成极具氧化能力的自由基或负离子。这类反应具有条件温和,能耗低,反应速度快且污染小等诸多优点。
本发明是通过光催化氧化一步反应得到三环苯并吗啉类衍生物,制备方法简单,反应条件温和,能耗低,种类多,收率高,产品纯度高,实用性强。此外,本发明合成的三环苯并吗啉类衍生是一类小分子化合物,相对分子质量在500以下,且具有一定的体外抗癌活性,说明本发明得到的小分子化合物有望用于制备相关的癌症治疗药物。
技术实现要素:
本发明的目的在于提供一种三环苯并吗啉衍生物及其制备方法,所得化合物能够抑制Hela细胞以及A549细胞的生长,具有一定的药理活性,且制备方法简单,实验条件温和,不要求高温高压、强酸强碱等苛刻条件,且反应收率高。
为实现上述目的,本发明采用如下技术方案:
一种三环苯并吗啉衍生物,其特征在于:具有如下结构通式中的一种:
R1为-COR、-SO2R,其中R为任意取代的C1-6烷基,任意取代的芳基或任意取代的杂环芳烃;R2为任意取代的C1-6烷基。
三环苯并吗啉衍生物的制备方法如下:
将原料色胺衍生物或色醇溶解于醇溶液,加入对甲苯磺酸(TsOH)和光敏剂亚甲兰,用LED灯照射反应1~4h,反应经光催化氧化得到三环苯并吗啉衍生物,反应收率一般在60%以上。
所述色胺衍生物的结构具有如下通式:
R1为-COR、-SO2R,其中R为任意取代的C1-6烷基,任意取代的芳基或任意取代的杂环芳烃。
所得的三环苯并吗啉类衍生物对Hela细胞株以及A549细胞株有一定的抑制活性,对A549细胞株的IC50值可达到50 μmol以下;具有用于制备抗癌药物的前景。
本发明的显著优点在于:
(1)本发明的合成方法简单,通过常用试剂一步反应即可得到目标产物,实验条件温和,不要求高温高压、强酸强碱等苛刻条件,反应时间短且收率一般可达到60%以上,部分化合物的收率可达到90%以上。
(2)所设计合成的三环苯并吗啉类化合物的分子量较小,一般在500以下,计算脂水分配系数(cLogP)一般在1左右,且生物实验证实该类化合物具有一定得抗癌活性,因此所得的目标产物具有用于制备抗癌药物的前景。
附图说明
图1:不同浓度的化合物Ih对肺癌Α549细胞的细胞毒性。
图2:不同浓度的化合物Ii对肺癌Α549细胞的细胞毒性。
图3:不同浓度的化合物Ii对宫颈癌Hela细胞的细胞毒性。
具体实施例
实施例1
(3aR ,9aS )-3a-methoxy-1-(phenylsulfonyl)-1,2,3,3a,9,9a-hexahydrobenzo[b]pyrrolo[2,3-e ][1,4]oxazine(化合物Ia的制备)
(1)N -(2-(1H -indol-3-yl)ethyl)benzenesulfonamide(中间体FZU-0006-031)的制备:
将1 g的色胺(Tryptamine)溶于15 mL的二氯甲烷中,加入759 mg的三乙胺(Et3N),冰浴条件下再缓慢滴加1.1 g的甲磺酰氯。撤去冰浴装置,室温搅拌反应3 h后,向混合液中加入20 mL二氯甲烷稀释,用蒸馏水萃取3次,收集有机相;将得到的粗品过硅胶柱分离得到1.8 g中间体IM-Ia,洗脱剂为PE/EtOAc = 2:1,反应收率为96%;产物室温下为浅黄色固体,熔点为78.2-79.6 oC;1H NMR (400 MHz, CDCl3) δ 8.12 (s, 1H), 7.81 – 7.73 (m, 2H), 7.53 (t, J = 7.4 Hz, 1H), 7.47 – 7.40 (m, 3H), 7.34 (d, J = 8.2 Hz, 1H), 7.19 (t, J = 7.6 Hz, 1H), 7.07 (t, J = 7.5 Hz, 1H), 6.93 (d, J = 2.2 Hz, 1H), 4.65 (t, J = 6.0 Hz, 1H), 3.29 (q, J = 6.6 Hz, 2H), 2.92 (t, J = 6.7 Hz, 2H);13C NMR (101 MHz, CDCl3) δ 139.89, 136.50, 132.66, 129.14, 127.02, 126.99, 122.77, 122.33, 119.61, 118.54, 111.55, 111.48, 43.24, 25.62;
(3aR ,9aS )-3a-methoxy-1-(phenylsulfonyl)-1,2,3,3a,9,9a-hexahydrobenzo[b]pyrrolo[2,3-e ]
[1,4]oxazine(化合物Ia)的制备:
取60 mg中间体IM-Ia溶于20 mL甲醇中,加入34 mg 对甲基苯磺酸(TsOH)和3 mg 美兰(MB);用LED灯照射反应2 h;反应完成后旋干溶剂,用乙酸乙酯和水萃取干燥浓缩后得到粗产物,粗品通过硅胶柱层析分离得到59 mg的目标产物Ia,柱层析中的洗脱剂为PE/EtOAc = 2:1, 反应收率为86%;产物在室温下为白色固体,熔点为184.5-185.4 oC;1H NMR (400 MHz, CDCl3) δ 7.78 (d, J = 7.7 Hz, 2H), 7.55 (t, J = 7.4 Hz, 1H), 7.45 (t, J= 7.7 Hz, 2H), 6.85 (t, J = 7.4 Hz, 2H), 6.75 – 6.69 (m, 1H), 6.64 (d, J = 7.8 Hz, 1H), 5.04 – 4.97 (m, 2H), 3.54 – 3.41 (m, 2H), 3.36 (s, 3H), 2.39 – 2.29 (m, 1H), 1.86 – 1.74 (m, 1H);13C NMR (101 MHz, CDCl3) δ 140.47, 138.35, 132.99, 129.27, 129.13, 127.33, 122.87, 119.59, 116.96, 115.04, 101.08, 70.51, 51.44, 44.25, 32.07. HRMS (ESI): calcd for C17H18N2O4S [M + H]+m/z 347.1060, found 347.1081;IR (ATR): 3400.95, 2923.69, 1615.15, 1504.78, 1445.94, 1161.10 cm-1。
实施例2
((3aR ,9aS )-3a-methoxy-3,3a,9,9a-tetrahydrobenzo[b ]pyrrolo[2,3-e ][1,4]oxazin-1(2H ) -yl)(phenyl)methanone(化合物Ib)的制备:
(1)中间体FZU-0006-032 (N -(2-(1H -indol-3-yl)ethyl)benzamide)的制备:
色胺(Tryptamine)与苯甲酰氯(benzoyl chloride)按实施例1中(1)的反应条件得到中间体FZU-0006-032 (N -(2-(1H -indol-3-yl)ethyl)benzamide);
(2)中间体FZU-0006-032按实施例1中(2)的光催化氧化条件反应得到目标产物Ib,反应收率为65%;Ib在常温下为黄色固体,熔点为141.5-142.3 oC; 1H NMR (400 MHz, CDCl3) δ 7.54 (d, J = 7.0 Hz, 2H), 7.44 (d, J = 6.8 Hz, 1H), 7.42 – 7.35 (m, 2H), 6.92 (d, J = 7.8 Hz, 1H), 6.86 (t, J = 7.3 Hz, 1H), 6.71 (t, J = 7.6 Hz, 1H), 6.65 (d, J = 7.4 Hz, 1H), 5.42 (s, 2H), 3.88 – 3.78 (m, 1H), 3.56 – 3.48 (m, 1H), 3.46 (s, 3H), 2.49 – 2.39 (m, 1H), 2.11 – 1.99 (m, 1H);13C NMR (101 MHz, CDCl3) δ 140.18, 135.05, 130.95, 130.29, 128.45, 127.89, 122.93, 118.63, 116.99, 114.45, 101.60, 69.46, 51.37, 47.08, 33.22, 29.80.HRMS (ESI): calcd for C18H18N2O3 [M + H]+m/z 311.1390, found 311.1385.IR (ATR): 3366.67, 2925.54, 1627.96, 1576.73, 1507.12, 1446.92, 1413.27 cm-1。
实施例3
(3aR ,9aS )-3a-methoxy-1-tosyl-1,2,3,3a,9,9a-hexahydrobenzo[b ]pyrrolo[2,3-e ][1,4]oxazine(化合物Ic)的制备:
(1)色胺衍生物(N -(2-(1H -indol-3-yl)ethyl)benzamide)(中间体FZU-0006-032)的制备:
色胺(Tryptamine)与对甲苯磺酰氯(TsCl)按实施例1中(1)的反应条件得到(N -(2-(1H -indol-3-yl)ethyl)-4-methylbenzenesulfonamide)(中间体FZU-0024-008);
(2)中间体FZU-0024-008按实施例1中(2)的光催化氧化条件反应得到目标产物Ic,反应收率为93%;Ic在常温下为白色固体,熔点为181.2-182.7 ℃;1H NMR (400 MHz, CDCl3) δ 7.67 (d, J = 8.2 Hz, 2H), 7.25 (d, J = 8.4 Hz, 2H), 6.91 – 6.79 (m, 2H), 6.76 – 6.69 (m, 1H), 6.65 (d, J = 7.7 Hz, 1H), 5.02 (s, 1H), 4.97 (d, J = 3.2 Hz, 1H), 3.50 – 3.40 (m, 2H), 3.36 (s, 3H), 2.40 (s, 3H), 2.36 – 2.30 (m, 1H), 1.82 – 1.71 (m, 1H);13C NMR (101 MHz, CDCl3) δ 143.87, 140.48, 135.12, 129.87, 129.17, 127.41, 122.77, 119.48, 116.89, 115.06, 101.12, 70.41, 51.39, 44.21, 32.02, 21.58;HRMS (ESI): calcd for C18H20N2O4S [M + H]+m/z 361.1217, found 361.1221;IR (ATR): 3401.00, 2923.59, 1614.99, 1597.87, 1504.93, 1437.89 cm-1。
实施例4
1-((3aR ,9aS )-3a-methoxy-3,3a,9,9a-tetrahydrobenzo[b ]pyrrolo[2,3-e ][1,4]oxazin-1(2H ) -yl)ethanone (化合物Id)的制备:
(1)色胺(Tryptamine)与乙酰氯(acetyl chloride)按实施例1中(1)的反应条件得到 (N -(2-(1H -indol-3-yl)ethyl)acetamide)(中间体FZU-0023-002);
(2)中间体中间体FZU-0023-002按实施例1中(2)的光催化氧化反应得到目标产物Id,反应收率为65%; Id在常温下为黄色固体,熔点为146.5-147.2 oC;1H NMR (400 MHz, CDCl3) δ 6.88 – 6.80 (m, 2H), 6.68 (t, J = 7.6 Hz, 1H), 6.62 (d, J = 7.7 Hz, 1H), 5.42 (s, 1H), 5.17 (d, J = 2.8 Hz, 1H), 3.68 – 3.55 (m, 2H), 3.44 (s, 3H), 2.51 – 2.44 (m, 1H), 2.14 – 2.04 (m, 1H), 2.00 (s, 3H);13C NMR (101 MHz, CDCl3) δ 171.48, 140.28, 130.19, 122.85, 118.78, 116.78, 114.62, 102.02, 68.84, 51.29, 44.63, 32.73, 22.22;HRMS (ESI): calcd for C13H16N2O3 [M + H]+m/z 249.1234, found 249.1229;IR (ATR): 3357.57, 2925.42, 1635.13, 1616.05, 1505.60, 1446.21 cm-1。
实施例5
(3aR,9aS)-3a-methoxy-1-(methylsulfonyl)-1,2,3,3a,9,9a-hexahydrobenzo[b]pyrrolo[2,3-e][1,4]oxazine(化合物Ie)的制备:
(1)色胺(Tryptamine)与甲磺酰氯(methanesulfonyl chloride)按实施例1中(1)的反应条件得到(N -(2-(1H -indol-3-yl)ethyl)methanesulfonamide)(中间体FZU-0006-033),
(2)中间体FZU-0006-033按实施例1中(2)的光催化氧化反应得到目标产物Ie,反应收率为72%;Ie在常温下为黄色固体,熔点为157.3-158.6 oC。1H NMR (400 MHz, CDCl3) δ 6.95 – 6.83 (m, 2H), 6.78 – 6.71 (m, 1H), 6.68 (d, J = 7.8 Hz, 1H), 5.13 (d, J = 4.4 Hz, 1H), 4.91 (d, J = 3.8 Hz, 1H), 3.67 (t, J = 9.3 Hz, 1H), 3.49 – 3.43 (m, 1H), 3.42 (s, 3H), 2.79 (s, 3H), 2.52 – 2.44 (m, 1H), 2.20 – 2.09 (m, 1H);13C NMR (101 MHz, CDCl3) δ 140.16, 129.14, 123.05, 119.60, 117.35, 114.66, 100.44, 70.63, 51.38, 43.60, 40.29, 31.81;HRMS (ESI): calcd for C12H16N2O4S [M + H]+m/z 285.0904, found 285.0901;IR (ATR): 3393.15, 2922.46, 1614.96, 1505.43, 1313.20, 1151.36 cm-1。
实施例6
(3aR ,9aS )-3a-methoxy-1-(propylsulfonyl)-1,2,3,3a,9,9a-hexahydrobenzo[b]pyrrolo[2,3-e ][1,4]oxazine(化合物If)的制备:
(1)色胺(Tryptamine)与丙磺酰氯(propane-1-sulfonyl chloride)按实施例1中(1)的反应条件得到(N -(2-(1H -indol-3-yl)ethyl)propane-1-sulfonamide)(中间体FZU-0024-002),
(2)中间体FZU-0024-002按实施例1中(2)的光催化氧化反应得到目标产物If,反应收率为82%; If在常温下为无色油状物;1H NMR (400 MHz, CDCl3) δ 6.92 – 6.83 (m, 2H), 6.77 – 6.71 (m, 1H), 6.66 (dd, J = 7.7, 1.4 Hz, 1H), 5.16 (d, J = 4.5 Hz, 1H), 4.88 (d, J = 4.2 Hz, 1H), 3.77 – 3.69 (m, 1H), 3.42 (s, 3H), 3.41 – 3.35 (m, 1H), 2.92 – 2.80 (m, 2H), 2.50 – 2.41 (m, 1H), 2.20 – 2.09 (m, 1H), 1.70 – 1.57 (m, 2H), 0.82 (t, J = 7.5 Hz, 3H);13C NMR (101 MHz, CDCl3) δ 140.34, 128.96, 122.91, 119.61, 117.26, 114.71, 100.34, 70.20, 56.14, 51.44, 43.65, 31.84, 16.99, 12.87;HRMS (ESI): calcd for C14H20N2O4S [M + H]+m/z 313.1217, found 313.1217;IR (ATR): 3388.48, 2964.37, 1615.36, 1505.09, 1311.69, 1126.28 cm-1。
实施例7
(3aR ,9aS )-1-(ethylsulfonyl)-3a-methoxy-1,2,3,3a,9,9a-hexahydrobenzo[b ]pyrrolo[2,3-e ][1,4]oxazine(化合物Ig)的制备:
(1)色胺(Tryptamine)与乙磺酰氯(ethanesulfonyl chloride)按实施例1中(1)的反应条件得到(N -(2-(1H -indol-3-yl)ethyl)ethanesulfonamide)(中间体FZU-0024-001),
(2)中间体FZU-0024-001按实施例1中(2)的光催化氧化反应得到目标产物Ig,反应收率为82%; Ig在常温下为无色油状物;1H NMR (400 MHz, CDCl3) δ 6.92 – 6.83 (m, 2H), 6.76 – 6.70 (m, 1H), 6.65 (d, J = 7.8 Hz, 1H), 5.18 (d, J = 4.4 Hz, 1H), 4.90 (d, J = 3.9 Hz, 1H), 3.74 (t, J = 9.3 Hz, 1H), 3.42 (s, 3H), 3.41 – 3.35 (m, 1H), 2.98 – 2.87 (m, 2H), 2.50 – 2.43 (m, 1H), 2.20 – 2.10 (m, 1H), 1.15 (t, J = 7.4 Hz, 3H);13C NMR (101 MHz, CDCl3) δ 140.24, 128.97, 122.94, 119.52, 117.27, 114.66, 100.27, 70.22, 51.43, 48.79, 43.71, 31.86, 7.91;HRMS (ESI): calcd for C13H18N2O4S [M + H]+m/z 299.1060, found 299.1061.IR (ATR): 3390.02, 2939.57, 1614.84, 1504.80, 1438.26, 1377.00 cm-1。
实施例8:
(3aR ,9aS )-3a-ethoxy-1-tosyl-1,2,3,3a,9,9a-hexahydrobenzo[b ]pyrrolo[2,3-e ][1,4]oxazine(化合物Ih)的制备:
将实施例3的中间体FZU-0024-008在乙醇(EtOH)溶液中按实施例1中(2)的光催化氧化反应得到目标产物Ih,反应收率为72%; Ih在常温下为无色油状物; 1H NMR (400 MHz, CDCl3) δ 7.66 (d, J = 8.0 Hz, 2H), 7.25 (d, J = 7.5 Hz, 2H), 6.88 – 6.78 (m, 2H), 6.71 (t, J = 7.6 Hz, 1H), 6.65 (d, J = 7.7 Hz, 1H), 4.99 (s, 1H), 4.96 (s, 1H), 3.82 – 3.71 (m, 1H), 3.62 – 3.51 (m, 1H), 3.44 (dd, J = 9.7, 4.0 Hz, 2H), 2.40 (s, 3H), 2.36 – 2.29 (m, 1H), 1.85 – 1.73 (m, 1H), 1.08 (t, J = 7.1 Hz, 3H);13C NMR (101 MHz, CDCl3) δ 143.86, 140.76, 135.13, 129.88, 129.19, 127.45, 122.61, 119.48, 116.81, 115.12, 101.03, 70.51, 59.76, 44.26, 32.65, 21.62, 15.43;HRMS (ESI): calcd for C19H22N2O4S [M + H]+m/z 375.1373, found 375.1377.IR (ATR): 3401.74, 2925.37, 1614.89, 1597.82, 1504.44, 1438.64 cm-1。
实施例9:(3aR,9aS)-3a-isopropoxy-1-tosyl-1,2,3,3a,9,9a-hexahydrobenzo[b]pyrrolo[2,3-e][1,4]
oxazine(化合物Ii)的制备:
将实施例3的中间体FZU-0024-008在异丙醇(2-propanol)溶液中按实施例1中(2)的光催化氧化条件反应得到目标产物Ii,反应收率为64%;Ii在常温下为白色固体,熔点为149.7-150.3 oC;1H NMR (400 MHz, CDCl3) δ 7.65 (d, J = 8.2 Hz, 2H), 7.24 (d, J= 8.1 Hz, 2H), 6.86 – 6.77 (m, 2H), 6.74 – 6.68 (m, 1H), 6.64 (d, J = 7.8 Hz, 1H), 4.99 (s, 1H), 4.94 (d, J = 3.1 Hz, 1H), 4.22 – 4.13 (m, 1H), 3.47 – 3.36 (m, 2H), 2.39 (s, 3H), 2.37 – 2.31 (m, 1H), 1.87 – 1.76 (m, 1H), 1.11 (d, J = 6.2 Hz, 3H), 1.03 (d, J = 6.2 Hz, 3H);13C NMR (101 MHz, CDCl3) δ 143.80, 140.83, 135.32, 129.84, 129.05, 127.44, 122.50, 119.47, 116.87, 115.12, 100.86, 70.75, 67.87, 44.19, 32.96, 24.12, 23.93, 21.61;HRMS (ESI): calcd for C20H24N2O4S [M + H]+m/z 389.1530, found 389.1530;IR (ATR):3401.51, 2973.49, 2925.55, 1615.32, 1598.10, 1505.30 cm-1。
实施例10:
(3aR ,9aS)-3a-methoxy-3,3a,9,9a-tetrahydro-2H -benzo[b ]furo[2,3-e ][1,4]oxazine (化合物Ij)的制备:
取32 mg色醇(Tryptophol)溶于20 mL甲醇(MeOH)中,加入34 mg 对甲基苯磺酸(TsOH)和3 mg 亚甲兰(MB);用LED灯照射反应2.5 h;反应完成后旋干溶剂,用乙酸乙酯和水萃取干燥浓缩后得到粗产物,粗品通过硅胶柱层析分离得到32 mg的目标产物Ij,柱层析中的洗脱剂为PE/EtOAc = 2:1, 反应收率为78%;产物在室温下为淡黄色油状物;1H NMR (400 MHz, CDCl3) δ 6.90 (d, J = 7.8 Hz, 1H), 6.85 (t, J = 7.5 Hz, 1H), 6.73 (t, J= 7.5 Hz, 1H), 6.64 (d, J = 7.6 Hz, 1H), 4.97 (d, J = 3.0 Hz, 1H), 4.82 (s, 1H), 4.11 – 4.02 (m, 1H), 4.01 – 3.95 (m, 1H), 3.44 (s, 3H), 2.49 (t, J = 8.7 Hz, 1H), 2.33 – 2.22 (m, 1H);13C NMR (101 MHz, CDCl3) δ 140.33, 129.12, 122.57, 119.29, 117.30, 114.54, 100.27, 83.70, 77.38, 77.06, 76.74, 62.37, 51.94, 33.73;HRMS (ESI): calcd for C11H13NO3 [M + H]+m/z 208.0968, found 208.0969. IR (ATR): 3368.02, 2937.14, 1614.98, 1504.97, 1437.39, 1387.55 cm-1。
实施例11:
(3aR ,9aS )-3a-ethoxy-3,3a,9,9a-tetrahydro-2H -benzo[b ]furo[2,3-e ][1,4]oxazine(化合物Ik)的制备:
合成方法条件与实施例10中化合物Ij的合成相同:色醇(Tryptamine)在乙醇(EtOH)溶液中经光催化氧化反应得到目标产物Ik,反应收率为57%; Ik在常温下为淡黄色油状物。1H NMR (400 MHz, CDCl3) δ 6.91 – 6.80 (m, 2H), 6.75 – 6.68 (m, 1H), 6.66 – 6.60 (m, 1H), 4.97 (s, 1H), 4.83 (s, 1H), 4.09 – 3.95 (m, 2H), 3.92 – 3.82 (m, 1H), 3.69 – 3.60 (m, 1H), 2.54 – 2.46 (m, 1H), 2.32 – 2.23 (m, 1H), 1.14 (t, J = 7.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ 140.68, 129.23, 122.46, 119.31, 117.29, 114.66, 100.16, 83.90, 62.56, 60.40, 34.50, 15.56; HRMS (ESI): calcd for C12H15NO3 [M + H]+m/z 222.1125, found 222.1121;IR (ATR): 3365.64, 2976.52, 2928.29, 2892.29, 1614.99, 1505.71, 1438.39, 1384.45 cm-1。
实施例12:
(3aR ,9aS )-3a-isopropoxy-3,3a,9,9a-tetrahydro-2H -benzo[b ]furo[2,3-e ][1,4]oxazine (化合物Il)的制备:
合成方法条件与实施例10中化合物Ij的合成相同; 色醇(Tryptamine)在异丙醇(2-propanol)溶液中经光催化氧化反应得到目标产物Il,反应收率为49%; Il在常温下为淡黄色油状物;1H NMR (400 MHz, CDCl3) δ 6.91 – 6.78 (m, 2H), 6.71 (t, J = 7.6 Hz, 1H), 6.63 (d, J = 7.7 Hz, 1H), 4.94 (d, J = 2.9 Hz, 1H), 4.80 (s, 1H), 4.29 – 4.18 (m, 1H), 4.08 – 3.95 (m, 2H), 2.57 – 2.47 (m, 1H), 2.35 – 2.25 (m, 1H), 1.19 (d, J = 6.2 Hz, 3H), 1.08 (d, J = 6.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ 140.77, 128.93, 122.31, 119.34, 117.37, 114.73, 99.93, 83.82, 68.64, 62.55, 34.71, 24.24, 23.89.HRMS (ESI): calcd for C13H17NO3 [M + H]+m/z 236.1281, found 236.1281。
应用实施例1:化合物Ih对Α549肿瘤细胞增殖和存活的抑制作用
材料:肺癌细胞株Α549;
受试药物:0、5 μΜ、10 μΜ、25 μΜ、50 μΜ、100μΜ的6个浓度的化合物;
细胞培养方法:取出液氮中冻存的A549 细胞,在37℃的温水中解冻,将细胞悬液移入1.5 mL 离心管中,置于离心机中,1500 rpm 离心5 min,弃去上清液,加入1 mL RPMI 1640 完全培养液,轻轻吹打均匀,将细胞悬液加入培养皿中,补加3 mL RPMI 1640 完全培养液,将培养皿置于5% CO2、37℃培养箱中培养。
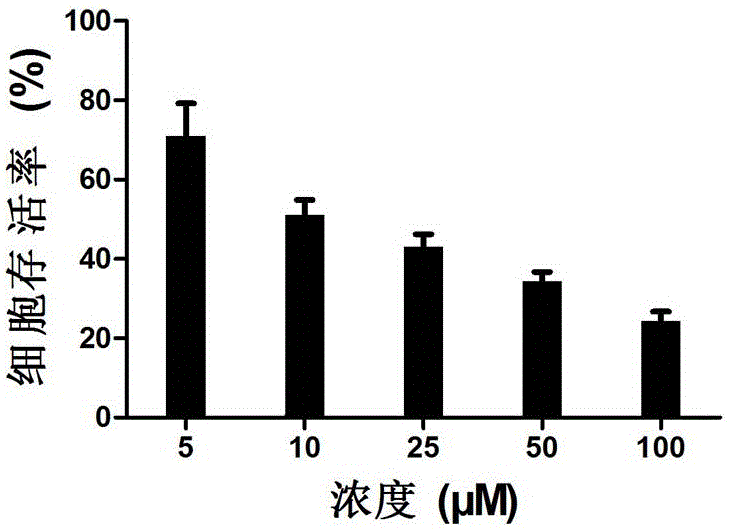
细胞毒性实验:将A549 细胞以8×103 个细胞/ 孔的密度接种到96 孔培养板中,培养24 h 后,吸弃旧的培养基,并于每孔中加入200 µL含有不同浓度化合物Ih的培养基,另设溶剂对照组和空白对照组,在培养箱中孵育72h后,吸弃孔中溶液,用PBS 洗涤3 遍,加入新鲜培养液90 μL,同时每孔加入10 μL MTT 溶液(5 mg/mL),继续在37 ℃、5% CO2(相对湿度90%)培养箱中培养4 h 后,终止培养,小心吸弃上清液,每孔加入150 μL DMSO,避光振荡10 min 使结晶物充分溶解;以酶标仪检测570 nm 处的吸收度(A),按照以下公式计算:细胞存活率%=(试验组平均A 值/ 空白对照组平均A 值)×100%;化合物Ih的细胞毒性结果如图1所示。
由图1可知,细胞的存活率与化合物Ih的浓度存在浓度依赖关系,随着化合物浓度增大,细胞存活率逐渐下降,表明化合物Ih可有效抑制肿瘤细胞增殖,半数有效抑制浓度IC50值约为10 μmol/L。
应用实施例2:化合物Ii对Α549肿瘤细胞增殖和存活的抑制作用
材料:肺癌细胞株Α549
受试药物:0、5 μΜ、10 μΜ、25 μΜ、50 μΜ、100μΜ的6个浓度的化合物;
细胞毒性实验过程如应用实施例1;化合物Ii的Α549肿瘤细胞毒性结果如图2所示。由图2可知,细胞的存活率与化合物Ii的浓度存在浓度依赖关系,随着化合物浓度增大,细胞存活率逐渐下降,表明化合物Ii可有效抑制肿瘤细胞增殖,半数有效抑制浓度IC50值约为25μmol/L。
实施例3:化合物Ii对Hela肿瘤细胞增殖和存活的抑制作用
材料:宫颈癌细胞株Hela
受试药物:0、5 μΜ、10 μΜ、25 μΜ、50 μΜ、100μΜ的6个浓度的化合物
细胞培养方法:取出液氮中冻存的Hela 细胞,在37℃的温水中解冻,将细胞悬液移入1.5 mL 离心管中,置于离心机中,1500 rpm 离心5 min,弃去上清液,加入1 mL DMEM完全培养液,轻轻吹打均匀,将细胞悬液加入培养皿中,补加3 mL DMEM完全培养液,将培养皿置于5% CO2、37℃培养箱中培养。
细胞毒性实验:将Hela细胞以8×103 个细胞/ 孔的密度接种到96 孔培养板中,培养24 h 后,吸弃旧的培养基,并于每孔中加入200 µL含有不同浓度化合物Ii的培养基,另设溶剂对照组和空白对照组,在培养箱中孵育72h后,吸弃孔中溶液,用PBS 洗涤3 遍,加入新鲜培养液90 μL,同时每孔加入10 μL MTT 溶液(5 mg/mL),继续在37 ℃、5% CO2(相对湿度90%)培养箱中培养4 h 后,终止培养,小心吸弃上清液,每孔加入150 μL DMSO,避光振荡10 min 使结晶物充分溶解。以酶标仪检测570 nm 处的吸收度(A),按照以下公式计算:细胞存活率%=(试验组平均A 值/ 空白对照组平均A 值)×100%;化合物Ii的宫颈癌细胞株Hela毒性结果如图3所示,对于Hela细胞,Ii同样表现出有效的肿瘤细胞增殖抑制能力,随着Ii浓度增加,肿瘤细胞生存率下降,其半数有效抑制浓度IC50值约为30μmol/L。
上述实施例所的三环苯并吗啉衍生物的活性参数如表1所示:表中M.W.为对应化合物的相对分子质量,TPSA为拓扑极性表面积参数,cLogP为计算脂水分配系数,存活率为浓度为10μmol/L化合物A549细胞72小时后,细胞的存活率。
表1. 各实施例所得化合物的活性参数
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 具有含硫取代基的杀有害生物活性杂环衍生物的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 靛红杂合喹唑啉类化合物合成的靛红衍生物及其在制备抗肿瘤药物中的应用的制造方法与工艺
- 一种杂环衍生物及使用该杂环衍生物的有机发光器件的制造方法与工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 一种含氮杂环衍生物及使用该含氮杂环衍生物的有机发光器件的制造方法与工艺
- 苯并二氮杂*衍生物的2-萘磺酸盐及晶型和它们的制备方法与制造工艺
- 一种二氰基甲烯基苯并四氢呋喃衍生物及其制备方法与制造工艺
- 苯并吲唑类衍生物及其制备方法、应用与制造工艺
- 一种二苯并环庚烷衍生物的制备方法与制造工艺
- Atropurpuran的苯并咪唑基和吗啉基衍生物组合物用于防治胰腺纤维化的制造方法与工艺
- 一种苯并咪唑衍生物镉配合物及其制备方法和应用
- 一种咪唑并吡啶巯乙酸类衍生物及其制备方法与应用
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 一种具有抗氧化活性的芳基苯并呋喃类化合物及其制备方法和应用与流程
- 一种含苯并双环酮与乙氧磺隆的除草组合物及其应用的制造方法与工艺
- 一种6‑氯呋喃[3,2‑B]吡啶的合成方法与流程
- 一类苯并吡喃类化合物及其应用的制造方法与工艺
- 一种以二苯并环庚烯为核心的化合物及其在有机电致发光器件上的应用的制造方法与工艺
- 一种含苯并双环酮与乙草胺的除草组合物及其应用的制造方法与工艺
- 一种含苯并双环酮与噁草酮的除草组合物及其应用的制造方法与工艺
- 分解二噁英前体的催化剂筛选系统及其使用方法与流程
- 一种无卤热固性树脂组合物以及含有它的预浸料、层压板和印制电路板的制造方法与工艺
- 一种以二联二苯并五元杂环为骨架的有机化合物及其在OLED上的应用的制造方法与工艺
- 6,7,8,9‑四氢‑5H‑苯并[7]轮烯‑2‑烷基胺类化合物及其用途的制造方法与工艺
- 用于PHOLED的具有氮杂‑二苯并噻吩或氮杂‑二苯并呋喃核的新材料的制造方法与工艺
- 多孔ZSM‑5沸石与γ‑Al2O3复合材料的合成及制备加氢脱硫催化剂的制造方法与工艺
- 一种含有氟噻虫砜和五氟虫腙的杀虫组合物的制造方法与工艺
- 苯并双(噻二唑)衍生物、包含其的油墨、以及使用了其的有机电子装置的制造方法
- 苯并噻二唑胺的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 用于有机电致发光器件的材料的制造方法与工艺
- 一种苯并噻咯类衍生物及其制备方法和有机发光器件与制造工艺
- 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件与制造工艺