一种化合物及其用于制备治疗糖尿病药物的应用的制作方法
本发明属于医药领域,特别是一种化合物及其用于治疗糖尿病的应用。
背景技术:
糖尿病是以持续高血糖为主要生化特征的综合代谢性疾病,主要是由机体胰岛素作用受损或是机体的胰岛素分泌不足引起的[1]。流行病学调查显示,糖尿病的发展会危及人的心脑血管和肾脏,已经成为世界上继肿瘤、心脑血管病之后第三位严重威胁人健康的慢性病。
糖尿病主要表现为血液及尿液中葡萄糖浓度的升高异常,患者有明显的多饮,多食,多尿,体重减轻的症状[2]。血糖的高低,受胰岛素的影响。胰岛素是一种能促进全身组织摄取、利用葡萄糖的激素,它有降低血液中葡萄糖浓度的作用。当进食碳水化合物之后,血液中葡萄糖增多,便会刺激胰岛素分泌。糖尿病作为一种慢性疾病,发病人数在快速上升,严重影响人们的正常生活。已被WHO列为慢性病防治的重点之一[3]。
糖尿病主要分为两种类型:
1型糖尿病,又称为胰岛素依赖型糖尿病(Insulin dependent diabetes mellitus,IDDM),主要是由于胰岛β细胞损害导致胰岛素分泌水平低而引起的高血糖[4];
2型糖尿病,非胰岛素依赖型糖尿病(Non-insulin dependent diabetes mellitus,NIDDM),是胰岛素分泌不足,胰岛素抵抗或由于其作用环节不健全而引起的高血糖,是最常见的一类糖尿病,在中国,占糖尿病患者总数的93.7%,且发病年龄日趋年轻化[5,6]。
当前市场上用于预防治疗糖尿病的药物类型众多,应根据病人的实际症状来进行合理的选择。对于1型糖尿病患者来说,需终身使用胰岛素制剂或者代用品,维持血糖正常水平;而对于2型糖尿病患者需通过严格控制饮食,并辅佐以口服降糖药使血糖处于正常水平。
口服降血糖药依其作用机制可分为四类:
1.胰岛素分泌促进剂,例如,磺酰脲类药物通过与胰岛β细胞膜上的特异性受体结合,以增加胰岛素分泌[7];非擴酰尿类与磺酰脲类药物结构不同,但作用机制与購酰脲类药物类似。主要区别是对β细胞的结合位点不同,来刺激胰岛素的分泌[8]。
2.双胍类,胰岛素增敏剂通过增强靶组织对胰岛素敏感性而降低血糖,且不刺激胰岛素分泌。主要有双胍类,此类药物可以通过抑制肝脏的糖异生途径,改善外周的胰岛素紀组织对葡萄糖的吸收和利用,进而来改善肌体对胰岛素的敏感性。减少肝糖输出及增加葡萄糖利用[9]。
3.格列酮类,其作用机制为,活化过氧化物酶体增值剂激活受体(peroxisome proliferator activated receptor-γ,PPARγ),增加胰岛素的敏感度,降低空腹血糖及血液中胰岛素的浓度。
4.α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor),例如,阿卡波糖,伏格列波糖以及米格列醇是用于治疗糖尿病的α-糖苷酶抑制剂类药物,它们都能够通过抑制体内α-糖苷酶的活性,减少淀粉和寡糖的降解,减少葡萄糖的产生以及延缓葡萄糖的吸收入血来实现其降低高血糖的药效活性。
α-葡萄糖苷酶的机制为:α-糖苷酶抑制剂结构类似于单糖或者寡糖,而其结构中一般含有氮、硫等杂原子,可与α-糖苷酶的活性空间紧密结合,且亲和力比酶的正常底物大,因此,α-糖苷酶抑制剂和寡糖竞争结合位点,通过占据糖苷酶活性空腔,减少寡糖的消化吸收速率[10],从而使碳水化合物的消化过程延长[11],降低葡萄糖的吸收。
参考文献:
[1]陈迎春,抗糖尿病药物瑞格列奈中间体的合成研究[D].吉林大学2007.
[2]杨潇,陈祥贵,代娟.基于细胞水平的2型糖尿病药物筛选模型研究进展[J].中国药房,2006,17(19).
[3]昌玉兰.糖尿病药物治疗新进展[J].华中医学杂志,2001,25(3):131-132.
[4]杜伟奇,施秀芳,邱明艳等.治疗糖尿病药物的研究进展[J].中国医院药学杂志,2005,25(1):67-69.
[5]陈景珠.内科学第[J].北京:人民卫生出版社,1996,997:275
[6]颜晓燕,盛艳梅,莫正纪.几类新型糖尿病治疗药物近期研究进展[J].四川生理科学杂志,2006,28(2):74-76.
[7]赵赛,朱雄,王尔华.口服2型糖尿病药物的研究进展[J].安徽医药,2006,10(3):161-163.
[8]沈澄.口服降糖药及其合理选择[J].Chinese General Practice,2002,5(0):2.
[9]C.J.Bailey,R.C.Turner.Metformin[J].The New England journal of medicine,1996,334(9):574.
[10]B.Junge,M.Matzke,J.Stoltefuss.Chemistry and structure-activity relationships of glucosidase inhibitors[J].Handbook of experimental pharmacology,1996,119:411-482.
[11]H.E.Lebovitz.Alpha-glucosidase inhibitors[J].Endocrinology and metabolism clinics of North America,1997,26(3):539-551.
技术实现要素:
本发明发现了一个新的化合物C-2,该化合物有极强的α-葡萄糖苷酶抑制活性,可用于制备治疗糖尿病的药物。
本发明的化合物结构式为:
命名为4-乙酰氧基-4,5,6-三羟基-2-羟甲基-2-环己烯酮。
本发明的化合物C-2理化性质为:
C9H12O6,黄色固体。
[α]D21=+106.88(c 0.37,MeOH);
UV(MeOH):λmax(logε)=219(3.58);
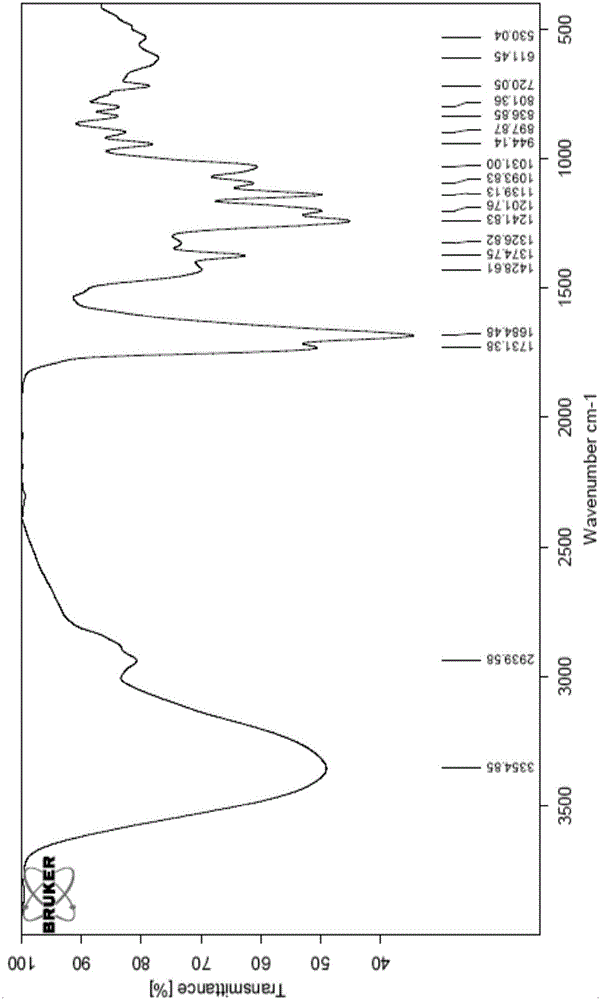
IR(KBr):νmax=3354,1731,1684,1241,1201,1139cm-1;
ESI-MS(positive)m/z:271.217[M+Na+MeOH]+;
1H-NMR(500MHz,CD3OD)δ:6.88(1H,d,J=5.2Hz,H-3),5.68(1H,dd,J=5.2,3.8Hz,H-4),4.34(1H,d,J=9.8Hz,H-6),4,25(2H,s,H-7),3.99(1H,dd,J=9.8,3.8Hz,H-5),2.10(3H,s,H-2’);
13C-NMR(125MHz,CD3OD)δ:198.8(C-1),172.1(C-1’),142.2(C-2),137.1(C-3),75.4(C-6),72.3(C-5),69.7(C-4),59.3(C-7),20,7(C-2’)。
该化合物从拉丁学名为Streptomyces avidinii的亲和素链霉菌的发酵液中提取得到,该菌株可在中国普通微生物菌种保藏管理中心获得,编号为:CGMCC 4.6409。
该化合物的提取包括:
(1)亲和素链霉菌的发酵培养:取活化好的亲和素链霉菌菌饼接种于黄豆粉液体培养基上进行培养得到发酵液,培养温度为28℃,培养时间为14天;
(2)化合物的提取分离:将(1)中得到的发酵液浓缩后经乙酸乙酯萃取得到粗提物,粗提物用硅胶柱划段后经氯仿-甲醇梯度洗脱收集得到第三个馏分,第三个馏分通过RP-18色谱柱分离收集得到第七个馏分,第七个馏分依次通过凝胶柱LH-20、硅胶柱和半制备型HPLC纯化即得所述化合物。
所述的化合物作为α-葡萄糖苷酶抑制剂的应用。所述的化合物用于制备治疗糖尿病药物的应用。本发明的化合物C-2作为α-葡萄糖苷酶抑制剂,可抑制碳水化合物的吸收并预防或治疗2型糖尿病的降血糖及减肥药,是具有潜力的。
附图说明
图1为本发明的化合物C-2的质谱图;
图2为本发明的化合物C-2的红外谱图;
图3为本发明的化合物C-2的紫外谱图;
图4为本发明的化合物C-2的氢谱图;
图5为本发明的化合物C-2的碳谱图;
以下结合说明书附图和具体实施方式对本发明做具体说明。
具体实施方式
本发明的化合物是从一株链霉菌Streptomyces的发酵液中分离得到的,是一个新的化合物,该化合物命名为C-2。该链霉菌菌株为链霉菌属Streptomyces avidinii no.8,可在中国普通微生物菌种保藏管理中心获得,编号为:CGMCC 4.6409;中文菌名:亲和素链霉菌;拉丁学名:Streptomyces avidinii。该链霉菌的培养条件为:保藏菌种采用PDA斜面培养基。将菌种接种于PDA平皿中,于28℃活化培养7天,至平皿上长满菌丝体。PDA平板培养基:每升培养基含200g土豆,20g葡萄糖,16g琼脂粉。
一、本发明的化合物的提取方法、鉴定及应用检验:
1、实验材料
培养基:
黄豆粉液体培养基:黄豆粉20g,淀粉10g,蔗糖3g,蛋白胨2g,酵母膏2g,K2HPO4 1g,MgSO4.7H2O 0.5g,CaCO3 2g,ZnSO4 0.01g,FeSO4.7H2O 0.01g,NaCl 2g,水1000ml,pH=7.2;
试剂与仪器:
常用有机溶剂:三氯甲烷,甲醇,乙酸乙酯,石油醚、丙酮等均为工业试剂,重蒸后使用。有机溶剂:DMSO,色谱甲醇,色谱乙腈等视实际使用情况使用分析纯或色谱纯试剂。
常用仪器:旋光仪Rudolph AutopolⅢ型;高效液相色谱仪:Waters 1525;紫外光谱仪:Thermo Evolution-300型;红外光谱仪:Bruker TENSOR 27型(溴化钾压片法);核磁共振:Bruker AvanceⅢ500(TMS内标);低分辨质谱仪:Thermo Fisher LTQ Fleet型;高分辨质谱仪:Agilent 6520Accurate-Mass Q-TOF LC/MS型。旋转蒸发仪:Büchi Rotavapor R-101、R-3HB型;低温冷却液循环泵:DLSB-10/20型(郑州长城科工贸有限公司);循环水式多用真空泵:SHB-Ⅲ型(郑州长城科工贸有限公司);超净工作台:SW-OJ-2F型(苏净集团苏州安泰空气技术有限公司);立式蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)。柱层析硅胶(100-200目、200-300目及300-400目)及薄层层析硅胶(硅胶H)均为青岛海洋化工厂生产;液相色谱柱:Hypersil BDS 5μm C18(250×4.6and 250×10;Thermo);羟丙基葡聚糖凝胶Sephadex LH-20和RP-C18反向硅胶均为Merk公司生产。
1.1链霉菌的发酵培养:
发酵培养条件包括:取活化好的菌饼(7mm2)接种于200mL黄豆粉液体培养基上,200mL黄豆粉液体培养基放置在500mL锥形瓶中进行培养;培养条件为28℃,120rpm条件下培养14天;发酵共得到80L发酵液。
1.2化合物提取分离:
将1.1中得到的80L发酵液浓缩至5L,等体积比加入乙酸乙酯萃取3次,得到粗提物20.0g用硅胶柱划段,用氯仿-甲醇(100:1→1:1)梯度洗脱,获得5个馏分A-E。馏分C通过RP-18色谱柱(甲醇-水,10-100%)分离,得到8个馏分(C1-C8)。馏分C7依次通过凝胶柱LH-20(溶剂为甲醇)、硅胶柱(溶剂为石油醚-乙酸乙酯,4:1)和半制备型HPLC(50%,甲醇-水,10ml/min)进一步纯化,得到的化合物命名为C-2(tR=10min,16mg)。
1.3对得到的化合物C-2分别进行了质谱、红外、紫外、氢谱和碳谱的测定,测定结果见图1-5:
化合物c-2的质谱ESI-MS在m/z 271.217处显示[M+Na+MeOH]+峰,结合该化合物的氢谱和碳谱,推断分子式为C9H12O6,不饱和度为4。从红外谱中可以推出存在羟基3354cm-1,和酯基或醛基1731,1684,cm-1;从13C-NMR可以看出,该化合物有9个碳,其中1个甲基δC20,7(C-2’),1个亚甲基δC59.3(C-7),4个次甲基(有三个连氧的次甲基δC75.4(C-6),72.3(C-5),69.7(C-4)和一个sp2杂化的次甲基碳δC137.1(C-3)),3个季碳(δC198.8(C-1),δC172.1(C-1’),δC142.2(C-2))。
通过对所有谱图数据综合分析,得出化合物C-2的结构式如下:
命名为4-乙酰氧基-4,5,6-三羟基-2-羟甲基-2-环己烯酮
(4-acetoxy-4,5,6-trihydroxy-2-hydroxymethyl-2-cyclohexenone)。
本发明的化合物C-2理化性质为:
C9H12O6,黄色固体。
[α]D21=+106.88(c 0.37,MeOH);
UV(MeOH):λmax(logε)=219(3.58);
IR(KBr):νmax=3354,1731,1684,1241,1201,1139cm-1;
ESI-MS(positive)m/z:271.217[M+Na+MeOH]+;
1H-NMR(500MHz,CD3OD)δ:6.88(1H,d,J=5.2Hz,H-3),5.68(1H,dd,J=5.2,3.8Hz,H-4),4.34(1H,d,J=9.8Hz,H-6),4,25(2H,s,H-7),3.99(1H,dd,J=9.8,3.8Hz,H-5),2.10(3H,s,H-2’);
13C-NMR(125MHz,CD3OD)δ:198.8(C-1),172.1(C-1’),142.2(C-2),137.1(C-3),75.4(C-6),72.3(C-5),69.7(C-4),59.3(C-7),20,7(C-2’)。
1.4化合物C-2作为α-葡萄糖苷酶抑制剂,治疗糖尿病的应用:
用以测定的药品有:α-葡萄糖苷酶,阿卡波糖Acarbose皆购自Alladin LTD公司。
α-葡萄糖苷酶抑制活性测定方法:
将3.75μLα-葡萄糖苷酶溶液(10U/ml)加入到596.25μL pH=6.8的磷酸盐缓冲液中,加入37.5μL不同浓度的样品溶液,在37℃条件下孵育40min;然后加入112.5μL PNPG(对硝基苯基-α-D-吡喃葡萄糖苷,p-Nitrophenylα-D-glucopyranoside)溶液,反应半小时后,400nm下测反应混合物的吸光度值。
阿卡波糖为阳性对照,含DMSO的缓冲液做空白对照。
每个实验体系需平行三组实验,最终取平均值。用SPSS软件输入5组数据,梯度浓度以及与之相对应的抑制率,拟合出标准曲线,取抑制率为50%的点,即可得到半数抑制浓度。
化合物C-2的活性测定:
以化合物C-2作为α-葡萄糖苷酶抑制剂的活性测定:
A样品溶液:DMSO溶解的化合物C-2的溶液,浓度见表1;
A空白溶液:含DMSO的缓冲液(NaCl:8.006g,KCl:0.201g,Na2HPO4﹒12H2O:2.901g,KH2PO4:0.259g,水:1000ML),注:DMSO含量不超过1%(V/V);
抑制率的计算:
抑制率%=(A空白溶液的吸光度-A样品溶液的吸光度)/A空白溶液的吸光度×100%。
表1
由表1中的数值以内插法求得IC50值:IC50=9.073μM。
阿卡波糖活性测定:
以阿卡波糖(Acarbose)作为α-葡萄糖苷酶抑制剂的活性测定:
B样品溶液:DMSO溶解的阿卡波糖溶液,浓度见表2;
A空白溶液:含DMSO的缓冲液,注:DMSO含量不超过1%(V/V)
抑制率的计算:抑制率%=(A空白溶液的吸光度-B样品溶液的吸光度)/A空白溶液的吸光度×100%,测定结果见表2。
表2
由上述之数值以内插法求得IC50值:IC50=663.281μM。
由以上结果分析比较可知,化合物C-2与阿卡波糖的IC50值(其定义为:抑制α-葡糖糖苷酶活性为50%时该抑制剂的浓度)的实验数据可知,阿卡波糖的抑制浓度为663.281μM,而化合物C-2的抑制浓度为9.073μM,说明本发明得到的化合物C-2能够以更低的浓度达到抑制α-葡萄糖苷酶活性的效果,其抑制活性远远高于阿卡波糖。因此,以本发明的化合物C-2作为α-葡萄糖苷酶抑制剂,可抑制碳水化合物的吸收并预防或治疗2型糖尿病的降血糖及减肥药,是具有潜力的。
- 还没有人留言评论。精彩留言会获得点赞!