甲基硫赭曲霉素的制备方法及其应用与流程
本发明涉及甲基硫赭曲霉素,具体是涉及甲基硫赭曲霉素的制备方法及其作为炎症因子的抑制剂的应用。
背景技术:
炎症是多种疾病的一个标志性特征,与炎症发生发展最相关的炎症因子主要是肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)。众多的研究表明,临床上许多疾病都与TNF-α介导的炎症反应有密切关系,如心脑缺血再灌注损伤、类风湿关节炎、炎症性肠病、动脉粥样硬化等等。TNF-α介导的炎症反应主要是通过核因子-κB(NF-κB)信号通路来实现的。NF-κB是一种重要的核转录因子,通常情况下NF-κB是以非活性状态存在于细胞质中,当NF-κB被激活,会发生核转位进入细胞核中,介导相关细胞因子、趋化因子及黏附因子如TNF-α、白介素-1(IL-1)、白介素-6(IL-6)等的产生,而TNF-α又可再作用促炎症因子介导炎症信号的表达,周而复始形成放大的炎症反应,加速病情的发展。因此阻断TNF-α介导的炎症反应对改善和治疗相关疾病具有重要的临床意义。
目前针对由TNF-α过量产生所导致的炎症性疾病采取的主要是延缓和阻止疾病进程的保守治疗,包括糖皮质激素(如强的松)、非甾体抗炎药和免疫抑制剂(如阿贝西普)三大类,但都是属于“治标不治本”。针对TNF-α的蛋白质性质开发的大分子抗体药物,目前已经批准上市的有三种单抗,它们具有起效迅速、耐受性好等优点,但价格昂贵,一年的治疗费用约需1万美元,而且只能采取注射的方式给药。陆续有报道指出,使用TNF-α大分子生物拮抗剂增加了患者感染肺结核和淋巴瘤的机会。
小分子可口服的TNF-α抑制剂药物,是抗炎症性疾病的药物发展的一个重要方向。但到目前为止这方面的研究并不多,还没有一个药物进入临床前试验阶段,因此小分子的炎症因子抑制剂的研究有很好的前景和经济价值。
甲基硫赭曲霉素(monomethylsulochrin,MMS)的分子式为C18H18O7,分子量为346.33,化学通式为methyl-5-hydroxy-2-(2-hydroxy-6-methoxy-4-methylbenzoyl)-3-methoxybenzoate,结构式如下所示:
甲基硫赭曲霉素是1965年由Turner WB等人(Turner WB,The production of trypacidin and monomethylsulochrin by Aspergillus fumigatus.J Chem Soc Perkin 1,1965,6658-6659.)首次从烟曲霉的发酵培养产物中分离得到,之后该化合物陆续从其他属真菌如青霉菌、镰刀菌中分离得到,并有报道该化合物对人类肝细胞株HepG2的半数抑制浓度(IC50)为63.5±0.6μM,对幽门螺旋杆菌的最小抑制浓度(MIC)为28.9±0.6μM(Ma YM,等,2004),但未见有抑制炎症因子活性的报道。
本申请人在中国专利201110458140.X中公开了曲霉菌CM9a Aspergillus sp.CM9a,该菌株已于2011年1月7日保藏于中国典型培养物保藏中心,地址:中国.武汉.武汉大学,邮编:430072,保藏中心保藏编号为:CCTCC NO:M2011006。
技术实现要素:
本发明的目的在于提供甲基硫赭曲霉素的制备方法。
本发明的另一目的在于提供甲基硫赭曲霉素在制备抑制炎症因子药物中的应用。
所述甲基硫赭曲霉素的制备方法如下:
1)曲霉菌CM9a Aspergillus sp.CM9a的种子培养和发酵培养,得曲霉菌CM9a Aspergillus sp.CM9a的发酵培养物;
2)曲霉菌CM9a Aspergillus sp.CM9a的发酵培养物的处理,具体方法如下:
发酵平板于28℃培养箱培养后,培养物切成小块,用乙酸乙酯、甲醇和冰醋酸混合溶剂过夜浸提3~4次,过滤,滤液减压浓缩至干得提取物浸膏,浸膏用乙酸乙酯和水溶解,静置分层,收集乙酸乙酯相;反复以上操作至水相无色,乙酸乙酯相减压浓缩至干,得到的乙酸乙酯相浸膏用甲醇和石油醚溶解萃取,反复萃取3~4次后,合并甲醇相,将甲醇相减压浓缩至干得发酵提取物;
3)甲基硫赭曲霉素的分离纯化,具体方法如下:
将步骤2)得到的发酵提取物用甲醇溶解后,经中压液相反相硅胶柱层析后用甲醇-水系统洗脱,收集,含有甲基硫赭曲霉素的组分位于50%甲醇-水系统中,将含有甲基硫赭曲霉素的组分洗脱液减压浓缩至干后,再采用氯仿-甲醇系统进行硅胶柱层析,从洗脱剂组成为10︰1的组分中获得甲基硫赭曲霉素的单体。
在步骤1)中,所述曲霉菌CM9a Aspergillus sp.CM9a的种子培养采用葡萄糖-土豆-琼脂培养基,配方为:葡萄糖20g,琼脂15g,土豆200g,土豆切碎,煮沸30min,4层纱布过滤,保留滤液,自来水定容至1L,121℃高压灭菌15min;培养基冷却前倒平板,每个平板约20mL培养基,先制作种子平板,以划线的方式接种,28℃培养5天;所述发酵培养是将种子平板用无菌小刀划成3mm×3mm的小块,每个直径10mm的发酵平板上放置3小块,置于28℃的培养箱中发酵。
在步骤2)中,所述培养可培养14天;所述小块的边长可为0.5cm;所述乙酸乙酯、甲醇和冰醋酸混合溶剂的体积比可为乙酸乙酯︰甲醇︰冰醋酸=80︰15︰5;所述滤液减压浓缩可采用旋转蒸发仪42℃减压浓缩;所述浸膏用乙酸乙酯和水溶解的乙酸乙酯和水的体积比可为1︰1;所述乙酸乙酯相减压浓缩至干可将乙酸乙酯相用旋转蒸发仪42℃减压浓缩至干;所述乙酸乙酯相浸膏用甲醇和石油醚溶解萃取的甲醇和石油醚的体积比可为1︰1。
在步骤3)中,所述中压液相反相硅胶柱可采用瑞士Buchi公司的反相硅胶(RP-18)柱;所述用甲醇-水系统洗脱可分别用30%、50%、70%、100%甲醇-水系统洗脱;所述收集可等体积分部收集;所述氯仿-甲醇系统可采用氯仿与甲醇体积比分别为100︰1,80︰1,50︰1,20︰1,10︰1,5︰1,1︰1的氯仿-甲醇系统;所述硅胶柱层析可采用80~120目的硅胶柱层析;从洗脱剂组成为10︰1的组分中获得甲基硫赭曲霉素的单体,产量约为100mg/10L发酵培养基。
本发明所述甲基硫赭曲霉素的理化参数如下:
甲基硫赭曲霉素单体为白色粉末状固体,微溶于甲醇、丙酮等有机溶剂,易溶于氯仿。以氯仿︰甲醇(10︰1,V:V)展开系统进行硅胶G254(青岛海洋化工厂)薄层层析检测时的相对保留值(Rf值)约为0.8,在碘缸和波长为365nm及254nm紫外灯下均能显色,硫酸-乙醇显色剂作用后再加热显紫红色。
所述甲基硫赭曲霉素可在制备抑制炎症因子药物中应用。
附图说明
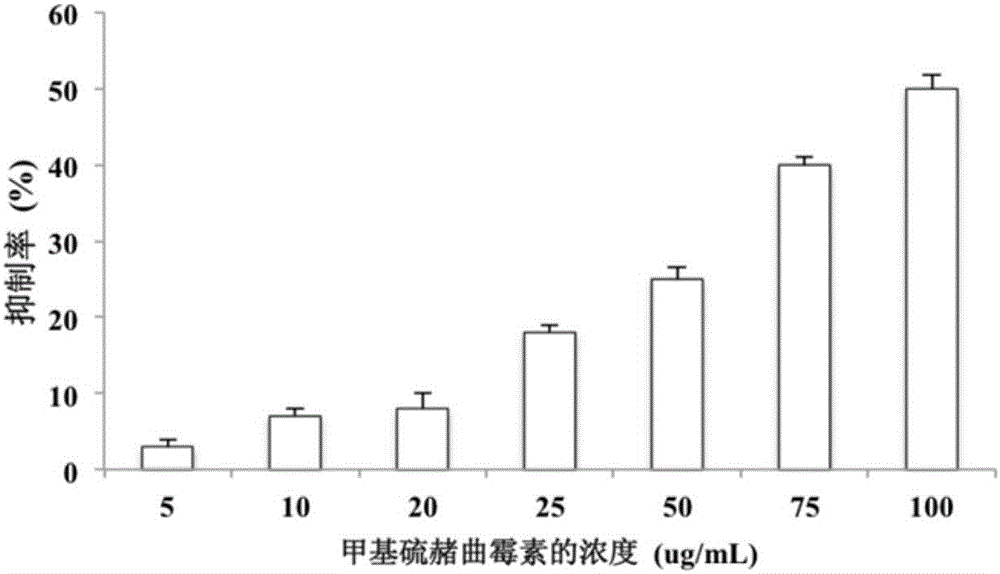
图1为甲基硫赭曲霉素抑制TNF-α对L929细胞的作用。在图1中,横坐标为样品浓度,单位:μg/mL。
图2为甲基硫赭曲霉素抑制巨噬细胞产生致炎因子TNF-α。
图3为甲基硫赭曲霉素抑制巨噬细胞产生致炎因子IL-6。
图4为甲基硫赭曲霉素抑制巨噬细胞致炎因子TNF-αmRNA的表达。
图5为甲基硫赭曲霉素抑制巨噬细胞致炎因子IL-6mRNA的表达。
图6为甲基硫赭曲霉素剂量依赖性的提高炎症小鼠的存活率。
具体实施方式
以下实施例将结合附图对本发明作进一步的说明。
本发明所述甲基硫赭曲霉素的制备方法实施例,包括以下步骤:
1)曲霉菌CM9a Aspergillus sp.CM9a的种子培养和发酵培养,得曲霉菌CM9a Aspergillus sp.CM9a的发酵培养物;所述曲霉菌CM9a Aspergillus sp.CM9a的种子培养采用葡萄糖-土豆-琼脂培养基,配方为:葡萄糖20g,琼脂15g,土豆200g,土豆切碎,煮沸30min,4层纱布过滤,保留滤液,自来水定容至1L,121℃高压灭菌15min;培养基冷却前倒平板,每个平板约20mL培养基,先制作种子平板,以划线的方式接种,28℃培养5天;所述发酵培养是将种子平板用无菌小刀划成3mm×3mm的小块,每个直径10mm的发酵平板上放置3小块,置于28℃的培养箱中发酵。
2)曲霉菌CM9a Aspergillus sp.CM9a的发酵培养物的处理,具体方法如下:发酵平板于28℃培养箱培养14天后,培养物切成边长为0.5cm的小块,用乙酸乙酯、甲醇和冰醋酸混合溶剂过夜浸提3~4次,过滤,滤液减压浓缩至干得提取物浸膏,浸膏用乙酸乙酯和水溶解,静置分层,收集乙酸乙酯相;反复以上操作至水相无色,乙酸乙酯相减压浓缩至干,得到的乙酸乙酯相浸膏用甲醇和石油醚溶解萃取,反复萃取3~4次后,合并甲醇相,将甲醇相减压浓缩至干得发酵提取物;所述乙酸乙酯、甲醇和冰醋酸混合溶剂的体积比可为乙酸乙酯︰甲醇︰冰醋酸=80︰15︰5;所述滤液减压浓缩可采用旋转蒸发仪42℃减压浓缩;所述浸膏用乙酸乙酯和水溶解的乙酸乙酯和水的体积比可为1︰1;所述乙酸乙酯相减压浓缩至干可将乙酸乙酯相用旋转蒸发仪42℃减压浓缩至干;所述乙酸乙酯相浸膏用甲醇和石油醚溶解萃取的甲醇和石油醚的体积比可为1︰1。
3)甲基硫赭曲霉素的分离纯化,具体方法如下:将步骤2)得到的发酵提取物用甲醇溶解后,经中压液相反相硅胶柱层析后用甲醇-水系统洗脱,收集,含有甲基硫赭曲霉素的组分位于50%甲醇-水系统中,将含有甲基硫赭曲霉素的组分洗脱液减压浓缩至干后,再采用氯仿-甲醇系统进行硅胶柱层析,从洗脱剂组成为10︰1的组分中获得甲基硫赭曲霉素的单体。所述中压液相反相硅胶柱可采用瑞士Buchi公司的反相硅胶(RP-18)柱;所述用甲醇-水系统洗脱可分别用30%、50%、70%、100%甲醇-水系统洗脱;所述收集可等体积分部收集;所述氯仿-甲醇系统可采用氯仿与甲醇体积比分别为100︰1,80︰1,50︰1,20︰1,10︰1,5︰1,1︰1的氯仿-甲醇系统;所述硅胶柱层析可采用80~120目的硅胶柱层析;从洗脱剂组成为10︰1的组分中获得甲基硫赭曲霉素的单体,产量约为100mg/10L发酵培养基。
本发明所述甲基硫赭曲霉素的核磁共振(NMR)图谱数据(以氘代氯仿为溶剂)如下:
核磁共振氢谱(1H-NMR,单位:ppm):6.91(d,2.16,1H),6.55(d,2.16,1H),3.58(s,3H),3.67(s,3H),6.37(s,1H),6.00(s,1H),2.06(s,3H),3.38(s,3H)(s:单峰,d:双峰);核磁共振碳谱(13C-NMR,单位:ppm):128.1s,129.8s,158.5s,104.1s,159.7s,108.7d,168.1s,52.6q,56.5q,111.8s,165.3s,111.4d,149.6s,104.1d,162.6s,22.4q,201.6s,56.3q(s:季碳,d:叔碳,t:仲碳,q:伯碳)。
本发明所述甲基硫赭曲霉素在细胞水平上抑制炎症因子TNF-α对细胞的致死作用如下:
用CCK-8法检测抑制致死的作用。操作方法为:对数生长期的小鼠层纤维L929细胞长满培养皿底部约95%时用胰酶消化。用含10%胎牛血清(FBS)的新鲜DMEM培养基培养分散成106个/mL的密度,每孔100μL细胞悬液加到平底的96孔板,37℃、5%CO2的培养箱中培养过夜。第二天吸掉培养基,全部更换为新鲜无血清DMEM培养基:空白对照组不含细胞,只有100μL DMEM培养基,阴性对照组加入98μL DMEM和2μL DMSO,TNF-α组加入98μL DMEM和2μL TNF-α(TNF-α的终浓度为2ng/mL),样品组加入96μL DMEM、2μL TNF-α和2μL已经梯度稀释的甲基硫赭曲霉素溶液(溶于DMSO中),每个浓度均设三个重复,在37℃含5%CO2的培养箱中培养24h。之后吸掉全部培养基,再次更换为90μL新鲜的无血清DMEM培养基。每孔加10μL CCK-8溶液(日本同仁化学公司),37℃避光反应2h,酶标仪450nm比色测定吸收值(OD值),取平均值后按公式“存活率(survival,%)=(OD样品-OD空白)/(OD阴性-OD空白)×100%”计算细胞的存活率。
图1给出甲基硫赭曲霉素抑制TNF-α对L929细胞的作用。
本发明所述甲基硫赭曲霉素抑制巨噬细胞致炎因子TNF-α和IL-6的产生:
采用酶联免疫吸附测定(ELISA)方法检测甲基硫赭曲霉素抑制脂多糖(LPS)刺激下的巨噬细胞Raw 264.7中致炎因子TNF-α和IL-6的产生。具体操作按照ELISA试剂盒的操作说明:将待检测因子的一抗包被在酶标板上,加入经1ng/mL LPS和不同浓度MMS处理2h后的巨噬细胞Raw 264.7培养液作为一抗(阴性对照组为不经LPS和MMS处理的巨噬细胞的上清液,空白对照组加相应体积的PBS),摇床轻微振摇2h,吸去上清液,加入二抗,摇床再轻微振摇2h,吸去二抗,加入辣根过氧化物酶(HRP)并辅以生色底物,在450nm处测定吸光值OD。抑制率=(OD阴性-OD空白/OD样品-OD空白)×100%。结果如图2和3所示,甲基硫赭曲霉素可抑制LPS刺激下的致炎因子TNF-α和IL-6的产生,半数抑制浓度(IC50)分别是100μg/mL和50μg/mL。
本发明所述甲基硫赭曲霉素抑制巨噬细胞中致炎因子TNF-α和IL-6在mRNA水平的表达如下:
采用实时定量PCR的方法,具体操作按照质粒抽提试剂盒(Takara kit):采用TRIzol法提取总RNA,再逆转录成cDNA,以TNF-α-sence(意义链)5'-GACCCTCACACTCAGATCATCTTCT-3'、TNF-α-antisence(反意义链)5'-CCTCCACTTGGTGGTTTGCT-3',IL-6-sence 5'-CTTCTTGGGACTGATGCTGGTG-3'、IL-6-antisence 5'-CGCTGGCTTTGTCTTTCTTGTTA-3'作为引物进行实时定量PCR检测。结果如图4和5所示,甲基硫赭曲霉素可以显著抑制巨噬细胞Raw264.7在LPS诱导下的TNF-α和IL-6基因mRNA水平的表达。
本发明所述甲基硫赭曲霉素提高LPS刺激的炎症小鼠的存活率:
SPF级BALB/c小鼠,体重20g±1g,随机等分为5组,分别是溶剂PBS对照组、LPS组和3个样品组,即LPS+MMS(17mg/kg)组、LPS+MMS(10mg/kg)组、LPS+MMS(33mg/kg)组。样品组的处理方式为尾静脉注射0.2mL相应剂量的MMS,半h后注射0.2mL 1.0mg/mL LPS,溶剂组和LPS组不注射MMS,仅尾静脉分别注射0.2mL PBS和0.2mL 1.0mg/mL LPS。之后每12h观察记录一次小鼠存活情况,连续观察72h,结果如图6所示。甲基硫赭曲霉素能剂量依赖地提高小鼠的存活率,对抗LPS对小鼠的致死作用(LPS作用于哺乳动物体内的巨噬细胞,使之产生IL-1、IL-6和TNF-α等细胞因子)。
- 还没有人留言评论。精彩留言会获得点赞!