一种快速检测豚鼠LCMV、SV、PVM、Reo‑3病毒的多重液相基因芯片方法及试剂与流程
本发明属于实验动物的病毒检测领域,具体涉及一种快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒(LCMV)、仙台病毒(SendaiVirus,SV)、鼠肺炎病毒(PVM)、呼肠孤3型病毒(Reo-3)的多重液相基因芯片方法及试剂。
背景技术:
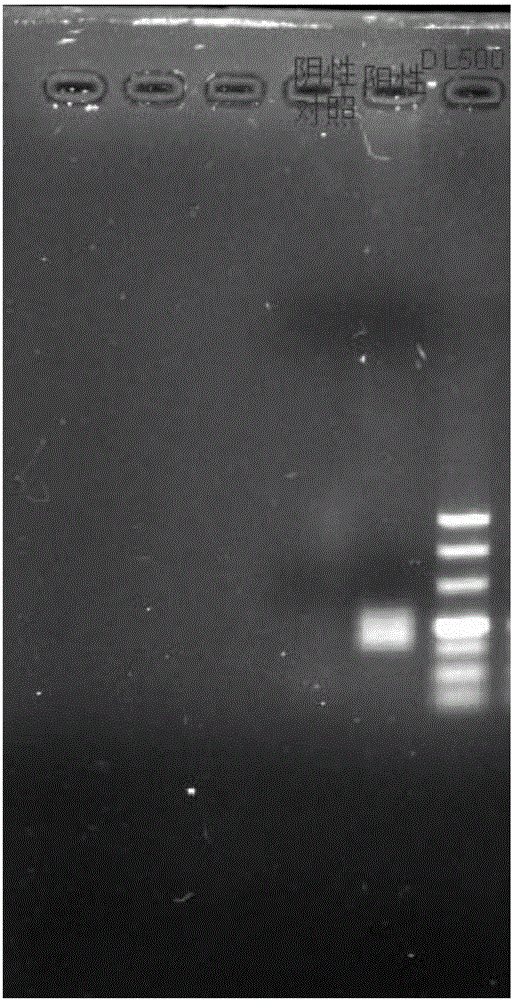
:实验动物的质量直接影响实验结果的准确性、可靠性、实验动物的福利以及工作人员的健康,建立并执行完善的实验动物健康监测方案,对保证和提高实验动物的质量非常重要。随着我国实验动物事业的发展和各项法规的健全、国际交流的增加,以及大跨国公司对国内实验动物质量的严格要求和国内转基因动物出口等需要,国内很多实验动物生产单位和动物使用单位,对实验动物健康监测的要求也在逐步与欧美等发达国家的健康监测水平接轨。在实验动物疾病中,病毒性疾病占有重要的位置。病毒的监测是实验动物质量控制中非常重要的环节。无病毒抗体(virusantibodyfree,VAF)是美国CharlesRiverLaboratories(CRL)提出的概念,此标准符合科研使用的实际需要和实验动物繁育的要求,也得到了全球众多实验动物使用者的认可。CRL在国际上率先使用luminex的x-tag、x-map技术进行实验动物的质量检测,而这项技术在国内实验动物质量检测中的应用还是空白。淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒是实验豚鼠常规病毒检测项目,其鉴别诊断通常需借助实验室诊断技术,如病毒分离、免疫荧光试验技术、电镜、免疫酶联吸附实验、RT-PCR和核苷酸序列分析等,虽然以上方法均能鉴别出不同类型的病毒,但如病毒分离、免疫荧光试验、电镜等方法费时费力,不适于临床快速诊断,也不适于大规模的流行病学调查;由于不同毒株间衣壳蛋白抗原具有相当大的变异性,因此酶联免疫吸附试验的应用也受到限制,而PCR技术具有特异性强、敏感度高的优点,但结果判定需要电泳,费时费力,且反应产物容易产生污染而导致假阳性。荧光定量PCR技术融合了PCR的多种优点,通过直接检测PCR反应过程中荧光信号的变化实现对目的分子的定量,不需要电泳检测,并且整个过程完全闭管式操作,污染机率降低,避免了常规PCR容易造成的假阳性问题。相对常规PCR,荧光定量PCR在敏感性、特异性与速度等方面具有优势,但实时荧光PCR技术受到荧光种类及仪器自身的限制,最多只能对5个靶标进行检测,且实验成功的难度极大,费用昂贵。技术实现要素:为解决上述问题,本发明建立了针对实验豚鼠的淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒的多重液相基因芯片方法。本发明的目的在于提供一种快速检测豚鼠LCMV、SV、PVM、Reo-3病毒的多重液相基因芯片方法及试剂。本发明所采取的技术方案是:一种快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒的多重液相基因芯片方法的引物,其核苷酸序列如下所示:引物L1:ACTGTGTAAAGCAGGCCAAGGTCTGT(SEQIDNO:1);引物L2:AACAATCAATTTGGCACAATGCC(SEQIDNO:2);引物S1:CCCAGCCATATACTCAGTCGTGC(SEQIDNO:3);引物S2:TCCACAACTTTTGTGACAGGACAC(SEQIDNO:4);引物P1:AGATCACAGAGCCCGTCAAAAT(SEQIDNO:5);引物P2:GCATATAACATCCAATACGAGTTTGAA(SEQIDNO:6);引物R1:ACGTCTCAAATACACTCTGATAC(SEQIDNO:7);引物R2:TTCCAATCKGGAGATTGCAAGTTG(SEQIDNO:8)。进一步的,所述引物L1和L2其中一条引物的5’端被生物素化;所述引物S1和S2其中一条引物的5’端被生物素化;所述引物P1和P2其中一条引物的5’端被生物素化;所述引物R1和R2其中一条引物的5’端被生物素化。进一步的,所述引物L1和L2、S1和S2、P1和P2、R1和R2中未被生物素化的引物的5’端连接有tag序列,所述tag序列能与荧光编码微球中带有的anti-tag序列互补配对。进一步的,所述引物L1和L2、S1和S2、P1和P2、R1和R2这4组引物对中连接的tag序列选自SEQIDNO:9~12所示的tag序列,且该4组引物对中连接的tag序列互不相同。一种快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒的多重液相基因芯片方法的试剂,该试剂中含有上述任一所述的引物。进一步的,所述试剂中还含有链霉亲和素-藻红蛋白复合物、4种编码不同荧光色的荧光编码微球。进一步的,所述荧光编码微球中还含有与引物中tag序列互补配对的anti-tag序列,编码不同荧光色的荧光编码微球中含有的anti-tag序列互不相同。一种快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒的多重液相基因芯片方法,包括如下步骤:1)从样品中提取病毒RNA,以RNA为模板进行反转录得cDNA产物;2)以反转录出的cDNA产物为模板,用上述任一所述的引物进行多重PCR扩增;3)将上步扩增产物、4种编码不同荧光色的荧光编码微球、链霉亲和素-藻红蛋白进行杂交;4)杂交结束后,通过Luminex系统对杂交产物进行检测分析,确定其病毒的类型;上述方法用于非疾病的诊断的治疗。进一步的,步骤2)中多重PCR扩增的反应体系为:步骤2)中多重PCR扩增的反应程序为:94℃预变性5min;94℃变性30s,57℃退火1min30s,72℃延伸30s;循环36次;72℃终延伸10min。进一步的,步骤3)中4种编码不同荧光色的荧光编码微球中还含有与引物中tag序列互补配对的anti-tag序列,4种荧光编码微球中含有的anti-tag序列互不相同。本发明的有益效果是:1)本发明方法同时对豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒进行检测时,通过PCR获得目标扩增片段,然后将扩增产物、荧光编码微球和链霉亲和素-藻红蛋白(SA-PE)进行杂交,然后通过检测仪读取MFI值时,分辩不同类型的病毒。2)本发明方法,能够同时对豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒进行准确检测,而且特异性强,灵敏度高,重复性好。与传统检测方法相比,本发明方法实现了对同一样本中的多种不同目的分子同时进行检测,样本用量少,操作简单、快速,可大大降低检测成本。本发明能保证相同的复性温度和杂交效率,且有效避免不同检测物标记的微球之间交叉杂交。附图说明图1是用鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒等的cDNA模板进行单重PCR的产物电泳图;图2是用鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒等的cDNA模板进行多重PCR的产物电泳图。具体实施方式一种快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒的多重液相基因芯片方法的引物,其核苷酸序列如下所示:引物L1:ACTGTGTAAAGCAGGCCAAGGTCTGT(SEQIDNO:1);引物L2:AACAATCAATTTGGCACAATGCC(SEQIDNO:2);引物S1:CCCAGCCATATACTCAGTCGTGC(SEQIDNO:3);引物S2:TCCACAACTTTTGTGACAGGACAC(SEQIDNO:4);引物P1:AGATCACAGAGCCCGTCAAAAT(SEQIDNO:5);引物P2:GCATATAACATCCAATACGAGTTTGAA(SEQIDNO:6);引物R1:ACGTCTCAAATACACTCTGATAC(SEQIDNO:7);引物R2:TTCCAATCKGGAGATTGCAAGTTG(SEQIDNO:8)。优选的,所述引物L1和L2其中一条引物的5’端被生物素化;所述引物S1和S2其中一条引物的5’端被生物素化;所述引物P1和P2其中一条引物的5’端被生物素化;所述引物R1和R2其中一条引物的5’端被生物素化。更优选的,引物L2、S2、P2和R2的5’端被生物素化。优选的,所述引物L1和L2、S1和S2、P1和P2、R1和R2中未被生物素化的引物的5’端连接有tag序列,所述tag序列能与荧光编码微球中带有的anti-tag序列互补配对。优选的,所述引物L1和L2、S1和S2、P1和P2、R1和R2这4组引物对中连接的tag序列选自SEQIDNO:9~12所示的tag序列,且该4组引物对中连接的tag序列互不相同;tag序列具体如下:CTTAAACTCTACTTACTTCTAATT(SEQIDNO:9);CTAAACATACAAATACACATTTCA(SEQIDNO:10);TACTTAAACATACAAACTTACTCA(SEQIDNO:11);AATAACAACTCACTATATCATAAC(SEQIDNO:12)。更优选的,引物L1、S1、P1和R1的5’端连接有tag序列。优选的,引物L1、S1、P1和R1的5’端通过间隔臂与tag序列连接。优选的,所述的间隔臂为Spacer18(六乙二醇,Spacer18为其通用的寡核苷酸修饰名称),修饰引物由生工生物工程(上海)股份有限公司合成。一种快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒的多重液相基因芯片方法的试剂,其特征在于,该试剂中含有上述任一所述的引物。优选的,上述试剂中还含有链霉亲和素-藻红蛋白复合物、4种编码不同荧光色的荧光编码微球。优选的,上述荧光编码微球中还含有与引物中tag序列互补配对的anti-tag序列,编码不同荧光色的荧光编码微球中含有的anti-tag序列互不相同。一种快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒的多重液相基因芯片方法,包括如下步骤:1)从样品中提取病毒RNA,以RNA为模板进行反转录得到cDNA产物;2)以反转录出的cDNA产物为模板,用上述任一所述的引物进行多重PCR扩增;3)将上步扩增产物、4种编码不同荧光色的荧光编码微球、链霉亲和素-藻红蛋白进行杂交;4)杂交结束后,通过Luminex系统对杂交产物进行检测分析,确定其病毒的类型;上述方法用于非疾病的诊断的治疗。优选的,步骤1)中反转录的反应体系为:优选的步骤1)中反转录的反应程序为:37℃15min;85℃5s,4℃保存。优选的步骤2)中多重PCR扩增的反应体系为:优选的,步骤2)中多重PCR扩增的反应程序为:94℃预变性5min;94℃变性30s,57℃退火1min30s,72℃延伸30s;循环36次;72℃终延伸10min。优选的,步骤3)所述杂交的反应体系和程序为:优选的,步骤3)中4种编码不同荧光色的荧光编码微球中还含有与引物中tag序列互补配对的anti-tag序列,4种荧光编码微球中含有的anti-tag序列互不相同。下面结合具体实施例对本发明作进一步的说明,但并不局限于此。实施例1引物经过对所设计的大量引物进行筛选后,发现引物对L1和L2、S1和S2、P1和P2、R1和R2对同时快检测豚鼠LCMV、SV、PVM、Reo-3病毒的效果最好,其碱基序列如下所示。引物L1:ACTGTGTAAAGCAGGCCAAGGTCTGT(SEQIDNO:1);引物L2:AACAATCAATTTGGCACAATGCC(SEQIDNO:2);引物S1:CCCAGCCATATACTCAGTCGTGC(SEQIDNO:3);引物S2:TCCACAACTTTTGTGACAGGACAC(SEQIDNO:4);引物P1:AGATCACAGAGCCCGTCAAAAT(SEQIDNO:5);引物P2:GCATATAACATCCAATACGAGTTTGAA(SEQIDNO:6);引物R1:ACGTCTCAAATACACTCTGATAC(SEQIDNO:7);引物R2:TTCCAATCKGGAGATTGCAAGTTG(SEQIDNO:8)。本发明采用多重液相基因芯片的方法对豚鼠淋巴细胞脉络丛脑膜炎病毒(LCMV)、仙台病毒(SV)、鼠肺炎病毒(PVM)、呼肠孤3型病毒(Reo-3)进行检测和区分,故将上述引物作进一步的修饰,以满足相应的操作要求。其中引物L1、S1、P1、R1的5’端通过间隔臂连接有tag序列,所连接的tag序列分别为:引物L1的tag序列为:CTTAAACTCTACTTACTTCTAATT(SEQIDNO:9);引物S1的tag序列为:CTAAACATACAAATACACATTTCA(SEQIDNO:10);引物P1的tag序列为:TACTTAAACATACAAACTTACTCA(SEQIDNO:11)。引物R1的tag序列为:AATAACAACTCACTATATCATAAC(SEQIDNO:12)。所述的间隔臂为Spacer18(六乙二醇,Spacer18为其通用的修饰寡核苷酸时名称),修饰引物由生工生物工程(上海)股份有限公司合成。实施例2用于快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒(LCMV)、仙台病毒(SV)、鼠肺炎病毒(PVM)、呼肠孤3型病毒(Reo-3)的多重液相基因芯片方法的试剂试剂包括以下组分:(1)实施例1所设计的引物;(2)4种编码不同荧光色的荧光编码微球,4种荧光编码微球分别含有不同的anti-tag序列的荧光编码微球,所述anti-tag序列能相应地与多重荧光免疫分析引物中的tag序列互补配对;4种微球均购自luminex公司,其中LCMV、SV、PVM和Reo-3分别对应的荧光编码微球号为MTAG-A056、MTAG-A062、MTAG-065和MTAG-077。(3)链霉亲和素-藻红蛋白复合物。实施例3快速检测豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒的多重液相基因芯片检测方法的建立(1)病毒RNA提取及反转录用天根OSR-M202病毒核酸提取试剂盒在TGuideM16自动核酸提取仪上提取上述4种病毒的RNA,用TakaraPrimeScriptTMRTMasterMix(PerfectRealTime)进行反转录反转录的反应体系为:反转录的反应程序为:37℃15min;85℃5s,4℃保存。(2)多重PCR扩增引物混合液的制备:将LCMV、SV、PVM和Reo-3的引物以4:1:1:1比例进行混合;多重PCR反应体系为:扩增的反应程序为:94℃预变性5min;94℃变性30s,57℃退火1min30s,72℃延伸30s;循环36次;72℃终延伸10min。其中,将部分多重PCR产物进行琼脂糖凝胶电泳分析,检测结果如图2所示,从中可以看出,由于这4种病毒的扩增产物大小相近,所以四重PCR扩增产物的电泳条带无法分辨。另外,分别用引物对L1和L2、S1和S2、P1和P2、R1和R2对豚鼠淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒引物进行单重PCR扩增,单重PCR反应体系为:PCR扩增的反应程序为:94℃预变性5min;94℃变性30s,57℃退火1min30s,72℃延伸30s;循环36次;72℃终延伸10min。分别对单重PCR扩增产物进行电泳检测,检测结果如图1所示(为2次电泳图片拼接),从中可以看出。LCMV、SV、PVM和Reo-3的产物大小的确都位于150-200bp之间;进一步说明在图2中,由于这四种病毒的扩增产物大小相近,所以PCR扩增产物的电泳条带无法分辨。(3)多重PCR产物与荧光编码微球工作液、链霉亲和素藻红蛋白(SA-PE)工作液进行杂交,包括以下步骤:分别包被有特异的anti-tag序列的4种微球,其中anti-tag序列能相应地与LCMV、SV、PVM和Reo-3四种病毒引物上的tag序列互补配对。四种微球均购自luminex公司,具体的LCMV、SV、PVM和Reo-3分别对应的荧光编码微球号为MTAG-A056、MTAG-A062、MTAG-065和MTAG-077。荧光编码微球工作液的制备:将2500个/μL荧光编码微球用1.1×TmHybrdizationBuffer稀释到1μL约含有125个/种荧光编码微球。SA-PE工作液制备:将1mg/mlSA-PE用1×TmHybrdizationBuffer稀释到10μg/μL。充分重悬荧光编码微球工作液,每个样品孔和背景孔加入微球工作液20μL,样品孔中加入5μLPCR产物,背景孔中加入5μLPCRblank产物,再加入75μL的SA-PE工作液,充分混匀,于金属加热器中37℃孵育30min。依照检测仪Luminex200仪器的说明将杂交后的50μL上述反应液进行检测,结果如表1所示,虽然多重模板的扩增产物无法用电泳分辨,但用检测仪Luminex200仪器读取MFI值时,明显分辨不同类型的病毒。表1LCMV、SV、PVM和Reo-3的多重液相基因芯片检测方法实验结果病毒名称MFI值LCMV4946.5SV8390.5PVM9430Reo-36200结果判断标准(注:该判断标准仅供参考,亦可对结果判断标准进行调整)如下:最低检测阈值(cutoff值)的确定:选取10份清洁级豚鼠脑和肺组织样品(每个样品平行重复3次)分别通过上述多重液相基因芯片方法进行检测,分别读取MFI值并计算其平均值和标准差。以平均值加3倍标准差的MFI值设定其为cutoff值。本发明所获得cutoff值分别为LCMV:422.6、SV:511.7、PVM:794.7和Reo-3:312.5,因此将本发明的cutoff值分别定为430、520、800、320。只有检测样品的MFI值高于上述数值时,该实验数据才能进行有效分析。待测样本的分析判断:1)当待测样本的MFI值≤cutoff值时,判断为阴性样本;2)待测样本的MFI值>cutoff值时,判断为阳性,需要进行重复实验或采取其他检测方法进一步验证。实施例4:LCMV、SV、PVM和Reo-3的多重液相基因芯片检测灵敏性实验将实施例3中反转录后的cDNA进行定量,采用10倍稀释法进行稀释,稀释至0.7fg/μL,用上述建立的多重液相基因芯片方法进行检测。LCMV、SV、PVM和Reo-3的多重液相基因芯片检测灵敏性实验结果如表2所示,实验结果表明,LCMV、SV、PVM和Reo-3的灵敏度较高,检出限分别为7ng/μL、0.07ng/μL、0.07ng/μL、7ng/μL。表2LCMV、SV、PVM和Reo-3的多重液相基因芯片检测灵敏性实验结果cDNA浓度700ng/μL70ng/μL7ng/μL0.7ng/μL0.07ng/μL0.007ng/μLLCMV50752355156616492.588SV8319804573306741.52166513.5PVM93478437691546632121208Reo-363893774188327370.547实施例5:LCMV、SV、PVM和Reo-3的多重液相基因芯片检测特异性实验分别用淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒、小鼠腺病毒、小鼠细小病毒、小鼠多瘤病毒、汉坦病毒、小鼠脑脊髓炎病毒、鼠痘病毒等作为模板进行多重液相基因芯片检测。实验结果如表3所示,只有淋巴细胞脉络丛脑膜炎病毒、仙台病毒、鼠肺炎病毒、呼肠孤3型病毒为阳性,其他的均为阴性,说明检测体系特异性良好。表3LCMV、SV、PVM和Reo-3的多重液相基因芯片检测特异性实验结果实施例6:LCMV、SV、PVM和Reo-3的多重液相基因芯片检测重复性实验四种病毒分别做了批内和批间实验,实验结果如表4所示。表4LCMV、SV、PVM和Reo-3的多重液相基因芯片检测重复性结果从表4结果可知,批内实验的变异系数在0.5%以下,批间实验的变异系数在1%以下,表明该方法的检测性能稳定,结果可靠,具有可重复性。实施例7:人工攻毒的样品的检测取人工攻毒的清洁级实验豚鼠组织样品12份(每种病毒3份),用天根OSR-M202病毒核酸提取试剂盒在TGuideM16自动核酸提取仪上提取RNA,然后用TakaraPrimeScriptTMRTMasterMix(PerfectRealTime)反转录获得cDNA。以cDNA作为模板,采用上述检测LCMV、SV、PVM和Reo-3的多重液相基因芯片检测方法进行检测,具体步骤参照实施例3,实验结果如表5所示。表5人工攻毒的清洁级实验豚鼠组织样品的检测结果检测实验结果表明,12份样品都超过了检测阈值,认定为阳性。与测序分析结果一致。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。<110>广东省实验动物监测所<120>一种快速检测豚鼠LCMV、SV、PVM、Reo-3病毒的多重液相基因芯片方法及试剂<130><160>12<170>PatentInversion3.5<210>1<211>26<212>DNA<213>人工序列<400>1actgtgtaaagcaggccaaggtctgt26<210>2<211>23<212>DNA<213>人工序列<400>2aacaatcaatttggcacaatgcc23<210>3<211>23<212>DNA<213>人工序列<400>3cccagccatatactcagtcgtgc23<210>4<211>24<212>DNA<213>人工序列<400>4tccacaacttttgtgacaggacac24<210>5<211>22<212>DNA<213>人工序列<400>5agatcacagagcccgtcaaaat22<210>6<211>27<212>DNA<213>人工序列<400>6gcatataacatccaatacgagtttgaa27<210>7<211>23<212>DNA<213>人工序列<400>7acgtctcaaatacactctgatac23<210>8<211>24<212>DNA<213>人工序列<400>8ttccaatckggagattgcaagttg24<210>9<211>24<212>DNA<213>人工序列<400>9cttaaactctacttacttctaatt24<210>10<211>24<212>DNA<213>人工序列<400>10ctaaacatacaaatacacatttca24<210>11<211>24<212>DNA<213>人工序列<400>11tacttaaacatacaaacttactca24<210>12<211>24<212>DNA<213>人工序列<400>12aataacaactcactatatcataac24当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1