优生优育检测试剂盒、检测用寡核苷酸和方法与流程
本发明属于基因检测领域,具体涉及用于优生优育的TORCH(如弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒等)检测项目的试剂盒、检测试剂和方法。
背景技术:
TORCH是一组病原微生物英文字母的缩写,T指刚地弓形虫(toxoplasma,TOX),O指其他微生物(Others,如柯萨奇病毒、梅青螺旋体、微小病毒、乙肝病毒等),R是指风疹病毒(rubella virus,RV),C指巨细胞病毒(cytomegalovirus,CMV),H指单纯疱疹病毒(herpes simplx virus,HSV)I、II型。此组病原体所引起的感染称之为TORCH感染。这几种病原体感染的范围广、危害大,孕妇由于内分泌系统的改变导致机体免疫力下降,容易发生原发性感染,以前感染过的孕妇体内潜伏的病毒也容易被激活而发生复发感染。妊娠期感染不仅危害母体,往往还对胎儿和新生儿产生严重不良后果,可以导致流产、早产、死胎或者胎儿生长迟缓和发育畸形,通过产道和母乳可以引起新生儿感染,如果累及神经系统,可造成不同程度的智力障碍以及各种瘫痪、失聪、失明等严重后遗症,从而影响人口素质。
弓形虫感染是TORCH病原体中唯一的人畜共患传染病,如猫、犬、羊、鸡均可成为感染源,弓形虫可通过人的伤口进入人体,食用未煮熟的肉类或污制品、饮用污染的水或吸入病畜排泄飞沫而被感染。感染后绝大多数为隐性感染,患者没有明显的症状和体征,对于妊娠期妇女孕初3个月感染,对胎儿造成严重影响,可导致流产、早产、死产或畸形。风疹病毒通过呼吸道感染,感染孕妇后能直接通过胎盘屏障,传播给胎儿的感染率随着孕期的进展而降低,因此妊娠期确定风疹感染的时间很重要。巨细胞病毒属于疱疹病毒,主要通过与排毒者密切接触而感染,是宫内感染危害最大的致畸病原体之一。孕妇感染后,可能引起病毒血症,通过血液、胎盘屏障、羊水等感染胎儿,致胚胎发育异常,造成流产、死胎、早产、畸形等。临床上,识别巨细胞病毒的感染情况对进一步鉴定胎儿感染后有无器官功能损坏,以及出生后有无后遗症有很重要的作用。单纯疱疹病毒有I、II型,其中以II型感染为主,传播途径主要是产道感染,孕早期对胎儿的损害大于妊娠晚期,对孕早期的影响主要是致胎儿流产、先天畸形、早产等。
TORCH感染已经受到全世界医学界尤其是妇产科和儿科医生的高度重视。欧美等发达国家早在七十年代就将风疹、弓形虫、巨细胞病毒等检测列为孕期筛查项目。在我国随着优生优育工作的深入进行,孕期TORCH检测逐步在医疗及计划生育部门开展起来。目前TORCH感染的临床诊断方法包括病原学检查、血清学检查、基因诊断等方法。
病原学检查包括体液或活组织穿刺物涂片、组织切片、镜检和病原体的分离和培养。一旦镜检发现或分离培养证实病原体的存在,即可确诊。但涂片、切片检测率低,且所需时间长,费用高,不适合作为常规检查项目。
血清学检查目前应用最多的是酶联免疫吸附试验(ELISA),利用抗原抗体特异性结合的原理检测血清中抗原或抗体的存在。TORCH在临床诊断中通常针对lgM或lgG。lgM在早期出现,以后被lgG替代。我国习惯使用TORCH 4项的IgM进行筛查,但IgM抗体试验影响因素很多,且国内人群TORCH各项目IgM阳性率不高,单纯使用IgM筛查容易出现假阳性。另外随着生活方式的多样化,HSV I生殖道感染的比例在逐年增加,如不区分HSV I和HSV II的筛查方法极易造成孕妇围产期未经鉴别的HSV感染,给新生儿造成潜在严重危害。因此为获得更加准确可靠的结果,同时进行TORCH筛查是必须的。
基因诊断包括用核酸序列为探针进行的分子杂交和已核酸扩增为基础的聚合酶链式反应(PCR)等,这类检测灵敏度高,能直接检测病原体的遗传物质,证明病原体的存在。检测样本多取材于孕妇羊水细胞、静脉血、绒毛标本、胎儿脐带血、尿、乳汁等。然而核酸斑点杂交、核酸原位杂交方法欠灵敏,特异性不高,不能作为临床常规诊断,现在普遍认为PCR法具有重复性好、特异性强、灵敏度高的特点,可使极微量的靶基因样品扩增百万倍,具有很高的敏感性,克服了漏检。随着PCR方法的使用,相继出现TORCH病原体单项PCR检测试剂,由于TORCH感染的症状、后果均相似,孕妇只得同时进行多项检测,使得价格较高,尚难在孕妇中广泛开展。目前采用PCR方法筛查TORCH时,需要单独四管分别检测弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒的情况。为了确定样本为HSV的哪种型别,甚至要使用五管分别检测弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒I型、单纯疱疹病毒II型的情况。这样不仅要消耗病人更多的样本,同时也极大地增加试剂和人力成本。
技术实现要素:
为了克服上述TORCH检测中的不足,本发明提供了一种用于优生优育检测的寡核苷酸包括:
检测巨细胞病毒的引物和探针序列为:
HCMV FP:AAGTGTTTATAATTCTGGTCGCA
HCMV RP:AGGGCCAGAAGCATCTGGTAA
HCMV P:ACCGGGACCACCGTCGTCTGA
检测单纯疱疹病毒的引物和探针序列为:
HSV通用FP:GGAGAGGGACATCCAGGACT
HSV通用RP:CATGAGCTTGTAATACACCGTCA
HSV通用P:CTCACCGCCGAACTGAGCAGACA
检测弓形虫的引物和探针序列为:
TOX FP:AGCCACAGAAGGGMCAGAAGT
TOX RP:CTCGYCGCYTCCCAACCA
TOX P:ATGCCGCTCCTCCAGCCGTC
检测风疹病毒的引物和探针序列为:
RV FP:CGCATYTGGAAYGGYAC
RV RP:GYRAACACRCTCATCAC
RV P:AAGCARTACCAYCCYACCG
检测单纯疱疹病毒I型的引物和探针序列为:
HSV-1FP:TGCAGAGCAACCCCATGAAG
HSV-1RP:GGCCTCGTCAAARTCGCC
HSV-1P:CTCAAGAACCCCACCARCCCGGA
检测单纯疱疹病毒II型的引物和探针序列为:
HSV-2FP:CTCCGGGTTTCACGTCGA
HSV-2RP:CGCAGGGAGAGCGTACTGA
HSV-2P:TGGTGGTGTTTGACTTTGCCAGCC
其中所述的M代表A或C,R代表A或G,Y代表C或T。
所述探针5`端的荧光基团标记为FAM、VIC、Texas Red、Cy5或HEX。
进一步地,探针HCMV P的5`端标记的荧光基团为FAM,探针HSV通用P的5`端标记的荧光基团为VIC,探针TOX P的5`端标记的荧光基团为Texas Red,探针RV P的5`端标记的荧光基团为Cys5,探针HSV-1P的5`端标记的荧光基团为FAM,探针HSV-2P的5`端标记的荧光基团为VIC。
本发明还提供了一种用于优生优育的TORCH检测试剂盒,包括DNA/RNA核酸提取试剂、荧光定量PCR扩增反应液、酶混合液、阳性对照品和阴性对照品,荧光定量PCR扩增反应液包括PCR反应液1和PCR反应液2,所述PCR反应液1包括检测巨细胞病毒的引物和探针、检测单纯疱疹病毒的引物和探针、检测弓形虫的引物和探针、检测风疹病毒的引物和探针,其中,
检测巨细胞病毒的引物和探针序列为:
HCMV FP:AAGTGTTTATAATTCTGGTCGCA
HCMV RP:AGGGCCAGAAGCATCTGGTAA
HCMV P:ACCGGGACCACCGTCGTCTGA
检测单纯疱疹病毒的引物和探针序列为:
HSV通用FP:GGAGAGGGACATCCAGGACT
HSV通用RP:CATGAGCTTGTAATACACCGTCA
HSV通用P:CTCACCGCCGAACTGAGCAGACA
检测弓形虫的引物和探针序列为:
TOX FP:AGCCACAGAAGGGMCAGAAGT
TOX RP:CTCGYCGCYTCCCAACCA
TOX P:ATGCCGCTCCTCCAGCCGTC
检测风疹病毒的引物和探针序列为:
RV FP:CGCATYTGGAAYGGYAC
RV RP:GYRAACACRCTCATCAC
RV P:AAGCARTACCAYCCYACCG
所述PCR反应液2包括检测单纯疱疹病毒I型的引物和探针、检测单纯疱疹病毒II型的引物和探针,其中,
检测单纯疱疹病毒I型的引物和探针序列为:
HSV-1FP:TGCAGAGCAACCCCATGAAG
HSV-1RP:GGCCTCGTCAAARTCGCC
HSV-1P:CTCAAGAACCCCACCARCCCGGA
检测单纯疱疹病毒II型的引物和探针序列为:
HSV-2FP:CTCCGGGTTTCACGTCGA
HSV-2RP:CGCAGGGAGAGCGTACTGA
HSV-2P:TGGTGGTGTTTGACTTTGCCAGCC
其中所述的M代表A或C,R代表A或G,Y代表C或T
所述探针5`端的荧光基团标记为FAM、VIC、Texas Red、Cy5或HEX。
进一步地,探针HCMV P 5`端标记的荧光基团为FAM,探针HSV通用P 5`端标记的荧光基团为VIC,探针TOX P 5`端标记的荧光基团为Texas Red,探针RV P 5`端标记的荧光基团为Cys5,探针HSV-1P 5`端标记的荧光基团为FAM,探针HSV-2P 5`端标记的荧光基团为VIC。
所述的阳性对照品包括HCMV DNA克隆质粒、HSV通用克隆质粒、TOX克隆质粒、含RV基因片段的病毒样颗粒、HSV-1克隆质粒和HSV-2克隆质粒
所述的阴性对照品包括0.9%NaCl。
本发明还提供了制备优生优育TORCH检测试剂盒的方法,包括以下步骤:
(1)配制DNA/RNA提取试剂;
(2)配制荧光定量PCR扩增反应液;
(3)配制酶混合液;
(4)配制阳性对照品;
(5)配制阴性对照品;
用于配制荧光定量PCR扩增反应液的寡核苷酸包括HCMV FP、HCMV RP和HCMV P;HSV通用FP、HSV通用RP和HSV通用P;TOX FP、TOX RP和TOX P;RV FP、RV RP和RV P;HSV-1FP、HSV-1RP和HSV-1P;HSV-2FP、HSV-2RP和HSV-2P。所述荧光定量PCR扩增反应液包括PCR反应液1和PCR反应液2,其中PCR反应液1包括检测巨细胞病毒的引物和探针、检测单纯疱疹病毒的引物和探针、检测弓形虫的引物和探针、检测风疹病毒的引物和探针;PCR反应液2包括检测单纯疱疹病毒I型的引物和探针、检测单纯疱疹病毒II型的引物和探针。
所述探针5`端的荧光基团标记为FAM、VIC、Texas Red、Cy5或HEX。
有益效果:本发明采用初筛和分型相结合的方式。初筛可以判断出样本是否为弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒阳性。若初筛结果显示样本单纯疱疹病毒为阳性,再将该样本进行单纯疱疹病毒分型检测。无论在初筛和分型检测时,均使用了一管多检的方式,这不仅减少筛查的成本,又提高了检测的通量。本发明所述试剂盒采用DNA/RNA共抽提试剂提取样本及DNA/RNA共扩增程序进行检测,这实现了在同一个反应体系中同时完成RNA样本和DNA样本的荧光定量PCR检测。所述试剂盒中采用UNG酶+dUTP防污染的试剂和措施,能有效的排除假阳性结果,提高TORCH检测的准确性。
附图说明
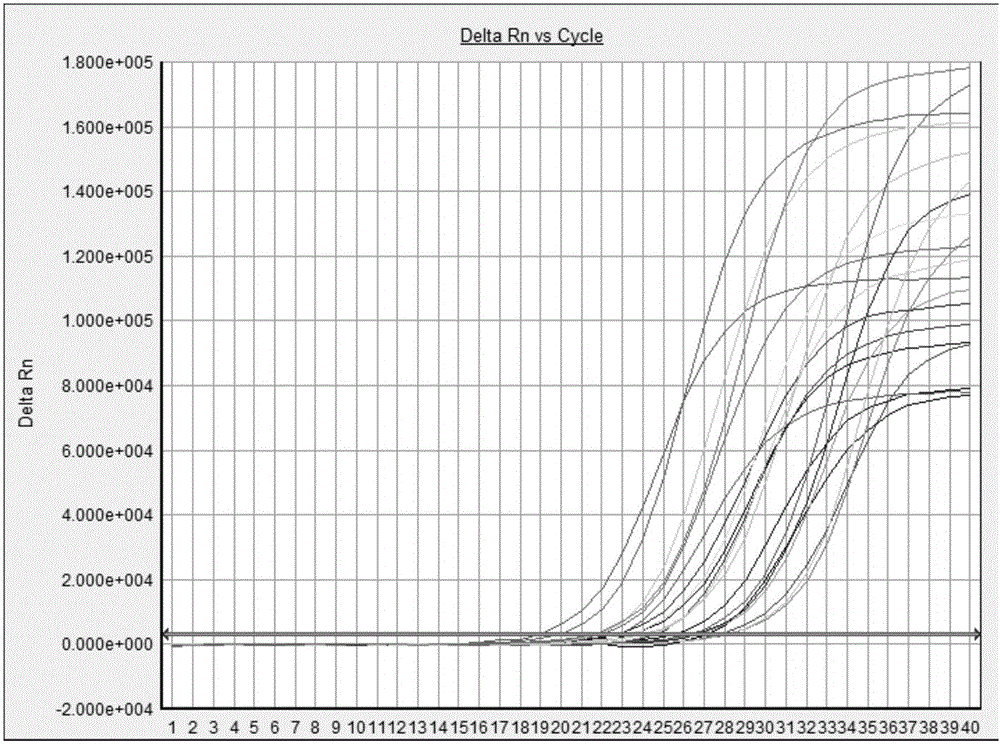
图1是临床样本HCMV检测结果。
图2是临床样本HSV检测结果。
图3是TOX检测结果。
图4是临床样本RV检测结果。
图5是临床样本HSV-1检测结果。
图6是临床样本HSV-2检测结果。
图7是消除残留的dU-DNA实验的电泳结果。
图8是UNG酶是否为外切酶活性实验的电泳结果。
具体实施方式
下面结合具体实施例,进一步阐述本发明。
实施例1检测试剂和试剂盒
用于TORCH检测的试剂包括PCR反应液1和PCR反应液2。所述PCR反应液1包括检测巨细胞病毒的引物和探针、检测单纯疱疹病毒的引物和探针、检测弓形虫的引物和探针和检测风疹病毒的引物和探针。其中,
检测巨细胞病毒的引物(HCMV FP和HCMV RP)和探针(HCMV P)序列如下:
HCMV FP:AAGTGTTTATAATTCTGGTCGCA
HCMV RP:AGGGCCAGAAGCATCTGGTAA
HCMV P:ACCGGGACCACCGTCGTCTGA
检测单纯疱疹病毒的引物(HSV通用FP和HSV通用RP)和探针(HSV通用P)序列如下:
HSV通用FP:GGAGAGGGACATCCAGGACT
HSV通用RP:CATGAGCTTGTAATACACCGTCA
HSV通用P:CTCACCGCCGAACTGAGCAGACA
检测弓形虫的引物(TOX FP和TOX RP)和探针(TOX P)序列如下:
TOX FP:AGCCACAGAAGGGMCAGAAGT
TOX RP:CTCGYCGCYTCCCAACCA
TOX P:ATGCCGCTCCTCCAGCCGTC
检测风疹病毒的引物(RV FP和RV RP)和探针(RV P)序列如下:
RV FP:CGCATYTGGAAYGGYAC
RV RP:GYRAACACRCTCATCAC
RV P:AAGCARTACCAYCCYACCG
所述PCR反应液2包括检测单纯疱疹病毒I型的引物和探针、检测单纯疱疹病毒II型的引物和探针,其中,
检测单纯疱疹病毒I型的引物(HSV-1FP和HSV-1RP)和探针(HSV-1P)序列如下:
HSV-1FP:TGCAGAGCAACCCCATGAAG
HSV-1RP:GGCCTCGTCAAARTCGCC
HSV-1P:CTCAAGAACCCCACCARCCCGGA
检测单纯疱疹病毒II型的引物(HSV-2FP和HSV-2RP)和探针(HSV-2P)序列如下:
HSV-2FP:CTCCGGGTTTCACGTCGA
HSV-2RP:CGCAGGGAGAGCGTACTGA
HSV-2P:TGGTGGTGTTTGACTTTGCCAGCC
其中所述的M代表A或C,R代表A或G,Y代表C或T。
其中探针5`端的荧光基团为FAM、VIC、Texas Red、Cy5、HEX等。
用于TORCH检测的试剂盒包括DNA/RNA核酸提取试剂、荧光定量PCR扩增反应液、酶混合液、阳性对照品和阴性对照品。
DNA/RNA核酸提取试剂包括:裂解液、洗涤液1、洗涤液2、洗脱液、Carrier RNA和核酸纯化柱。
荧光定量PCR扩增反应液包括PCR反应液1和PCR反应液2。根据检测需要,探针5`端的荧光基团为FAM、VIC、Texas Red、Cy5、HEX等。
阳性对照品包括:HCMV DNA克隆质粒、HSV通用克隆质粒、TOX克隆质粒、含RV基因片段的病毒样颗粒、HSV-1克隆质粒、HSV-2克隆质粒。
阴性对照品包括:包括0.9%NaCl。
实施例2检测试剂盒的制备方法及试剂盒的检测原理
本发明所述的TORCH检测试剂盒的制备方法,包括以下步骤:
(1)配制DNA/RNA提取试剂;
(2)配制荧光定量PCR扩增反应液;
(3)配制酶混合液;
(4)配制阳性对照品;
(5)配制阴性对照品;
本发明所述试剂盒的检测原理:分别选用弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒通用型、单纯疱疹病毒I和单纯疱疹病毒II基因片段设计特异引物及特异探针,该探针能与引物扩增区域中间的一段DNA或cDNA模板发生特异性结合,在PCR延伸反应过程中,Taq酶的外切酶活性将5’端荧光基团从探针上切割下来,使之游离于反应体系中,从而脱离了3’端荧光淬灭基团的屏蔽,即能接受光刺激而发出可供仪器检测的荧光,从而实现在全封闭反应体系中对TORCH核酸的自动化检测。试剂盒采用初筛和分型相结合的方式,通过PCR反应液1初筛待测样本是否为弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒阳性;若检测的样本单纯疱疹病毒为阳性,再将该样本进行单纯疱疹病毒分型检测。试剂盒中同时也使用了UNG酶+dUTP防污染措施,能有效的排除假阳性结果。
实施例3核酸提取步骤
1)取出样本,震荡混匀,吸取1mL样本于1.5mL离心管中,12000rpm离心1min,小心吸弃上清,保留100μl样本。
2)每管(包括阴性对照、阳性对照和待测样本)加入300μl含Carrier RNA的裂解液,旋涡振荡数秒混合均匀,室温静置10分钟。
3)每管加入320μl无水乙醇,温和地翻转离心管3-5次混合均匀。
4)取一个核酸纯化柱放入到2ml离心管中,吸取步骤3)中的混合液加入到核酸纯化柱中,盖上管盖,12000rpm离心30秒。
5)弃2ml离心管中的滤液,并将2ml离心管在纸巾上倒扣拍击一次,将核酸纯化柱置回到2ml离心管中,在核酸纯化柱中加入500μl洗涤液1,盖上管盖,12000rpm离心30秒。
6)弃2ml离心管中的滤液,并将2ml离心管在纸巾上倒扣拍击一次,将核酸纯化柱置回到2ml离心管中,在核酸纯化柱中加入600μl洗涤液2,盖上管盖,14000rpm离心1分钟。
7)弃2ml离心管中的滤液,并将2ml离心管在纸巾上倒扣拍击一次,将核酸纯化柱置回到2ml离心管中,14000rpm离心1分钟。
8)弃2ml离心管,将核酸纯化柱置于一个洁净的1.5ml离心管中,在纯化柱的膜中央加入50μl洗脱液,盖上管盖,室温静置1分钟,12000rpm离心30秒。
9)弃纯化柱,洗脱的核酸用于后续试验;或储存于-20℃备用。
实施例4荧光PCR反应步骤
检测HCMV/HSV/RV/TOX的PCR反应液1配制,检测体系40μl。配方为:
PCR反应液1:Tris-HCl(pH8.3)10mmol/L、KCl 50mmol/L、MgCl2 4mmol/L、dNTPs各150umol/L、BSA 0.2μg/μl、HCMV FP 100nmol/L、HCMV RP 100nmol/L、HCMV P 75nmol/L、HSV通用FP 100nmol/L,HSV通用RP 100nmol/L,HSV通用P 75nmol/L,TOX FP 100nmol/L,TOX RP 100nmol/L,TOX P 75nmol/L,RV FP 200nmol/L,RV FP 250nmol/L,RV P 125nmol/L,用DEPC-H20调至0.6μl;
酶混合液:Taq酶3U、逆转录酶5U、RNA酶抑制剂5U、UNG酶0.2U。
将上述PCR反应液1 18.6μl,酶混合液1.4μl充分混匀后,按20μl量分装到PCR反应管中,转移至样本处理区。对应的反应管中分别加入20μl的实施例3中所得的核酸,盖紧反应管,转移至检测区进行实时荧光PCR扩增反应,对样本进行初筛。
检测HSV-1/HSV-2的PCR反应液2配制,检测体系40μl。配方如下:
PCR反应液2:Tris-HCl(pH8.3)10mmol/L、KCl 50mmol/L、MgCl2 4mmol/L、dNTPs各150umol/L、BSA 0.2μg/μl、HSV-1FP 100nmol/L、HSV-1RP 100nmol/L、HSV-1P 75nmol/L、HSV-2FP 100nmol/L,HSV-2RP 100nmol/L,HSV-2P75nmol/L,用DEPC-H20调至0.6μl;
酶混合液:Taq酶3U、逆转录酶5U、RNA酶抑制剂5U、UNG酶0.2U。
将上述PCR反应液2 18.6μl,酶混合液1.4μl充分混匀后,按20μl量分装到PCR反应管中,转移至样本处理区。对应的反应管中分别加入20μl的实施例3中所得的核酸,盖紧反应管,转移至检测区进行实时荧光PCR扩增反应,对样本进行HSV样本进行分型检测。
实时荧光PCR扩增反应程序如表1,其中:
表1实时荧光PCR扩增反应程序
在本实施例中各通道结果解释如表2所示:
表2
实施例5临床样本检测
按实施例1至4的试剂和方法检测临床样本135例。对照分别选用商业化的荧光PCR检测试剂盒进行对比试验。商业化荧光PCR检测试剂盒选自人巨细胞病毒(HCMV)核酸检测试剂盒(荧光PCR法)(对照组1)、单纯疱疹病毒核酸(PCR)荧光检测试剂盒(对照组2)、弓形虫核酸扩增(PCR)荧光检测试剂盒(对照组3)、风疹病毒核酸检测试剂盒(PCR-荧光探针法)(对照组4)、单纯疱疹病毒I型(HSV-I)核酸检测试剂盒(荧光PCR法)(对照组5)和单纯疱疹病毒II型(HSV-II)核酸检测试剂盒(荧光PCR法)(对照组6)。检测结果见表3和图1至6。图1是HCMV检测结果。图2是HSV检测结果。图3是TOX检测结果。图4是RV检测结果。图5是HSV-1检测结果。图6是HSV-2检测结果。
表3是对比结果(注:“+”表示阳性结果,“-”表示低于试剂检测下限,“N/A”表示未进行此项检测)。
实验结果显示:
HCMV:135例检测样本中,采用本发明所述试剂和方法,共检测出81例HCMV阳性,该81例阳性样本经对照试剂检测80例阳性,1例阴性,将此例对照组阴性样本经测序方法确认为阳性结果。
HSV:135例检测样本中,采用本发明所述试剂和方法,共检测出20例HSV阳性,分型检测6例HSV-1,14例HSV-2;该20例阳性样本经对照试剂检测20例HSV阳性,分型检测5例HSV-1,14例HSV-2。其中对照组1例HSV-1阳性未检测出。
TOX:135例检测样本中,采用本发明所述试剂和方法,共检测出14例TOX阳性,该14例阳性样本经对照试剂检测12例阳性,2例阴性,将此例对照组阴性样本经测序方法确认为阳性结果。
RV:135例检测样本中,采用本发明试剂和方法,共检测出5例RV阳性,该5例阳性样本经对照试剂检测4例阳性,1例阴性,将此例对照组阴性样本经测序方法确认为阳性结果。
实施例6R&D试剂盒灵敏度检测结果
按照实施例1至4所述试剂和方法分别检测HCMV、HSV、TOX、RV、HSV-1、HSV-2阳性样本。分别将阳性样本进行梯度稀释,浓度分别约为1×103copies/ml,500copies/ml,100copies/ml,每个浓度重复8次。测试结果如表4所示,本发明所述试剂盒的灵敏度为500copies/ml。
表4:(注:“+”表示阳性结果,“-”表示低于试剂检测下限)
实施例7UNG酶控制污染验证结果
(1)将UNG酶以dU-DNA为底物,采用实施例4的步骤1的反应程序,以UNG酶对底物进行消化反应,观察反应结果。并设置不加UNG酶作为对照组。检测结果如图7所示,结果显示UNG酶可以消除残留的dU-DNA。UNG处理可以破坏残余产物,杜绝污染,提高检测的特异性。
(2)将UNG酶与质粒DNA在37℃下反应2小时,观察反应结果。检测结果如图8所示,结果显示为单一扩增条带。单一扩增条带,说明无外切酶活性检出,若出现长短不同条带则说明有外切酶活性检出。
实验结果显示,本发明采用UNG酶可以破坏残余产物,杜绝污染,预防非特异性PCR扩增和污染,提高TORCH检测的准确性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于检测犬副流感病毒试剂盒的制造方法与工艺
- 腹泻相关病毒多重基因检测体系及其试剂盒和应用的制造方法与工艺
- 基于POCKIT Micro荧光PCR平台的禽流感病毒H7亚型检测试剂及应用的制造方法与工艺
- 一种流行性乙型脑炎的重组酶常温扩增核酸(RT‑RPA)试纸条检测试剂盒及应用的制造方法与工艺
- 一种腺苷高半胱氨酸酶基因启动子区甲基化程度检测试剂盒及测定方法与流程
- 一种检测心肌梗死的试剂及其应用的制造方法与工艺
- 用于检测CDKN2B基因变异的试剂盒及CDKN2B基因变异率的定量检测方法与流程
- 一种CYP2C19*3基因型检测试剂盒及其检测方法与流程
- 一种CYP2C19*2基因型检测试剂盒及其检测方法与流程
- 基于高通量测序法的人类多基因突变检测试剂盒的制造方法与工艺
- 一种用于检测犬副流感病毒试剂盒的制造方法与工艺
- 腹泻相关病毒多重基因检测体系及其试剂盒和应用的制造方法与工艺
- 基于POCKIT Micro荧光PCR平台的禽流感病毒H7亚型检测试剂及应用的制造方法与工艺
- 一种流行性乙型脑炎的重组酶常温扩增核酸(RT‑RPA)试纸条检测试剂盒及应用的制造方法与工艺
- 一种腺苷高半胱氨酸酶基因启动子区甲基化程度检测试剂盒及测定方法与流程
- 一种检测心肌梗死的试剂及其应用的制造方法与工艺
- 用于检测CDKN2B基因变异的试剂盒及CDKN2B基因变异率的定量检测方法与流程
- 一种CYP2C19*3基因型检测试剂盒及其检测方法与流程
- 一种CYP2C19*2基因型检测试剂盒及其检测方法与流程
- 基于高通量测序法的人类多基因突变检测试剂盒的制造方法与工艺