一种同时鉴别8种牛病原体的引物组合及GeXP检测方法与流程
本发明涉及一种同时鉴别8种牛病原体的引物组合及GeXP检测方法。
背景技术:
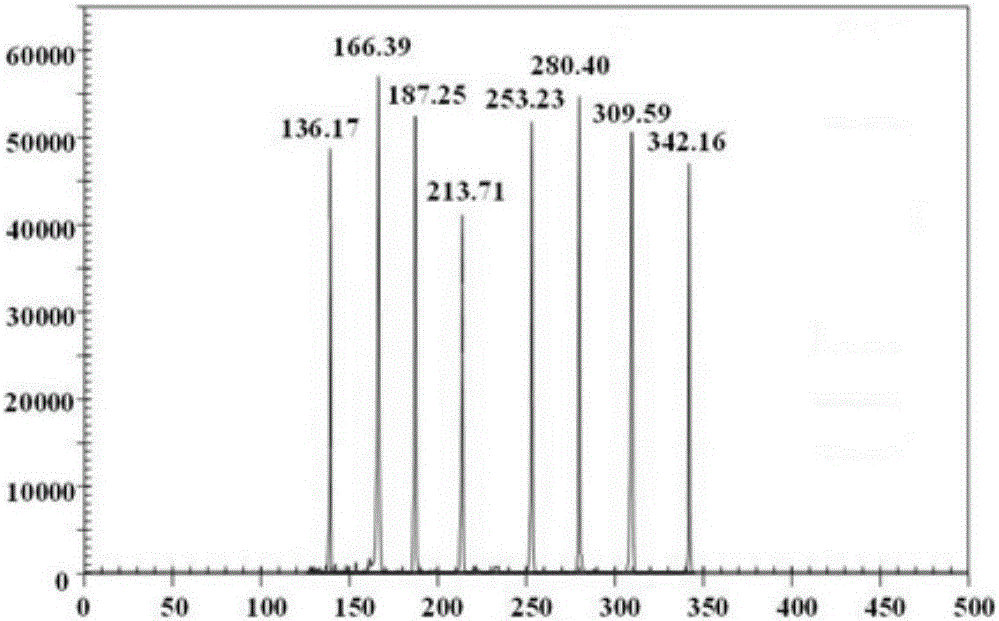
:目前我国现有牛存栏头数1.38亿头,牛肉产量达到675.9万吨,是世界第四大牛肉生产国。近年来广西养牛业发展也十分迅速,拥有全国第5位的牛存栏量,其中水牛存栏数达到450万头,占全国水牛总数的1/5,居全国之首,世界第二。随着养牛业的发展,牛传染病的发病率也在逐年升高,已经成为制约养牛业发展的一大重要因素,具体表现为:老病仍在流行,并且病原出现了新的血清型或变异株,新疾病陆续出现,给牛病的防控带来困难。每年大量牛因疾病死亡,造成了严重的经济损失,据统计2015年全年国内肉牛的因传染病全程死亡率高达5%,导致的直接经济损失高达90-150亿元,牛传染病严重地影响了我国肉类及其制品进入国际市场。口蹄疫病毒(FootandMouthDiseaseVirus,FMDV)、蓝舌病病毒(BluetongueVirus,BTV)、水泡性口炎病毒(VesicularStomatitisVirus,VSV)、牛病毒性腹泻病毒(BovineViralDiarrhealVirus,BVDV),牛轮状病毒(BovineRotavirus,BRV),产肠毒大肠杆菌(EnterotoxigenicE.coli,ETEC)、牛传染性鼻气管炎病毒(InfectiousBovineRhinotracheitisVirus,IBRV)和小反刍兽疫病毒(PestedesPetitsRuminantsVirus,PPRV)是严重危害养牛业的8种主要传染性疾病的病原体,这些病原体的存在,时时刻刻危害着养牛业的发展。由FMDV引发的牛口蹄疫、由VSV引发的牛水泡性口炎和由BTV引发的牛蓝舌病病是牛的高度急性传染病,一般呈暴发性流行,临床上在口腔,蹄部及乳房出现病变,症状十分相似难以区分,死亡率高,被世界动物卫生组织(OIE)列为A类传染病。BVDV,BRV和ETEC也是引起牛腹泻的主要病原体,且BVDV以持续性感染无症状形式存在,牛群中相当一部分牛是这些病原体的携带者,并且常随着其它病暴发,患病牛的症状为急性水样腹泻,急速消瘦。IBRV属于免疫抑制性疾病病毒,感染机体后还可继发细菌感染,据调查不仅各品种的牛均有感染的报道,而且感染地区遍布全国各省市,感染率居高。由PPRV引发的小反刍兽疫病也是近年来出现在的外来新病,OIE将其列为必须报告的动物疫病,在我国列为一类动物疫病。这些疾病是养牛业的巨大潜患,一旦暴发,将会造成巨大的经济损失,因此开展牛传染病的快速检测技术的研究势在必行。快速准确地检测诊断传染病是进行有效防控的前提和基础。目前用于鉴别诊断这些牛传染病的主要方法有病原分离鉴定和血清学试验等,但这些方法常受临床病料新鲜度、污染程度或血清效价的限制,导致结果有误,且耗时耗力,在实际应用中有一定的局限性。随着分子生物学的进步,以PCR技术为基础发展起来的分子生物学诊断方法已广泛应用于传染病的检测诊断,包括PCR、荧光PCR和LAMP等,但这些方法只能对单一或2至4种病原体进行检测,无法实现真正意义上的同时对多种病原体实行高通量检测。GeXP多基因表达分析系统是一种新型的高通量的基因检测技术,将多重PCR技术和毛细管电泳技术有效的结合起来,采用荧光标记通用引物和特异性嵌合引物(即基因特异性引物5’端连接通用引物)相结合从而引发多重PCR体系的扩增,可同时对多达30个目的基因进行有效检测分析,实现真正意义上的高通量检测鉴别多种病原体的目的。技术实现要素:本发明的目的是提供一种同时鉴别8种牛病原体的引物组合及GeXP检测方法。本发明提供了一种引物组合,由引物对I、引物对II、引物对III、引物对IV、引物对V、引物对VI、引物对VII和引物对VIII组成;所述引物对I由引物FMDV-F和引物FMDV-R组成;所述引物FMDV-F为如下(a1)或(a2)或(a3):(a1)序列表的序列1所示的单链DNA分子;(a2)序列表的序列1自5′末端第19至36位核苷酸所示的单链DNA分子;(a3)将(a1)或(a2)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物FMDV-R为如下(a4)或(a5)或(a6):(a4)序列表的序列2所示的单链DNA分子;(a5)序列表的序列2自5′末端第20至43位核苷酸所示的单链DNA分子;(a6)将(a4)或(a5)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物对II由引物BTV-F和引物BTV-R组成;所述引物BTV-F为如下(a7)或(a8)或(a9):(a7)序列表的序列3所示的单链DNA分子;(a8)序列表的序列3自5′末端第19至41位核苷酸所示的单链DNA分子;(a9)将(a7)或(a8)经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的DNA分子;所述引物BTV-R为如下(a10)或(a11)或(a12):(a10)序列表的序列4所示的单链DNA分子;(a11)序列表的序列4自5′末端第20至37位核苷酸所示的单链DNA分子;(a12)将(a10)或(a11)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物对III由引物VSV-F和引物VSV-R组成;所述引物VSV-F为如下(a13)或(a14)或(a15):(a13)序列表的序列5所示的单链DNA分子;(a14)序列表的序列5自5′末端第19至38位核苷酸所示的单链DNA分子;(a15)将(a13)或(a14)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物VSV-R为如下(a16)或(a17)或(a18):(a16)序列表的序列6所示的单链DNA分子;(a17)序列表的序列6自5′末端第20至38位核苷酸所示的单链DNA分子;(a18)将(a16)或(a17)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物对IV由引物BVDV-F和引物BVDV-R组成;所述引物BVDV-F为如下(a19)或(a20)或(a21):(a19)序列表的序列7所示的单链DNA分子;(a20)序列表的序列7自5′末端第19至36位核苷酸所示的单链DNA分子;(a21)将(a19)或(a20)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物BVDV-R为如下(a22)或(a23)或(a24):(a22)序列表的序列8所示的单链DNA分子;(a23)序列表的序列8自5′末端第20至44位核苷酸所示的单链DNA分子;(a24)将(a22)或(a23)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物对V由引物BRV-F和引物BRV-R组成;所述引物BRV-F为如下(a25)或(a26)或(a27):(a25)序列表的序列9所示的单链DNA分子;(a26)序列表的序列9自5′末端第19至40位核苷酸所示的单链DNA分子;(a27)将(a25)或(a26)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物BRV-R为如下(a28)或(a29)或(a30):(a28)序列表的序列10所示的单链DNA分子;(a29)序列表的序列10自5′末端第20至37位核苷酸所示的单链DNA分子;(a30)将(a28)或(a29)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物对VI由引物ETEC-F和引物ETEC-R组成:所述引物ETEC-F为如下(a31)或(a32)或(a33):(a31)序列表的序列11所示的单链DNA分子;(a32)序列表的序列11自5′末端第19至36位核苷酸所示的单链DNA分子;(a33)将(a31)或(a32)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物ETEC-R为如下(a34)或(a35)或(a36):(a34)序列表的序列12所示的单链DNA分子;(a35)序列表的序列12自5′末端第20至40位核苷酸所示的单链DNA分子;(a36)将(a34)或(a35)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物对VII由引物IBRV-F和引物IBRV-R组成;所述引物IBRV-F为如下(a37)或(a38)或(a39):(a37)序列表的序列13所示的单链DNA分子;(a38)序列表的序列13自5′末端第19至41位核苷酸所示的单链DNA分子;(a39)将(a37)或(a38)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物IBRV-R为如下(a40)或(a41)或(a42):(a40)序列表的序列14所示的单链DNA分子;(a41)序列表的序列14自5′末端第20至36位核苷酸所示的单链DNA分子;(a42)将(a40)或(a41)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物对VIII由引物PPRV-F和引物PPRV-R组成:所述引物PPRV-F为如下(a43)或(a44)或(a45):(a43)序列表的序列15所示的单链DNA分子;(a44)序列表的序列15自5′末端第19至44位核苷酸所示的单链DNA分子;(a45)将(a43)或(a44)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子;所述引物PPRV-R为如下(a46)或(a47)或(a48):(a46)序列表的序列16所示的单链DNA分子;(a47)序列表的序列16自5′末端第20至36位核苷酸所示的单链DNA分子;(a48)将(a46)或(a47)经过一个或几个核苷酸的取代和/或缺失和/或添加且具有相同功能的DNA分子。所述引物组合的用途为如下(b1)至(b6)中的任意一种:(b1)鉴别8种牛病原体;(b2)制备用于鉴别8种牛病原体的试剂盒;(b3)检测待测病原体是否为口蹄疫病毒、蓝舌病病毒、水泡性口炎病毒、牛病毒性腹泻病毒、牛轮状病毒、产肠毒素大肠杆菌、牛传染性鼻气管炎病毒或小反刍兽疫病毒;(b4)制备用于检测待测病原体是否为口蹄疫病毒、蓝舌病病毒、水泡性口炎病毒、牛病毒性腹泻病毒、牛轮状病毒、产肠毒素大肠杆菌、牛传染性鼻气管炎病毒或小反刍兽疫病毒的试剂盒;(b5)检测待测样本中是否含有口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒;(b6)制备用于检测待测样本中是否含有口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒的试剂盒。本发明还保护所述引物组合的应用,为如下(b1)至(b6)中的任意一种:(b1)鉴别8种牛病原体;(b2)制备用于鉴别8种牛病原体的试剂盒;(b3)检测待测病原体是否为口蹄疫病毒、蓝舌病病毒、水泡性口炎病毒、牛病毒性腹泻病毒、牛轮状病毒、产肠毒素大肠杆菌、牛传染性鼻气管炎病毒或小反刍兽疫病毒;(b4)制备用于检测待测病原体是否为口蹄疫病毒、蓝舌病病毒、水泡性口炎病毒、牛病毒性腹泻病毒、牛轮状病毒、产肠毒素大肠杆菌、牛传染性鼻气管炎病毒或小反刍兽疫病毒的试剂盒;(b5)检测待测样本中是否含有口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒;(b6)制备用于检测待测样本中是否含有口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒的试剂盒。本发明还保护含有所述引物组合的试剂盒;所述试剂盒的用途为如下(c1)或(c2)或(c3):(c1)鉴别8种牛病原体;(c2)检测待测病原体是否为口蹄疫病毒、蓝舌病病毒、水泡性口炎病毒、牛病毒性腹泻病毒、牛轮状病毒、产肠毒素大肠杆菌、牛传染性鼻气管炎病毒或小反刍兽疫病毒;(c3)检测待测样本中是否含有口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒。本发明还保护所述试剂盒的制备方法,包括将各条引物单独包装的步骤。本发明还保护一种鉴别8种牛病原体的方法,包括如下步骤(d1)或(d2):(d1)将待测病原体的核酸进行反转录,得到DNA模板,采用所述引物组合进行PCR扩增(具体可进行6eXP多重PCR扩增;扩增产物可进行毛细管电泳检测),如果扩增产物含有165-167bp的DNA片段、待测病原体为或候选为口蹄疫病毒,如果扩增产物含有135-137bp的DNA片段、待测病原体为或候选为蓝舌病病毒,如果扩增产物含有278-281bp的DNA片段、待测病原体为或候选为水泡性口炎病毒,如果扩增产物含有308-310bp的DNA片段、待测病原体为或候选为牛病毒性腹泻病毒,如果扩增产物含有211-214bp的DNA片段、待测病原体为或候选为牛轮状病毒,如果扩增产物含有342-345bp的DNA片段、待测病原体为或候选为小反刍兽疫病毒,如果扩增产物含有252-254bp的DNA片段、待测病原体为或候选为产肠毒素大肠杆菌,如果扩增产物含有187-189bp的DNA片段、待测病原体为或候选为牛传染性鼻气管炎病毒;(d2)检测待病原体的基因组DNA或cDNA中是否含有所述引物对I的靶序列、所述引物对II的靶序列、所述引物对III的靶序列、所述引物对IV的靶序列、所述引物对V的靶序列、所述引物对VI的靶序列、所述引物对VII的靶序列或所述引物对VIII的靶序列,如果所述cDNA中含有所述引物对I的靶序列、待测病原体为或候选为口蹄疫病毒,如果所述cDNA中含有所述引物对II的靶序列、待测病原体为或候选为蓝舌病病毒,如果所述cDNA中含有所述引物对III的靶序列、待测病原体为或候选为水泡性口炎病毒,如果所述cDNA中含有所述引物对IV的靶序列、待测病原体为或候选为牛病毒性腹泻病毒,如果所述cDNA中含有所述引物对V的靶序列、待测病原体为或候选为牛轮状病毒,如果所述基因组DNA中含有所述引物对VI的靶序列、待测病原体为或候选为产肠毒素大肠杆菌,如果所述cDNA中含有所述引物对VII的靶序列、待测病原体为或候选为牛传染性鼻气管炎病毒,如果所述cDNA中含有所述引物对VIII的靶序列、待测病原体为或候选为小反刍兽疫病毒。所述待测病原体的核酸的制备方法具体如下:将待测病原体进行基因组DNA提取操作和RNA提取操作(可在同一体系中进行也可分别进行后混合),得到核酸溶液。本发明还保护一种检测待测病原体是否为口蹄疫病毒、蓝舌病病毒、水泡性口炎病毒、牛病毒性腹泻病毒、牛轮状病毒、产肠毒素大肠杆菌、牛传染性鼻气管炎病毒或小反刍兽疫病毒的方法,包括如下步骤(e1)或(e2):(e1)将待测病原体的核酸进行反转录,得到DNA模板,采用所述引物组合进行PCR扩增(具体可进行6eXP多重PCR扩增;扩增产物可进行毛细管电泳检测),如果扩增产物含有165-167bp的DNA片段、待测病原体为或候选为口蹄疫病毒,如果扩增产物含有135-137bp的DNA片段、待测病原体为或候选为蓝舌病病毒,如果扩增产物含有278-281bp的DNA片段、待测病原体为或候选为水泡性口炎病毒,如果扩增产物含有308-310bp的DNA片段、待测病原体为或候选为牛病毒性腹泻病毒,如果扩增产物含有211-214bp的DNA片段、待测病原体为或候选为牛轮状病毒,如果扩增产物含有342-345bp的DNA片段、待测病原体为或候选为小反刍兽疫病毒,如果扩增产物含有252-254bp的DNA片段、待测病原体为或候选为产肠毒素大肠杆菌,如果扩增产物含有187-189bp的DNA片段、待测病原体为或候选为牛传染性鼻气管炎病毒;(e2)检测待病原体的基因组DNA或cDNA中是否含有所述引物对I的靶序列、所述引物对II的靶序列、所述引物对III的靶序列、所述引物对IV的靶序列、所述引物对V的靶序列、所述引物对VI的靶序列、所述引物对VII的靶序列或所述引物对VIII的靶序列,如果所述cDNA中含有所述引物对I的靶序列、待测病原体为或候选为口蹄疫病毒,如果所述cDNA中含有所述引物对II的靶序列、待测病原体为或候选为蓝舌病病毒,如果所述cDNA中含有所述引物对III的靶序列、待测病原体为或候选为水泡性口炎病毒,如果所述cDNA中含有所述引物对IV的靶序列、待测病原体为或候选为牛病毒性腹泻病毒,如果所述cDNA中含有所述引物对V的靶序列、待测病原体为或候选为牛轮状病毒,如果所述基因组DNA中含有所述引物对VI的靶序列、待测病原体为或候选为产肠毒素大肠杆菌,如果所述cDNA中含有所述引物对VII的靶序列、待测病原体为或候选为牛传染性鼻气管炎病毒,如果所述cDNA中含有所述引物对VIII的靶序列、待测病原体为或候选为小反刍兽疫病毒。本发明还保护一种检测待测样本中是否含有口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒的方法,包括如下步骤(f1)或(f2):(f1)将待测样本的核酸进行反转录,得到DNA模板,采用所述引物组合进行PCR扩增(具体可进行GeXP多重PCR扩增;扩增产物可进行毛细管电泳检测),如果扩增产物含有165-167bp的DNA片段、待测样本含有或疑似含有口蹄疫病毒,如果扩增产物含有135-137bp的DNA片段、待测样本含有或疑似含有蓝舌病病毒,如果扩增产物含有278-281bp的DNA片段、待测样本含有或疑似含有水泡性口炎病毒,如果扩增产物含有308-310bp的DNA片段、待测样本含有或疑似含有牛病毒性腹泻病毒,如果扩增产物含有211-214bp的DNA片段、待测样本含有或疑似含有牛轮状病毒,如果扩增产物含有342-345bp的DNA片段、待测样本含有或疑似含有小反刍兽疫病毒,如果扩增产物含有252-254bp的DNA片段、待测样本含有或疑似含有产肠毒素大肠杆菌,如果扩增产物含有187-189bp的DNA片段、待测样本含有或疑似含有牛传染性鼻气管炎病毒;(f2)检测待测样本的基因组DNA或cDNA中是否含有所述引物对I的靶序列、所述引物对II的靶序列、所述引物对III的靶序列、所述引物对IV的靶序列、所述引物对V的靶序列、所述引物对VI的靶序列、所述引物对VII的靶序列或所述引物对VIII的靶序列,如果所述cDNA中含有所述引物对I的靶序列、待测样本含有或疑似含有口蹄疫病毒,如果所述cDNA中含有所述所述引物对II的靶序列、待测样本含有或疑似含有蓝舌病病毒,如果所述cDNA中含有所述所述引物对III的靶序列、待测样本含有或疑似含有水泡性口炎病毒,如果所述cDNA中含有所述所述引物对IV的靶序列、待测样本含有或疑似含有牛病毒性腹泻病毒,如果所述cDNA中含有所述所述引物对V的靶序列、待测样本含有或疑似含有牛轮状病毒,如果基因组DNA含有所述引物对VI的靶序列、待测样本含有或疑似含有产肠毒素大肠杆菌,如果所述cDNA中含有所述引物对VII的靶序列、待测样本含有或疑似含有牛传染性鼻气管炎病毒,如果所述cDNA中含有所述引物对VIII的靶序列、待测样本含有或疑似含有小反刍兽疫病毒。本发明还保护引物组合,为如下(g1)或(g2):(g1)所述引物对I或所述引物对II或所述引物对III或所述引物对IV或所述引物对V或所述引物对VI或所述引物对VII或所述引物对VIII;(g2)所述引物对I、所述引物对II、所述引物对III、所述引物对IV、所述引物对V、所述引物对VI、所述引物对VII和所述引物对VIII中的任意两个引物对的组合、任意三个引物对的组合、任意四个引物对的组合、任意五个引物对的组合、任意六个引物对的组合或任意七个引物对的组合。所述引物组合的用途为鉴别口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒。本发明还保护所述引物组合的应用,为鉴别口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒。本发明还保护含有所述引物组合的试剂盒;所述试剂盒的用途为鉴别口蹄疫病毒和/或蓝舌病病毒和/或水泡性口炎病毒和/或牛病毒性腹泻病毒和/或牛轮状病毒和/或产肠毒素大肠杆菌和/或牛传染性鼻气管炎病毒和/或小反刍兽疫病毒。以上任一所待测病原体的核酸的制备方法或待测样本的核酸的制备方法具体如下:将待测病原体进行基因组DNA提取操作和RNA提取操作(可在同一体系中进行也可分别进行后混合),得到核酸溶液。以上任一所述8种牛病原体为口蹄疫病毒、蓝舌病病毒、水泡性口炎病毒、牛病毒性腹泻病毒、牛轮状病毒、产肠毒素大肠杆菌、牛传染性鼻气管炎病毒和小反刍兽疫病毒。以上任一所述待测病原体具体可为FMDVO型灭活病毒、FMDVA型灭活病毒、FMDVAsiaI型灭活病毒、VSVNJ型灭活病毒、VSVIND型灭活病毒、BTV4型灭活病毒、BTV8型灭活病毒、BTV9型灭活病毒、BTV15型灭活病毒、BTV17型灭活病毒、BTV18型灭活病毒、PPRV疫苗株、BVDV参考毒株OregonCV24株(BVDV-1型)、BVDV参考毒株NADL株(BVDV-1型)、BVDV参考毒株牦牛株(BVDV-1型)、BRV参考毒株NCDV、BRV参考毒株BRVO14、IBRV病毒、ETEC参考株1676、ETEC参考株1751、ETEC参考株B41、BVDV毒株GX-BVDV1、BVDV毒株GX-BVDV2、BVDV毒株GX-BVDV3、BVDV毒株GX-BVDV4、BVDV毒株GX-BVDV5、BVDV毒株GX-BVDV6、BVDV毒株GX-BVDV7、BVDV毒株GX-BVDV8、BVDV毒株GX-BVDV9、BVDV毒株GX-BVDV10、BVDV毒株GX-BVDV11、BVDV毒株GX-BVDV12、BVDV毒株GX-BVDV13、BVDV毒株GX-041、BRV毒株GX-BRV-1、BRV毒株GX-BRV-2、BRV毒株GX-BRV-3、BRV毒株GX-BRV-4、BRV毒株GX-BRV-5、BRV毒株GX-BRV-6、BRV毒株GX-BRV-7或BRV毒株GX-BRV-8。以上任一所述“所述引物对I的靶序列”具体可为如下(h1)或(h2)或(h3):(h1)序列表的序列27所示的DNA分子;(h1)序列表的序列27自5′末端第19至146位核苷酸所示的DNA分子;(h3)与(h1)或(h2)具有98%以上同源性的DNA分子。以上任一所述“所述引物对II的靶序列”具体可为如下(h4)或(h5)或(h6):(h4)序列表的序列28所示的DNA分子;(h5)序列表的序列28自5′末端第19至117位核苷酸所示的DNA分子;(h6)与(h4)或(h5)具有98%以上同源性的DNA分子。以上任一所述“所述引物对III的靶序列”具体可为如下(h7)或(h8)或(h9):(h7)序列表的序列29所示的DNA分子;(h8)序列表的序列29自5′末端第19至259位核苷酸所示的DNA分子;(h9)与(h7)或(h8)具有98%以上同源性的DNA分子。以上任一所述“所述引物对IV的靶序列”具体可为如下(h10)或(h11)或(h12):(h10)序列表的序列30所示的DNA分子;(h11)序列表的序列30自5′末端第19至289位核苷酸所示的DNA分子;(h12)与(h10)或(h11)具有98%以上同源性的DNA分子。以上任一所述“所述引物对V的靶序列”具体可为如下(h13)或(h14)或(h15):(h13)序列表的序列31所示的DNA分子;(h14)序列表的序列31自5′末端第19至192位核苷酸所示的DNA分子;(h15)与(h13)或(h14)具有98%以上同源性的DNA分子。以上任一所述“所述引物对VIII的靶序列”具体可为如下(h16)或(h17)或(h18):(h16)序列表的序列32所示的DNA分子;(h17)序列表的序列32自5′末端第19至325位核苷酸所示的DNA分子;(h18)与(h16)或(h17)具有98%以上同源性的DNA分子。以上任一所述“所述引物对VI的靶序列”具体可为如下(h19)或(h20)或(h21):(h19)序列表的序列33所示的DNA分子;(h20)序列表的序列33自5′末端第19至234位核苷酸所示的DNA分子;(h21)与(h19)或(h20)具有98%以上同源性的DNA分子。以上任一所述“所述引物对VII的靶序列”具体可为如下(h22)或(h23)或(h24):(h22)序列表的序列34所示的DNA分子;(h23)序列表的序列34自5′末端第19至169位核苷酸所示的DNA分子;(h24)与(h22)或(h23)具有98%以上同源性的DNA分子。以上任一所述待测样本具体可为粪便拭子、眼试子、鼻粘液拭子、抗凝血、OP液(食道-咽部分泌物)、水泡液、直肠黏膜组织样本、水泡皮组织样本或淋巴结组织样本。以上任一所述GeXP多重PCR扩增的反应体系中,引物组合中的各条引物的浓度如下:FMDV-F和FMDV-R的浓度均为0.2μmol/μL,BTV-F和BTV-R的浓度均为0.2μmol/μL,VSV-F和VSV-R的浓度均为0.2μmol/μL,BVDV-F和BVDV-R的浓度均为2μmol/μL,BRV-F和BRV-R的浓度均为0.2μmol/μL,ETEC-F和ETEC-R的浓度均为0.2μmol/μL,IBRV-F和IBRV-R的浓度均为0.2μmol/μL,PPRV-F和PPRV-R的浓度均为2μmol/μL。以上任一所述GeXP多重PCR扩增的反应体系(20μL)具体可为:模板1μL(10-100ng),GenomeLabGeXPStarterKit5×buffer4μL(buffer内含有通用引物,通用引物由序列表的序列25所示的引物A和序列表的序列26所示的引物B组成,其中引物A的5’末端具有CY5荧光基团的标记,引物A和引物B的工作浓度均为0.25μM),MgCl2(25μM)4μL,含有引物组合中的所有引物的引物混合物1μL,DNApolymerase10U,用超纯水补足至20μL。以上任一所述GeXP多重PCR扩增的反应程序具体可为:95℃5分钟预变性;94℃30秒,55℃30秒,72℃30秒,10个循环;94℃30秒,68℃30秒,72℃30秒,10个循环;94℃30秒,50℃30秒,72℃30秒,10个循环;72℃延伸5min,结束反应。以上任一所述毛细管电泳的电泳条件为:90℃120秒,变性;2.0KV30秒,吸入样品;6.0KV35分钟,分离样品。本发明建立的GeXP检测方法可以同时鉴别口蹄疫病毒、蓝舌病病毒、水泡性口炎病毒、牛病毒性腹泻病毒、牛轮状病毒、产肠毒素大肠杆菌、牛传染性鼻气管炎病毒和小反刍兽疫病毒8种牛传染病的病原体。本方法具有高通量、特异性和灵敏度较高的特点,可用于牛病流行病学的监测和突发疫情的鉴别诊断,保障养牛业的健康发展。附图说明图1为实施例2中各待测样本的多重PCR扩增结果图。图2为实施例2中8种牛病原体混合样本的多重PCR扩增结果图。图3为实施例5中采用反应体系1-5时多重PCR的扩增结果图。图4为实施例6中采用混合液A和混合液B为模板进行多重PCR的扩增结果图。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。由于GeXP本身系统的误差,扩增片断大小与理论值存在±2bp偏差均属于正确结果。FMDVO型灭活病毒、FMDVA型灭活病毒、FMDVAsiaI型灭活病毒、VSVNJ型灭活病毒、VSVIND型灭活病毒、BTV4型灭活病毒、BTV8型灭活病毒、BTV9型灭活病毒、BTV15型灭活病毒、BTV17型灭活病毒、BTV18型灭活病毒、PPRV疫苗株:参考文献:秦敏,邹丰才,杨云庆,等.蓝舌病、口蹄疫、小反刍兽疫和水泡性口炎多重PCR检测方法的建立[J].动物医学进展,2015,36(9):18-22.;由云南出入境检验检疫局惠赠,公众可从广西壮族自治区兽医研究所获得。BVDV参考毒株OregonCV24株(BVDV-1型):中国兽医药品监察所,货号:AV69。BVDV参考毒株NADL株(BVDV-1型):中国兽医药品监察所,货号:AV67。BVDV参考毒株牦牛株(BVDV-1型):中国兽医药品监察所,货号:AV68。BRV参考毒株NCDV:中国兽医药品监察所,货号:AV51。BRV参考毒株BRVO14:中国兽医药品监察所,货号:AV52。IBRV病毒:中国兽医微生物菌种保藏管理中心,货号:AV21。ETEC参考株1676:中国兽医药品监察所,货号:212。ETEC参考株1751:中国兽医药品监察所,货号:214。ETEC参考株B41:中国兽医药品监察所,货号:215。BVDV毒株GX-BVDV1、BVDV毒株GX-BVDV2、BVDV毒株GX-BVDV3、BVDV毒株GX-BVDV4、BVDV毒株GX-BVDV5、BVDV毒株GX-BVDV6、BVDV毒株GX-BVDV7、BVDV毒株GX-BVDV8、BVDV毒株GX-BVDV9、BVDV毒株GX-BVDV10、BVDV毒株GX-BVDV11、BVDV毒株GX-BVDV12、BVDV毒株GX-BVDV13、BVDV毒株GX-041:参考文献:FanQ,XieZ,XieL,etal.Areversetranscriptionloop-mediatedisothermalamplificationmethodforrapiddetectionofbovineviraldiarrheavirus[J].JournalofVirologicalMethods,2012,186(1-2):43-48.;公众可以从广西壮族自治区兽医研究所获得。BRV毒株GX-BRV-1、BRV毒株GX-BRV-2、BRV毒株GX-BRV-3、BRV毒株GX-BRV-4、BRV毒株GX-BRV-5、BRV毒株GX-BRV-6、BRV毒株GX-BRV-7、BRV毒株GX-BRV-8:参考文献:XieZ,FanQ,LiuJ,etal.Reversetranscriptionloop-mediatedisothermalamplificationassayforrapiddetectionofBovineRotavirus[J].BmcVeterinaryResearch,2012,8(1):451-452.;公众可以从广西壮族自治区兽医研究所获得。GenomeLabGeXPStarterKit5×buffer:其中含有序列表的序列25所示的引物A和序列表的序列26所示的引物B,其中引物A的5’末端具有CY5荧光基团的标记;美国贝克曼库尔特公司。样品缓冲液:美国贝克曼库尔特公司,货号:M409196。DNAsizestandardkit-400BasePairs:美国贝克曼库尔特公司产品,货号:608098。DNApolymerase:美国SIGMA公司,货号:D4184-1.5KU。MgCl2(25μM):美国SIGMA公司,货号:M8787-1.5ML。EasyPureViralDNA/RNAKit:北京全式金生物技术有限公司,货号:ER201-01。实施例1、引物组合的设计和制备进行大量序列分析、比对获得了用于鉴别FMDV、BTV、VSV、BVDV、BRV、ETEC、IBRV和PPRV8种牛病原体的若干引物。将各个引物进行预实验,比较灵敏度、特异性等性能,最终得到用于鉴别8种牛病原体的8对特异性引物。每个特异性引物对,正向引物和反向引物均由靶向区段和通用引物区段组成,通用引物区段位于靶向区段的5’端。用于鉴定FMDV的引物对由如下两条引物组成(5’→3’):FMDV-F(序列表的序列1):AGGTGACACTATAGAATAGCCGTGGGACCATACAGG;FMDV-R(序列表的序列2):GTACGACTCACTATAGGGAAAGTGATCTGTAGCTTGGAATCTC。下划线部分为通用引物区段。用于鉴定BTV的引物对由如下两条引物组成(5’→3’):BTV-F(序列表的序列3):AGGTGACACTATAGAATAAGGGTAACTCACAGCAAACTCAA;BTV-R(序列表的序列4):GTACGACTCACTATAGGGAGAGCAGCCTGTCCATCCC。下划线部分为通用引物区段。用于鉴定VSV的引物对由如下两条引物组成(5’→3’):VSV-F(序列表的序列5):AGGTGACACTATAGAATAAAACTACTGGACGGGCTTGA;VSV-R(序列表的序列6):GTACGACTCACTATAGGGATGAGATGCCCAAATGTTGC。下划线部分为通用引物区段。用于鉴定BVDV的引物对由如下两条引物组成(5’→3’):BVDV-F(序列表的序列7):AGGTGACACTATAGAATAGTGAGTTCGTTGGATGGC;BVDV-R(序列表的序列8):GTACGACTCACTATAGGGATATGTTTTGTATAAGAGTTCATTTG。下划线部分为通用引物区段。用于鉴定BRV的引物对由如下两条引物组成(5’→3’):BRV-F(序列表的序列9):AGGTGACACTATAGAATACAGTGGCTTCCATTAGAAGCAT;BRV-R(序列表的序列10):GTACGACTCACTATAGGGAGGTCACATCCTCTCACTA。下划线部分为通用引物区段。用于鉴定ETEC的引物对由如下两条引物组成(5’→3’):ETEC-F(序列表的序列11):AGGTGACACTATAGAATACTCAGGTGCGAAAGCGTG;ETEC-R(序列表的序列12):GTACGACTCACTATAGGGACGTTGCATCGAATTAAACCAC。下划线部分为通用引物区段。用于鉴定ETEC的引物对由如下两条引物组成(5’→3’):IBRV-F(序列表的序列13):AGGTGACACTATAGAATAGCGTCATTTACAAGGAGAACATC;IBRV-R(序列表的序列14):GTACGACTCACTATAGGGAATCTCGCCCATGCCCAC。下划线部分为通用引物区段。用于鉴定PPRV的引物对由如下两条引物组成(5’→3’):PPRV-F(序列表的序列15):AGGTGACACTATAGAATATGGTTTGAGAACAGAGAAATAATAGA;PPRV-R(序列表的序列16):GTACGACTCACTATAGGGAGCTTGTTGCCGGGGGTC。下划线部分为通用引物区段。用于鉴定FMDV的引物对命名为引物对I。用于鉴定BTV的引物对命名为引物对II。用于鉴定VSV的引物对命名为引物对III。用于鉴定BVDV的引物对命名为引物对IV。用于鉴定BRV的引物对命名为引物对V。用于鉴定ETEC的引物对命名为引物对VI。用于鉴定IBRV的引物对命名为引物对VII。用于鉴定PPRV的引物对命名为引物对VIII。上述各引物对组成引物组合。实施例2、特异性一、单一模板实验1、提取待测样本的总RNA,并反转录为cDNA。待测样本分别为:FMDVO型灭活病毒、BTV4型灭活病毒、VSVNJ型灭活病毒、BVDV参考毒株OregonCV24株(BVDV-1型)、BRV参考毒株NCDV、PPRV疫苗株、IBRV病毒。2、提取待测样本的基因组DNA。待测样本分别为ETEC参考株1676。3、分别以步骤1得到的cDNA和步骤2得到的基因组DNA为模板,采用实施例1的引物组合进行GeXP多重PCR。多重PCR的反应体系(20μL):模板1μL,GenomeLabGeXPStarterKit5×buffer4μL(buffer内含有通用引物,通用引物由序列表的序列25所示的引物A和序列表的序列26所示的引物B组成,其中引物A的5’末端具有CY5荧光基团的标记,引物A和引物B的工作浓度均为0.25μM),MgCl2(25μM)4μL,含有引物组合中的所有引物的引物混合物1μL,DNApolymerase10U,用超纯水补足至20μL。多重PCR的反应体系中,FMDV-F和FMDV-R的浓度均为0.2μmol/μL,BTV-F和BTV-R的浓度均为0.2μmol/μL,VSV-F和VSV-R的浓度均为0.2μmol/μL,BVDV-F和BVDV-R的浓度均为2μmol/μL,BRV-F和BRV-R的浓度均为0.2μmol/μL,ETEC-F和ETEC-R的浓度均为0.2μmol/μL,IBRV-F和IBRV-R的浓度均为0.2μmol/μL,PPRV-F和PPRV-R的浓度均为2μmol/μL。设置用等体积水作为模板的阴性对照。模板为步骤1得到的各个cDNA样本时,1μL模板中的DNA含量约100ng;模板为步骤2得到的基因组DNA样本时,1μL模板中的DNA含量约100ng;多重PCR的反应程序:95℃5分钟预变性;94℃30秒,55℃30秒,72℃30秒,10个循环;94℃30秒,68℃30秒,72℃30秒,10个循环;94℃30秒,50℃30秒,72℃30秒,10个循环;72℃延伸5min,结束反应。4、将步骤3的多重PCR扩增产物进行毛细管电泳,具体步骤为:将3μL多重PCR扩增产物、38.75μL样品缓冲液和0.25μLDNAsizestandardkit-400BasePairs漩涡震荡混匀,加入上样板中,每孔滴加1滴石蜡封闭液面,避免甲酰胺氧化和样品蒸发。在缓冲液板上每孔加入180μL的样品缓冲液,进行毛细管电泳。毛细管电泳条件:90℃120秒,变性;2.0KV30秒,吸入样品;6.0KV35分钟,分离样品。不同大小片段的PCR产物在电泳中分离,仪器通过检测PCR产物携带的荧光基团辨认其片段大小和信号强度。电泳完成后,使用仪器自带软件ExpressProfilersoftware分析结果。根据电泳结果进行判断,判断标准为:8种牛病原体目的基因的扩增片断大小分别为:FMDV:165-167bp,BTV:135-137bp,VSV:278-281bp,BVDV:308-310bp,BRV:211-214bp,PPRV:342-345bp,ETEC:252-254bp,IBRV:187-189bp。由于GeXP本身系统的误差,扩增片断大小与理论值存在±2bp偏差均属于正确结果。电泳结果如图1所示。图1中,横坐标表示片段大小(单位为bp),纵坐标表示信号强度,即PCR扩增产物的含量。图1A为FMDVO型灭活病毒cDNA的多重PCR扩增结果,扩增得到165.03bp的DNA片段。图1B为BTV4型灭活病毒cDNA的多重PCR扩增结果,扩增得到136.72bp的DNA片段。图1C为VSVNJ型灭活病毒cDNA的多重PCR扩增结果,扩增得到278.04bp的DNA片段。图1D为BVDV参考毒株OregonCV24株(BVDV-1型)cDNA的多重PCR扩增结果,扩增得到309.58bp的DNA片段。图1F为BRV参考毒株NCDVcDNA的多重PCR扩增结果,扩增得到211.71bp的DNA片段。图1F为PPRV疫苗株cDNA的多重PCR扩增结果,扩增得到344.20bp的DNA片段。图1G为ECTC菌株GX-ETEC1基因组DNA的多重PCR扩增结果,扩增得到252.24bp的DNA片段。图1H为IBRV病毒cDNA的多重PCR扩增结果,扩增得到188.21bp的DNA片段。每个反应只出现特异性单峰,无其它信号峰,且片段大小与判断标准相符。阴性对照均无扩增,无目的信号峰值。二、混合模板实验1、提取待测样本的总RNA,并反转录为cDNA。待测样本分别为:FMDVO型灭活病毒、BTV4型灭活病毒、VSVNJ型灭活病毒、BVDV参考毒株OregonCV24株(BVDV-1型)、BRV参考毒株NCDV、PPRV疫苗株、IBRV病毒。2、提取待测样本的基因组DNA。待测样本分别为ETEC参考株1676。3、将步骤1得到的7种cDNA、步骤2得到的1种基因组DNA混合。4、以步骤3得到的混合液为模板,采用实施例1的引物组合进行GeXP多重PCR。多重PCR的反应体系(20μL):模板1μL,GenomeLabGeXPStarterKit5×buffer4μL(buffer内含有通用引物,通用引物由序列表的序列25所示的引物A和序列表的序列26所示的引物B组成,其中引物A的5’末端具有CY5荧光基团的标记,引物A和引物B的工作浓度均为0.25μM),MgCl2(25μM)4μL,含有引物组合中的所有引物的引物混合物1μL,DNApolymerase10U,用超纯水补足至20μL。多重PCR的反应体系中,FMDV-F和FMDV-R的浓度均为0.2μmol/μL,BTV-F和BTV-R的浓度均为0.2μmol/μL,VSV-F和VSV-R的浓度均为0.2μmol/μL,BVDV-F和BVDV-R的浓度均为2μmol/μL,BRV-F和BRV-R的浓度均为0.2μmol/μL,ETEC-F和ETEC-R的浓度均为0.2μmol/μL,IBRV-F和IBRV-R的浓度均为0.2μmol/μL,PPRV-F和PPRV-R的浓度均为2μmol/μL。设置用等体积水作为模板的阴性对照。1μL模板中FMDVO型灭活病毒的cDNA为约100ng,BTV4型灭活病毒的cDNA为约100ng,VSVNJ型灭活病毒的cDNA为约100ng,BVDV参考毒株OregonCV24株(BVDV-1型)的cDNA为约100ng,BRV参考毒株NCDV的基因组DNA为约100ng,PPRV疫苗株的基因组DNA为约100ng,ECTC菌株GX-ETEC1的基因组DNA为约100ng,IBRV病毒的cDNA为约100ng。多重PCR的反应程序:95℃5分钟预变性;94℃30秒,55℃30秒,72℃30秒,10个循环;94℃30秒,68℃30秒,72℃30秒,10个循环;94℃30秒,50℃30秒,72℃30秒,10个循环;72℃延伸5min,结束反应。5、将步骤4的多重PCR扩增产物进行毛细管电泳,具体步骤为:将3μL多重PCR扩增产物、38.75μL样品缓冲液和0.25μLDNAsizestandardkit-400BasePairs漩涡震荡混匀,加入上样板中,每孔滴加1滴石蜡封闭液面,避免甲酰胺氧化和样品蒸发。在缓冲液板上每孔加入180μL的样品缓冲液,进行毛细管电泳。毛细管电泳条件:90℃120秒,变性;2.0KV30秒,吸入样品;6.0KV35分钟,分离样品。不同大小片段的PCR产物在电泳中分离,仪器通过检测PCR产物携带的荧光基团辨认其片段大小和信号强度。电泳完成后,使用仪器自带软件ExpressProfilersoftware分析结果。根据电泳结果进行判断,判断标准为:8种牛病原体目的基因的扩增片断大小分别为FMDV:165-167bp,BTV:135-137bp,VSV:278-281bp,BVDV:308-310bp,BRV:211-214bp,PPRV:342-345bp,ETEC:252-254bp,IBRV:187-189bp。检测结果如图2所示。图2中,横坐标表示片段大小(单位为bp),纵坐标表示信号强度,即PCR扩增产物的含量。结果表明,使用GeXP多重PCR可以同时检测出8种病原体对应的8种信号峰,FMDV:166.39bp,BTV:136.17bp,VSV:280.40bp,BVDV:309.59bp,BRV:213.71bp,PPRV:342.16bp,ETEC:253.23bp,IBRV:187.25bp,无其它杂峰。阴性对照均无扩增,无目的信号峰值。实施例3、普适性1、提取待测样本的总RNA,并反转录为cDNA。待测样本分别为:FMDVO型灭活病毒、FMDVA型灭活病毒、FMDVAsiaI型灭活病毒、BTV4型灭活病毒、BTV8型灭活病毒、BTV9型灭活病毒、BTV15型灭活病毒、BTV17型灭活病毒、BTV18型灭活病毒、VSVNJ型灭活病毒、VSVIND型灭活病毒、BVDV参考毒株OregonCV24株(BVDV-1型)、BVDV参考毒株NADL株(BVDV-1型)、BVDV参考毒株牦牛株(BVDV-1型)、BVDV毒株GX-BVDV1、BVDV毒株GX-BVDV2、BVDV毒株GX-BVDV3、BVDV毒株GX-BVDV4、BVDV毒株GX-BVDV5、BVDV毒株GX-BVDV6、BVDV毒株GX-BVDV7、BVDV毒株GX-BVDV8、BVDV毒株GX-BVDV9、BVDV毒株GX-BVDV10、BVDV毒株GX-BVDV11、BVDV毒株GX-BVDV12、BVDV毒株GX-BVDV13、BVDV毒株GX-041、BRV参考毒株NCDV、BRV参考毒株BRV014、BRV毒株GX-BRV-1、BRV毒株GX-BRV-2、BRV毒株GX-BRV-3、BRV毒株GX-BRV-4、BRV毒株GX-BRV-5、BRV毒株GX-BRV-6、BRV毒株GX-BRV-7、BRV毒株GX-BRV-8、PPRV疫苗株、IBRV病毒。2、提取待测样本的基因组DNA。待测样本分别为:ETEC参考株1676、ETEC参考株1751、ETEC参考株B41。3、分别以步骤1得到的cDNA和步骤2得到的基因组DNA为模板,采用实施例1的引物组合进行GeXP多重PCR。多重PCR的反应体系(20μL):模板1μL,GenomeLabGeXPStarterKit5×buffer4μL(buffer内含有通用引物,通用引物由序列表的序列25所示的引物A和序列表的序列26所示的引物B组成,其中引物A的5’末端具有CY5荧光基团的标记,引物A和引物B的工作浓度均为0.25μM),MgCl2(25μM)4μL,含有引物组合中的所有引物的引物混合物1μL,DNApolymerase10U,用超纯水补足至20μL。多重PCR的反应体系中,FMDV-F和FMDV-R的浓度均为0.2μmol/μL,BTV-F和BTV-R的浓度均为0.2μmol/μL,VSV-F和VSV-R的浓度均为0.2μmol/μL,BVDV-F和BVDV-R的浓度均为2μmol/μL,BRV-F和BRV-R的浓度均为0.2μmol/μL,ETEC-F和ETEC-R的浓度均为0.2μmol/μL,IBRV-F和IBRV-R的浓度均为0.2μmol/μL,PPRV-F和PPRV-R的浓度均为2μmol/μL。设置用等体积水作为模板的阴性对照。模板为步骤1得到的各个cDNA样本时,1μL模板中的DNA含量约100ng;模板为步骤2得到的各个基因组DNA样本时,1μL模板中的DNA含量约100ng;多重PCR的反应程序:95℃5分钟预变性;94℃30秒,55℃30秒,72℃30秒,10个循环;94℃30秒,68℃30秒,72℃30秒,10个循环;94℃30秒,50℃30秒,72℃30秒,10个循环;72℃延伸5min,结束反应。4、将步骤3的多重PCR扩增产物进行毛细管电泳,具体步骤为:将3μL多重PCR扩增产物、38.75μL样品缓冲液和0.25μLDNAsizestandardkit-400BasePairs漩涡震荡混匀,加入上样板中,每孔滴加1滴石蜡封闭液面,避免甲酰胺氧化和样品蒸发。在缓冲液板上每孔加入180μL的样品缓冲液,进行毛细管电泳。毛细管电泳条件:90℃120秒,变性;2.0KV30秒,吸入样品;6.0KV35分钟,分离样品。不同大小片段的PCR产物在电泳中分离,仪器通过检测PCR产物携带的荧光基团辨认其片段大小和信号强度。电泳完成后,使用仪器自带软件ExpressProfilersoftware分析结果。根据电泳结果进行判断,判断标准为:8种牛病原体目的基因的扩增片断大小分别为FMDV:165-167bp,BTV:135-137bp,VSV:278-281bp,BVDV:308-310bp,BRV:211-214bp,PPRV:342-345bp,ETEC:252-254bp,IBRV:187-189bp。由于GeXP本身系统的误差,扩增片断大小与理论值存在±2bp偏差均属于正确结果。采用实施例1的引物组合对待测样本进行多重PCR扩增,每个样本只出现对应病原体的特异性单峰,无其他信号峰,且片段大小与判断标准相符,结果表明,实施例1设计的引物组合普遍适用于8种牛病原体。实施例4、质粒标准品制备FMDV标准品:将序列表的序列17所示的双链DNA分子与pMD-18T载体连接,得到重组质粒(命名为FMDV标准品)。BTV标准品:将序列表的序列18所示的双链DNA分子与pMD-18T载体连接,得到重组质粒(命名为BTV标准品)。VSV标准品:将序列表的序列19所示的双链DNA分子与pMD-18T载体连接,得到重组质粒(命名为VSV标准品)。BVDV标准品:将序列表的序列20所示的双链DNA分子与pMD-18T载体连接,得到重组质粒(命名为BVDV标准品)。BRV标准品:将序列表的序列21所示的双链DNA分子与pMD-18T载体连接,得到重组质粒(命名为BRV标准品)。PPRV标准品:将序列表的序列22所示的双链DNA分子与pMD-18T载体连接,得到重组质粒(命名为PPRV标准品)。ETEC标准品:将序列表的序列23所示的双链DNA分子与pMD-18T载体连接,得到重组质粒(命名为ETEC标准品)。IBRV标准品:将序列表的序列24所示的双链DNA分子与pMD-18T载体连接,得到重组质粒(命名为IBRV标准品)。实施例5、敏感性1、将实施例4制备的FMDV标准品、BTV标准品、VSV标准品、BVDV标准品、BRV标准品、ETEC标准品、IBRV标准品和PPRV标准品等拷贝数混合,得到混合液。2、用ddH2O10倍梯度稀释步骤2得到的混合液,得到各个稀释液。3、将步骤2得到的稀释液作为模板,采用实施例1制备的引物组合进行GeXP多重PCR。多重PCR的反应体系(20μL):模板1μL,GenomeLabGeXPStarterKit5×buffer4μL(buffer内含有通用引物,通用引物由序列表的序列25所示的引物A和序列表的序列26所示的引物B组成,其中引物A的5’末端具有CY5荧光基团的标记,引物A和引物B的工作浓度均为0.25μM),MgCl2(25μM)4μL,含有引物组合中的所有引物的引物混合物1μL,DNApolymerase10U,用超纯水补足至20μL。多重PCR的反应体系中,FMDV-F和FMDV-R的浓度均为0.2μmol/μL,BTV-F和BTV-R的浓度均为0.2μmol/μL,VSV-F和VSV-R的浓度均为0.2μmol/μL,BVDV-F和BVDV-R的浓度均为2μmol/μL,BRV-F和BRV-R的浓度均为0.2μmol/μL,ETEC-F和ETEC-R的浓度均为0.2μmol/μL,IBRV-F和IBRV-R的浓度均为0.2μmol/μL,PPRV-F和PPRV-R的浓度均为2μmol/μL。设置用等体积水作为模板的阴性对照。由于采用的稀释液的稀释度不同,形成如下不同的反应体系:反应体系1中,FMDV标准品、BTV标准品、VSV标准品、BVDV标准品、BRV标准品、ETEC标准品、IBRV标准品和PPRV标准品的初始浓度均为106拷贝/μL;反应体系2中,FMDV标准品、BTV标准品、VSV标准品、BVDV标准品、BRV标准品、ETEC标准品、IBRV标准品和PPRV标准品的初始浓度均为105拷贝/μL;反应体系3中,FMDV标准品、BTV标准品、VSV标准品、BVDV标准品、BRV标准品、ETEC标准品、IBRV标准品和PPRV标准品的初始浓度均为104拷贝/μL;反应体系4中,FMDV标准品、BTV标准品、VSV标准品、BVDV标准品、BRV标准品、ETEC标准品、IBRV标准品和PPRV标准品的初始浓度均为103拷贝/μL;反应体系5中,FMDV标准品、BTV标准品、VSV标准品、BVDV标准品、BRV标准品、ETEC标准品、IBRV标准品和PPRV标准品的初始浓度均为102拷贝/μL;反应体系6中,FMDV标准品、BTV标准品、VSV标准品、BVDV标准品、BRV标准品、ETEC标准品、IBRV标准品和PPRV标准品的初始浓度均为10拷贝/μL;反应体系7中,FMDV标准品、BTV标准品、VSV标准品、BVDV标准品、BRV标准品、ETEC标准品、IBRV标准品和PPRV标准品的初始浓度均为1拷贝/μL。多重PCR的反应程序:95℃5分钟预变性;94℃30秒,55℃30秒,72℃30秒,10个循环;94℃30秒,68℃30秒,72℃30秒,10个循环;94℃30秒,50℃30秒,72℃30秒,10个循环;72℃延伸5min,结束反应。4、将步骤3的多重PCR扩增产物进行毛细管电泳,具体步骤为:将3μL多重PCR扩增产物、38.75μL样品缓冲液和0.25μLDNAsizestandardkit-400BasePairs漩涡震荡混匀,加入上样板中,每孔滴加1滴石蜡封闭液面,避免甲酰胺氧化和样品蒸发。在缓冲液板上每孔加入180μL的样品缓冲液,进行毛细管电泳。毛细管电泳条件:90℃120秒,变性;2.0KV30秒,吸入样品;6.0KV35分钟,分离样品。不同大小片段的PCR产物在电泳中分离,仪器通过检测PCR产物携带的荧光基团辨认其片段大小和信号强度。电泳完成后,使用仪器自带软件ExpressProfilersoftware分析结果。根据电泳结果进行判断,判断标准为:8种牛病原体目的基因的扩增片断大小分别为FMDV:165-167bp,BTV:135-137bp,VSV:278-281bp,BVDV:308-310bp,BRV:211-214bp,PPRV:342-345bp,ETEC:252-254bp,IBRV:187-189bp。由于GeXP本身系统的误差,扩增片断大小与理论值存在±2bp偏差均属于正确结果。检测结果如图3所示。图3A-图3E依次对应采用反应体系1-5时多重PCR的扩增结果,图3中,横坐标表示片段大小(单位为bp),纵坐标表示信号强度,即PCR扩增产物的含量。结果表明,当检测体系中待测DNA的浓度低至100拷贝/μL时,也可以检测出8种病原体。实施例6、干扰性1、将实施例4制备的IBRV标准品、BRV标准品、ETEC标准品、BVDV标准品和PPRV标准品混合,得到混合液A。2、将实施例4制备的FMDV标准品、BTV标准品、IBRV标准品、BRV标准品和ETEC标准品混合,得到混合液B。3、分别以步骤1得到的混合液A和步骤2得到的混合液B作为模板,采用实施例1制备的引物组合进行GeXP多重PCR。多重PCR的反应体系(20μL):模板1μL,GenomeLabGeXPStarterKit5×buffer4μL(buffer内含有通用引物,通用引物由序列表的序列25所示的引物A和序列表的序列26所示的引物B组成,其中引物A的5’末端具有CY5荧光基团的标记,引物A和引物B的工作浓度均为0.25μM),MgCl2(25μM)4μL,含有引物组合中的所有引物的引物混合物1μL,DNApolymerase10U,用超纯水补足至20μL。多重PCR的反应体系中,FMDV-F和FMDV-R的浓度均为0.2μmol/μL,BTV-F和BTV-R的浓度均为0.2μmol/μL,VSV-F和VSV-R的浓度均为0.2μmol/μL,BVDV-F和BVDV-R的浓度均为2μmol/μL,BRV-F和BRV-R的浓度均为0.2μmol/μL,ETEC-F和ETEC-R的浓度均为0.2μmol/μL,IBRV-F和IBRV-R的浓度均为0.2μmol/μL,PPRV-F和PPRV-R的浓度均为2μmol/μL。设置用等体积水作为模板的阴性对照。以混合液A为模板时,反应体系中,IBRV标准品的浓度为103拷贝/μL,BRV标准品的浓度为105拷贝/μL,ETEC标准品的浓度为105拷贝/μL,BVDV标准品的浓度为105拷贝/μL,PPRV标准品的浓度为107拷贝/μL。以混合液B为模板时,反应体系中,FMDV标准品的浓度为104拷贝/μL,BTV标准品的浓度为108拷贝/μL,IBRV标准品的浓度为104拷贝/μL,BRV标准品的浓度为105拷贝/μL,ETEC标准品的浓度为105拷贝/μL。多重PCR的反应程序:95℃5分钟预变性;94℃30秒,55℃30秒,72℃30秒,10个循环;94℃30秒,68℃30秒,72℃30秒,10个循环;94℃30秒,50℃30秒,72℃30秒,10个循环;72℃延伸5min,结束反应。4、将步骤3的多重PCR扩增产物进行毛细管电泳,具体步骤为:将3μL多重PCR扩增产物、38.75μL样品缓冲液和0.25μLDNAsizestandardkit-400BasePairs漩涡震荡混匀,加入上样板中,每孔滴加1滴石蜡封闭液面,避免甲酰胺氧化和样品蒸发。在缓冲液板上每孔加入180μL的样品缓冲液,进行毛细管电泳。毛细管电泳条件:90℃120秒,变性;2.0KV30秒,吸入样品;6.0KV35分钟,分离样品。不同大小片段的PCR产物在电泳中分离,仪器通过检测PCR产物携带的荧光基团辨认其片段大小和信号强度。电泳完成后,使用仪器自带软件ExpressProfilersoftware分析结果。根据电泳结果进行判断,判断标准为:8种牛病原体目的基因的扩增片断大小分别为FMDV:165-167bp,BTV:135-137bp,VSV:278-281bp,BVDV:308-310bp,BRV:211-214bp,PPRV:342-345bp,ETEC:252-254bp,IBRV:187-189bp。由于GeXP本身系统的误差,扩增片断大小与理论值存在±2bp偏差均属于正确结果。检测结果如图4所示。图4中,横坐标表示片段大小(单位为bp),纵坐标表示信号强度,即PCR扩增产物的含量。图4A为采用混合液A为模板进行多重PCR的扩增结果,图4B为采用混合液B为模板进行多重PCR的扩增结果。结果表明,当反应体系中起始模板的浓度悬殊较大时,仍能准确敏感的检测出低浓度的模板,干扰性小。实施例7、临床样本检测待测样本为:305份临床样本,其中包括156份粪便拭子,30份眼试子,30份鼻粘液拭子,70份抗凝血,2份0P液(食道-咽部分泌物),2份水泡液,15份组织样品(10份直肠黏膜,2份水泡皮,3份淋巴结)。临床样品采集于2012-2014年广西各地,约1/2的样品来源于各地奶牛场无症状奶牛,约1/4的样品来源于具有腹泻,消瘦,流鼻涕等临床症状的牛,1/4样品来源于具有精神不撅,吞咽困难,发烧,口腔糜烂出现水泡,口鼻白沫的牛。1、使用EasyPureViralDNA/RNAKit提取待测样本的DNA/RNA,得到DNA/RNA混合溶液。2、将步骤1得到的DNA/RNA混合溶液反转录得到DNA/cDNA混合溶液。3、将步骤2得到的DNA/cDNA混合溶液作为模板,采用实施例1制备的引物组合进行进行GeXP多重PCR。多重PCR的反应体系(20μL):模板1μL(DNA含量为10-100ng),GenomeLabGeXPStarterKit5×buffer4μL(buffer内含有通用引物,通用引物由序列表的序列25所示的引物A和序列表的序列26所示的引物B组成,其中引物A的5’末端具有CY5荧光基团的标记,引物A和引物B的工作浓度均为0.25μM),MgCl2(25μM)4μL,含有引物组合中的所有引物的引物混合物1μL,DNApolymerase10U,用超纯水补足至20μL。多重PCR的反应体系中,FMDV-F和FMDV-R的浓度均为0.2μmol/μL,BTV-F和BTV-R的浓度均为0.2μmol/μL,VSV-F和VSV-R的浓度均为0.2μmol/μL,BVDV-F和BVDV-R的浓度均为2μmol/μL,BRV-F和BRV-R的浓度均为0.2μmol/μL,ETEC-F和ETEC-R的浓度均为0.2μmol/μL,IBRV-F和IBRV-R的浓度均为0.2μmol/μL,PPRV-F和PPRV-R的浓度均为2μmol/μL。设置用等体积水作为模板的阴性对照。多重PCR的反应程序:95℃5分钟预变性;94℃30秒,55℃30秒,72℃30秒,10个循环;94℃30秒,68℃30秒,72℃30秒,10个循环;94℃30秒,50℃30秒,72℃30秒,10个循环;72℃延伸5min,结束反应。4、将步骤3的多重PCR扩增产物进行毛细管电泳,具体步骤为:将3μL多重PCR扩增产物、38.75μL样品缓冲液和0.25μLDNAsizestandardkit-400BasePairs漩涡震荡混匀,加入上样板中,每孔滴加1滴石蜡封闭液面,避免甲酰胺氧化和样品蒸发。在缓冲液板上每孔加入180μL的样品缓冲液,进行毛细管电泳。毛细管电泳条件:90℃120秒,变性;2.0KV30秒,吸入样品;6.0KV35分钟,分离样品。不同大小片段的PCR产物在电泳中分离,仪器通过检测PCR产物携带的荧光基团辨认其片段大小和信号强度。电泳完成后,使用仪器自带软件ExpressProfilersoftware分析结果。根据电泳结果进行判断,判断标准为:8种牛病原体目的基因的扩增片断大小分别为FMDV:165-167bp,BTV:135-137bp,VSV:278-281bp,BVDV:308-310bp,BRV:211-214bp,PPRV:342-345bp,ETEC:252-254bp,IBRV:187-189bp。由于GeXP本身系统的误差,扩增片断大小与理论值存在±2bp偏差均属于正确结果。5、将步骤4得到的阳性扩增产物进行测序以验证结果的正确性。检测结果如表1所示。表1临床样本检测结果统计病原体GeXP多重PCR阳性数目测序阳性数目阳性结果样本占总样本的比例FMDV662.0%BTV323210.5%VSV000%BVDV414113.4%BRV882.6%ETEC555518.0%IBRV441.31%PPRV220.7%BVDV+ETEC232310.5%BRV+ETEC551.6%305份样品中,148份检测结果为阳性,其中单重感染为92份(单冲感染样本占阳性结果样本的30.1%),混合感染28份(混合感染样本占阳性结果样本的9.2%)。测序结果显示阳性结果均为对应的病毒,无非特异性扩增的假阳性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1