一种NK细胞无血清培养基及其配制方法与流程
本发明涉及一种NK细胞无血清培养基及其配制方法,属于细胞培养技术领域。
背景技术:
无血清培养基是指不需要添加血清就可以维持细胞在体外较长时间生长繁殖的合成培养基,可以应用于培养免疫细胞,例如淋巴细胞(例如,T淋巴细胞、B细胞、NK细胞等)、树突状细胞(也称DC细胞)、单核/巨噬细胞等。
自然杀伤细胞(Natural Killer cell,NK)是机体重要的免疫细胞,在机体抗肿瘤、抗病毒等过程中发挥重要作用。NK细胞通过非特异性识别靶细胞,通过分泌颗粒酶、穿孔素、细胞因子等途径杀伤靶细胞。同时NK细胞表达FcγRⅢA,与抗体分子的Fc段结合,通过抗体实现对靶细胞的特异性识别和杀伤。因此,NK细胞在肿瘤或者病毒性疾病的治疗上有很大的应用价值。
直接从体内分离出来的NK细胞往往面临数量上和功能上的不足,需要在体外进行大量的扩增和活化才能回输到体内去,达到治疗的效果。NK细胞的扩增和活化主要是通过以下几个途径实现的:
1、ζ链活化途径。NK细胞虽不表达TCR-CD3复合物,但部分NK细胞表达ζ链。ζ链和NK表面的IgGFc受体FcγRⅢ(CDl6)形成复合体。Ig分子和FcγRⅢ结合时,ζ链胞内段上的ITAM即可发生酪氨酸磷酸化,通过信号转导通路引起胞质内Ca2+浓度和IP3水平升高,促进细胞因子合成和ADCC效应。外周血中的NK细胞几乎均可通过此途径活化。部分NK细胞表达CD2分子,还有可能通过CD2与CD58相互作用可使ζ链发生酪氨酸磷酸化,使NK细胞活化。
2、IL-2R激活途径。NK细胞表面表达IL-2Rβγ链,在IL-2的诱导下,NK细胞开始大量表达IL-2Rα链,βγ链与α链的结合有利于形成高亲和力IL-2受体,从而使NK细胞在IL-2的刺激下进一步发生增殖。在IL 2刺激下NK细胞表达黏附分子,使NK胞质中的颗粒增加并促进丝氨酸酯酶mRNA的表达,从而提高NK细胞的细胞毒活性。
3、IL-18和Il-12激活途径。ILl8和IL12共同作用,通过胞内的ITAM而达到促进NK细胞活化的作用。
4、IL-15激活途径。IL-15与IL-2有相似的结构,对NK细胞的活化和增殖有促进作用。
5、IL-21激活途径。IL21分子结构与IL-15相似,协同IL-15促进NK细胞增殖、分化和细胞毒活性。
6、A群链球菌通过TLR途径激活NK细胞,促进NK细胞的杀伤活性和增殖能力。
7、除了上述外加的细胞因子外,一些TLR
现有的NK细胞扩增和活化培养体系一般是在扩增的同时对NK细胞进行杀伤活性的过度激活,这种培养体系容易造成NK细胞的过早衰老,表现为存活时间缩短,扩增倍数不高。另外,利用现有的培养基培养NK细胞的过程中需额外添加多种刺激因子等物质,操作繁杂且容易造成污染。
技术实现要素:
鉴于相关技术的上述问题和/或其他问题,本发明提供了一种NK细胞无血清培养基,该培养基分成两个独立包装的组分,在细胞培养的不同阶使用,从而将NK细胞培养过程分为诱导阶段和增殖阶段,提高培养效果的同时将细胞诱导培养过程简化降低污染事件的发生。培养基中还加入了聚肌胞[Poly(I:C)],聚肌胞可诱导免疫细胞的分化、成熟或者分泌细胞因子,如IL-12、IL-15、TNFa、IFN-r等,促进免疫细胞的活化增殖的能力;聚肌胞还可以促进膜结合型IL-15Ra表达的能力,IL-15Ra可与IL-15紧密结合,这种结合状态的IL-15对NK细胞有更强烈的促活化和促增殖的效应。本发明提供的NK细胞无血清培养基更适合高效培养NK细胞,提高增殖倍数。
本发明提供了一种应用于NK细胞培养的无血清培养基,所述NK细胞无血清培养基包括诱导培养基组分和扩增培养基组分。
诱导培养基组分和扩增培养基组分都以DME F12培养基为基础培养基,添加白蛋白、重组人转铁蛋白、重组人胰岛素、胆固醇、乙醇胺、抗坏血酸、硫酸庆大霉素、硫酸铜、硫酸锌、和氯化锰,并调节pH值为6.8-7.5。
诱导培养基组分还含有CD2单抗、CD16单抗、CD335单抗、IL-2、IL-12、IL-18、IL-21、IL-15、聚肌胞。
扩增培养基组分还含有IL-2、IL-12、IL-18、IL-21、IL-15。
优选的,培养基中白蛋白的浓度为0.001-0.5mmol/L、重组人转铁蛋白的浓度为0.1-500mg/L、重组人胰岛素的浓度为0.1-100mg/L、胆固醇的浓度为0.1-20mg/L、乙醇胺的浓度为0.1-20mg/L、抗坏血酸的浓度为0.1-100mg/L、硫酸庆大霉素的浓度为1×103-1×106IU/L、硫酸铜的浓度为0.0001-0.01mg/L、硫酸锌的浓度为0.01-10mg/L、氯化锰的浓度为0.0001-0.001mg/L。
优选的,诱导培养基组分中CD2单抗的浓度为1-100μg/L、CD16单抗的浓度为1-100μg/L、CD335单抗的浓度为1-100μg/L、IL-2的浓度为1×104-1×106IU/L、IL-12的浓度为0.01-100μg/L、IL-18的浓度为0.01-100μg/L、IL-21的浓度为0.01-100μg/L、IL-15的浓度为0.01-100μg/L、聚肌胞的浓度为0.1-100mg/L。
扩增培养基组分中IL-2的浓度为1×104-1×106IU/L、IL-12的浓度为0.01-100μg/L、IL-18的浓度为0.01-100μg/L、IL-21的浓度为0.01-100μg/L、IL-15的浓度为0.01-100μg/L。
优选的,本发明再一方面还提供了上述的NK细胞无血清培养基在培养NK细胞方面的应用。
本发明的NK细胞无血清培养基,将培养基分成两个独立包装的组分,在细胞培养的不同阶使用,从而将NK细胞培养过程分为诱导阶段和增殖阶段,培养基中还加入了聚肌胞,更适合高效培养NK细胞,提高增殖倍数。
附图说明
图1为用实施例1-3与对比例1-3培养基培养的NK细胞第5-20的增殖曲线的结果;
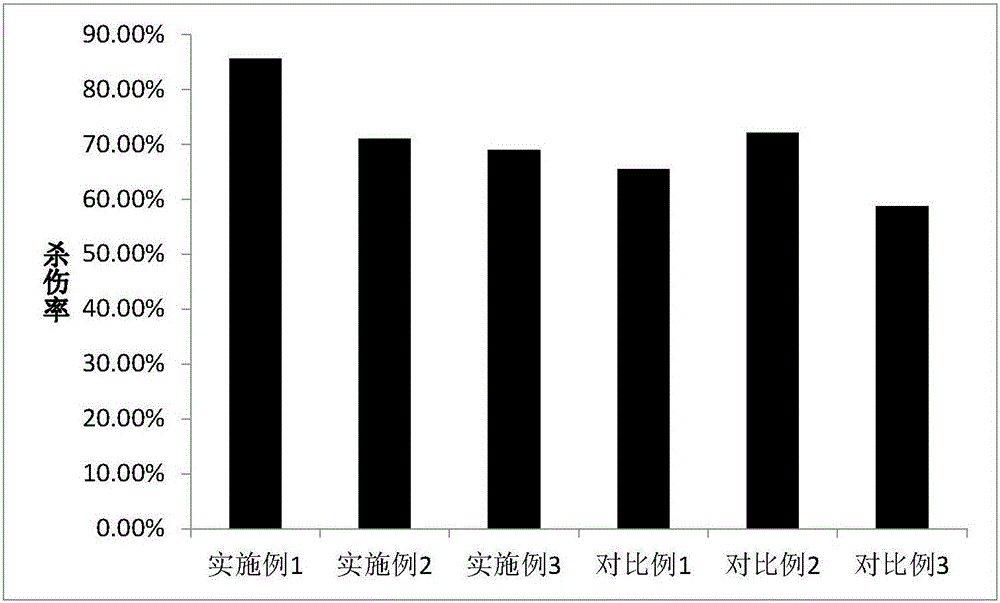
图2为用实施例1-3与对比例1-3培养基培养得到的NK细胞杀瘤实验的结果;
图3为用实施例1-3与对比例1-3培养基培养得到的NK细胞比例的结果;
具体实施方式
以下通过实施例对本发明作进一步的说明,但本发明并不限于这些具体实施方式。
实施例1
步骤一:配制NK细胞无血清培养基基础组分。
称取DME F12培养基粉末(购自SIGMA公司的D8900产品)和1.2g碳酸氢钠用注射水配制成DME F12培养基溶液。
按每一升DME F12培养基溶液,分别添加白蛋白溶液(含0.0375mmol白蛋白);再在每份中,继续添加以下物质:重组人转铁蛋白50mg(购自SIGMA公司的T3705产品)、重组人胰岛素10mg(购自江苏万邦生化医药股份有限公司的胰岛素注射液产品)、胆固醇2mg(购自SIGMA公司的C1231产品)、乙醇胺2mg(购自SIGMA公司的E0135产品)、抗坏血酸2.5mg(购自SIGMA公司的A4544产品)、硫酸庆大霉素10000IU(购自上海第一生化药业有限公司的硫酸庆大霉素注射液产品)、硫酸铜0.001mg、硫酸锌0.5mg和氯化锰0.0005mg,搅拌使充分溶解。
再用0.1mol/L盐酸和0.1mol/L NaOH溶液调节pH值为6.8-7.5之间,0.1um滤膜过滤除菌,分装,4-8摄氏度保存。
步骤二:配制NK细胞活化培养基。
在每升NK细胞无血清培养基基础组分中加入1mg CD2单抗(ebioscience,16-0029-85),1mg CD16单抗(ebioscience,16-0167-85),1mgCD335单抗(ebioscience,16-3359-85),50万IU IL-2,1mg Il-12(R&D systems,219-IL-025),1mg Il-18(R&D systems,B001-5),1mg Il-21(Peprotech,200-21),1mg Il-15(R&D systems,247-ILB-025),10mg/L聚肌胞(Sigmaaldrich,P9582-50MG)。混匀,0.1um滤膜过滤除菌,分装,4-8摄氏度保存。
步骤三:配制NK细胞扩增培养基。
在每升NK细胞无血清培养基基础组分中加入50万IU IL-2,1mg Il-12(R&D systems,219-IL-025),1mg Il-18(R&D systems,B001-5),1mg Il-21(Peprotech,200-21),1mg Il-15(R&D systems,247-ILB-025)。混匀,0.1um滤膜过滤除菌,分装,4-8摄氏度保存。
实施例2
配制培养基的操作与实施例1相同,仅添加的物质的终浓度不同:
白蛋白的浓度为0.001mmol/L、重组人转铁蛋白的浓度为0.1mg/L、重组人胰岛素的浓度为0.1mg/L、胆固醇的浓度为0.1mg/L、乙醇胺的浓度为0.1mg/L、抗坏血酸的浓度为0.1mg/L、硫酸庆大霉素的浓度为1×103IU/L、硫酸铜的浓度为0.0001mg/L、硫酸锌的浓度为0.01mg/L、氯化锰的浓度为0.0001-0.001mg/L。
优选的,诱导培养基组分中CD2单抗的浓度为1μg/L、CD16单抗的浓度为1μg/L、CD335单抗的浓度为1μg/L、IL-2的浓度为1×104IU/L、IL-12的浓度为0.01μg/L、IL-18的浓度为0.01μg/L、IL-21的浓度为0.01μg/L、IL-15的浓度为0.01μg/L、聚肌胞的浓度为0.1mg/L。
扩增培养基组分中IL-2的浓度为1×104IU/L、IL-12的浓度为0.01μg/L、IL-18的浓度为0.01μg/L、IL-21的浓度为0.01μg/L、IL-15的浓度为0.01μg/L。
实施例3
配制培养基的操作与实施例1相同,仅添加的物质的终浓度不同:
白蛋白的浓度为0.5mmol/L、重组人转铁蛋白的浓度为500mg/L、重组人胰岛素的浓度为100mg/L、胆固醇的浓度为20mg/L、乙醇胺的浓度为20mg/L、抗坏血酸的浓度为100mg/L、硫酸庆大霉素的浓度为1×106IU/L、硫酸铜的浓度为0.01mg/L、硫酸锌的浓度为10mg/L、氯化锰的浓度为0.001mg/L。
优选的,诱导培养基组分中CD2单抗的浓度为100μg/L、CD16单抗的浓度为100μg/L、CD335单抗的浓度为100μg/L、IL-2的浓度为1×106IU/L、IL-12的浓度为100μg/L、IL-18的浓度为100μg/L、IL-21的浓度为100μg/L、IL-15的浓度为100μg/L、聚肌胞的浓度为100mg/L。
扩增培养基组分中IL-2的浓度为1×106IU/L、IL-12的浓度为100μg/L、IL-18的浓度为100μg/L、IL-21的浓度为100μg/L、IL-15的浓度为100μg/L。
对比例1~3
对比例1:市售的CellGro SCGM Medium;
对比例2:市售的TAKARA公司的GT-T551;
对比例3:市售的友康免疫细胞无血清培养基(NK)。
细胞增殖对比实验
用实施例1-3的培养基培养NK细胞,操作步骤如下:
用ficoll淋巴细胞分离液分离外周血单个核细胞(PBMC),收集分离液上层血浆,56度灭活30分钟,离心后取上清得到热灭活自体血浆;中间层单个核细胞用生理盐水洗2次后得到外周血单个核细胞(PBMC)。取PBMC用NK细胞诱导培养基调整细胞浓度为2×106/ml,加入2%热灭活自体血浆,接种到培养瓶中培养。第5天,计数细胞浓度,用含2%热灭活自体血浆的NK细胞扩增培养基调整细胞浓度为1×106/ml,继续培养。以后每2-3天用含2%热灭活自体血浆的NK细胞扩增培养基补液一次。分别在第5天、10天、15天、20天采样计数细胞,绘制细胞增殖曲线。
对比例1-3培养基按照说明书培养NK细胞,分别在第5天、10天、15天、20天采样计数细胞,绘制细胞增殖曲线。结果见图1
结论:本发明实施例1的NK细胞培养方法诱导的NK细胞增殖倍数比对比例更高,增殖速度更快。
杀瘤对比实验
将上述细胞增殖能力实验中培养第15天的NK细胞作为效应细胞,以K562细胞为靶细胞。
首先配制效应细胞溶液:取培养至15天的NK细胞,用含2%FBS的RPMI 1640培养基洗2次,用含2%FBS的RPMI 1640培养基配成1×106/ml细胞悬液。靶细胞K562细胞用2%FBS的RPMI 1640培养基洗一次,用含2%FBS的RPMI 1640培养基配成1×105/ml细胞悬液。按效靶比10:1接种到96孔板内,同时设置效应细胞孔和靶细胞孔,按每种培养基3个复孔,37度5%CO2培养24小时。用MTT法测吸光度值,计算杀瘤率。结果见图2
杀瘤率%=1-(试验孔-效应细胞孔)/靶细胞孔。
结论:本发明实施例1培养的NK细胞杀伤活性高于对比例各组。
流式表型对比
取细胞增殖能力实验中培养至第20天的细胞,分成3管,每管细胞数1×106。按NK细胞检测试剂盒操作(BD bioscience,货号340300)用PBS溶液洗2次。加入300ul PBS溶液重悬细胞,第一管作为空白对照,另外两管按说明书分别加入流式荧光抗体。避光4度孵育20分钟。孵育完后,每管加入1ml PBS溶液,1500转离心5分钟,去上清,重复清洗一次。加入500ul PBS溶液重悬细胞,上机分析,得到NK细胞百分比。结果见图3
结论:本发明实施例1培养的NK细胞杀伤活性高于对比例各组。
应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施方式中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施方式的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施方式或变更均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!