一种快速获得和纯化人脐带间充质干细胞的方法与流程
本发明属于生物技术领域,涉及一种获得和纯化干细胞的方法。具体地,涉及一种快速获得人脐带间充质干细胞,并在短期内获得高度纯化干细胞的方法。
背景技术:
间充质干细胞(marrow stromal cells,MSCs)是广泛存在于机体组织器官间质中,具有自我增殖能力、多向分化能力的干细胞。大量文献报道,MSCs可以在不同条件下,向属于中胚层、内胚层甚至外胚层的终末细胞分化。因此广泛地被应用于细胞生物学、组织工程学等研究中。
在组织工程研究中,MSCs的来源一直是其发展的瓶颈。在既往使用的MSCs中,成体细胞来源的MSCs数量有限,取材会带来新的创伤,且获得的细胞增殖能力不强;胚胎来源的MSCs数目较多,增殖力强,但存在来源上的伦理问题;骨髓来源的MSCs虽然较多且增殖力较强、可方便地自体取材、不存在伦理问题,但骨髓中MSCs的数量非常少,与造血干细胞等其他细胞相比,约占整个骨髓有核细胞的十万分之一,并随年龄的增加,骨髓腔干细胞数量急剧减少。因此,需要寻找更稳定可靠的MSCs来源。
近年来研究发现,在人的脐带中也发现了MSCs——人脐带间充质干细胞(human umbilical marrow stromal cells,hUMSCs),因其来源稳定、易于获得、不存在伦理问题,有望成为组织工程理想的种子细胞。具有多向分化的潜能,在适当的条件下可分化为骨骼肌细胞、血管内皮细胞、中枢神经元和神经胶质细胞等。
hUMSCs是脐带华通氏胶样组织中所含有的一类多能干细胞,它能表达干细胞的相关标志,具有向终末组织细胞分化的能力。脐带为新生儿废弃组织,有来源广泛、自体取材、无排异反应等优势。但在研究中还存在一些问题,其中之一就是如何快速获得高纯度的hUMSCs。但是脐带是一个含有间充质干细胞、造血干细胞、成纤维干细胞等多种细胞的组织。在体外培养过程中,除了间充质干细胞的增殖外,造血系细胞、成纤维细胞的增殖也相当迅速.降低了所获取的脐带间充质干细胞纯度。因此,需要一种便捷、高效、经济的hUMSCs富集方法。我们将获取的脐带华通氏胶置于培养皿中,待细胞从胶块中爬出后,应用流式细胞仪对获得的原代贴壁细胞进行初步筛选,并用一种复合胶原酶进行差速消化法传代,以期能在较短时间内获得纯度较高的hUMSCs。
在先前获取hUMSCs的研究中,大多通常采用胶块酶消化法和差速贴壁法等来制备,但这些方法均存在一定不足。其中胶块酶消化法可获得较多干细胞,但此方法需将胶块长期浸泡在消化液中,对干细胞活力有较大影响,细胞贴壁能力及增殖能力往往达不到要求;而差速贴壁法获取hUMSCs的方法虽然要求低,易推广,但获为了提高干细胞纯度所需传代周期长,其速度往往达不到要求。而实验和临床研究需要一种便捷、高效、可靠的hUMSCs富集方法。
技术实现要素:
为了解决上述问题,本发明目的是提供一种快速获得并纯化人脐带间充质干细胞(human umbilical marrow stromal cells,hUMSCs)的方法,在短时间内得到足够高纯度的可供研究和实际使用的hUMSCs。
为了实现上述技术目的,本发明采用了以下技术方案:
这种快速获得和纯化人脐带间充质干细胞的方法,包括如下步骤:
1)在无菌条件下,收集人类新生儿脐带组织,用无菌PBS液冲洗,去除血污,将脐带中的血管组织通过机械分离法去除,得到华通氏胶块;
2)将步骤1)中获得的华通氏胶块用无菌剪制成小块,并用细胞培养液重悬后,接种于培养皿中,然后在培养箱中孵育,得到贴壁细胞;
3)将步骤2)培养皿中的培养液及悬浮细胞弃去,用复合胶原酶差速消化,将贴壁细胞消化下来,加入PBS清洗、重悬后得到细胞悬液:P1代hUMSCs;
4)将步骤3)得到的P1代hUMSCs用滤网过滤,去除华通氏胶块,收集过滤细胞液,离心后弃上清,再用无血清DMEM液清洗2次,用流式细胞仪进行细胞筛选;
5)将步骤4)中流式细胞仪筛选后得到的细胞再次用培养液重悬后,接种于培养皿中,然后在培养箱中孵育,得到贴壁细胞;
将步骤5)培养皿中再次用复合胶原酶差速消化,将贴壁细胞消化下来,得到的细胞悬液进行流式细胞仪鉴定,即可得到高纯度的P2代hUMSC。
作为优选:步骤1)中获取的脐带须以与胎盘连接处为起点,长度在40-50cm;所进行的操作均在无菌条件下进行,不额外使用抗生素。
作为优选:步骤2)中制成的华通氏胶块为2-3mm3左右,细胞培养液为:含体积分数为20-25%FBS的DMEM;培养箱孵育条件为:在37℃、5%CO2、95%湿度的条件下,10cm培养皿中孵育,时间为72-96h。
作为优选:步骤3)中用于差速消化贴壁细胞、以提高所获脐带基质干细胞纯度的消化液为collegenase NB4复合胶原酶溶液,采用浓度为0.125-0.25%;添加胶原酶溶液后,将培养皿放入细胞培养箱内,37℃孵育15-20min后,加入0.05-0.1%的trypsin-EDTA终止复合胶原酶消化,加含体积分数为10%FBS的DMEM培养液终止trypsin-EDTA消化,加入PBS反复吹打后,收集所得细胞,以1000-1500r/min离心5min,去上清,用PBS重悬后再次离心,以洗去残留消化液。
作为优选:步骤4)中滤网为150-200目,洗涤细胞所用离心速度为600-800g,时间为3-5min;用流式细胞仪进行细胞筛选前,用带有一种荧光的干细胞表面CD标记抗体和带有另一种荧光的非干细胞表面CD标记抗体对细胞进行标记。
作为优选:步骤5)中流式细胞仪进行筛选后,细胞培养液采用的是含体积分数为8-10%FBS的DMEM,按细胞密度1×104/cm2-2×104/cm2接种于10cm培养皿中,培养箱孵育条件为:在37℃,5%CO2、95%湿度的条件下,孵育时间为48-72h。
作为优选:步骤2)和步骤5)中,需待贴壁细胞长满至培养皿底的85%-90%后,再进行复合胶原酶差速消化。
本发明的有益效果是:1)全过程采用不含有抗生素的液体进行操作,避免抗生素对细胞的毒性影响hUMSCs的增殖活力;2)直接采用华通氏胶块进行培养,制成的华通氏胶块为2mm3左右,避免制作过小胶块所需的机械剪切使干细胞受到损伤,或者胶块过大使干细胞不易爬出;3)胶块所用培养液为:含体积分数为25%FBS的DMEM,有利于干细胞从胶块爬出;4)所用滤网可将胶块滤除,而干细胞得以滤过,采用的消化酶为复合酶,利用其对基质干细胞和成纤维细胞的胞外基质不同消化速度,实现差速消化分离;5)用干细胞表面CD标记和非干细胞表面CD标记作为流式细胞仪筛选标记,一次筛选就大大提高干细胞表面CD标记阳性、非干细胞表面CD标记阴性的hUMSCs比例;6)经过2次复合胶原酶差速消化和1次流式细胞仪双CD抗原筛选,就可实现快速纯化并获得大量用于进一步研究所需的hUMSCs。
附图说明
图1为本发明的实施例1细胞培养示意图,2mm3左右的华通氏胶块置于含体积分数为25%FBS的DMEM培养72h后,有大量细胞从胶块中爬出(×40);
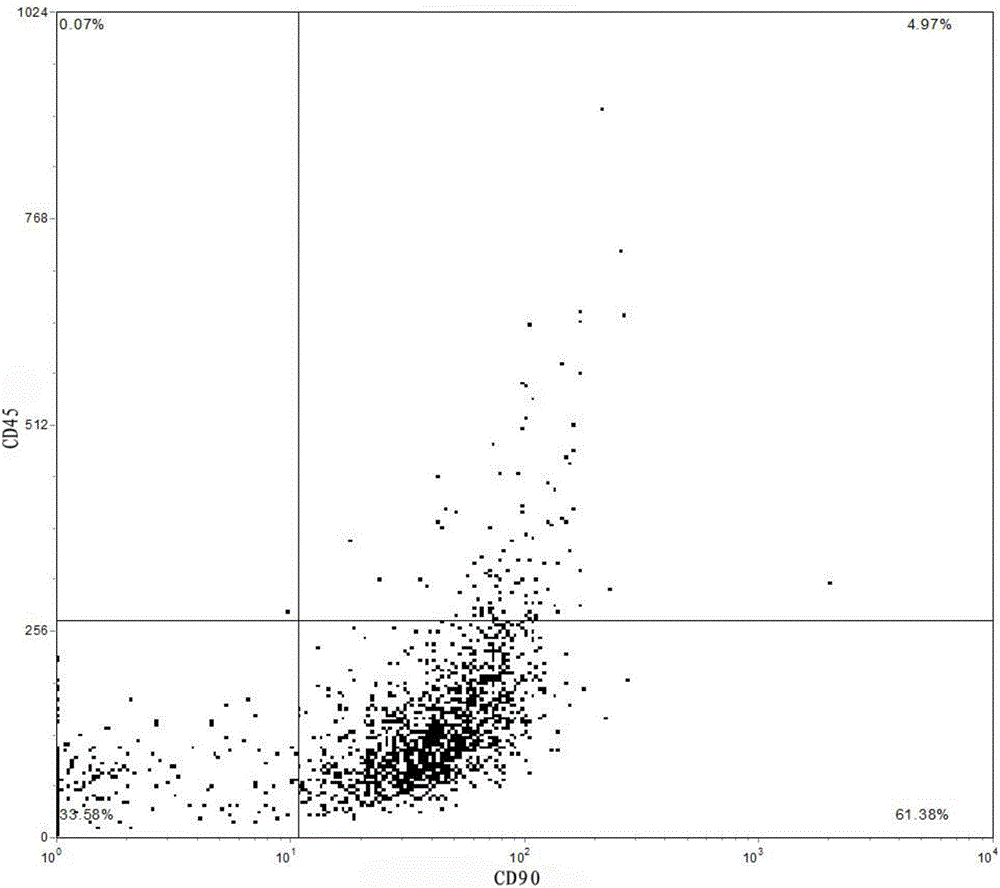
图2为本发明的实施例1流式细胞仪筛选示意图,经复合胶原酶消化后得到的P1代hUMSCs经流式细胞仪筛选,得到61%左右的细胞,其表面CD标记阳性、非干细胞表面CD标记阴性;
图3为本发明的实施例1细胞培养示意图,用0.05%复合胶原酶覆盖皿底,在37℃培养箱中消化15min后,得到大量形态已成圆形的P2代hUMSCs(×40);
图4为本发明的实施例1流式细胞仪鉴定示意图,P2代hUMSCs经过流式细胞仪鉴定,细胞表面CD标记阳性、非干细胞表面CD标记阴性的基质干细胞比例可达到95%左右。
具体实施方式
下面结合实施例对本发明做进一步描述。下述实施例的说明只是用于帮助理解本发明。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
本发明提供了一套获得并纯化脐带干细胞的方法,其包括下述操作步骤:
1)在无菌条件下,收集人类新生儿脐带组织,用无菌PBS液冲洗,去除血污,将脐带中的血管组织通过机械分离法去除,得到华通氏胶块;
2)将步骤(1)中获得的华通氏胶块用无菌剪制成小块,并用细胞培养液重悬后,接种于培养皿中,然后在培养箱中孵育,得到贴壁细胞;
3)将步骤(2)培养皿中的培养液及悬浮细胞弃去,用复合胶原酶差速消化,将贴壁细胞消化下来,加入PBS清洗、重悬后得到细胞悬液(P1代hUMSCs);
4)将步骤(3)得到的P1代hUMSCs用滤网过滤,去除华通氏胶块,收集过滤细胞液,离心后弃上清,再用无血清DMEM液清洗2次,用流式细胞仪进行细胞筛选;
5)将步骤(4)中流式细胞仪筛选后得到的细胞再次用培养液重悬后,接种于培养皿中,然后在培养箱中孵育,得到贴壁细胞;
6)将步骤(5)培养皿中再次用复合胶原酶差速消化,将贴壁细胞消化下来,得到的细胞悬液进行流式细胞仪鉴定,即可得到高纯度的P2代hUMSCs。
在上述步骤中,所进行的操作均在无菌条件下进行,所用液体为灭菌液体,无添加任何抗生素。
在上述步骤中,步骤1)获取的脐带须以其与胎盘连接处为起点,长度在40-50cm。
在上述步骤中,步骤2)中华通氏胶块不宜剪切得过小,制成2-3mm3左右的小块为宜,采用的培养液为含体积分数为20-25%FBS的DMEM,接种于培养皿后在37℃,5%CO2、95%湿度的条件下,培养箱中孵育72-96h。
在上述步骤中,步骤3)中用于差速消化贴壁细胞、以提高所获脐带基质干细胞纯度的消化液为collegenase NB4复合胶原酶溶液,采用浓度为0.125-0.25%;添加胶原酶溶液后,将培养皿放入细胞培养箱内,37℃孵育15-20min后,加入0.05-0.1%的trypsin-EDTA终止复合胶原酶消化,加含体积分数为10%FBS的DMEM培养液终止trypsin-EDTA消化,加入PBS反复吹打后,收集所得细胞,以1000-1500r/min离心5min,去上清,用PBS重悬后再次离心,以洗去残留消化液。
在上述步骤中,步骤4)中滤网为150-200目,滤过后的细胞用无血清DMEM液清洗,离心条件为600-800g,离心时间3-5min,以上步骤重复两次洗涤杂质。用流式细胞仪进行细胞筛选前,用带有一种荧光的干细胞表面CD标记抗体和带有另一种荧光的非干细胞表面CD标记抗体对细胞进行标记。
在上述步骤中,步骤5)筛选后的细胞所用培养液为含体积分数为8-10%FBS的DMEM,按细胞密度1×104/cm2~2×104/cm2接种于10cm培养皿中,在37℃、5%CO2、95%湿度的条件下,培养箱中孵育48-72h。
在上述步骤中,步骤2)和步骤5)需待贴壁细胞长满至培养皿底的85%-90%后,再进行复合胶原酶差速消化。
在本发明中,用流式细胞仪对获得P1代hUMSCs进行筛选及P2代hUMSCs进行鉴定,包括以下步骤:
a.带有一种荧光的干细胞表面CD标记抗体和带有另一种荧光的非干细胞表面CD标记抗体进行标记,IgG2a-CY5、IgG1-PE进行阴性对照标记。
b.4℃暗室中孵育30min,加无血清DMEM以600g-800g离心3-5min漂洗2遍,重悬成1mL悬液。
c.用流式细胞仪在无菌条件下分选带有一种荧光的CD抗体标记(标记了干细胞表面表达的特异性CD抗原)的细胞,以及带有另一种荧光的CD抗体标记(标记了非干细胞表面表达的特异性CD抗原)的细胞。
在本发明中,用流式细胞仪进行所述的筛选及鉴定,所使用的干细胞表面CD标记和非干细胞表面CD标记可以是表1中的任意组合,抗体所携带的有机荧光物为荧光为CY5、PE或FITC。
在本发明中,经流式细胞仪筛选后的细胞可按照细胞密度1×104~2×104/cm2的密度接种于10cm培养皿。
在本发明中,一次采到的新生儿脐带组织,用上述方法在单个10cm培养皿中培养,经过6-7d后,所得到的hUMSCs数可达1×106以上,细胞纯度可达95%以上(图4)。
本发明所使用的材料,如无特别说明,均为市售产品。
表1为干细胞表面CD抗原,可在列表任选一个干细胞表面CD抗原和一个非干细胞表面CD抗原组成筛选标记:
实施例1
1、获取新生儿脐带
在无菌条件下,以脐带与胎盘连接处为起点获取长度在45cm的健康新生儿脐带组织,用PBS反复冲洗去除血污,用显微器械小心将脐带中的血管组织通过机械分离法去除,得到华通氏胶,将其剪切成2mm3左右的碎块。
2、获得P1代hUMSCs
1)将获得的华通氏胶碎块再次用PBS洗涤后,用体积分数为25%FBS的DMEM培养液重悬后,接种于10cm培养皿中,然后在37℃,5%CO2、95%湿度的条件下,培养箱中孵育84h,得到贴壁细胞(图1)。
2)培养液及悬浮细胞弃去,并用PBS液洗涤后,加入0.125%复合胶原酶覆盖皿底,在37℃培养箱中消化15min后,加入0.05%的trypsin-EDTA终止复合胶原酶消化,加含体积分数10%FBS的DMEM培养液终止trypsin-EDTA消化,加入PBS反复吹打得到P1代hUMSCs细胞悬液。
3)将悬液用150目的滤网过滤,600g离心5min,再用无血清的DMEM洗涤2次。
3、用流式细胞仪对P1代hUMSCs进行筛选
1)分别在2个Eppendof管中,加入100μL buffer(含2%FBS)制成含有1×105个细胞的悬液。1号管分别加入CD90-CY5、CD45-PE(各1μL);2号管加入IgG2a-CY5、IgG1-PE(各1μL)作为阴性对照。4℃暗室中孵育30min,加buffer以800g离心3min漂洗2遍,加入buffer 10mL制成悬液,用流式细胞仪在无菌条件下分选表达CD90+、CD45-干细胞标记的细胞(约占61%,图2)。
2)获得分选细胞后再次离心后弃上清,加入含体积分数10%FBS的DMEM培养液,吹打形成悬液后,按细胞密度1×104/cm2接种于10cm培养皿中。在37℃、5%CO2、95%湿度的条件下孵育。
4、P2代hUMSCs的收获及鉴定
1)待60h后,细胞长满至10cm培养皿底的85%,用浓度为0.05%的collegenase NB4复合胶原酶溶液,对贴壁细胞进行差速消化(图3)。37℃孵育10min后,加入0.05%的trypsin-EDTA终止collegenase NB4消化,加含体积分数10%FBS的DMEM培养液终止trypsin-EDTA消化,获得的P2代hUMSCs。
2)收集吹打后所得细胞,以600g离心5min,去上清,用无血清的DMEM洗涤2次,去残留消化液,重悬后细胞计数达1×106,流式细胞仪进行P2细胞纯度鉴定,纯度达95%(图4)。
- 还没有人留言评论。精彩留言会获得点赞!