二硫代甲酸衍生物及其制备方法和应用与流程
本发明涉及医药技术,具体涉及二硫代甲酸衍生物及其制备方法和应用。
背景技术:
癌症是严重影响人类生活质量和生存的重大疾病之一,90%以上病人不是死于原位癌而是死于癌转移。在癌细胞浸润转移时,癌旁的血管形成为肿瘤细胞生长提了条件,肿瘤细胞的生长需要有血管形成,而血管的增生亦为肿瘤转移提供了条件。所以血管形成是肿瘤治疗的重要靶点。同时,在正常的成人中,除了创伤愈合及生殖周期外,几乎所有的新生血管形成都是病理性的,如肿瘤、风湿性关节炎及糖尿病眼底病变等。故选择这一靶点也是更安全、毒副作用更小的治疗方法,所以开发有效的血管形成药物是抑制癌转移重要途径之一。不同化合物抑制血管形成已有不少国内专利(中国专利:2011100042161;028121252;2011100042176;CN101011380A)。二硫代甲酸衍生物由于良好的生物活性备受药物工作者青睐,如吡咯二硫代甲酸酯可抑制核因子(NF-kB),并抑制癌细胞侵袭转移及血管形成,50微摩完全抑制血管形成。其他衍生物如二硫代甲酸氨基甲酸酯能够上调包括血管细胞粘附分子。但有关二吡啶酮腙二硫代甲酸丙酸酯对肿瘤及血管形成的抑制作用未有报道。
技术实现要素:
本发明合成了新型的吡啶(醛、酮)腙二硫代甲酸丙酸酯,其具有新的生物学特性:(1)可抑制肝癌、结肠癌、卵巢癌细胞的生长,具有较小的半数抑制浓度;(2)在很低浓度即可抑制血管形成,并抑制癌细胞转移。(3)细胞毒性与诱导凋亡、周期阻滞及自噬有关。
本发明的技术方案是:二硫代甲酸衍生物的制备方法,其合成路线如下式所示,
所述二硫代甲酸衍生物是吡啶醛腙二硫代甲酸丙酸酯或吡啶酮腙二硫代甲酸丙酸酯。
本发明的进一步改进包括:所述的方法,其具体过程包括:取1mmol的KOH置于圆底烧瓶,用体积比为5:1的乙醇-水混合物溶解放置在冰水浴,向其中加入80%的水合肼1mmol,在0-5的低温环境中15分钟,之后向圆底烧瓶中逐滴加入1mmol二硫化碳;继续反应30分钟,随后加入3ml溶解有1mmol二吡啶酮或吡啶醛的无水乙醇溶液和一滴冰乙酸,回流1.5小时,浓缩,冷却,得到红棕色的粉末,即得二吡啶酮腙二硫代甲酸钾,将所得的0.5mmol二吡啶酮腙或吡啶醛腙二硫代甲酸钾溶于5ml乙醇与0.5mmol 3-溴代丙酸室温反应1小时,过滤并用冷乙醇洗涤得黄色的二吡啶酮腙或吡啶醛腙二硫代甲酸丙酸酯固体,经硅胶柱(乙酸乙酯/石油醚=3:1)层析纯化。
本发明还提供了一种按照上述方法制得二硫代甲酸衍生物。
本发明进一步提供了吡啶醛腙二硫代甲酸丙酸酯或吡啶酮腙二硫代甲酸丙酸酯在制备抗肿瘤药物中的应用。
本发明还提供了吡啶醛腙二硫代甲酸丙酸酯或吡啶酮腙二硫代甲酸丙酸酯在制备抑制血管形成药物中的应用。
附图说明
图1二吡啶酮腙二硫代甲酸丙酸酯对肝癌细胞的生长抑制作用
图2二吡啶酮腙二硫代甲酸丙酯对HUVEC细胞的生长抑制作用
图3a是对照组。
图3b是0.2μM二吡啶酮腙二硫代甲酸丙酸酯对HUVEC细胞形成圆环的抑制作用。
图3c是0.39μM吡啶酮腙二硫代甲酸丙酸酯对HUVEC细胞形成圆环的抑制作用。
图4是二吡啶酮腙二硫代甲酸丙酸酯诱导ROS作用。
图5是Western Blotting分析二吡啶酮腙二硫代甲酸丙酸酯细胞处理后,凋亡相关蛋白的变化。
具体实施方式
下面结合附图对本发明做详细说明。
实例一,二吡啶酮腙二硫代甲酸丙酸酯的制备
1、本发明实施例中使用的试剂如下:
无水乙醇(天津市德恩化学试剂有限公司),溴丙酸(萨恩化学技术(上海)有限公司),KOH(天津市德恩化学试剂有限公司),80%水合肼(天津市天力化学试剂有限公司),二硫化碳(天津市天力化学试剂有限公司),二吡啶酮(Sigma),。
2、2-二吡啶酮腙二硫代甲酸丙酸酯的制备合成方法
取1mmol的KOH(56.1mg)置于圆底烧瓶,用乙醇-水混合物(5:1)溶解放置在冰水浴,向其中加入80%的水合肼1mmol(50.1mg),在0-5的低温环境中15分钟之后向圆底烧瓶中逐滴加入1mmol(76.2mg)二硫化碳。继续反应30分钟。随后加入3ml溶解有1mmol二吡啶酮的无水乙醇溶液和一滴冰乙酸,回流1.5小时,浓缩,冷却,得到红棕色的粉末,即得二吡啶酮腙二硫代甲酸钾。产率:80%,熔点:mp:140.5℃.NMR(D6-DMSO):13.35(s,NH),8.85(d,H,J=4Hz),8.63(d,H,J=4Hz),8.03(m,2H,J=8Hz),7.95(d,H,J=8Hz),7.63(dd,H,J=4Hz),7.59(d,H,J=8Hz),7.54(dd,H,J=4Hz).IR(KBr压片,cm-1):3430,1624,1587,1519,1461,1430,1217,1187,1133,1051,1012,992,800,753,731,712,648,618,590.ESI-MS(m/z):350.9540(M-H+2K,calcd:350.9525).
将所得的二吡啶腙二硫代甲酸钾(0.5mmol)溶于5ml乙醇与0.5mmol 3-溴代丙酸室温反应1小时,过滤并用冷乙醇洗涤得黄色的二吡啶酮腙二硫代甲酸丙酸酯固体。产率(90%),熔点155℃.1HNMR(Bruker,D6-DMSO):15.0(s,NH),8.85(d,H,J=4Hz),8.63(d,H,J=4Hz),8.03(m,2H,J=8Hz),7.95(d,H,J=8Hz),7.63(dd,H,J=4Hz),7.59(d,H,J=8Hz),7.54(dd,H,J=4Hz),3.43(tri,2H,J=8Hz),2.71(tri,H,J=8Hz).IR(cm-1):IR(KBr,cm-1):3404,1701,1587,1458,1356,1329,1288,1234,1207,1133,1061,1034,1014,803,753,701,654,593.ESI-MS(microTOF-Q III,Bruker):m/z:385.0203(M+K,calcd:385.01954).
实例二,抗肿瘤活性实验
1、试剂及检测仪器:
MTT(Sigma),胰酶(北京拜尔迪生物技术有限公司)。培养基(北京索莱宝生物技术有限公司),血清(浙江天杭生物科技有限公司),DMSO(天津市德恩化学试剂有限公司)。酶标仪(Theromo Scientific)
2、MTT法评估目标化合物的抗肿瘤活性
以HepG2(肝癌)、Bel-7402(肝癌)细胞为测试细胞株,选用对数生长期的贴壁肿瘤细胞,经胰酶消化后,用10%胎牛血清的RPMI 1640培养基配成5×103个/ml的细胞悬液,接种到96孔培养板,每孔接种100微升,37,5%CO2培养24小时。设立阴性对照组、阳性对照组及实验组。细胞贴壁后实验组更换新的含有不同浓度被测样品的培养基。阳性组对照给予顺铂,阴性对照组则换为含有等体积溶剂的培养基。每组设三个复孔,37,5%CO2培养48小时。弃去上清液,每孔加入10微升新鲜配制的10mg/ml MTT的无血清培养基。37继续培养4小时。小心弃上清,并加入100微升DMSO,在平板震荡器震荡均匀后,在酶标仪上测定每孔在570纳米的吸光度(OD)值。按下列公式计算药物对肿瘤细胞生长的抑制率:抑制率(%)=(对照组的OD值-实验组的OD值)/对照组的OD值×100.并计算半数抑制浓度(IC50:50%细胞生长抑制时的浓度)。在形态上HepG2细胞及Bel-7402细胞经不同浓度的待测药物处理48小时后,死细胞的数量随着药物浓度增加逐渐增加。细胞的增殖受到抑制。形态上随着药物浓度增加,贴壁性减弱,细胞逐渐变园,个数随药物浓度增加变化上升。如图1二吡啶酮腙二硫代甲酸丙酸酯对肝癌细胞的生长抑制作用。2-二吡啶酮腙硫代甲酸丙酸酯对HepG2细胞的IC50为:2.5μM;Bel-7402细胞为:IC50为:IC50=1.3±0.3μM顺铂对HepG2细胞的IC50为:11.2μM。
实例三,抑制血管形成实验
试剂:
ECM matrix gel(Millipore);MTT(Sigma),胰酶(Beijing Biodee Biotechnology Co,Ltd),培养基(北京索莱宝生物技术有限公司),血清(浙江天杭生物科技有限公司),DMSO(天津市德恩化学试剂有限公司),
1、对脐静脉内皮细胞(HUVEC)细胞生长抑制。
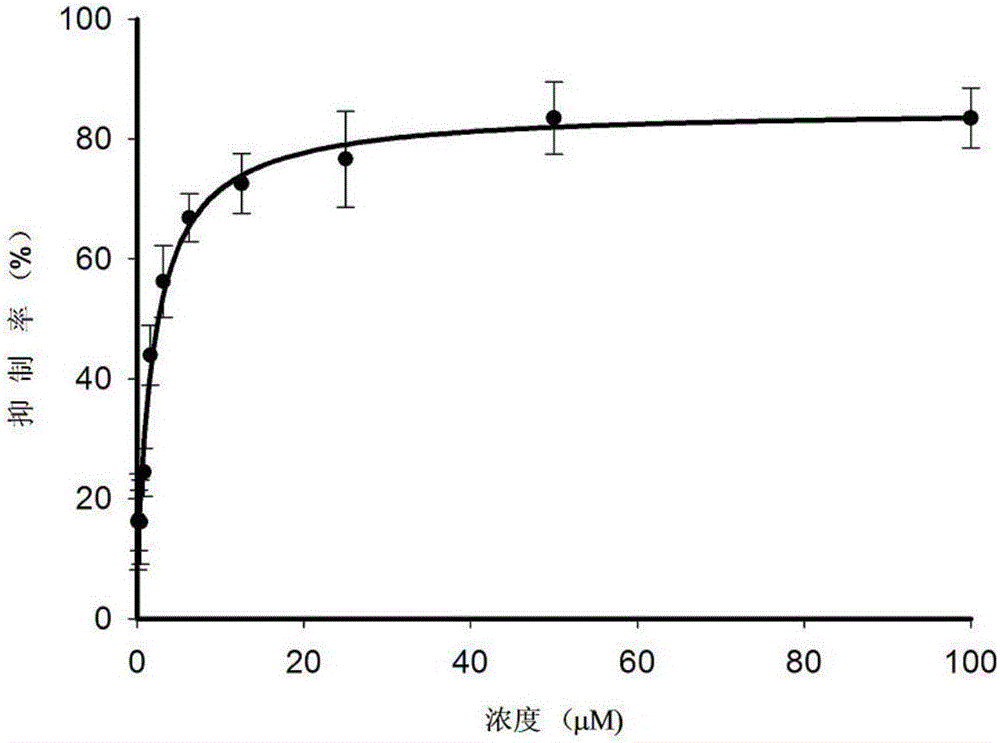
细胞培养方法如对肿瘤细胞生长抑制实验与实例二,抗肿瘤活性实验相同,但所使用的细胞为脐静脉内皮细胞。根据MTT法,所得半数抑制浓度(IC50)为:2.5±0.3μM。图2二吡啶酮腙二硫代甲酸丙酯对HUVEC细胞的生长抑制作用
2、对血管形成(圆环)抑制作用
实验步骤:1)按公司推荐的方法,将100μl冷的10X稀释液加到900μl ECM Matrix,混合均匀。将50μl ECM胶加到96孔板,37℃固化1小时;2)选用对数生长期的贴壁HUVEC细胞,经胰酶消化后,用10%胎牛血清的RPMI 1640培养基配成5×103个/ml的细胞悬液,接种到96孔培养板,每孔接种100微升。然后分别加入不同浓度二吡啶酮腙二硫代甲酸丙酸酯。未加药物为对照。37℃,5%CO2培养10小时。倒置显微镜观察,圆环的多少。结果显示:0.39μM 2-二吡啶酮腙二硫代甲酸丙酸酯即可完全抑制血管形成(吡咯二硫代甲酸盐为50μM完全抑制),是吡咯二硫代甲酸盐浓度的1/120。
图3二吡啶酮腙二硫代甲酸丙酸酯对HUVEC细胞形成圆环的抑制作用。(a)对照;(b)0.2μM吡啶酮腙二硫代甲酸丙酸酯;(C)0.39μM吡啶酮腙二硫代甲酸丙酸酯
实例四,二吡啶酮腙二硫代甲酸丙酸酯细胞毒性与诱导凋亡有关
试剂:活性氧检测试剂-H2DCF-DA(碧云天生物技术公司,北京);Bcl-2,bax,caspase 3,caspase8,cyclin D1,β-actin单抗,二抗(博士德,武汉);LC3(proteintech,武汉)
仪器:Amersham imager 600(GE Healthcare Life Sciences,USA);F97Pro荧光分光光度仪(上海棱光技术有限公司):
1、二吡啶酮腙二硫代甲酸丙酸酯处理肝癌细胞时,ROS(reactive oxygen species)升高
收集大约106个HepG2细胞,经PBS洗涤,细胞混悬于含有H2DCF-DA并且无血清培养基,二氧化碳培养箱培养30分钟。离心弃去上清并用无血清培养基洗涤。然后将此细胞混悬液分别移取100微升分置不同PCR管中,再加入不同浓度的二吡啶酮腙二硫代甲酸丙酸酯处理一小时。用荧光分光光度仪直接测定对照组、实验组的荧光值(488nm激发)。如图4所示,二吡啶酮腙二硫代甲酸丙酸酯处理的细胞的ROS(荧光)明显高于对照组,显示与ROS有关。
2、二吡啶酮腙二硫代甲酸丙酸酯处理肝癌细胞时,凋亡相关蛋白发生改变
Western blotting分析凋亡相关蛋白发生改变,具体方法为:收集大约1x107HepG2经过或未经过二吡啶酮腙二硫代甲酸丙酸酯处理细胞,经PBS洗涤后,裂解(裂解液:50mM Tris-HCl,pH 8.0,150mM NaCl,1.0%NP-40,10%glycerol and protease inhibitors),14000×g离心,上清直接使用或储存-80℃。经蛋白定量后,50μg蛋白分别加入13%聚丙烯酰胺胶中电泳(200V for 2小时.然后转到PVDF膜(60V for 2小时)。随后该膜经洗涤后,在5%脱脂奶中进行封闭。弃去后再经洗涤,与一抗在室温共孵育2小时。再经洗涤后与二抗共孵育一小时,洗涤后.用增强液增敏,在Amersham imager 600(GE Healthcare Life Sciences,USA)获得蛋白条带。显然与对照相比,bcl-2减少,bax,caspase增加,说明二吡啶酮腙二硫代甲酸丙酸酯诱导的细胞毒性涉及凋亡。图5Western Blotting分析二吡啶酮腙二硫代甲酸丙酸酯细胞处理后,凋亡相关蛋白的变化。图中1是1.56μM二吡啶酮腙二硫代甲酸丙酸酯;2是0.78μM二吡啶酮腙二硫代甲酸丙酸酯;3是对照组。相关蛋白如图所示。
实例五,二吡啶酮腙二硫代甲酸丙酸酯细胞毒性与细胞周期停滞有关
将1x105HepG2细胞接种到六孔板孵育24小时(37℃,5%CO2)。更换为新鲜培养基后加入不同浓度(1.5及3.12μM)二吡啶酮腙二硫代甲酸丙酸酯继续培养24小时(未加药为对照),随后弃去培养液,胰酶消化后收集细胞,洗涤,并用70%乙醇固定。经碘化丙啶染色后,用流式细胞仪(Becton-Dickinson,USA)检测。与对照相比经二吡啶酮腙二硫代甲酸丙酸酯处理后S期细胞明显增多,说明二吡啶酮腙二硫代甲酸丙酸酯可干扰细胞周期。
实例六,二吡啶酮腙二硫代甲酸丙酸酯细胞毒性与诱导细胞自噬有关
将肝癌细胞分别接种到24孔板,贴壁后加入不同浓度(0.78and 1.56μM)的二吡啶酮腙二硫代甲酸丙酸酯,继续在(37℃,5%CO2)培养箱中培养24小时,然后加入吖啶橙(终浓度1μg/ml)进一步15分钟,PBS洗涤后,荧光显微镜观察并记录。结果显示在二吡啶酮腙二硫代甲酸丙酸酯处理的HepG2细胞中橙红色粒状斑点增多,标志自噬增强。
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!