一种鞘氨醇单胞菌遗传转化的方法与流程
本发明属于生物技术领域,具体涉及一种鞘氨醇单胞菌,以及一种通过电击对鞘氨醇单胞菌进行遗传转化的方法。
背景技术:
鞘氨醇单胞菌是一类丰富的新型微生物资源,其在地球上分布极其广泛,在各种水体,土壤,大气以及极端环境都有它存在的踪影。鞘氨醇单胞菌从属与a‐变形菌纲,鞘氨醇单胞菌目,鞘氨醇单胞菌科。该属菌株为革兰氏阴性菌,无孢子,以单侧生极性鞭毛运动,多呈黄色,专性需氧且能产生过氧化氢酶。鞘氨醇单胞菌自身具有很强的代谢能力,可以降解芳香族化合物,对于保护环境具有潜在应用价值;该属某些菌株胞外能够合成有价值的胞外生物高聚物,具有很高的经济利用价值;同时该属某些菌株胞内可以合成多种具较强抗氧化能力的类胡萝卜素,在工业生产上具有很高的应用价值。因此,鞘氨醇单胞菌目前受到了广泛的重视与研究。通过dna重组技术向其导入外源dna片段以研究鞘氨醇单胞菌降解芳香族化合物相关基因已成为研究其降解机制的重要手段,同时,根据应用微生物学,为提高生物高聚物,类胡萝卜素产量,将外源限速酶基因导入其体内也是一个重要应用手段。
常见对鞘氨醇单胞菌的基因转化,是通过三亲结合的方法将外源基因导入菌体内,但该方法存在周期长,操作复杂,转化效率低,可重复性差等缺点。通过电穿孔转化方案,即利用脉冲电场造成细胞壁的改变从而将外源dna导入细胞内,可以克服三亲结合转化法带来的困难。但由于常用质粒的复制子在鞘氨醇单胞菌中都无法复制的原因,无法实现将质粒或携带外源基因的质粒导入鞘氨醇单胞菌并使其在体内复制。因此,寻找鞘氨醇单胞菌兼容性复制子是基因转化的关键。
技术实现要素:
本发明的目的是提供一种鞘氨醇单胞菌,以及利用电击法将外源基因转化到鞘氨醇单胞菌体内的新方法。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
一种鞘氨醇单胞菌,保藏号为cgmccno.12394。
一种鞘氨醇单胞菌遗传转化的方法,包括以下步骤:
(1)构建电击转化鞘氨醇单胞菌所需质粒;
(2)制备鞘氨醇单胞菌感受态细胞;
(3)电击转化鞘氨醇单胞菌感受态细胞,转化后培养;
(4)转化用于遗传改造效果的验证。
根据所述的一种鞘氨醇单胞菌遗传转化的方法,其中步骤(1)中所述电击转化鞘氨醇单胞菌所需质粒是由将鞘氨醇单胞菌内源质粒复制子与phsg398质粒连接所构成。
根据所述的一种鞘氨醇单胞菌遗传转化的方法,其中所述步骤(1)中电击转化鞘氨醇单胞菌所需质粒是由将鞘氨醇单胞菌内源质粒或内源质粒上任何长度带有复制子的dna片段或基本上同源的一段dna序列与phsg398质粒连接所构成。
根据所述的一种鞘氨醇单胞菌遗传转化的方法,其中所述步骤(2)制备鞘氨醇单胞菌感受态细胞是将鞘氨醇单胞菌接种至lb培养基内,于28℃摇床孵育至吸光度od600nm=0.6-0.9,离心收集,使用预冷的10%甘油洗两遍,于-80℃冻存。
根据所述的一种鞘氨醇单胞菌遗传转化的方法,其中所述步骤(3)电击转化鞘氨醇单胞菌感受态细胞,采用电击条件为2.0kv-2.5kv,脉冲时间为4.5-5.5ms。
根据所述的一种鞘氨醇单胞菌遗传转化的方法,其中所述步骤(3)转化后培养是向电击后的鞘氨醇单胞菌感受态细胞加入tb培养基,震荡培养2-6小时。
根据所述的一种鞘氨醇单胞菌在对鞘氨醇单胞菌的遗传改造中的应用,是将由鞘氨醇单胞菌内源质粒上任意片段或基本同源的一段dna序列组成的质粒,用于对鞘氨醇单胞菌的遗传改造。
根据所述的一种鞘氨醇单胞菌遗传转化的方法,该方法包括下述步骤:
(一)构建转化所必须的质粒:
1、鞘氨醇单胞菌内源质粒的提取由常用质粒抽提试剂盒实现,将获得的内源质粒分别用限制性内切酶bamhⅰ,ecorⅰ,salⅰ进行消化,分别获得长度为6kb,5kb,3kb的dna片段,其三者共同特征是都含有内源质粒的复制子;
2、将带氯霉素抗性的质粒phsg398分别用限制性内切酶bamhⅰ,ecorⅰ,salⅰ进行消化,与(1)获得的三种不同大小的dna片段进行连接,构建得到三种不同大小的的质粒phsg398‐repb,phsg398‐repe,phsg398‐reps;
(二)制备感受态细胞:
1、从4℃冰箱中取出保藏的鞘氨醇单胞菌kib,挑取至lb液体培养基中,于28℃,220rpm过夜培养15-18小时,活化菌体;
2、用移液枪吸取2.5ml步骤1的培养物在无菌超净台接种于50mltb培养基中,28℃,220rpm振荡培养至od600nm=0.8;
3、将步骤2的菌液冰浴10min后,放入离心管中,4℃/5000rpm离心5min,弃上清,收集细胞;
4、在无菌超净台上用4℃预冷的20ml的10%甘油通过移液枪吹悬步骤3得到的细胞,4℃、5000rpm离心5min,弃上清,收集细胞,漂洗2次;
5、在无菌超净台上用2ml10%甘油吹悬步骤4得到的细胞,分装于离心管中,-80℃保存;
(三)电击转化
1、取100ng步骤一所构建的三种不同大小的质粒phsg398‐repb,phsg398‐repe,phsg398‐reps,分别加入到步骤二制备的感受态细胞中,在冰上通过移液枪轻微吐吸使所述质粒dna和感受态细胞充分混匀,冰浴2min;
2、将完成步骤1的体系转移至0℃预冷的1mm电击杯中,用电转仪进行电击,电压25kv/cm,时间常数=5ms;
3、完成步骤2后,立即向电击杯中加入1mltb培养基,混匀;
4、完成步骤3后,将电击杯中的菌液全部吸出至离心管中,28℃,220rpm振荡培养2-6小时;
5、将完成步骤4的培养体系涂布于含有终浓度为15μg/ml氯霉素的lb固体培养基平板,28℃培养48小时;
6、随机挑取生长出来的单克隆,提取质粒琼脂糖凝胶电泳,验证转化结果;
(四)转化用于遗传改造效果验证
1、将步骤一构建得到的phsg398‐reps质粒,用smaⅰ酶切,回收得到的片段与从衣藻中克隆的酮化酶基因bkt连接,得到phsg398‐reps‐bkt质粒;
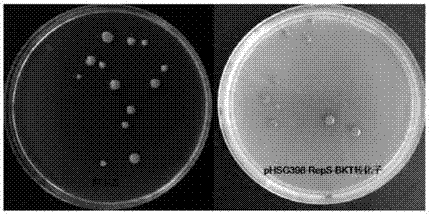
2、将phsg398‐reps‐bkt质粒,按步骤三电击转化鞘氨醇单胞菌,bkt基因在鞘氨醇单胞菌中表达,鞘氨醇单胞菌由原来的黄色变成了红色,超高效液相色谱分析,类胡萝卜素上的紫罗酮环上都加上了羰基,证明鞘氨醇单胞菌转化系统构建成功。
根据所述的一种鞘氨醇单胞菌遗传转化的方法,其中所述转化内源质粒复制子dna在3233bp‐4641bp之间;鞘氨醇单胞菌转化后回复时间为2‐6小时。
本发明针对三亲结合转化方法用于鞘氨醇单胞菌时存在的操作繁琐、成功率低、周期长、转化效率低等问题,提供了一种简便易行的鞘氨醇单胞菌快速转化新方法,该方法依托质粒复制的常规原理,思路清晰,操作简便,转化效果好,为菌株进行遗传操作打下了基础。本发明可在鞘氨醇单胞菌菌株改造上应用,如降解芳香族化合物机理,工业化生产结冷胶与类胡萝卜素,前景十分广阔。
附图说明:
图1为质粒phsg398图谱。
图2表示四种质粒phsg398,phsg398‐repb,phsg398‐repe,phsg398‐reps分别转化鞘氨醇单胞菌的生长状况。
图3表示转化系统建立成功,质粒phsg398‐reps‐bkt的转入使鞘氨醇单胞菌由黄色变成红色。
图4表示转入质粒phsg398‐reps‐bkt的鞘氨醇单胞菌转化子,高效液相色谱分析色素图谱。
图5表示鞘氨醇单胞菌内源质粒复制子确定在3233bp‐4641bp之间。
具体实施方法:
下面结合附图,用本发明的实施例来进一步更好的说明和理解本发明,但并不限定本发明。
下述实施例的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例用到的仪器或设备:
普通分光光度计购自:美国thermoscientific公司,biomate3s
高速离心机购自:德国eppendorf公司,5804r
电泳仪购自:美国bio-rad公司,powerpac
凝胶自动成像仪购自:美国labnet公司,uvpec3-310
超高效液相色谱购自:美国安捷伦科技有限公司,1290infinity
色谱柱购自:美国安捷伦科技有限公司,eclipseplusc18rrhd1.8μm
pcr仪购自:美国abi公司,veriti
电击转化仪购自:美国bio-rad公司,genepulserxcell
超净工作台购自:北京恒奥生物科技有限公司,9sw-cj-1f
ph计购自:丹佛仪器(北京)有限公司,ub-7
恒温摇床购自:上海比朗生物科技有限公司,bilon-cos-211b
高压灭菌器购自:上海博迅实业有限公司,yxq-ls-50s
恒温水浴锅购自:常州国宇仪器制造有限公司,hh
下述实施例的培养基或菌种:
鞘氨醇单胞菌kib:由本实验室分离,是在培养海洋微藻aurantiochytriumsp.sk4时,平板培养基上的污染物,平板培养基配方为:将5g葡萄糖、2g酵母提取物、50%人工海水、8g琼脂粉和蒸馏水充分混匀并用蒸馏水定容至1l;121摄氏度高温灭菌20min;人工海水培养为:30gnacl、0.7gkcl、10.8gmgcl2·6h2o、2.638gmgso4、0.756gcacl2和蒸馏水充分混匀并用蒸馏水定容至1l。该菌颜色鲜艳,菌落光滑圆润,挑取单克隆于lb培养液中,28摄氏度,220rpm培养。“鞘氨醇菌(sphingobiumsp.)”于2016年4月25日保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编:100101,电话:010-64807355,传真:010-64807288,电子邮件:cgmcc@im.ac.cn,网址:http://www.im.ac.cn),保藏号为cgmccno.12394。分类命名为:sphingobiumsp.该生物材料(株)的存活性经中国微生物菌种保藏管理委员会普通微生物中心保藏中心于2016.04.25检测为“存活”。
大肠杆菌jm109,购买于takara公司。
lb液体培养基(ph7.0)的制备方法:将10g氯化钠、10g胰蛋白胨、5g酵母提取物和蒸馏水充分混匀并用蒸馏水定容至1l;121摄氏度高温灭菌20min。
lb固体培养基(ph7.0)的制备方法:将10g氯化钠、10g胰蛋白胨、5g酵母提取物、10g琼脂粉和蒸馏水充分混匀并用蒸馏水定容至1l;121摄氏度高温灭菌20min。
tb液体培养基(ph6.5)的制备方法:将12g蛋白胨,24g酵母粉,4g甘油,2.312g磷酸二氢钾,16.416g三水磷酸氢二钾和蒸馏水充分混匀,并用蒸馏水定容至1l;121摄氏度高温灭菌20min。
10%甘油溶液的制备方法:将10g甘油用双蒸水溶解并定容至100ml;121摄氏度高温灭菌20min。
实施例1
本发明提供的一种电击转化鞘氨醇单胞菌的方法,包括构建转化所必须的质粒和制备感受态细胞、电击转化、转化后效果验证四个步骤;其中,所述构建转化所必须的质粒依次包括如下步骤:鞘氨醇单胞菌内源质粒的提取由常用质粒抽提试剂盒实现,将带有内源质粒复制子的dna片段与质粒phsg398连接,构建得到可在鞘氨醇单胞菌体内复制的质粒;所述制备感受态细胞包括如下步骤:将鞘氨醇单胞菌在lb培养基中活化,将活化后的鞘氨醇单胞菌接种于tb培养基中,振荡培养,培养至od600nm=0.8;所述tb培养基的制备方法为:将12g蛋白胨,24g酵母粉,4g甘油,2.312g磷酸二氢钾,16.416g三水磷酸氢二钾和蒸馏水充分混匀,并用蒸馏水定容至1l,ph调至6.5;所述电击转化包括如下步骤:将所述构建的质粒与所述感受态细胞混匀并冰浴,进行电击,得到导入所述构建质粒的重组鞘氨醇单胞菌。所述电击转化中,电击的电压为2.5kv。所述电击转化中,脉冲时间为4.5‐5.5ms。所述电击转化还包括在所述电击后进行如下处理步骤:向电击杯中加入1mltb培养基并混匀,振荡培养2h。
本发明提供的一种电击转化鞘氨醇单胞菌的方法,通过一系列改良实验条件来提高鞘氨醇单胞菌的转化效率。具体实验过程如下:
电击转化鞘氨醇单胞菌的方法:
(一)构建转化所必须的质粒:
1、鞘氨醇单胞菌内源质粒的提取由常用质粒抽提试剂盒实现,将获得的内源质粒分别用限制性内切酶bamhⅰ,ecorⅰ,salⅰ进行消化,分别获得长度为6kb,5kb,3kb的dna片段,其三者共同特征是都含有内源质粒的复制子。
2、将带氯霉素抗性的质粒phsg398分别用限制性内切酶bamhⅰ,ecorⅰ,salⅰ进行消化,与上述获得的三种不同大小的dna片段进行连接。构建得到三种不同大小的的质粒phsg398‐repb,phsg398‐repe,phsg398‐reps。
(二)制备感受态细胞:
1、取出从4℃冰箱中保藏的鞘氨醇单胞菌kib,挑取至lb液体培养基中,于28℃,220rpm过夜培养15-18小时,活化菌体;
2、用移液枪吸取2.5ml步骤1的培养物在无菌超净台接种于50mltb培养基中,28℃,220rpm振荡培养至od600nm=0.8;
3、将步骤2的菌液冰浴10min后,放入离心管中,4℃/5000rpm离心5min,弃上清,收集细胞;
4、在无菌超净台上用4℃预冷的20ml的10%甘油通过移液枪吹悬步骤3得到的细胞,4℃、5000rpm离心5min,弃上清,收集细胞,漂洗2次;
5、在无菌超净台上用2ml10%甘油吹悬步骤4得到的细胞,分装于离心管(100μl/管)中,-80℃保存。
(三)电击转化
1、取100ng步骤一所构建的三种不同大小的质粒phsg398‐repb,phsg398‐repe,phsg398‐reps,分别加入到1管步骤二制备的感受态细胞中,在冰上通过移液枪轻微吐吸使所述质粒dna和感受态细胞充分混匀,冰浴2min;
2、将完成步骤1的体系转移至0℃预冷的电击杯(1mm)中,用电转仪进行电击(电压25kv/cm,时间常数=5ms);
3、完成步骤2后,立即向电击杯中加入1mltb培养基,混匀;
4、完成步骤3后,将电击杯中的菌液全部吸出至离心管中,28℃,220rpm振荡培养2小时。
5、将完成步骤4的培养体系涂布于含有终浓度为15μg/ml氯霉素的lb固体培养基平板,28℃培养48小时。
6、随机挑取生长出来的单克隆,提取质粒琼脂糖凝胶电泳,验证是否转化成功。
经反复实验,空载体phsg398的转入,并不能长出任何克隆,而分别转入质粒phsg398‐repb,phsg398‐repe,phsg398‐reps的鞘氨醇单胞菌均可长出一定数量的阳性克隆,并且上述实验转化效率与插入dna片段长短成反比,如图2。
(四)转化用于遗传改造效果验证
1、将步骤一构建得到的phsg398‐reps质粒,用smaⅰ酶切,回收得到的片段与从衣藻中克隆的酮化酶基因bkt连接,得到phsg398‐reps‐bkt质粒。
2、将phsg398‐reps‐bkt质粒,按步骤三电击转化鞘氨醇单胞菌。bkt基因在鞘氨醇单胞菌中表达,鞘氨醇单胞菌由原来的黄色变成了红色(图3),超高效液相色谱分析,类胡萝卜素上的紫罗酮环上都加上了羰基(图4)。可以说明鞘氨醇单胞菌转化系统构建成功,并十分可靠,可以应用于对鞘氨醇单胞菌的遗传改造。
本发明还在以上实验的基础上进行优化,具体优化条件如下:
一、鞘氨醇单胞菌转化所需内源质粒复制子长度优化
在上述实验基础上,以质粒phsg398‐reps为模板,以phsgf1240/repr1728为引物,扩增后自连得到质粒phsg398‐repdel‐1。再以phsg398‐repdel‐1为模板,分别以phsgr1222/repf288,phsgr1222/repf488,phsgr1222/repf688为引物,扩增后自连得到质粒phsg398‐repdel‐2,phsg398‐repdel‐3,phsg398‐repdel‐4。如图5所示,最终将转化所需最短内源质粒复制子dna确定在3233bp‐4641bp之间。
二、鞘氨醇单胞菌转化后回复时间优化
鞘氨醇单胞菌转化后回复时间由2小时增加至6小时后,效果更佳。
实施例2:
鞘氨醇单胞菌的电击转化:
一、鞘氨醇单胞菌kib(保藏号为cgmccno.12394)转化所必须质粒的构建:
质粒phsg398(图谱见图1):购自takara公司;
穿梭质粒phsg398‐repb,phsg398‐repe,phsg398‐reps是在phsg398质粒基础上改造得到的,制备方法如下:
1、鞘氨醇单胞菌内源质粒的提取由常用质粒抽提试剂盒实现,将获得的内源质粒分别用限制性内切酶bamhⅰ,ecorⅰ,salⅰ进行消化,分别获得长度为6kb,5kb,3kb的含内源质粒复制子的dna片段。
2、将带氯霉素抗性的质粒phsg398分别用限制性内切酶bamhⅰ,ecorⅰ,salⅰ进行消化,与上述获得的三种不同大小的含内源质粒复制子的dna片段进行连接。构建得到三种不同大小的质粒phsg398‐repb,phsg398‐repe,phsg398‐reps。
酶切和连接反应的步骤如下所示:
酶切:
总反应体积20μl,在37℃温浴两小时,琼脂糖凝胶电泳回收相应dna片段。
连接反应体系
总反应体积为10μl,16℃过夜连接。将连接产物转化至大肠杆菌jm109,随机挑取单克隆于摇菌管中,37℃过夜培养,取2ml培养物提取质粒,酶切检测,确认构建成功后分别得到重组质粒phsg398‐repb,phsg398‐repe,phsg398‐reps。
质粒phsg398‐reps‐bkt的制备方法如下:
1.将质粒phsg398‐reps用限制性内切酶smaⅰ消化,回收dna片段。
酶切及去磷酸化反应的步骤如下所示:
总反应体积20μl,在25℃温浴两小时,琼脂糖凝胶电泳回收相应dna片段。回收所得片段去磷酸化,步骤如下:
总反应体积50μl,在37℃温浴30min,过回收柱终止反应。
2.以衣藻基因组为模板,以bktf和bktr分别为上下游引物,扩增酮化酶bkt基因。pcr体系和步骤如下:
总反应体积20μl,98℃预变性1min,98℃变性10s,60℃退火5s,72℃延伸30s,35个循环,72℃延伸5min。将扩增得到的dna片段,胶回收后末端磷酸化,磷酸化反应步骤如下所示:
总反应体积25μl,37℃温浴30min,过回收柱终止反应。
3.连接步骤1,2所得到的dna片,得到质粒phsg398‐reps‐bkt,步骤如下:
phsg398-reps片段2μl
bkt片段6μl
ligase1μl
10xligasebuffer1μl。
总反应体积为10μl,16℃过夜连接。将连接产物转化至大肠杆菌jm109,随机挑取单克隆于摇菌管中,37℃过夜培养,取2ml培养物提取质粒,pcr检测,确认构建成功后得到重组质粒phsg398‐reps‐bkt。
二.感受态细胞的制备
1、取出从4℃冰箱中保藏的鞘氨醇单胞菌kib,挑取至lb液体培养基中,于28℃,220rpm过夜培养15-18小时,活化菌体;
2、用移液枪吸取2.5ml步骤1的培养物在无菌超净台接种于50mltb培养基中,28℃,220rpm振荡培养至od600nm=0.8;
3、将步骤2的菌液冰浴10min后,放入离心管中,4℃/5000rpm离心5min,弃上清,收集细胞;
4、在无菌超净台上用4℃预冷的20ml的10%甘油通过移液枪吹悬步骤3得到的细胞,4℃、5000rpm离心5min,弃上清,收集细胞,漂洗2次;
5、在无菌超净台上用2ml10%甘油吹悬步骤4得到的细胞,分装于离心管(100μl/管)中,-80℃保存。
三、电击转化
1、取100ng步骤一所构建的三种不同大小的质粒phsg398‐repb,phsg398‐repe,phsg398‐reps,分别加入到1管步骤二制备的感受态细胞中,在冰上通过移液枪轻微吐吸使所述质粒dna和感受态细胞充分混匀,冰浴2min;
2、将完成步骤1的体系转移至0℃预冷的电击杯(1mm)中,用电转仪进行电击(电压25kv/cm,时间常数=5ms);
3、完成步骤2后,立即向电击杯中加入1mltb培养基,混匀;
4、完成步骤3后,将电击杯中的菌液全部吸出至离心管中,28℃,220rpm振荡培养2小时。
5、将完成步骤4的培养体系涂布于含有终浓度为15μg/ml氯霉素的lb固体培养基平板,28℃培养48小时。
6、随机挑取生长出来的单克隆,提取质粒,分别用限制性内切酶bamhⅰ,ecorⅰ,salⅰ酶切检测,琼脂糖凝胶电泳,验证是否转化成功。经反复实验,空质粒phsg389的转入并不能长出任何克隆,而转入质粒phsg398‐repb,phsg398‐repe,phsg398‐reps均可长出相应数量的克隆,并且长出的克隆数与插入dna片段长短成反比(如图2)。质粒phsg398‐repb,phsg398‐repe,phsg398‐reps的共有特点是,插入的dna片段都包含鞘氨醇单胞菌内源质粒上的质粒复制子repa,而repa的插入使质粒phsg398获得了可以在鞘氨醇单胞菌中复制的能力。
四、转化用于遗传改造效果验证
1、取100ng步骤一所构建的质粒phsg398‐reps‐bkt,按步骤三所述的电击转化方法转入步骤二制备的感受态中。
2、长出的菌落由野生型的黄色变成了红色,如图3。其本质是基因bkt在鞘氨醇单胞菌中表达,使鞘氨醇单胞菌体内的色素发生改变,高效液相色谱分析如图4,红色峰为野生型鞘氨醇单胞菌,蓝色峰为转化株,所有类胡萝卜素的紫罗酮环上都引入了羰基。说明鞘氨醇单胞菌可以用这种简便的转化方法对其进行遗传改造。
3、该转化方法的建立意义重大,是对鞘氨醇单胞菌进行基因转化研究的有效手段,为鞘氨醇单胞菌的基因工程育种、遗传学及分子生物学研究提供了方便、快速和高效的基因导入方法,可用于对鞘氨醇单胞菌降解芳香族化合物、胞外生产冷凝胶及胞内生产类胡萝卜素等机制的研究与工业化应用。
实施例3
为了进一步确定鞘氨醇单胞菌转化所需的最短有效片段,提高转化效率,本发明同时进行了如下试验,并得出结果:
1、质粒phsg398‐repd‐1,phsg398‐repd‐2,phsg398‐repd‐3,phsg398‐repd‐4是在phsg398‐reps质粒基础上改造得到的,制备方法如下:
以穿梭质粒phsg398‐reps为模板,以phsgf1240tggcactggccgtcgttttacaac和repr1728caagcttgcgcctgttcgcgtccagtcct为上下游引物,扩增后自连得到质粒phsg398‐repd‐1。pcr体系和步骤如下:
总反应体积20μl,98℃预变性1min,98℃变性10s,60℃退火5s,72℃延伸150s,35个循环,72℃延伸5min。将扩增得到的dna片段胶回收后末端磷酸化,磷酸化反应步骤如下所示:
总反应体积25μl,37℃温浴30min,过回收柱终止反应,将产物自连,自连反应步骤如下:
dna8ul
ligase1μl
10xligasebuffer1μl。
总反应体积为10μl,16℃过夜连接。将连接产物转化至大肠杆菌jm109,随机挑取单克隆于摇菌管中,37℃过夜培养,取2ml培养物提取质粒,酶切检测,确认构建成功后得到重组质粒phsg398‐rep‐1。
再以穿梭质粒phsg398‐repd‐1为模板,以phsgr1222gacgtcgactctagaggatccccgggta和repf288cgcccccttcttgttctaagcagatcc分别为上下游引物,phsgr1222和repf488gtgttacctacggagtaagttacgcggctc分别为上下游引物,phsgr1222和repf688atgagcctgcttccagatcggcacc分别为下上游引物,扩增后自连得到质粒phsg398‐repd‐2,phsg398‐repd‐3,phsg398‐repd‐4。pcr体系和步骤如下:
总反应体积20μl,98℃预变性1min,98℃变性10s,62℃退火5s,72℃延伸150s,35个循环,72℃延伸5min。
总反应体积20μl,98℃预变性1min,98℃变性10s,62℃退火5s,72℃延伸150s,35个循环,72℃延伸5min。
总反应体积20μl,98℃预变性1min,98℃变性10s,62℃退火5s,72℃延伸150s,35个循环,72℃延伸5min。
将扩增得到的dna片段分别胶回收后末端磷酸化,磷酸化反应步骤如下所示:
总反应体积25μl,37℃温浴30min,过回收柱终止反应,将产物自连,自连反应步骤如下:
dna8ul
ligase1μl
10xligasebuffer1μl。
总反应体积为10μl,16℃过夜连接。将连接产物转化至大肠杆菌jm109,随机挑取单克隆于摇菌管中,37℃过夜培养,取2ml培养物提取质粒,酶切检测,确认构建成功后分别得到重组质粒phsg398‐repdel‐2,phsg398‐repdel‐3,phsg398‐repdel‐4。phsg398‐reps,phsg398‐repd‐1,phsg398‐repd‐2,phsg398‐repd‐3,phsg398‐repd‐4的关系如图5。
2.将获得的质粒phsg398‐reps,phsg398‐repd‐1,phsg398‐repd‐2,phsg398‐repd‐3,phsg398‐repd‐4分别转化鞘氨醇单胞菌。感受态制备方法如实施例1的步骤二,电击转化方法如实施例1的步骤三。转入质粒phsg398‐reps,phsg398‐repd‐1,phsg398‐repd‐2,phsg398‐repd‐3的鞘氨醇单胞菌均有阳性克隆长出,而转入质粒phsg398‐repd‐4的鞘氨醇单胞菌没有长出任何克隆,与转入空载体phsg398的现象一致,经分析,质粒phsg398‐reps,phsg398‐repd‐1,phsg398‐repd‐2,phsg398‐repd‐3均含有完整的鞘氨醇单胞菌内源质粒复制子,可以使重组质粒在鞘氨醇单胞菌内复制,最终将鞘氨醇单胞菌内源质粒复制子确定在3233bp‐4641bp之间。
最后应说明的是:以上实施例仅为本发明的优选实施例,并不能用于限制本发明,本领域的普通技术人员都会理解,在本发明的保护范围内,对于上述实施例进行修改,添加和替换都是可能的,其都没有超出本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!