一种来源于伯克霍尔德氏菌的DPE及其应用的制作方法
本发明属于基因工程技术领域,具体涉及一种来源于伯克霍尔德氏菌(Burkholderia sp.)MR1的D-阿洛酮糖-3-差向异构酶(DPE)及其应用。
背景技术:
D-阿洛酮糖是近年发现的一种具有特殊保健功能的新型功能性稀少糖,它的甜度相当于果糖的70%,能量只有蔗糖的0.3%,具有低能量、改善肠道菌群、降低血糖、抗龋齿等生理功能。2011年FDA认可甜味剂D-阿洛酮糖可以作为食品添加剂使用。自此D-阿洛酮糖得到了迅速发展,市场上出现了多种含D-阿洛酮糖的产品,像糖尿病患者就应选择此类低热量安全性高的甜味剂,此类甜味剂可以使患者在维持健康膳食的前提下同样享受甜蜜滋味。2012年,松谷化学工业在日本国内发售添加有13%~15%比例的D-阿洛酮糖、阿洛糖等3种以上的稀少糖糖浆产品(Rare-sugar sweet(简称RSS)),受到消费者欢迎。
自然界中,D-阿洛酮糖的含量极少,近年来通过新技术开发可实现其大规模生产。D-阿洛酮糖的生产方法有化学法和生物法。化学合成法存在工艺复杂、副产物多、分离纯化困难、食品安全性等问题。日本的研究学者Izumori于2002年建立了稀少糖的生物转化生产策略,即Izumoring方法,该方法中利用酮糖差向异构酶(ketose epimerase)、醛糖异构酶(aldose isomerases)和多元醇脱氢酶(poly dehydrogenase)进行所有单糖及糖醇之间的相互转化,从而利用廉价的原料制备各种稀少糖(K.Izomuri,2006,J.Biotechnol.,124 :717-722)。Izumoring策略提示了D-阿洛酮糖的生物转化方法,即利用食品工业中加工副产物淀粉为原料经过现有成熟工艺获得D-果糖,再通过酮糖3位差向异构酶把D-果糖差向异构化为D-阿洛酮糖,该方法因具有反应简单、产物单一、纯化步骤容易等优点而逐渐吸引了众多科学家的关注,也成为D-阿洛酮糖商业化生产的热点和焦点。
当前可以实现将D-果糖异构化为D-阿洛酮糖,有两种异构化酶:D-阿洛酮糖-3-差向异构酶(D-psicose-3-epimerase,缩写为DPE)和D-塔格糖-3-差向异构酶(D-tagatose-3-epimerase,缩写为DTE),DPE的最适底物为D-阿洛酮糖,DTE的最适底物则为D-塔格糖。对于这两种异构酶,已经发现的有Rhodobacter sphaeroides SK01来源的DTE酶,Clostridium cellulolyticum H10来源、Ruminococcus sp.来源和Clostridium scindens来源的DPEase酶。这些酶统称为DTEase家族酶。目前,DPE酶用于催化D-果糖和D-阿洛酮糖之间的转化,利用D-果糖生产D-阿洛酮糖。目前,专利或文献报道的DPE基因较少,使未来作为生产D-阿洛酮糖的可选择来源酶受到到局限性,限制了其应用范围。
技术实现要素:
发明目的:针对现有技术中存在的不足,本发明的目的是提供一种来源于伯克霍尔德氏菌(Burkholderia sp.)MR1的D-阿洛酮糖-3-差向异构酶。本发明的另一目的是提供上述D-阿洛酮糖-3-差向异构酶的编码基因。本发明还有一目的是提供表达上述D-阿洛酮糖-3-差向异构酶的载体或宿主菌。本发明还有一目的是提供上述D-阿洛酮糖-3-差向异构酶的应用。
技术方案:为了实现上述发明目的,本发明采用的技术方案为:
一种来源于伯克霍尔德氏菌(Burkholderia sp.)MR1的D-阿洛酮糖-3-差向异构酶,其氨基酸序列如SEQ ID NO.1所示。
编码所述的D-阿洛酮糖-3-差向异构酶的基因,其核苷酸序列如SEQ ID NO.2所示。
表达所述的D-阿洛酮糖-3-差向异构酶的重组载体或宿主菌。
所述的D-阿洛酮糖-3-差向异构酶在制备D-阿洛酮糖中的应用。
所述的重组载体或宿主菌在表达D-阿洛酮糖-3-差向异构酶中的应用。
所述的重组载体或宿主菌在制备D-阿洛酮糖中的应用。
有益效果:与现有技术相比,本发明获得了Burkholderia sp. MR1的D-阿洛酮糖-3-差向异构酶基因,并将其克隆表达于大肠杆菌细胞中。该酶可以将廉价的D-果糖转化为D-阿洛酮糖,并且有很好的热稳定性和催化效率,酶反应底物浓度高,且转化率高,这对通过基因重组和表达技术的大规模工业化生产十分有利,有很强的竞争力。
附图说明
图1是D-果糖标准物的高效液相色谱图;
图2是D-阿洛酮糖标准物的高效液相色谱图;
图3是BsDPE粗酶液与D-阿洛酮糖60℃反应后的高效液相色谱图;
图4是重组BsDPE的最适温度结果图;
图5是重组BsDPE的最适pH结果图;
图6是果糖浓度对重组BsDPE活性的影响结果图;
图7是温度对重组BsDPE稳定性的影响(40℃,50℃,60℃)结果图。
具体实施方式
下面结合具体实施例对本发明做进一步的说明。应理解这些实施例仅用于说明本发明而不是限制本发明的范围。
实施例1 重组BsDPE及表达
从伯克霍尔德氏菌(Burkholderia sp.)MR1中分离获得一未知蛋白,其氨基酸序列如SEQ ID NO.1所示,推测为DPE蛋白,表达该DPE蛋白的DNA序列如SEQ ID NO.2所示,由常州基宇生物科技有限公司进行全基因合成,5’和3’端分别带有NdeI和BamHI酶切位点。表达DPE蛋白的DNA序列,也可以伯克霍尔德氏菌的基因组DNA为模板,进行常规PCR方法获得。
将全基因合成的DNA片段和表达载体pET 29a(Novagen)分别用NdeI和BamHI限制性内切酶(New England Biolabs,NEB)双酶切后进行连接反应,连接反应体系(10 μL):T4 DNA连接酶(Takara)1 μL;10×T4 Buffer 1 μL;基因片段与载体8 μL(摩尔比5﹕1),16℃过夜反应。
然后,将10μL连接反应液加到100 μL的E.coli DH5α感受态细胞(购于天根生化科技(北京)有限公司)中,置于冰上30分钟,42℃热激90 s,迅速放在冰上冷却2 min,接着加入无菌的800 μL的LB液体培养基。37℃,160 rpm培养1 h。然后培养液3000 rpm离心2 min,吸掉700 μL的上清,用移液枪轻轻吹打重悬菌体。然后涂布到含有 50 μg/mL 硫酸卡那霉素(Kan)的LB固体平板上,培养12-16 h。挑取单菌落打入10 μL ddH2O,进行菌落PCR验证,筛选出阳性克隆单菌落。菌落PCR反应体系(25 μL):单菌落悬液1 μL;r-Taq聚合酶(5 U/μL,Takara)0.2 μL;dNTP Mixture(2.5 mM each,Takara)2 μL;10×PCR Buffer 2.5 μL;引物T7(20 μM)和T7 ter(20 μM)各0.5 μL;ddH2O 18.3 μL。PCR条件:94℃预变性5 min;94℃变性30 s;58℃退火1 min;72℃延伸1 min;循环28次;72℃ 10 min。琼脂糖凝胶电泳验证阳性克隆的单菌落接种到5 mL的LB液体培养基中,培养12 h,取1 mL送测序同时留样保存在15%甘油的EP管中。
最后,把重组质粒BsDPE-pET29a转化到BL21(DE3)感受态细胞(购于天根生化科技(北京)有限公司),由此制备得到BsDPE的表达菌株。
挑取在含卡那霉素( 终浓度为50 μg/mL) 的LB培养基平板上出现的阳性转化子,接种于3 mL含卡那霉素( 终浓度为50 μg/mL) 的LB培养基,37℃,200 rpm过夜培养,以1%的接种量接入50 mL以上LB培养基中,37℃,200 rpm继续培养4-5 h;待培养物OD600=0.6-0.8时,加入IPTG,使其终浓度为0.1 mmol/L,20℃,150 rpm过夜培养。6000 rpm 离心收集菌体,用去离子水洗涤三次,用2 mL无菌水重悬菌体,超声破碎,12000 rpm离心收集上清液,即为BsDPE粗酶液。
实施例2. 重组BsDPE的酶活测定
标准反应条件如下:取0.25 μL的DPE粗酶液与0.5 mL 50%的D-果糖溶液于60℃反应10 min,然后100℃处理10 min灭活酶的活性。用0.45 μm的微孔滤膜过滤,滤液做高效液相分析。高效液相色谱按如下条件进行:岛津SHIMADZU LC-20A HPLC with RID detector;分析柱:Waters Sugar-Pak I, 6.5×300mm column;流动相:水;流速:0.6 mL/min;柱温:80℃;检测器:RID,检测器温度60℃。
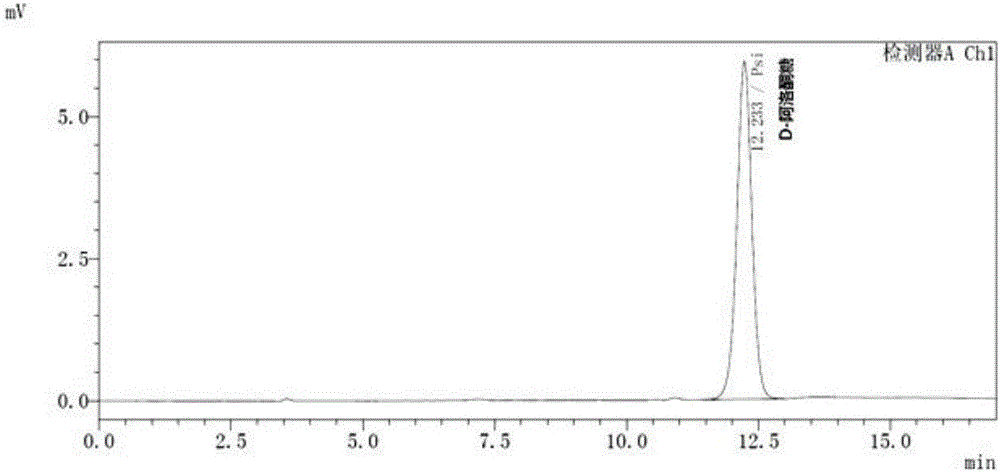
以Sigma 公司生产的D-果糖和D-阿洛酮糖纯品为标准品,将实施例1获得的样品进行分析,上样量为20 μL。色谱分析结果显示D-果糖和D-阿洛酮糖标准物(图1、图2)、DPE与D-果糖(图3)60℃反应1 h后的高效液相色谱图。通过与D-果糖和D-阿洛酮糖标准品的保留时间进行比较鉴别出各个峰。图1中保留时间为9.389 min 对应的峰为D-果糖,图2中保留时间为12.233 min对应的峰为D-阿洛酮糖。由此可见,本发明中分离得到的来源于Burkholderia sp. MR1的DPE酶可以催化D-果糖和D-阿洛酮糖之间的差向异构反应,反应达到平衡时D-果糖和D-阿洛酮糖的浓度比例约为7:3(图3)。
实施例3 重组BsDPE 酶学性质的鉴定
最适温度的测定:按照实施例2中的标准反应,以50%果糖为底物,分别于25、35、40、45、50、55、60、65、70、80℃下反应10 min,然后100℃处理10 min灭活。以60℃下酶活为100%,计算各温度下的相对酶活。
最适pH 的测定:按照上例中的标准反应,以50%果糖为底物,分别于pH 5.0、6.0、7.0、7.5、8.0、8.5、9.0、10.0下反应10 min,然后100℃处理10 min灭活。以pH7.0下酶活为100%,计算各pH下的相对酶活。
温度对酶稳定性的影响:按照实施例2中的标准反应,首先将DPE分别于40、50、60℃下保温30、60、90、120、150min,然后以50%果糖为底物,60℃下反应10 min,100℃处理10 min灭活。以不经热处理的酶活为100%,计算各温度下保温不同时间时的相对酶活。
结果见图4-7,可见Burkholderia sp. MR1的DPE的最适反应温度为65℃(图4),最适pH5.0-9.0(图5),并且在果糖浓度10~50%均保持30%左右转化率(图6)。此外,该酶热稳定性较好,于60℃下保温150min相对酶活仍然在80%左右(图7)。
实施例6. 1L反应体系下BsDPE酶转化果糖生成D-阿洛酮糖反应验证
反应体系:果糖500 g,纯化水500g,氯化钴1mM。
将上述样品混匀后预热至60℃进行反应,加入BsDPE粗酶液30mL,机械搅拌开始进行反应,反应过程中取样然后100℃处理10 min灭活酶的活性。用0.45 μm的微孔滤膜过滤,滤液做高效液相分析。结果反应3h转化率达到29.6%,停止反应。
SEQUENCE LISTING
<110> 上海立足生物科技有限公司
<120> 一种来源于伯克霍尔德氏菌的DPE及其应用
<130> 100
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 290
<212> PRT
<213> Burkholderia sp.
<400> 1
Met Asn Lys Val Gly Met Phe Tyr Thr Tyr Trp Ser Thr Glu Trp Met
1 5 10 15
Val Asp Phe Pro Ala Thr Ala Lys Arg Ile Ala Gly Leu Gly Phe Asp
20 25 30
Met Met Glu Ile Ser Leu Gly Glu Phe His Asn Leu Pro Asp Ala Lys
35 40 45
Lys Arg Glu Leu Lys Ser Val Ala Asp Asp Leu Gly Leu Thr Val Met
50 55 60
Cys Cys Ile Gly Leu Lys Ser Glu Tyr Asp Phe Ala Ser Pro Asp Lys
65 70 75 80
Ser Val Arg Asp Ala Gly Thr Glu Tyr Val Lys Arg Leu Leu Asp Asp
85 90 95
Cys His Leu Leu Gly Ala Pro Val Phe Ala Gly Leu Thr Phe Cys Ala
100 105 110
Trp Pro Gln Ser Pro Pro Leu Asp Met Lys Asp Lys Arg Pro Tyr Val
115 120 125
Asp Arg Ala Ile Asp Ser Val Arg Arg Val Ile Lys Val Ala Glu Asp
130 135 140
Tyr Gly Ile Ile Tyr Ala Leu Glu Val Val Asn Arg Phe Glu Gln Trp
145 150 155 160
Leu Cys Asn Asp Ala Lys Glu Ala Leu Ala Phe Ala Asp Ala Val Asp
165 170 175
Ser Pro Ala Cys Lys Val Gln Leu Asp Thr Phe His Met Asn Ile Glu
180 185 190
Glu Ser Ser Phe Arg Asp Ala Ile Leu Ala Cys Lys Gly Lys Met Gly
195 200 205
His Phe His Leu Gly Glu Ala Asn Arg Leu Pro Pro Gly Glu Gly Arg
210 215 220
Leu Pro Trp Asp Glu Ile Phe Gly Ala Leu Lys Glu Ile Glu Tyr Asp
225 230 235 240
Gly Thr Ile Val Met Glu Pro Phe Met Arg Lys Gly Gly Ser Val Ser
245 250 255
Arg Ala Val Gly Val Trp Arg Asp Met Ser Asn Gly Ala Thr Asp Glu
260 265 270
Gln Met Asp Glu Arg Ala Arg Arg Ser Leu Gln Phe Val Arg Glu Lys
275 280 285
Leu Ala
290
<210> 2
<211> 873
<212> DNA
<213> Burkholderia sp.
<400> 2
atgaacaaag tgggcatgtt ctatacctat tggagcaccg aatggatggt tgattttccg 60
gcaaccgcaa aacgtattgc aggtctgggt tttgatatga tggaaattag cctgggcgaa 120
tttcataatc tgccggatgc aaaaaaacgc gaactgaaaa gcgttgcaga tgatctgggt 180
ctgaccgtta tgtgttgtat tggtctgaaa tccgaatatg attttgccag tccggataaa 240
agcgttcgtg atgcaggcac cgaatatgtt aaacgtctgc tggatgattg tcatctgctg 300
ggtgcaccgg tttttgccgg tctgaccttt tgtgcatggc ctcagagccc tccgctggat 360
atgaaagata aacgtccgta tgttgatcgt gccattgata gcgttcgtcg tgttattaaa 420
gttgccgaag attatggcat tatctatgcc ctggaagtgg tgaatcgttt tgaacagtgg 480
ctgtgtaatg atgcaaaaga agcactggca tttgcagatg cagttgatag tccggcatgt 540
aaagttcagc tggatacctt tcacatgaac attgaagaaa gcagcttccg tgatgcaatt 600
ctggcctgta aaggtaaaat gggtcatttt catctgggtg aagcaaatcg tctgcctccg 660
ggtgaaggtc gtctgccgtg ggatgaaatt tttggtgcac tgaaagaaat cgagtatgat 720
ggcaccattg ttatggaacc gtttatgcgt aaaggtggta gcgttagccg tgcagttggt 780
gtttggcgtg atatgagcaa tggtgcaacc gatgagcaga tggatgaacg tgcccgtcgt 840
agcctgcaat ttgttcgtga aaaactggca taa 873
- 还没有人留言评论。精彩留言会获得点赞!