用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
本发明涉及盖塔病毒诊断和检测领域,具体而言,涉及一种用于盖塔病毒实时荧光定量PCR检测体系及检测方法。
背景技术:
盖塔病毒(GETV)是一种RNA病毒,属披盖病毒科甲病毒属成员,广泛分布于亚洲及澳大利亚北部的太平洋沿岸地区,在中国、印度、巴基斯坦、东南亚、日本等国家和地区均有盖塔病毒流行的报道。1955年,该病毒在马来西亚首次分离到,一年后在日本也分离到这种病毒。六十年代,澳大利亚研究者进行了人和动物血清抗体检查,证明了GETV对人和动物的感染性。1978年,甲野等首次在日本赛马群中发现了由本病毒引起的传染病,两个月之内感染了同群的大部分马匹。病马以体温升高(38.5-41℃,持续1-4天)症状为主,约1/3的病马伴随发疹和浮肿,一周后可痊愈。痊愈马血清中出现特异性中和抗体、补结抗体和血凝抑制抗体。当时采用组织培养病毒接种健康马,能引起与自然病马同样的症状。1979和1983年,该病再次在日本流行,全国大约1/4的马匹呈血清阳性,流行期间20%~70%的感染马出现临床症状。此后,灭活疫苗开始用于该病的预防。对马致病性的发现,重新引起了学者们对GETV的兴趣,尤其是GETV对人类和其它携带抗体动物的致病性方面。
目前,检测盖塔病毒的主要方法有病原分离、血凝和血凝抑制方法、间接免疫荧光(IFA)、普通的RT-PCR方法等等,但是病原分离的方法需要的时间比较长,需要在生物安全三级实验室进行,而血凝抑制的特异性和敏感性并不能满足检验检疫的要求,另外间接免疫荧光法需要较昂贵的显微镜和有经验的实验人员,且该方法经验性较强,耗时长,难度相对较大,不易操作,最后普通的RT-PCR方法相比于前两种方法虽然具有操作简便、速度快、以及特异性强等优点,但是当病毒含量比较低时,会出现假阴性的结果,灵敏度比较低。
鉴于以上问题的存在,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种用于盖塔病毒实时荧光定量PCR检测的检测体系,所述检测体系中所包含的引物组和探针特异性强,重复性好,灵敏度高,检测的最低模板量可以达到2.03x101copies/μl,而普通的RT-PCR方法最低只能检测到2.03x105copies/μl,其灵敏度可以达到常规的RT-PCR技术的10000倍。
本发明的第二目的在于提供一种盖塔病毒的实时荧光定量PCR检测方法,该检测方法操作简便,检测效率高,当病毒含量非常低时,依然能进行准确的检测,完全不会有假阴性的结果发生,避免了错误率,并且该检测方法相对与常用的其他检测方法具有更高的敏感性、特异性以及准确性,此外该检测方法还具有很强的应用性,可良好的用于盖塔病毒的检测,弥补了盖塔病毒实时荧光定量PCR检测的相关技术空白。
为了实现本发明的上述目的,特采用以下技术方案:
本发明提供了一种用于盖塔病毒实时荧光定量PCR的检测体系,包括用于扩增盖塔病毒基因序列的引物组以及拥有捕获盖塔病毒基因序列的探针,所述引物组由具有SEQ ID No.1所示碱基序列的上游引物,具有SEQ ID No.2所示碱基序列的下游引物组成,所述探针具有SEQ ID No.3所示碱基序列。
本发明提供的用于盖塔病毒实时荧光定量PCR的检测体系,特异性强,重复性好,灵敏度高,其灵敏度可以达到常规的RT-PCR技术的10000倍,该引物组是发明人通过参照GenBank收录的所有盖塔基因序列保守区进行特定设计的一对具有特异性的引物,因此特异性非常好,采用该引物组以及探针用于盖塔病毒实时荧光定量PCR检测在本领域中尚属首创,现有技术中没有任何记载。
另外,探针优选为TaqMan探针,这种荧光探针是一种寡核苷酸探针,优选地,荧光基团FAM连接在探针的5'末端,而淬灭剂则在3'末端,检测特异性非常强,只有特异扩增产物才会产生荧光信号,非特异扩增和引物二聚体不会产生荧光信号,可实现对同一次反应中的多个目标进行多重检测。
本发明还提供了一种用于盖塔病毒实时荧光定量PCR检测方法,具体包括如下步骤:
以上述的检测体系对待测样品进行实时荧光定量PCR检测。
本发明这种盖塔病毒的实时荧光定量PCR检测方法,操作简便,检测效率高,当病毒含量非常低时,依然能进行准确的检测,完全不会有假阴性的结果发生,避免了错误率,并且该检测方法相对与常用的其他检测方法具有更高的敏感性、特异性以及准确性,此外该检测方法具有很强的应用性,可良好的用于盖塔病毒的检测,弥补了盖塔病毒实时荧光定量PCR检测的相关技术空白,也为类似于盖塔病毒的其他病原基因的检测奠定了相关的定量分析基础,给本领域技术人员以相关技术启示。
优选地,在进行实时荧光定量PCR检测之前,需要先建立Ct值与标准样品的不同拷贝数所构成的标准曲线。
优选地,实时荧光定量PCR检测所用的待测样品为盖塔病毒的总RNA反转录得到的cDNA。
因此,在真正的进行实时荧光定量PCR检测的过程中,将待测样品与标准样品以相同的反应体系和PCR程序进行实时荧光定量PCR,得到的Ct值与所述标准曲线比对,即可得到待测样品中盖塔病毒基因的表达量。
其中,在相同的反应体系和PCR程序进行实时荧光定量PCR的检测结果是可以直接由电脑软件读出的,不需要进行后续处理,这种操作步骤避免了检测结果假阳性的产生及对环境的污染,实现了待测样品的定量检测,整个检测过程大概只需1h左右,相对于常规的RT-PCR方法,大大简化了操作步骤,缩短了检测时间,提高了劳动效率。
并且,预先采用标准样品制得标准曲线,然后将待测样品以与标准样品同样的条件进行实时荧光定量PCR,得到的Ct值与标准曲线比对,即可得知待测样品中盖塔病毒基因的表达量,通过这种操作方式可以完全避免其他因素对表达量的影响,增加了测定盖塔病毒基因的准确度,这也是采用实时荧光定量PCR检测方法的优势所在。
更进一步的,标准样品的制备方法包括:
(A)提取盖塔病毒的总RNA,反转录得到cDNA;
(B)采用上游引物、下游引物对cDNA进行PCR扩增,反应后进行琼脂糖凝胶电泳,回收目标片段,即得。
其中,对盖塔病毒的总RNA进行实际提取操作时,一般是按照以下步骤进行:将Vero细胞置于含10%胎牛血清的DMEM培养基中培养,培养条件为37℃、5%CO2的细胞培养箱,待细胞长到单层90%密度时,将培养基弃去,并用PBS溶液洗涤2次,按照MOI:0.5的量将GETV病毒液加入T25培养瓶中,并补充无血清的DMEM培养基至5mL,将培养瓶放入37℃、5%CO2培养箱中继续培养4-5d,然后将培养瓶放入-80℃的冰箱中,反复冻融三次后将病毒液取出,离心转速9000g,离心5min,取上清-80℃保存备用,然后采用试剂盒针对已经离心的GETV病毒液上清进行总RNA提取,本发明采用的试剂盒一般为北京全式金生物技术有限公司ViralDNA/RNAKit试剂盒,按照上述操作步骤即可完成整个盖塔病毒的总RNA的提取。
后续,经在Genbank网站,查找GETV毒株M1 NSP1的基因序列(GenBank登录号为EU015061),比对GenBank中GETV各亚型代表株,XY0904(JN582181)、HB0234(EU015062)、YN0540(EU015063)的NSP1序列,设计特异性引物,上游引物GETV-F,序列为:GAGAAAGAAGTGCTTGC,下游引物GETV-R,序列为:GGTGATCTTCTTTACCAC,扩增出的目标片段大小为200bp,以用于标准样品的制作。
回收目标片段时,最好是先将目标片段连接至载体上,进行质粒扩增,扩增后提取质粒,经鉴定正确后,该质粒为标准样品。
优选地,上述步骤所用的载体为pMD18-T载体。
优选地,质粒扩增的具体步骤为:将回收的目标片段克隆至pMD18-T载体上,转化至DH5α感受态细胞,挑取生长良好的菌落培养。
挑取了生长良好的菌落进行测序鉴定,如果测序的结果与GETV毒株M1序列一致的情况下,说明本发明的目标基因片段扩增完全正确,该质粒扩增的方法简单易行,且容易获得大量含有目标片段的质粒。
优选地,实时荧光定量PCR检测的PCR反应体系为:Premix Ex TaqTMProbe qPCR 10-13μl,上游引物10-12μmol、下游引物10-12μmol,探针4-5μmol,检测样品1-2μl,ddH2O补齐至25μL。
待测样品采用该PCR反应体系进行实时荧光定量PCR,得到的曲线稳定。此外,PCR反应体系的选择可以根据选用的试剂盒推荐进行,还可以选用其他体积,如常用的20μl体系、50μl体系等,其中成分的含量只需要相应地降低或升高即可。
优选地,实时荧光定量PCR扩增程序为:94-95℃预变性30-35s,94-95℃变性5-7s,55-60℃退火10-15s,72-75℃延伸15-20s,共35-40个循环。以该实时荧光定量PCR扩增程序进行扩增,扩增特异性好,扩增得到的数据稳定。
此外,对标准样品反转录得到的cDNA采用相同的PCR反应体系和PCR扩增程序进行实时荧光定量PCR,可以得到标准曲线。
与现有技术相比,本发明的有益效果为:
(1)本发明的用于盖塔病毒实时荧光定量PCR检测的引物组和探针,所述的引物组和探针特异性强,重复性好,灵敏度高,检测的最低模板量可以达到2.03x101copies/μl,而普通的RT-PCR方法最低只能检测到2.03x105copies/μl,其灵敏度可以达到常规的RT-PCR技术的10000倍;
(2)本发明提供的盖塔病毒的实时荧光定量PCR检测方法,操作简便,检测效率高,当病毒含量非常低时,依然能进行准确的检测,完全不会有假阴性的结果发生,避免了错误率,并且该检测方法相对与常用的其他检测方法具有更高的敏感性、特异性以及准确性;
(3)本发明的盖塔病毒的实时荧光定量PCR检测方法具有很强的应用性,可良好的用于盖塔病毒的检测,弥补了盖塔病毒实时荧光定量PCR检测的相关技术空白,也为类似于盖塔病毒的其他病原基因的检测奠定了相关的定量分析基础,给本领域技术人员以相关技术启示。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1为本发明实施例1的盖塔基因PCR产物的琼脂糖凝胶电泳检测图;
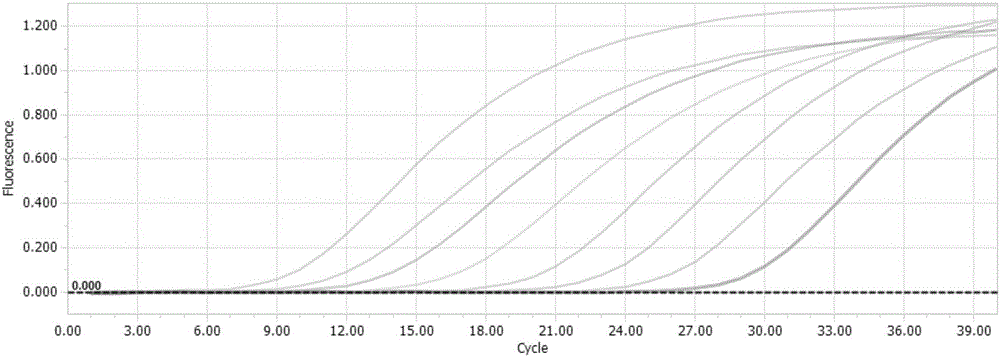
图2为本发明实施例2的不同拷贝数浓度标准品的实时荧光定量RT-PCR扩增曲线图;
图3为本发明实施例2中实时荧光定量RT-PCR标准曲线图;
图4为本发明实施例3中不同拷贝数浓度标准品的常规RT-PCR电泳图;
图5为本发明实施例3中实时荧光定量RT-PCR特异性试验结果图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
1、引物与探针的设计与合成:
经在Genbank网站,查找GETV毒株M1NSP1的基因序列(GenBank登录号为EU015061),比对GenBank中GETV各亚型代表株,XY0904(JN582181)、HB0234(EU015062)、YN0540(EU015063)的NSP1序列,设计特异性扩增引物和探针,上游引物GETV-F,序列为:GAGAAAGAAGTGCTTGC,下游引物GETV-R,序列为:GGTGATCTTCTTTACCAC,TaqMan探针序列为:AACCTTCGCATGACACCACC。
2、总RNA的提取及cDNA的合成:
1)将Vero细胞置于含10%胎牛血清的DMEM培养基中培养,培养条件为37℃、5%CO2的细胞培养箱,待细胞长到单层90%密度时,将培养基弃去,并用PBS溶液洗涤2次,按照MOI:0.5的量将GETV病毒液加入T25培养瓶中,并补充无血清的DMEM培养基至5mL,将培养瓶放入37℃、5%CO2培养箱中继续培养4-5d,然后将培养瓶放入-80℃的冰箱中,反复冻融三次后将病毒液取出,离心转速9000g,离心5min,取上清-80℃保存备用;
2)然后采用北京全式金生物技术有限公司ViralDNA/RNAKit试剂盒针对已经离心的GETV病毒液上清进行总RNA提取;
3)按照北京全式金生物技术有限公司-UniOne-StepgDNARemovalandcDNASynthesisSuperMix试剂盒说明书,将步骤b总RNA为模板,反转录合成总cDNA,总cDNA样品保存至-80℃保存备用。
3、盖塔病毒基因的常规PCR扩增:
以上述反转录获得的cDNA为模板,利用引物GETV-F和GETV-R对盖塔病毒基因进行常规PCR扩增。
常规PCR扩增体系如下:
PCR反应程序为:95℃预变性5min,再以35个循环进行PCR扩增,扩增条件为95℃变性30s,60℃退火30s,72℃延伸30s,最后再72℃延伸10min。
得到的PCR产物取10μL进行1.0%琼脂糖凝胶电泳检测,结果如图1所示。图1显示有符合预期大小(约200bp)的条带。
4、回收目标片段
得到的PCR产物经1.0%琼脂糖凝胶电泳后,在紫外灯下观察到符合预期大小(约200bp)的目标片段,用手术刀片将其小心切下后,扩增产物采用OMEGAGelExtractionKit试剂盒纯化回收,然后克隆到pMD18-T载体,并转化到DH5α平板,挑取生长良好的菌落,进行测序鉴定,测序结果与GETV毒株M1序列一致,表明基因片段的扩增完全正确,并采用OMEGAPlasmidMiniKitI试剂盒提取阳性重组质粒,即为标准样品。
实施例2制作标准曲线
利用紫外分光光度计定量,将计算好拷贝数的标准DNA作为模板,以10倍系列稀释,稀释浓度在2.03×1010copies/μl,采用荧光定量PCR反应体系和反应程序,在定量荧光PCR仪上进行PCR扩增,绘制标准溶解曲线,仪器使用BIO-RADCFX96TMRealTimeSystem,在稀释的线性浓度范围内,扩增曲线良好,呈光滑“S”型,具体扩增曲线如图2所示,反应结束后,自动生成标准曲线,标准曲线图如图3所示。
从图3中可以看出,模板量与对应的Ct值之间线性相关,相关系数为0.99,说明本实施例建立的检测方法可以准确检测盖塔病毒GETV,Ct值分别为28.59、25.17、22.26、19.46、15.71、12.85、10.93和8.73,标准曲线的斜率为-2.8833,截距为31.82,直线方程为y=-2.8833x+31.82。
其中,实时荧光定量PCR检测的反应体系为:
反应程序为:95℃预变性30s,95℃变性5s,55℃退火10s,72℃20s,共40个循环。
实施例3
1、实时荧光定量PCR与常规PCR灵敏度的对比
将GETV病毒液分别进行普通RT-PCR检测与实时荧光定量RT-PCR检测,但是普通RT-PCR检测方法最低只能检测到2.03×105copies/μl,从图4的普通RT-PCR检测方法的敏感性电泳图可以清楚的看到,但是采用实时荧光定量RT-PCR检测的方法却可以能检测到最低模板量为2.03×101copies/μl,这一点从图2的扩增曲线结果也可以清晰的得知,因此其敏感性比普通PCR检测方法高10000倍,本发明的检测方法具有更高的灵敏度。
其中图4中,各样品病毒拷贝数为:
1:2.03x108copies/μl
2:2.03x107copies/μl
3:2.03x106copies/μl
4:2.03x105copies/μl
5:2.03x104copies/μl
6:2.03x103copies/μl
7:2.03x102copies/μl
2、实时荧光定量PCR的重复性
利用DPS软件对不同浓度cDNA分别进行5批次的批内和批间的重复性实验,结果显示批内变异系数均小于1%,批间变异系数均小于2%,说明本发明的方法具有较好的组间重复性,该方法获得的数据比较稳定。
表2实时荧光定量RT-PCR的重复性试验结果
3、实时荧光定量PCR的特异性
利用本发明建立起来的实时荧光定量PCR方法对分别检测了GETV、CDV、HSV、CPV和SIV病毒,具体结果参照图5,发现只有GETV检测结果为阳性(荧光信号超过阈值),其他对照样品检测结果均为阴性(荧光信号均未超过阈值),表明该方法中的引物和探针具有较高的特异性,能够特异地检测到盖塔病毒。
实施例4
制作标准曲线的方法步骤与实施例2基本相同,只是荧光定量PCR反应体系和反应程序具体如下:
实时荧光定量PCR检测的反应体系为:
反应程序为:94℃预变性35s,94℃变性7s,60℃退火15s,75℃15s,共35个循环。
用该PCR反应体系进行了标准曲线的制作,以及待检测样品的检测,结果与实施例2一致。
实施例5
制作标准曲线的方法步骤与实施例2基本相同,只是荧光定量PCR反应体系和反应程序具体如下:
实时荧光定量PCR检测的反应体系为:
反应程序为:94℃预变性32s,94℃变性6s,67℃退火12s,73℃17s,共38个循环。
用该PCR反应体系进行了标准曲线的制作,以及待检测样品的检测,结果与实施例2一致。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种C型EV71病毒的TaqMan荧光实时定量PCR检测方法
- 一种鲤春病毒血症病毒的荧光定量pcr检测方法
- 一种利用实时荧光pcr检测偏肺病毒的方法和组合物的制作方法
- 一种病毒三重荧光定量rt-pcr检测方法及其试剂盒的制作方法
- 一种麻疹病毒一步实时荧光定量rt-pcr试剂盒的制作方法
- 一种用于检测日本乙型脑炎病毒的荧光rt-pcr试剂盒的制作方法
- 尼帕病毒和猪瘟病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 尼帕病毒和猪繁殖与呼吸综合症病毒二重荧光rt-pcr检测试剂及其制备方法与用图
- 用于辛德比斯病毒荧光rt-pcr检测的引物和lna探针及其试剂盒的制作方法
- 鸭痘病毒的实时荧光pcr检测方法及检测用引物和探针的制作方法
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种燕麦花叶病毒的实时荧光RT‑PCR检测方法、引物和探针及试剂盒与流程
- 一种检测羊边界病毒的实时荧光定量RT‑PCR试剂盒及应用的制造方法与工艺
- 检测口蹄疫病毒的荧光定量PCR试剂盒及系统的制造方法与工艺
- 五种猪腹泻病毒多重实时荧光定量PCR快速诊断试剂盒及应用的制造方法与工艺
- Sweepoviruses病毒实时荧光定量PCR检测的通用引物、探针及其检测方法与流程
- 一种鹅星状病毒实时荧光定量PCR检测的引物和探针的制作方法与工艺
- 一种葡萄斑点病毒荧光定量PCR检测的专用引物和方法与流程
- 一种樱桃病毒A荧光定量PCR检测的专用引物和方法与流程
- 猪瘟病毒、牛病毒性腹泻病毒双重荧光定量RT‑PCR检测方法与流程
- 一种南瓜花叶病毒实时荧光RT‑PCR检测试剂盒及其方法与流程
- 检测禽呼肠孤病毒的通用PCR引物及其检测试剂盒的制作方法与工艺
- 鹿流行性出血病病毒实时荧光RT‑PCR检测试剂盒的制作方法与工艺
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 用于盖塔病毒实时荧光定量PCR检测体系及检测方法与流程
- 一种用于绝对定量检测猪繁殖与呼吸综合征病毒的ddPCR方法、引物及其应用和试剂盒与流程
- 高灵敏监测POPs的转荧光蛋白基因鱼的制作与应用的制造方法与工艺
- 一种收发一体式开放光路大气检测系统的制造方法与工艺
- 一种用于鉴别西红花的荧光PCR检测引物组、试剂盒及检测方法和应用与流程
- 转基因玉米MON87403品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种具有蓝色荧光的手性有机染料分子及其制备方法与应用与流程
- 一种基于直接竞争荧光免疫法定量检测叶酸功能化二氧化硅靶向纳米药物载体的方法与流程
- 螯合剂的定量方法及螯合剂定量系统与流程
- 一种棒状杆菌属细菌和克氏棒状杆菌多重荧光定量PCR引物、探针、试剂盒和检测方法与流程
- 一种染料定量输送装置的制造方法
- 一种基于半阈值追踪算法的荧光分子断层成像重建方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺