一种L‑天冬氨酸氧化酶包涵体纯化复性方法与流程
本发明涉及一种L-天冬氨酸氧化酶包涵体纯化复性方法,属于生物工程领域的蛋白质表达纯化工艺。
背景技术:
在蛋白质工程领域中,如何获得生物学活性的蛋白是一个关键性问题,这对于研究基因的功能、开发蛋白治疗药物以及制备生物材料都具有重要的意义。使用最广泛的表达宿主大肠杆菌,蛋白往往以不可溶的包涵体形式出现,如何从无活性的包涵体中复性获得具有生物活性的可溶蛋白,成为蛋白质工程领域的一大难题。
当蛋白在原核宿主中大量表达时,由于宿主细胞内折叠因素的限制,比如蛋白表达过快或者蛋白折叠理化环境不合适,导致部分蛋白错误折叠或者未能折叠完成形成不可溶状态而形成沉淀的包涵体。包涵体可以在细菌的细胞质和周质空间中聚集,一般为球状,由于宿主和培养条件的不同,其大小也不相同,一般直径范围为0.1-0.8μm,结构致密,能够抵抗细胞内蛋白酶酶解。海绵状的包涵体同时含有活性组分和无活性组分,也具有部分生物学活性。
L-天冬氨酸氧化酶存在于细菌,古菌,植物以及动物细胞中,该酶在细菌内是烟酰胺二核苷酸从头合成途径的第一个酶。目前,多种不用来源和功能的L-天冬氨酸氧化酶在大肠杆菌中进行了异源表达,但是产量较低,大部分蛋白以无活性的包涵体形式存在。但是尚无有效的方法进行包涵体的复性,严重制约该类酶在工业上的应用。
技术实现要素:
本发明的目的在于解决上述的技术问题,提供一种有效的L-天冬氨酸氧化酶包涵体纯化复性方法。
本发明的目的通过以下技术方案来实现:
一种L-天冬氨酸氧化酶包涵体纯化复性方法,包括如下步骤:
S1、包涵体沉淀的收集,将L-天冬氨酸氧化酶基因进行针对大肠杆菌密码子优化,通过全基因合成构建于大肠杆菌表达载体上,通过诱导表达,获得表达菌体;将表达菌体使用6000rpm离心15分钟收集菌体,使用缓冲液A洗涤并悬起,菌体高压破碎,离心收集包涵体沉淀获得包涵体沉淀;
S2、包涵体沉淀的充分洗涤,对S1中的包涵体沉淀使用含有非离子型表面活性剂的缓冲液B漂洗两次,再使用不含有非离子型表面活性剂的缓冲液C漂洗两次,并使用含有6~8M变性剂的缓冲液C溶解蛋白;
S3、变性蛋白使用镍柱纯化,首先使用缓冲液C洗脱非特异性结合的杂蛋白,最终使用缓冲液D洗脱目的蛋白;
S4、将纯化的变性蛋白使用缓冲液D稀释至蛋白浓度低于1mg/ml,置于透析缓冲液中保持透析温度为4℃,透析12小时以上,离心收集上清。
S5、将上清使用超滤管浓缩,加入FAD,在温度4℃时,结合30分钟以上,再通过分子筛纯化分离单体蛋白和聚集蛋白,获得均一的天然活性蛋白,所述目的蛋白摩尔量与FAD摩尔量之比小于1:3。
优选地,所述缓冲液A为,50 mMTris-HCl,100 mMNaCl,pH 8.0;
所述缓冲液B为,50 mMTris-HCl,100 mMNaCl,0.1 mM EDTA,0.1 mM DTT,1% TritonX-100,pH 8.0;
所述缓冲液C为,50 mMTris-HCl,200 mMNaCl,10~30 mM imidazole,8 M urea,pH 8.0;
所述缓冲液 D为,50 mMTris-HCl,200 mMNaCl,300~500 mM imidazole,8 M urea,pH 8.0;
所述透析缓冲液为20mM Na2HPO4,200mMNaCl,pH 8.0。
优选地,所述S2中使用的非离子型表面活性剂为TritonX-100,所述菌体与缓冲液重量体积比为1:50。
优选地,所述S2中所述非离子型表面活性剂浓度为0.5%-1%。
优选地,所述S2中变性剂为尿素。
优选地,所述S3中也可以将S2漂洗后的蛋白直接使用含有300~500mM咪唑的缓冲液直接溶解蛋白,所述缓冲液为,50 mMTris-HCl,100 mMNaCl,0.1 mM EDTA,0.1 mM DTT,pH 8.0。
优选地,所述L-天冬氨酸氧化酶序列为SEQ ID NO.1。
优选地,所述表达载体为PET载体,所述工程菌诱导表达温度为30~37℃,诱导时间为4~6小时。
包涵体复性时,首先要用高浓度变性剂(如8M尿素)或者还原剂使包涵体溶解,肽链展开,之后通过去除多余的变性剂或者还原剂,使蛋白慢慢折叠成正确结构。常用的方法包括稀释复性,透析复性,色谱柱复性等。
本发明的有益效果:本发明解决了L-天冬氨酸氧化酶复性的问题,使用方便快捷的方法进行L-天冬氨酸氧化酶的包涵体纯化以及复性,通过包涵体的漂洗以及镍柱纯化获得纯度较高的变性蛋白,通过一步透析复性过程,逐渐去掉变性剂,蛋白折叠为有活性的蛋白分子,复性效率不低于10%。
然后经过一步透析和分子筛纯化获得有活性的高纯度酶。
本发明能够有效的节省辅因子FAD的使用,通过透析后添加,避免了透析时的FAD损失,降低经济成本。
附图说明
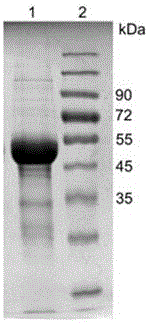
图1包涵体纯化后SDS-PAGE检测图谱。
图2复性后native-PAGE检测图谱,1:分子筛纯化前复性蛋白;2、分子筛纯化后复性蛋白。
图3上清可溶蛋白与复性蛋白的分子筛纯化UV图谱。
具体实施方式
本发明具体揭示了一种有效的L-天冬氨酸氧化酶包涵体纯化复性方法。具体包括如下步骤:
S1、将L-天冬氨酸氧化酶基因进行针对大肠杆菌密码子优化,经过密码子优化后的L-天冬氨酸氧化酶基因序列为SEQ ID NO.1。
通过全基因合成构建于大肠杆菌表达载体上。通过诱导表达,获得高蛋白量表达菌体。具体的,将L-天冬氨酸氧化酶基因进行针对大肠杆菌密码子优化,通过全基因合成目的基因,合成基因中包含Nco I和Xho I酶切位点,使用Nco I和Xho I核酸内切酶对目的基因片段和载体pET28a进行酶切,37℃酶切1 h。使用cycle-pure核酸一步回收试剂盒回收目的基因片段,载体使用胶回收试剂盒回收。将片段和载体使用T4 DNA连接酶连接,然后转化E.coli DH5α。挑选正确的单克隆测序,测序正确的表达载体转化BL21(DE3),37℃温箱培养至菌落长出。
挑取菌落至LB液体培养基中,37℃过夜培养,按照1:100的比例接种于新鲜的1L的LB培养基中,37℃培养至OD600为0.4~0.6,加入1mM IPTG于37℃下培养4~6小时,获得高蛋白量表达菌体。
所述表达工程菌株使用37℃诱导,可以在短时间内获得高产量包涵体,当诱导表达5小时以上,菌体内含有的杂质会增多。
通过缓冲液buffer A(50mMTris-HCl,100mMNaCl,pH8.0)洗涤并悬起,菌体高压破碎3次,以充分裂解细胞。镜检破碎效率高于98%,离心收集包涵体沉淀。
S2、按照每毫克包涵体加入50ml缓冲液buffer B (50mMTris-HCl,100mMNaCl,0.1mM EDTA,0.1mM DTT,1% TritonX-100,pH8.0)的比例,充分搅拌至无大颗粒,于冰上放置10分钟,使用15000rpm离心20分钟,弃去上清。之后将上述过程重复一次以充分漂洗,以充分溶解酯类。
S3、按照每毫克包涵体加入50ml缓冲液buffer B(不含有TritonX-100)的比例,充分搅拌悬起,冰上放置10分钟,使用15000rpm离心20分钟以去掉tritonX-100,去上清。该步骤重复一次。该步骤去掉残留的表面活性剂,减少其对于蛋白复性的影响。
S4、使用缓冲液buffer C(50mM Tris-HCl,200mM NaCl,10~30mM imidazole,8M urea,pH 8.0)溶解包涵体,使用15000rpm离心40分钟,上清即为目的变性蛋白。
与镍柱混合孵育,4℃下使蛋白充分结合镍柱。弃去未结合组分,使用加入50mM咪唑的buffer C清洗镍柱3个柱体积,使用缓冲液buffer D(50mM Tris-HCl,200mM NaCl,400mM imidazole,8M urea,pH 8.0)洗脱变性蛋白。
包涵体蛋白也可以直接使用缓冲液D(50mM Tris-HCl,200mM NaCl,300~500mM imidazole,8M urea,pH 8.0;)溶解包涵体蛋白,冰上放置10分钟,使用15000rpm离心30分钟,取上清即蛋白变性溶液。
以上所述S4缓冲液D中使用含有400mM咪唑的8M 尿素溶液溶解包涵体或者使用含有400mM咪唑的8M尿素溶液洗脱结合在镍柱上的包涵体。含有咪唑的变性蛋白在透析时,上清活力最高。
S5、使用缓冲液D将变性蛋白浓度稀释至1mg/ml,取10ml样品置于透析缓冲液(20mM磷酸钠,200mMNaCl,pH8.0)中透析18小时,15000rpm离心去沉淀,浓缩上清,按照摩尔比加入大于3倍蛋白量的FAD,混匀后于4℃静置,进行分子筛纯化。所述包涵体纯化后进行SDS-PAGE检测,其图谱如图1所示。所述透析缓冲液含有一定的盐离子能够有效的促进蛋白的折叠。相比于其他的缓冲体系,使用磷酸缓冲液会有效的提高复性效率。
一般根据摩尔比加入5倍蛋白量的FAD孵育半小时。实验证明,在透析复性后加入FAD并不会影响复性蛋白效率,与透析时直接加入FAD效果一致。
透析样品体积大于5ml,浓度小于1mg/ml。低浓度的蛋白含量在透析时,能够减少聚集的产生,提高复性效率。
实施例一
将来源于嗜热古菌Sulfolobustokodaii的 L-天冬氨酸氧化酶基因经过密码子优化后,目的基因通过全基因合成,通过分子克隆连接到pET-28a载体上,转入大肠杆菌宿主中表达,产物大部分为包涵体形式,因此,应用本实验的方法进行包涵体的纯化复性,获得有活性的高纯度L-天冬氨酸氧化酶。具体步骤如下:
步骤一、将诱导表达的菌株使用6000rpm转速离心15分钟,去上清收集菌体。将菌体使用buffer A(50mMTris-HCl,100mMNaCl,pH8.0)洗涤2次,然后继续使用buffer A悬起菌体,使用高压破碎,4℃下循环破碎三次,使用15000rpm转速离心50分钟,收集包涵体沉淀。
步骤二、每毫克包涵体加入50ml缓冲液buffer B (50mMTris-HCl,100mMNaCl,0.1mMEDTA,0.1mM DTT,1%TritonX-100,pH8.0)清洗包涵体,用15000rpm离心20分钟,收集沉淀。之后将上述过程重复一次以充分漂洗。
步骤三、每毫克包涵体加入50ml缓冲液buffer B(不含有TritonX-100)清洗包涵体,用15000rpm离心20分钟以去掉tritonX-100,去上清。该步骤重复一次。
步骤四、使用缓冲液buffer D(50mM Tris-HCl,200mM NaCl,400mM imidazole,8M urea,pH 8.0)溶解包涵体,使用15000rpm离心40分钟,上清即为目的变性蛋白。
步骤五、使用缓冲液buffer D将变性蛋白浓度稀释至1mg/ml,取10ml装入透析袋,置于透析缓冲液(20mM磷酸钠,200mMNaCl,pH 8.0)中透析过夜(大于18小时),15000rpm离心30分钟,收集上清并浓缩。加入5倍摩尔量的FAD,于4℃下结合30分钟,使用分子筛进行纯化。
酶活测定方法。
通过4-氨基安替吡啉苯酚法来测定过氧化氢的增加量。将1 ml的反应液在30℃反应10 min,测定其在505 nm下每分钟吸光值的增加量。酶活单位的定义为:30℃下每分钟释放1 µmol过氧化氢所需的酶量。1 ml的反应液体系包括10 U/mL的过氧化物酶,25 mmol/L L-谷氨酸、2 mmol/L的4-氨基安替吡啉、10 mmol/L的苯酚和适量的酶于pH 7.4的磷酸盐缓冲液中。
结果,最终透析后上清蛋白量为0.1mg/ml,复性效率为10%,加入FAD后,经过分子筛纯化,去掉未结合的FAD以及杂蛋白,通过非变性胶检测,其复性后蛋白为单体,获得纯酶比酶活为0.16 U/mg。
本发明尚有多种具体的实施方式。凡采用等同替换或者等效变换而形成的所有技术方案,均落在本发明要求保护的范围之内。
SEQ ID NO.1
ATGATATATATTATTGGCTCAGGCATTGCAGGCCTGTCAGCAGGCGTTGCACTGCGTCGCGCAGGAAAGAAAGTGACCCTGATTAGTAAACGTATTGATGGCGGCTCTACCCCGATTGCCAAAGGCGGTGTTGCAGCATCAGTGGGTTCAGATGATAGTCCGGAACTACATGCACAGGATACCATTCGTGTGGGCGATGGTCTGTGTGATGTTAAGACCGTTAATTATGTTACCTCAGAAGCAAAGAATGTGATTGAAACCTTTGAATCTTGGGGCTTTGAATTTGAAGAGGACCTGCGCCTGGAAGGCGGCCATACCAAACGTCGTGTGCTGCATCGTACCGATGAAACCGGTCGCGAAATCTTTAACTTTCTGCTGAAACTGGCACGCGAAGAAGGTATTCCGATTATTGAAGATCGCCTGGTGGAAATTCGCGTTAAAGATGGTAAAGTGACCGGCTTTGTGACCGAGAAACGCGGCCTGGTGGAAGATGTGGATAAACTGGTGCTGGCAACCGGCGGCTATAGCTATCTGTATGAATATAGCTCAACCCAGTCTACCAATATTGGGGACGGTATGGCAATTGCCTTCAAAGCAGGTACTATTCTGGCAGATATGGAATTTGTTCAGTTTCATCCGACCGTTACCTCACTGGATGGCGAAGTGTTTCTGCTGACCGAAACCCTGCGCGGCGAAGGTGCACAGATTATTAATGAGAATGGCGAACGCTTTCTGTTTAATTATGATAAACGTGGCGAACTGGCACCGCGTGATATTCTGAGCCGCGCAATATACATTGAAATGCTGAAAGGCCATAAAGTGTTTATTGATCTGTCTAAGATTGAAGACTTTGAACGCAAATTTCCGGTTGTTGCCAAATATCTGGCACGTCATGGTCATAATTACAAGGTTAAGATTCCGATCTTTCCGGCAGCACACTTTGTGGATGGCGGTATTCGCGTTAATATTCGTGGTGAATCAAATATTGTTAATCTGTATGCAATTGGCGAAGTGAGCGATAGCGGCCTGCATGGTGCAAATCGCCTGGCATCTAATAGCCTGCTGGAAGGTCTGGTGTTTGGCATTAATCTGCCGCGCTATGTGGATAGTTCTTGGGAAGGCATTAGTACCGATGATGGTATTGTTCATAGCGTGCGCATTAGCGGTAATAAGACCCTGTCACTGAAAGAAATTCGCCGCATTAATTGGGAGAATGTGGGCATTATTCGTAATGAGGAGAAACTGGTTAAAGCAATTAATACCTATAGCTCTAGTACCCAGAACGAGGCAATTATTAGCTATCTGACCGCACTGGCAGCAGAAATTCGTAAAGAATCACGCGGTAATCACTTTCGCGAAGATTATCCGTACAAAGACCCGAATTGGGAGAAACGCATCTACTTCAAACTGGTTGTG
- 还没有人留言评论。精彩留言会获得点赞!