一种水稻EPSPS突变体及其编码基因和应用的制作方法
本发明涉及基因工程技术领域,具体而言,涉及一种水稻EPSPS突变体及其编码基因和应用。
背景技术:
草甘膦是目前世界上使用的最为广泛的除草剂之一,至今已使用了近四十年。草甘膦抑制5-烯醇丙酮莽草酸-3-磷酸合成酶(EPSPS)的活性。EPSPS在莽草酸途径中催化PEP和shikimate-3-phosphate合成EPSP,最终合成芳香族氨基酸色氨酸、苯丙氨酸和酪氨酸。草甘膦导致芳香族胺基酸合成受阻,进而影响植物正常生长,终致死亡。
目前培育抗草甘膦品种的方法是应用基因工程手段将来自细菌的抗草甘膦基因导入农作物中,从而培育出转基因抗草甘膦作物新品种。1996年开始推广以来,种植面积迅速增加,至2015年,全球抗草甘膦转基因作物种植面积已达1.5亿公顷,占转基因作物种植总面积的83%,给农业生产和环境带来了巨大利益。
但是,目前农业上应用最广的抗草甘膦基因是来源于农杆菌(Agrobacterium tumefaciens)CP4菌株的CP4EPSPS。虽然先后从微生物中发现了许多能抗草甘膦的EPSPS基因,但这些基因在农作物中尚未得到广泛应用。这些微生物抗草甘膦基因在农作物中的应用是将这些基因如CP4EPSPS,用转基因的方法在农作物中表达。由此而产生的转基因作物虽然有相当大的推广面积,但由于反转基因浪潮,转基因作物在全世界的接受程度任然较低,即使在转基因作物种植面积最大的美洲,转基因也主要局限于玉米、大豆、棉花等几个作物。
技术实现要素:
本发明的目的在于提供一种水稻EPSPS突变体(即5-烯醇丙酮莽草酸-3-磷酸合成酶突变体),其来源水稻,具有草甘膦抗性。
本发明的另一目的在于提供一种编码基因,其编码上述的水稻EPSPS突变体。
本发明的另一目的在于提供一种质粒载体,其含有上述的编码基因。
本发明的另一目的在于提供含有上述质粒载体的重组菌或重组细胞。
本发明的另一目的在于提供上述编码基因在培育抗草甘膦植物中的应用。
本发明是这样实现的:
一种水稻EPSPS突变体,其氨基酸序列如SEQ ID NO.1所示。
一种编码基因,其编码上述的EPSPS突变体。
一种质粒载体,其含有上述的编码基因。
含有上述质粒载体的重组菌或重组细胞。
上述的编码基因在培育抗草甘膦植物中的应用。
本发明提供的一种水稻EPSPS突变体及其编码基因和应用有益效果是:
本发明提供的水稻EPSPS突变体,其氨基酸序列如SEQ ID NO.1所示,将其与野生型水稻EPSPS的氨基酸序列(SEQ ID NO.3)相比较,具有多个氨基酸残基突变位点,分别是由N端至C端的第70位氨基酸残基由A突变为G、第111位氨基酸残基由G突变为A、第116位氨基酸残基由P突变为S、第152位氨基酸残基由Q突变为R、第213位氨基酸残基由K突变为R、第250位氨基酸残基由K突变为Q、第252位氨基酸残基由K突变为E、以及第342位氨基酸残基由V突变为A,上述8个位点的突变结果使得该水稻EPSPS突变体具有草甘膦抗性,同时保持了自身的生物酶催化活性,转化该水稻EPSPS突变体的植株或重组菌均能够正常生长,且该水稻EPSPS突变体来源于水稻,其可应用于培育抗草甘膦植物例如水稻、烟草、大豆、玉米、小麦、棉花和高粱等,具有广阔的应用前景。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
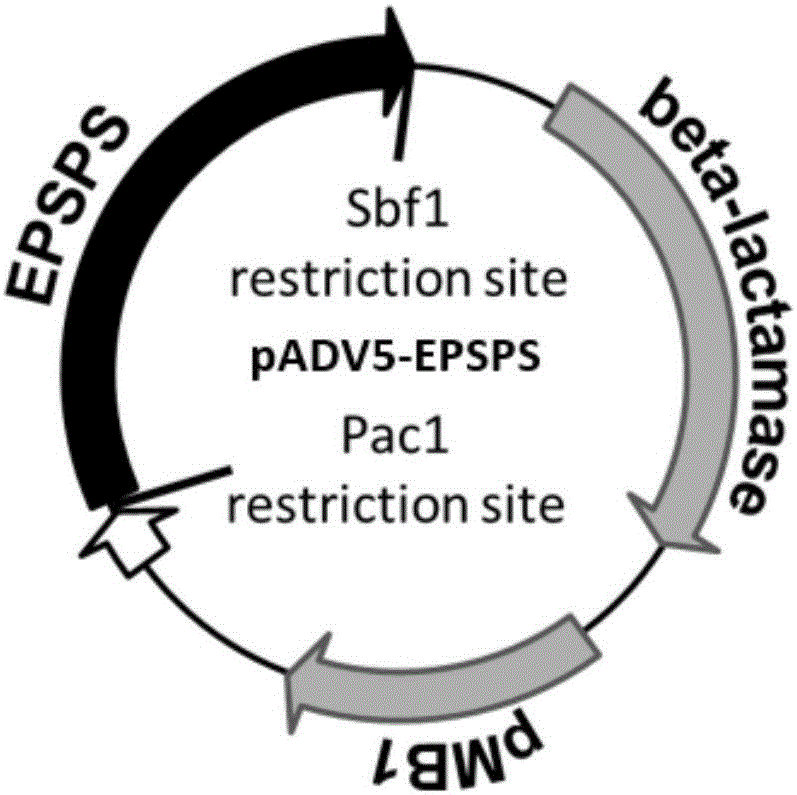
图1为本发明实施例1提供的pADV5-EPSPS载体的结构示意图;
图2为本发明实施例3提供的pBI121-EPSPS载体的结构示意图;
图3为本发明实施例1提供的OsEM基因和OsE基因的部分序列对比结果图;
图4为本发明实施例4提供的转OsEM基因和野生型OsE及CP4正对照在不同草甘膦浓度培养基上的生长情况;
图5为本发明实施例4提供的转OsEM基因大豆植株的PCR检测的凝胶电泳结果图;
图6为本发明实施例5提供的转OsEM基因阳性大豆植株经第一次草甘膦处理后的第7天的生长状况的照片图;
图7为本发明实施例5提供的转OsEM基因阳性大豆植株经第二次草甘膦处理后的第14天的生长状况的照片图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的水稻EPSPS突变体及其编码基因和应用进行具体说明。
一方面,本发明提供了一种水稻EPSPS突变体(即5-烯醇丙酮莽草酸-3-磷酸合成酶的突变体),其来源水稻,具有草甘膦抗性。该水稻EPSPS突变体的氨基酸序列如SEQ ID NO.1所示,由454个氨基酸残基组成。
将其与野生型水稻EPSPS(SEQ ID NO.3)的氨基酸序列相比较,具有多个氨基酸残基的位点突变。分别是:由N端至C端的第70位氨基酸残基由A突变为G、第111位氨基酸残基由G突变为A、第116位氨基酸残基由P突变为S、第152位氨基酸残基由Q突变为R、第213位氨基酸残基由K突变为R、第250位氨基酸残基由K突变为Q、第252位氨基酸残基由K突变为E、以及第342位氨基酸残基由V突变为A(如图2所示),该多个位点的突变的综合作用结果使得该水稻EPSPS突变体具有草甘膦抗性,同时保持了自身的生物活性。
再一方面,本发明提供了一种编码基因,其编码上述的水稻EPSPS突变体。
根据密码子的简并性,在水稻EPSPS突变体的氨基酸序列基础上能够很容易地得到该水稻EPSPS突变体的编码序列。只要能够编码出上述水稻EPSPS突变体的编码序列即属于本发明的保护范围。
进一步地,该编码基因的碱基序列如SEQ ID NO.2所示。
本发明的发明人采用快速定向进化系统,将来源于水稻的野生型EPSPS基因(SEQ ID NO.4)进行错配PCR,并将产物转化到敲除EPSPS基因和C-P Lyase基因后的大肠杆菌DH5α,经草甘膦抗性压筛选后得到了SEQ ID NO.2所示的编码基因。该快速定向进化系统筛选速度快、效率高。且由于采用的双敲除的大肠杆菌作为宿主菌,有效地排除了宿主菌内源性基因突变产生的干扰,确保筛选出的突变基因具有相应的草甘膦,有效地排出了假阳性的干扰。
与野生型EPSPS基因(SEQ ID NO.4)相比较,该编码基因(SEQ ID NO.2)的5’端至3’端的第209位的碱基由C突变为G、第332位的连续两个碱基由GA突变为CG、第346位由C突变为T、第348位由A突变为C、第455位由A突变为G、第638位由A突变为G、第748位由A突变为C、第755位由A突变为G、第1025位由T突变为C。上述碱基的突变直接导致了水稻EPSPS突变体相应位点的氨基酸残基突变,赋予了水稻EPSPS突变体的草甘膦抗性。
另一方面,本发明还提供了一种质粒载体,其含有上述的编码基因。
进一步地,该质粒载体是植物表达载体。
另一方面,本发明还提供了含有上述质粒载体的重组菌或重组细胞。
另一方面,本发明还提供了上述编码基因在培育抗草甘膦植物中的应用。
进一步地,该应用包括:将所述编码基因连接至植物表达载体,并转化目的植物。
其中,转化目的植物的方法可以根据实际情况选择,例如农杆菌介导法、基因枪法等。只要是利用本发明提供的编码基因进行应用培育抗草甘膦植物即属于本发明的保护范围。
此外,目的植物的类型可根据实际需要选择,其可以是水稻、烟草、大豆、玉米、小麦、棉花和高粱中的任意一种。也可以是其他类型的植物或农作物,其均属于本发明的保护范围。
此外,容易理解,在本发明提供的上述编码基因基础上,本领域的技术人员可以不通过转基因技术手段来培育抗草甘膦植物,而是以该编码基因为模板,并修饰目的植物的内源EPSPS基因,例如将内源EPSPS基因的编码序列修饰为该编码基因的碱基序列,在目的植物中编码出与本发明提供的水稻EPSPS突变体一样的蛋白,使得目的植物具有草甘膦抗性。这样的应用也属于本发明的保护范围。
其中,目的植物包括但不限于水稻、烟草、大豆、玉米、小麦、棉花和高粱。在其他类型的植物中进行上述应用也属于本发明的保护范围。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供了的获取水稻EPSPS基因突变体的方法以及获得的水稻EPSPS基因突变体,具体步骤如下。
1构建水稻EPSPS基因的突变体库
1.1采用常规方法将野生型水稻EPSPS基因的mRNA反转录成cDNA(如SEQ ID NO.4所示)并克隆到pADV5载体。
1.2用正向引物PV325和反向引物PV323,以连接有水稻EPSPS基因的pADV5载体为模板,进行第一轮错配PCR。其中,所用引物的碱基序列如下。
PV325:5’-TGAGCGCAACGCAATTAATGTGAG-3’;
PV323:5’-CGTAAGGAGAAAATACCGCATCAGG-3’。
PCR反应体系:25.3μL的H2O、4μL的易错PCR MIX、4μL的易错PCR dNTP、4μL的MnCl2、0.8μL的PV325(10μM)、0.8μL的PV323(10μM)、0.1μL的Taq酶、2μL的模板。
PCR反应程序:95℃,30秒;60℃,30秒;72℃,2分钟;40个循环。PCR产物经1%琼脂糖电泳,然后切胶回收,得到第一轮PCR产物。
1.3以上述第一轮PCR产物为模板,用正向引物2M1H、反向引物2M1T,进行第二轮PCR。其中,所用引物的碱基序列如下。
2M1H:
5’-ttacgtacgttaattaATGGCGTCCAACGCCGCGGCTGCG-3’
2M1T:
5’-ttacgtacgtcctgcaggTCAGTTCCTGACGAAAGTGCTTAGAACG-3’。
PCR反应体系:31.9μL的H2O、2.5μL的DMSO、5μL的10xPCR buffer、5μL的dNTP、4μL的MgCl2、0.5μL的2M1H(10μM)、0.5μL的2M1T(10μM)、0.1μL的Taq酶、0.5μL的模板(第一轮PCR产物)。
PCR反应程序:95℃,30秒;60℃,30秒;72℃,2分钟;60个循环
1.4对获得的PCR产物进行1%琼脂糖电泳,将与目的条带大小(1.5kb左右)一致的条带进行胶回收纯化。
1.5对回收的产物进行Pac1和Sbf1双酶切,然后将其用T4DNA连接酶连接至经同样双酶切后的新的pADV5载体上,获得连接产物。此步骤得到连接产物为携带有水稻EPSPS基因突变体的pADV5载体,命名为pADV5-EPSPS,其结构如图1所示。
1.6转化双敲除的大肠杆菌(敲除EPSPS基因和C-P Lyase基因后的大肠杆菌DH5α,命名为EDCE,其制备方法可参考申请号为2016103256926的中国发明专利)
将上述连接产物(pADV5-EPSPS)加入到50μL EDCE感受态细胞中,充分混匀置于冰上30min;42℃热激90s,冰浴2min后加入LB液体培养基500μL;37℃低速(150r/min)振荡培养90min。
经过该步骤的处理,携带有水稻EPSPS突变基因的pADV5载体转化到EDCE中,得到转化产物,也就是水稻EPSPS基因突变体库。
2抗性筛选
2.1将上述转化产物低速离心,然后接种于含有不同草甘膦浓度的筛选培养基(5mL)上(筛选培养基相互之间含有的草甘膦浓度有所差别,其含草甘膦的浓度分别是10mM、20mM、50mM,当然草甘膦的浓度可以根据实际情况设定),于37℃、过夜培养。
其中,筛选培养基是以M9为基础培养基,再添加一定浓度的抗生素Spec(Spectinomycin、奇放线菌素)、Gen(Gentamycin、庆大霉素)、Amp(Ampicillin、氨苄青霉素)以及不同浓度的草甘膦得到的培养基。M9培养基的基础成分如下:Na2HPO4 13~14g/L、KH2PO4 5.7~6.3g/L、NaCl 0.9~1.1g/L、NH4Cl 1.8~2.2g/L、葡萄糖37~43g/L、MgSO4·7H2O 48~52g/L、CaCl2 21~23g/L。
3测序和序列比对分析
3.1分离在筛选培养基上长出的单克隆抗性菌,然后送样测序,测pADV5-EPSPS上的EPSPS基因序列,其碱基序列如SEQ ID NO.2所示,即为水稻EPSPS突变基因。将该水稻EPSPS突变基因命名为OsEM基因。其编码出的5-烯醇丙酮莽草酸-3-磷酸合成酶,命名为水稻EPSPS突变体,氨基酸序列如SEQ ID NO.1所示。
3.2序列比对分析,将得到的OsEM基因与野生型水稻EPSPS基因(SEQ ID NO.4)对比分析。
结果如图3所示:OsEM基因自5’端至3’端的第209位由C突变为G、第332位的连续两个碱基由GA突变为CG、第346位由C突变为T、第348位由A突变为C、第455位由A突变为G、第638位由A突变为G、第748位由A突变为C、第755位由A突变为G、第1025位由T突变为C。
其中,第209位由C突变为G,导致水稻EPSPS突变体的第70位氨基酸残基由A(丙氨酸)突变为G(甘氨酸);
第332位的连续两个碱基由GA突变为CG,导致水稻EPSPS突变体的第111位氨基酸残基由G(甘氨酸)突变为A(丙氨酸);
第346位由C突变为T和第348位由A突变为C,导致水稻EPSPS突变体的第116位氨基酸残基由P(脯氨酸)突变为S(丝氨酸);
第455位由A突变为G,导致水稻EPSPS突变体的第152位氨基酸残基由Q(谷氨酰胺)突变为R(精氨酸);
第638位由A突变为G,导致水稻EPSPS突变体的第213位氨基酸残基由K(赖氨酸)突变为R(精氨酸);
第748位由A突变为C,导致水稻EPSPS突变体的第250位氨基酸残基由K(赖氨酸)突变为Q(谷氨酰胺);
第755位由A突变为G,导致水稻EPSPS突变体的第252位氨基酸残基由K(赖氨酸)突变为E(谷氨酸);
第1025位由T突变为C,导致水稻EPSPS突变体的第342位氨基酸残基由V(缬氨酸)突变为A(丙氨酸);共8个氨基酸突变位点(如图2中的框线所示)。
实施例2
本实施例以转化了野生型水稻EPSPS基因(命名为OsE基因,SEQ ID NO.3)的EDCE作为对照组,以实施例1中的步骤3.1得到的含OsEM基因(SEQ ID NO.2)的单克隆抗性菌为实验组,检测OsEM基因在细菌中的抗草甘膦能力。
将对照组和实验组分别接种至含0mM、5mM、10mM、20mM、50mM、75mM、100mM浓度草甘膦的培养基(筛选培养基)中,观察各组的菌落生长状况,用生长饱和指数来表示(饱和指数=0,没有生长;饱和指数=1,少量生长;饱和指数=2,生长至半饱和;饱和指数=3,旺盛生长,但还有生长余地;饱和指数=4,快速生长,细菌在培养基中已达最高(饱和)浓度或者说生长已经达到极限)。结果如表1所示。
表1.转化OsEM基因的实验组和转化OsE基因的对照组在含不同浓度草甘膦培养基中的生长饱和指数
表1的结果显示,在含0mM草甘膦的培养基上实验组(含OsEM基因)和对照组(含OsE基因)均能正常生长(饱和指数均为4);但在含5mM、10mM、20mM、50mM、75mM、100mM草甘膦的培养基上,对照组不能生长(饱和指数为0),而实验组能正常生长(饱和指数为4)。由此表明,实施例1得到的OsEM基因(SEQ ID NO.2)能够赋予EPSPS和C-P Lyase缺陷型的大肠杆菌草甘膦抗性,使其在高达100mM草甘膦的培养基中保持生长状态。
此外,本实例还用了目前农业上转基因作物中应用最广的抗草甘膦CP4-EPSPS基因作为正对照,将分别转化有OsE基因(负对照组),OsEM基因(实验组)和CP4-EPSPS基因(正对照组)的大肠杆菌分别接种在含0mM、1mM、50mM、100mM浓度草甘膦的固体培养基上,观察各组的菌落生长状况。结果如图3所示。
图3的结果显示,在含0mM草甘膦的培养基上实验组(含OsEM基因)和负对照组(含OsE基因)及正对照组(含CP4基因)均能正常生长(有明显白色菌斑);但在含1mM、50mM草甘膦的培养基上,负对照组(OsE)不能生长,而实验组(OsEM)和正对照(CP4)能正常生长;在含100mM草甘膦的培养基上,负对照组和正对照均不能生长,而实验组(OsEM)能正常生长。由此表明,实施例1得到水稻EPSPS突变基因(OsEM基因、SEQ ID NO.2)能够赋予EPSPS和C-P Lyase缺陷型的大肠杆菌草甘膦抗性,使其在高达100mM草甘膦的培养基中保持生长状态,其草甘膦抗性超过CP4-EPSPS基因。
实施例3
本实施例提供了上述OsEM基因在培育抗草甘膦烟草中的应用。其包括如下步骤。
1制备农杆菌菌液
1.1按常规方法提取由实施例1得到的单克隆抗性菌的质粒(含OsEM基因)。将其用Pac1和Sbf1双酶切,回收小片段,然后用T4DNA连接酶将小片段连接至经同样双酶切后的pBI121载体上,得到pBI121-EPSPS载体,其结构如图2所示。
1.2将pBI121-EPSPS载体转化GV3101(根癌农杆菌、Agrobactrium tumefaciens)感受态细胞,挑取单克隆进行菌落PCR检测,得到阳性菌株;再将阳性菌株接种到1mL的含50μg·mL-1卡那霉素和50μg·mL-1利福平的YEP培养中扩繁,保存于-80℃,或用于后续实验。
2烟草转化
2.1吸取上述保存的农杆菌液10μL,接种到1ml的含50μg·mL-1利福平和50μg·mL-1卡那霉素的YEP液体培养基中,28℃,200r/min培养至OD600为0.6-0.8,再将该菌液扩大培养至OD600约为0.5。用MS液体培养液(MS1培养基不加琼脂)稀释该菌液并加入20mg/L的AS,作为浸染液。
2.2将烟草种子(野生型“Wisconsin38”)播种在无菌培养基中,选取25-30天的烟草小苗叶片作为转化外植体。
2.3将叶片除去叶脉和叶边缘,切割成0.4×0.4cm2方块,于浸染液中浸泡5-10min,期间不断摇动浸染液,使菌体与叶片充分接触。
2.6用镊子将叶片取出置于无菌滤纸上,待菌液被吸干后将叶片转至MS1共培养基中,28℃暗培养48h。
2.7将叶片转至MS2诱导分化培养基中进行选择培养。15-20天转接一次,3-4周后有绿芽长出。待芽长到1-2cm高时,切下不定芽,转入MS3生根筛选培养基进行生根。
待诱导出强壮的根后,取出幼苗,洗净根部培养基,移栽至育苗土中,幼苗成活,得到转OsEM基因烟草植株,然后移栽至大田或者温室或用于后续分析。
3转基因植株的检测
采用PCR法检测出转OsEM基因烟草植株,根据OsEM基因的序列和烟草内参基因(NtA)设计正反向检测引物,序列如下:
针对OsEM基因:
OSES53:5’-GCAAGTTGTCCACCACTGTTGTGCC-3’;
ATC5:5’-CTGCAATGGTGTGCAGAACCCATC-3’;扩增片段大小为300bp;
针对NtA内参基因:
NtAct5:5’-CAGGTATTGTGTTGGATTCCGGCG-3’;
NtAct3:5’-CACTGTACTTGCGTTCAGGAGGCG-3’,扩增片段大小为571bp。
分别提取本实施例中的步骤2.7得到转OsEM基因烟草植株的基因组DNA,均一化至100ng/μL,作为。
PCR检测体系:10μL 2×TsINGKe,2μL引物混合物(10μmol/L的OSES53、ATC5、NtAct5、NtAct3,各0.5μL),1μL基因组DNA模板(100ng/μL),7μL ddH2O。
PCR检测程序:94℃,3min;94℃,30s;62℃,30s;72℃,45s;30个循环;72℃,10min;12℃保持。
PCR扩增产物1.5%琼脂糖凝胶电泳,在300bp位置和571bp位置有条带的则为转OsEM基因阳性烟草植株。
实施例4
本实施例提供了上述OsEM基因在培育抗草甘膦大豆中的应用。包括如下步骤。
1OsEM基因转化大豆
1.1种子消毒和萌发:大豆种子(野生型William 82)采用氯气干法灭菌,选出干净饱满的种子,100粒/皿,放入干燥器,100ml漂白液加8ml盐酸(12N),消毒时间20小时。使用时取出灭菌后的大豆种子,放入萌发培养基(蔗糖20g/L+GELLAN GUM POWDER),在25℃,暗中培养2天。
1.2侵染与共培养:培养由实施例3步骤1得到的农杆菌菌液至OD600为0.5-1.0时,将其倒入50ml离心管,离心(5000rpm、10min)。去上清,加入浸染液(B5大量、微量及有机+蔗糖30g/L+MES 3.9g/L+GA3 0.25mg/L+6-BA 1.67mg/L+L-Cys 400mg/L+AS 30mg/L)进行重悬,保持0D600在0.5-1.0,得到用于后续浸染的农杆菌重悬液。将吸胀的大豆种子从萌发培养基转移到无菌培养皿中,沿着种脐用手术刀纵向切割种子,将子叶和下胚轴均匀分开两瓣,去除种皮后,作为外植体备用。
1.3将农杆菌重悬液倒入洁净的无菌培养皿中,放入大约200个外植体,室温侵染1小时。将外植体取,盾片朝下,置于5ml共培养基(B5大量、微量及有机+蔗糖30g/L+MES 3.9g/L+GA30.25mg/L+6-BA 1.67mg/L+L-Cys 400mg/L+DTT 154.2mg/L+AS 30mg/L)上(共培养基上接种的外植体数量可根据情况调整),在25℃条件下,共培养5天。
1.4筛选与再生:将共培养后的外植体转接到芽诱导培养基(B5大量、微量及有机+蔗糖30g/L+MES 0.59g/L+GELLAN GUM POWDER+6-BA 1.67mg/L+cefotaxime 400mg/L+Glyphosate 15mg/L),于25℃,光周期16/8h、培养3周。
1.5新生芽长出后,转接至芽伸长培养基(B5大量、微量及有机+蔗糖30g/L+MES 0.59g/L+GELLAN GUM POWDER+6-BA 1.67mg/L+cefotaxime 400mg/L+Glyphosate 15mg/L),于25℃,光周期16/8h、光照培养3-5周。
1.6将伸长3-4cm的幼芽切下,转接到生根培养基(1/2MS大量、微量、铁盐、维他命+蔗糖20g/L+MES 0.59g/L+GELLAN GUM POWDER+IAA 0.2/L),于25℃,光周期16/8h、光照培养至生根;待诱导出强壮的根后,取出幼苗,洗净根部培养基,移栽至育苗土中,幼苗成活,得到转OsEM基因大豆植株,然后移栽至大田或者温室或用于后续分析。
2转基因植株的检测
采用PCR法检测出转OsEM基因大豆植株,OsEM基因的检测引物同实施例3(OSES53和ATC5),大豆内参基因(GmC)的正反向检测引物,序列如下:
针对GmC内参基因:
GmCons6F:5’-CATGCTTTGGCTGTTGGAGATTTG-3’;
GmCons6R:5’-GAACCTGATGGTGTTGGTAGAGGCG-3’;片段大小为658bp。
分别提取上述步骤1.6得到转OsEM基因大豆植株的基因组DNA(分别编号),均一化至100ng/μL后作为模板。
PCR检测体系:10μL 2×TsINGKe,2μL引物混合物(10μmol/L的OSES53、ATC5、GmCons6F、GmCons6R,各2μL),1μL基因组DNA(100ng/μL),7μL ddH2O。
PCR检测程序:94℃,3min;94℃,30s;62℃,30s;72℃,45s;30个循环;72℃,10min;12℃保持。
PCR扩增产物1.5%琼脂糖凝胶电泳,结果如图4所示,在300bp位置和658bp位置有条带的则为转OsEM基因阳性大豆植株。
图4的结果显示(图中:M为Maeker、Pos为阳性对照、WT为野生型植株、192、193、194、195、197、198、199以及203为不同转OsEM基因大豆植株编号),编号为192、193、194、195、197、198、199以及203的转OsEM基因大豆植株有两条带,呈阳性,其为转OsEM基因阳性大豆植株。
实施例5
本实施例以野生型大豆植株为对照,以实施例4得到的转OsEM基因阳性大豆植株作为实验组,验证OsEM基因在植株中的草甘膦抗性。实验方法如下。
1将生长状况一致,株高10-20cm的转OsEM基因阳性大豆植株与3株大小相似的野生型大豆植株编号后随机混合,均匀地排放在同一实验区域(避免叶片重叠)。
2计算实验组和对照组的占地区域面积,根据区域面积,按1060克/公顷(0.106g/m2)剂量来喷施草甘膦。
3用市售的41%草甘膦铵盐农达,根据上述的喷洒浓度(0.106g/m2),取相应体积的草甘膦铵盐农达,然后用20倍体积水稀释后,均匀喷施在实验组和对照组的植株上。
4待叶面干燥后,将实验组和对照组的植株移入温室培养。
5拍照、记录植株的生长状况。
生长状况的统计标准为:如果植株没有任何的草甘膦损伤现象,生长正常,为高草甘膦抗性植株,用“+++”表示;如果植株的叶片颜色有些发黄,生长略为缓慢,为中草甘膦抗性植株,用“++”表示;如果植株的部分叶片枯萎,生长非常缓慢,为低草甘膦抗性植株,用“+”表示;如果植株枯萎、死亡,为非草甘膦抗性植株(不具有草甘膦抗性),用“-”表示。
喷洒草甘膦后,于第7天观察并拍照记录各组植株的生长状况如图6所示,并统计出各种抗性的植株数量,结果见表2。
然后将生长良好的植株移栽至大盆中生长,于第21天进行第二次喷洒草甘膦(浓度为1.06g/m2)处理,2周后再拍照,记录各组植株的生长状况,结果如7所示。
表2.本实施例的实验组和对照组经第一次草甘膦处理后第7天的生长状况统计结果
注:表中的数字表示植株数量
图6(图中:1、2、3为野生型植株,a、b、c为转基因植株)和表2的结果显示,对照组中,3株野生型大豆植株均表现出不具有草甘膦抗性,而实验组中,大部分的转OsE基因阳性大豆植株都具有草甘膦抗性,其中,有4株表现出高草甘膦抗性(如图6中的a、b、c所示),1株表现出中草甘膦抗性,3株表现出低草甘膦抗性。
由图7的结果显示(图中:a、b和c为转OsE基因阳性大豆植株、d为野生型大豆植株),实验组的转OsE基因阳性大豆植株经1.06g/m2草甘膦处理后能够持续生长、表现出生长茂盛、叶片持绿度高、植株高等生长旺盛的态势(如图7中a和b所示);抗性不强的转OsE基因阳性大豆植株(如图7中c所示)表现出生长缓慢和叶片发黄;对照组的野生型大豆植株则枯萎、死亡(如图7中的d所示)。
以上结果表明,该OsE基因能够不仅赋予大肠杆菌抗100mM草甘膦浓度的抗性,还能够赋予大豆植株抗1.06g/m2草甘膦浓度的抗性,该OsE基因的抗性远远地高于现有的抗草甘膦基因,其表现出优异草甘膦抗性,同时转化该OsE基因的大肠杆菌和大豆植株均能正常生长,说明OsE基因编码的水稻EPSPS突变体的生物酶活性正常。
综上,相较于野生型水稻EPSPS(SEQ ID NO.3)及其编码基因(SEQ ID NO.4),本发明提供的水稻EPSPS突变体(SEQ ID NO.1)及其编码基因(SEQ ID NO.2)具有更高的草甘膦抗性和完整的生物酶活性;此外,该编码基因(SEQ ID NO.2)来源于水稻品种本身而不是微生物,其可适于转化各种植物品种例如水稻、烟草、大豆、玉米、棉花、高粱、小麦等植物,其具有更广阔的适用范围。同时,根据本发明提供的水稻EPSPS突变基因的序列,可以将其用于培育新的抗草甘膦的水稻品种中(非转基因方法),获得抗草甘膦的非转基因常规品种,提高新品种的公众接受程度。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 四川天豫兴禾生物科技有限公司
<120> 一种水稻EPSPS突变体及其编码基因和应用
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 454
<212> PRT
<213> 人工序列
<400> 1
Met Ala Ser Asn Ala Ala Ala Ala Ala Ala Lys Ala Glu Glu Ile Val
1 5 10 15
Leu Gln Pro Ile Arg Glu Ile Ser Gly Ala Val Gln Leu Pro Gly Ser
20 25 30
Lys Ser Leu Ser Asn Arg Ile Leu Leu Leu Ser Ala Leu Ser Glu Gly
35 40 45
Thr Thr Val Val Asp Asn Leu Leu Asn Ser Glu Asp Val His Tyr Met
50 55 60
Leu Glu Ala Leu Lys Gly Leu Gly Leu Ser Val Glu Ala Asp Lys Val
65 70 75 80
Ala Lys Arg Ala Val Val Val Gly Cys Gly Gly Lys Phe Pro Val Glu
85 90 95
Lys Asp Ala Lys Glu Glu Val Gln Leu Phe Leu Gly Asn Ala Ala Thr
100 105 110
Ala Met Arg Ser Leu Thr Ala Ala Val Thr Ala Ala Gly Gly Asn Ala
115 120 125
Thr Tyr Val Leu Asp Gly Val Pro Arg Met Arg Glu Arg Pro Ile Gly
130 135 140
Asp Leu Val Val Gly Leu Lys Arg Leu Gly Ala Asp Val Asp Cys Phe
145 150 155 160
Leu Gly Thr Glu Cys Pro Pro Val Arg Val Lys Gly Ile Gly Gly Leu
165 170 175
Pro Gly Gly Lys Val Lys Leu Ser Gly Ser Ile Ser Ser Gln Tyr Leu
180 185 190
Ser Ala Leu Leu Met Ala Ala Pro Leu Ala Leu Gly Asp Val Glu Ile
195 200 205
Glu Ile Ile Asp Arg Leu Ile Ser Ile Pro Tyr Val Glu Met Thr Leu
210 215 220
Arg Leu Met Glu Arg Phe Gly Val Lys Ala Glu His Ser Asp Ser Trp
225 230 235 240
Asp Arg Phe Tyr Ile Lys Gly Gly Gln Gln Tyr Glu Ser Pro Gly Asn
245 250 255
Ala Tyr Val Glu Gly Asp Ala Ser Ser Ala Ser Tyr Phe Leu Ala Gly
260 265 270
Ala Ala Ile Thr Gly Gly Thr Val Thr Val Gln Gly Cys Gly Thr Thr
275 280 285
Ser Leu Gln Gly Asp Val Lys Phe Ala Glu Val Leu Glu Met Met Gly
290 295 300
Ala Lys Val Thr Trp Thr Asp Thr Ser Val Thr Val Thr Gly Pro Pro
305 310 315 320
Arg Glu Pro Tyr Gly Lys Lys His Leu Lys Ala Val Asp Val Asn Met
325 330 335
Asn Lys Met Pro Asp Ala Ala Met Thr Leu Ala Val Val Ala Leu Phe
340 345 350
Ala Asp Gly Pro Thr Ala Ile Arg Asp Val Ala Ser Trp Arg Val Lys
355 360 365
Glu Thr Glu Arg Met Val Ala Ile Arg Thr Glu Leu Thr Lys Leu Gly
370 375 380
Ala Ser Val Glu Glu Gly Pro Asp Tyr Cys Ile Ile Thr Pro Pro Glu
385 390 395 400
Lys Leu Asn Ile Thr Ala Ile Asp Thr Tyr Asp Asp His Arg Met Ala
405 410 415
Met Ala Phe Ser Leu Ala Ala Cys Ala Asp Val Pro Val Thr Ile Arg
420 425 430
Asp Pro Gly Cys Thr Arg Lys Thr Phe Pro Asn Tyr Phe Asp Val Leu
435 440 445
Ser Thr Phe Val Arg Asn
450
<210> 2
<211> 1365
<212> DNA
<213> 人工序列
<400> 2
atggcgtcca acgccgcggc tgcggcggcg aaggcggagg agatcgtgct ccagcccatc 60
agggagatct ccggggcggt tcagctgcca gggtccaagt cgctctccaa caggatcctc 120
ctcctctccg ccctctccga gggcacaaca gtggtggaca acttgctgaa cagtgaggat 180
gttcactaca tgcttgaggc cctgaaaggc ctcgggctct ctgtggaagc agataaagtt 240
gcaaaaagag ctgtagtcgt tggctgtggt ggcaagtttc ctgttgagaa ggatgcgaaa 300
gaggaagtgc aactcttctt ggggaacgct gcgactgcaa tgcgatcctt gacagcagcc 360
gtgactgctg ctggtggaaa tgcaacttat gtgcttgatg gagtgccacg aatgagggag 420
agaccgattg gtgacttggt tgtcgggttg aaacgacttg gtgcggatgt cgactgtttc 480
cttggcactg aatgcccacc tgttcgtgtc aagggaattg gaggacttcc tggtggcaag 540
gttaagctct ctggttccat cagcagtcag tacttgagtg ccttgctgat ggctgctcct 600
ttggcccttg gggatgtgga gatcgaaatc attgacagac taatctccat tccttacgtt 660
gaaatgacat tgagattgat ggagcgtttt ggtgtgaagg cagagcattc tgatagttgg 720
gacagattct atattaaggg agggcagcag tacgaatctc ctggaaatgc ctatgttgaa 780
ggtgatgcct caagcgcgag ctatttcttg gctggtgctg caatcactgg aggcactgtg 840
acagttcaag gttgtggtac gaccagtttg cagggtgatg tcaaatttgc tgaggtactt 900
gagatgatgg gagcaaaggt tacatggact gacaccagtg taaccgtaac tggtccacca 960
cgtgagcctt atgggaagaa acacctgaaa gctgttgatg tcaacatgaa caaaatgcct 1020
gatgctgcca tgacccttgc cgttgttgca ctcttcgctg atggtccaac tgctatcaga 1080
gatgtggctt cctggagagt aaaggaaacc gaaaggatgg ttgcaattcg gaccgagcta 1140
acaaagctgg gagcatcggt tgaagaaggt cctgactact gcatcatcac cccaccggag 1200
aagctgaaca tcacggcaat cgacacctac gatgatcaca ggatggccat ggccttctcc 1260
ctcgctgcct gcgccgacgt gcccgtgacg atcagggacc ctggttgcac ccgcaagacc 1320
ttccccaact acttcgacgt tctaagcact ttcgtcagga actga 1365
<210> 3
<211> 454
<212> PRT
<213> 水稻(Oryza sativa)
<400> 3
Met Ala Ser Asn Ala Ala Ala Ala Ala Ala Lys Ala Glu Glu Ile Val
1 5 10 15
Leu Gln Pro Ile Arg Glu Ile Ser Gly Ala Val Gln Leu Pro Gly Ser
20 25 30
Lys Ser Leu Ser Asn Arg Ile Leu Leu Leu Ser Ala Leu Ser Glu Gly
35 40 45
Thr Thr Val Val Asp Asn Leu Leu Asn Ser Glu Asp Val His Tyr Met
50 55 60
Leu Glu Ala Leu Lys Ala Leu Gly Leu Ser Val Glu Ala Asp Lys Val
65 70 75 80
Ala Lys Arg Ala Val Val Val Gly Cys Gly Gly Lys Phe Pro Val Glu
85 90 95
Lys Asp Ala Lys Glu Glu Val Gln Leu Phe Leu Gly Asn Ala Gly Thr
100 105 110
Ala Met Arg Pro Leu Thr Ala Ala Val Thr Ala Ala Gly Gly Asn Ala
115 120 125
Thr Tyr Val Leu Asp Gly Val Pro Arg Met Arg Glu Arg Pro Ile Gly
130 135 140
Asp Leu Val Val Gly Leu Lys Gln Leu Gly Ala Asp Val Asp Cys Phe
145 150 155 160
Leu Gly Thr Glu Cys Pro Pro Val Arg Val Lys Gly Ile Gly Gly Leu
165 170 175
Pro Gly Gly Lys Val Lys Leu Ser Gly Ser Ile Ser Ser Gln Tyr Leu
180 185 190
Ser Ala Leu Leu Met Ala Ala Pro Leu Ala Leu Gly Asp Val Glu Ile
195 200 205
Glu Ile Ile Asp Lys Leu Ile Ser Ile Pro Tyr Val Glu Met Thr Leu
210 215 220
Arg Leu Met Glu Arg Phe Gly Val Lys Ala Glu His Ser Asp Ser Trp
225 230 235 240
Asp Arg Phe Tyr Ile Lys Gly Gly Gln Lys Tyr Lys Ser Pro Gly Asn
245 250 255
Ala Tyr Val Glu Gly Asp Ala Ser Ser Ala Ser Tyr Phe Leu Ala Gly
260 265 270
Ala Ala Ile Thr Gly Gly Thr Val Thr Val Gln Gly Cys Gly Thr Thr
275 280 285
Ser Leu Gln Gly Asp Val Lys Phe Ala Glu Val Leu Glu Met Met Gly
290 295 300
Ala Lys Val Thr Trp Thr Asp Thr Ser Val Thr Val Thr Gly Pro Pro
305 310 315 320
Arg Glu Pro Tyr Gly Lys Lys His Leu Lys Ala Val Asp Val Asn Met
325 330 335
Asn Lys Met Pro Asp Val Ala Met Thr Leu Ala Val Val Ala Leu Phe
340 345 350
Ala Asp Gly Pro Thr Ala Ile Arg Asp Val Ala Ser Trp Arg Val Lys
355 360 365
Glu Thr Glu Arg Met Val Ala Ile Arg Thr Glu Leu Thr Lys Leu Gly
370 375 380
Ala Ser Val Glu Glu Gly Pro Asp Tyr Cys Ile Ile Thr Pro Pro Glu
385 390 395 400
Lys Leu Asn Ile Thr Ala Ile Asp Thr Tyr Asp Asp His Arg Met Ala
405 410 415
Met Ala Phe Ser Leu Ala Ala Cys Ala Asp Val Pro Val Thr Ile Arg
420 425 430
Asp Pro Gly Cys Thr Arg Lys Thr Phe Pro Asn Tyr Phe Asp Val Leu
435 440 445
Ser Thr Phe Val Arg Asn
450
<210> 4
<211> 1365
<212> DNA
<213> 水稻(Oryza sativa)
<400> 4
atggcgtcca acgccgcggc tgcggcggcg aaggcggagg agatcgtgct ccagcccatc 60
agggagatct ccggggcggt tcagctgcca gggtccaagt cgctctccaa caggatcctc 120
ctcctctccg ccctctccga gggcacaaca gtggtggaca acttgctgaa cagtgaggat 180
gttcactaca tgcttgaggc cctgaaagcc ctcgggctct ctgtggaagc agataaagtt 240
gcaaaaagag ctgtagtcgt tggctgtggt ggcaagtttc ctgttgagaa ggatgcgaaa 300
gaggaagtgc aactcttctt ggggaacgct ggaactgcaa tgcgaccatt gacagcagcc 360
gtgactgctg ctggtggaaa tgcaacttat gtgcttgatg gagtgccacg aatgagggag 420
agaccgattg gtgacttggt tgtcgggttg aaacaacttg gtgcggatgt cgactgtttc 480
cttggcactg aatgcccacc tgttcgtgtc aagggaattg gaggacttcc tggtggcaag 540
gttaagctct ctggttccat cagcagtcag tacttgagtg ccttgctgat ggctgctcct 600
ttggcccttg gggatgtgga gatcgaaatc attgacaaac taatctccat tccttacgtt 660
gaaatgacat tgagattgat ggagcgtttt ggtgtgaagg cagagcattc tgatagttgg 720
gacagattct atattaaggg agggcagaag tacaaatctc ctggaaatgc ctatgttgaa 780
ggtgatgcct caagcgcgag ctatttcttg gctggtgctg caatcactgg aggcactgtg 840
acagttcaag gttgtggtac gaccagtttg cagggtgatg tcaaatttgc tgaggtactt 900
gagatgatgg gagcaaaggt tacatggact gacaccagtg taaccgtaac tggtccacca 960
cgtgagcctt atgggaagaa acacctgaaa gctgttgatg tcaacatgaa caaaatgcct 1020
gatgttgcca tgacccttgc cgttgttgca ctcttcgctg atggtccaac tgctatcaga 1080
gatgtggctt cctggagagt aaaggaaacc gaaaggatgg ttgcaattcg gaccgagcta 1140
acaaagctgg gagcatcggt tgaagaaggt cctgactact gcatcatcac cccaccggag 1200
aagctgaaca tcacggcaat cgacacctac gatgatcaca ggatggccat ggccttctcc 1260
ctcgctgcct gcgccgacgt gcccgtgacg atcagggacc ctggttgcac ccgcaagacc 1320
ttccccaact acttcgacgt tctaagcact ttcgtcagga actga 1365
- 还没有人留言评论。精彩留言会获得点赞!