使用无血清淋巴细胞培养基培养及冻存CIK细胞的方法及得到的CIK细胞与流程
本发明涉及细胞生物技术领域,尤其是一种使用无血清淋巴细胞培养基培养及冻存CIK细胞的方法及得到的CIK细胞,是一套可标准化生产操作的方法。
背景技术:
2000年国际肿瘤生物治疗及基因治疗年会中指出“免疫细胞疗法是现代科技中唯一有可能彻底清除癌症细胞的方法”。梦想照进现实,癌症正在逐渐被我们战胜。细胞免疫疗法是除手术、放疗、化疗以外的第四大癌症治疗模式。但增龄与疾病时刻挑战着我们的免疫系统,储存年轻正常的自体免疫细胞变得十分必要。世界范围的免疫细胞库建设已具有一定规模。
目前主流的冻存方法是直接冻存PBMC或扩增完成后冻存。直接冻存PBMC细胞冻存数量较少,且细胞活力较对数期生长细胞低,加上冻存细胞成分的复杂性,复苏后大量细胞死亡,影响后期培养。扩增完成后冻存细胞工作量较大,且复苏细胞活性不能很好保证。
技术实现要素:
本发明所要解决的技术问题是,提供一种CIK细胞的简便安全的使用无血清淋巴细胞培养基培养及冻存CIK细胞的方法及得到的CIK细胞。
为了解决上述技术问题,本发明采用的技术方案是:一种使用无血清淋巴细胞培养基培养及冻存CIK细胞的方法,采用联合包被技术,在CIK细胞培养过程中用多种细胞因子诱导细胞扩增,增强杀伤活性;利用自体血清配置冻存液,并选取对数期生长细胞冻存。
具体地,包括如下步骤:
(1)用含Retronectin和CD3mAb蛋白的无血清淋巴细胞培养基包被培养瓶,CO2培养箱孵育2小时或4℃过夜;
(2)采集常规外周血或脐带血,Ficoll-Hypaque密度梯度离心,2000rpm/min,离心25min;
(3)收集步骤(2)中上层血浆,将收集的血浆置于56℃水浴锅30min以灭活补体;3000rpm/min,离心6min除去血浆中析出物,并将上层自体血清转移至离心管,放置于4℃冰箱备用;
(4)收集步骤(2)中的白膜层细胞,洗两次,获得全部的单核细胞;
(5)取步骤(1)中包被的培养瓶,重悬细胞并按照细胞接种密度(2-10)*105/ml加入无血清淋巴细胞培养基,补加步骤(3)中备用的自体血清和INF-γ,并将细胞培养液混合均匀后放置在二氧化碳培养箱中培养;
(6)培养第1天,补加IL-1α、IL-2;
(7)培养第5天,取刚进入对数期生长的CIK细胞,制备单细胞悬液,并对细胞进行计数,细胞计数后以1500rpm/min,离心6min,倒弃上清液;
(8)取步骤(3)中备用的自体血清,与DMSO按比例配置细胞冻存液;
(9)根据计数,调整细胞冻存浓度,加入低温冻存液重悬细胞,并将冻存终细胞悬液分装至冻存管中,按照程序降温冻存细胞。
所述步骤(1)中预包被培养瓶使用0.5-1ug/ml的Retronectin和2-5ug/ml CD3mAb蛋白联合包被。
所述步骤(5)中培养第0天补加INF-γ终浓度为500-1000U/ml,按体积百分比,加入自体血清为培养体系的5%-10%。
所述步骤(6)中培养第一天补加IL-1α终浓度为0.05-0.2U/ml、IL-2终浓度为500-1000U/ml。
所述步骤(8)中细胞冻存液采用自体血清和DMSO按照体积比例9:1配制。
所述步骤(9)中冻存细胞终浓度确定为(1-2)*107/ml。
上述使用无血清淋巴细胞培养基培养及冻存CIK细胞的方法得到的CIK细胞。
本发明的有益效果:本发明培养方法能短时间内扩增出3*109以上的淋巴细胞,其中CIK(CD3+CD56+)比例达到25%以上;该细胞冻存方法够在不引入外源动物血清的情况下保证细胞特性不变,提高冻存复苏细胞活性,保证扩增效率。
附图说明
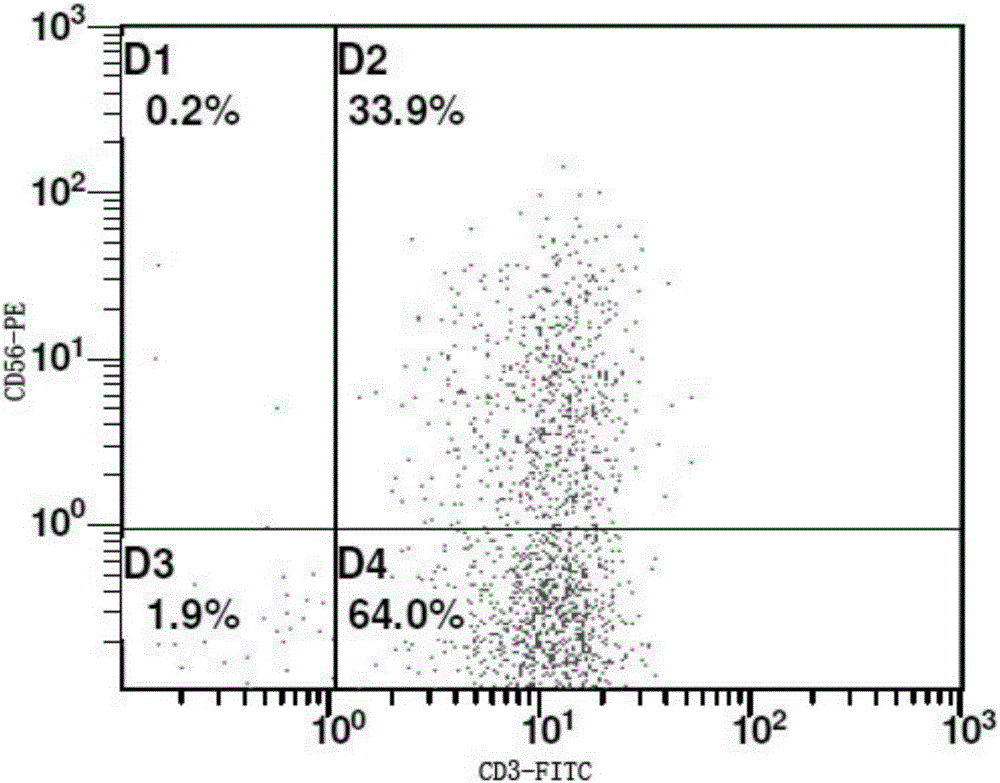
图1是本发明实施例1细胞流式检测图。
具体实施方式
本发明使用无血清淋巴细胞培养基培养及冻存CIK细胞的方法,该细胞培养方法采用联合包被技术,并在CIK细胞培养过程中用多种细胞因子诱导细胞扩增,增强其杀伤活性;细胞冻存方法利用自体血清配置冻存液,并恰当选取对数期生长细胞冻存。
包括如下步骤:
(1)用含Retronectin和CD3mAb蛋白的无血清淋巴细胞培养基包被培养瓶,CO2培养箱孵育2小时或4℃过夜;
(2)采集常规外周血或脐带血,Ficoll-Hypaque密度梯度离心,2000rpm/min,离心25min;
(3)收集步骤(2)中上层血浆,将收集的血浆置于56℃水浴锅30min以灭活补体;3000rpm/min,离心6min除去血浆中析出物,并将上层自体血清转移至离心管,放置于4℃冰箱备用;
(4)收集步骤(2)中的白膜层细胞,洗两次,获得全部的单核细胞;
(5)取步骤(1)中包被的培养瓶,重悬细胞并按照细胞接种密度(2-10)*105/ml加入无血清淋巴细胞培养基,补加步骤(3)中备用的自体血清和INF-γ,并将细胞培养液混合均匀后放置在二氧化碳培养箱中培养;
(6)培养第1天,补加IL-1α、IL-2;
(7)培养第5天,取刚进入对数期生长的CIK细胞,制备单细胞悬液,并对细胞进行计数,细胞计数后以1500rpm/min,离心6min,倒弃上清液;
(8)取步骤(3)中备用的自体血清,与DMSO按比例配置细胞冻存液;
(9)根据计数,调整细胞冻存浓度,加入低温冻存液重悬细胞,并将冻存终细胞悬液分装至冻存管中,按照程序降温冻存细胞。
所述步骤(1)中预包被培养瓶使用0.5-1ug/ml的Retronectin和2-5ug/ml CD3mAb蛋白联合包被。
所述步骤(5)中培养第0天补加INF-γ终浓度为500-1000U/ml,按体积百分比,加入自体血清为培养体系的5%-10%。
所述步骤(6)中培养第一天补加IL-1α终浓度为0.05-0.2U/ml、IL-2终浓度为500-1000U/ml。
所述步骤(8)中细胞冻存液采用自体血清和DMSO按照体积比例9:1配制。
所述步骤(9)中冻存细胞终浓度确定为(1-2)*107/ml。
上述使用无血清淋巴细胞培养基培养及冻存CIK细胞的方法得到的CIK细胞。
具体地说,包括如下步骤:
(1)用10ml含Retronectin和CD3mAb蛋白的无血清淋巴细胞培养基包被一个T175培养瓶,CO2培养箱孵育2小时或4℃过夜;
(2)取采集常规外周血或脐带血60ml,Ficoll-Hypaque密度梯度离心,2000rpm/min,离心25min;
(3)收集步骤(2)中上层血浆于50ml离心管并编号,将收集的血浆置于56℃水浴锅30min以灭活补体;3000rpm/min,离心6min除去血浆中析出物,并将上层自体血清转移至新的离心管,并放置于4℃冰箱备用;
(4)收集步骤(2)中的白膜层细胞,洗两次,最终获得(4-10)*107个单核细胞;
(5)取步骤(1)中包被的T175培养瓶,重悬细胞并按照细胞接种密度(2-5)*105/ml加入无血清淋巴细胞培养基(LONZA公司的X-VIVO 15培养基)至T175细胞培养瓶中,并按照培养体系补加上述自体血清和INF-γ,并将细胞培养液混合均匀后放置在二氧化碳培养箱中培养;
(6)培养第1天,按照培养体系加入IL-1α、IL-2;
(7)培养第5天,取刚进入对数期生长的CIK细胞,制备单细胞悬液,并对细胞进行计数,细胞计数后以1500rpm/min,离心6min,倒弃上清液;
(8)取步骤(3)中备用血清,与DMSO按比例配置细胞冻存液;
(9)根据计数,调整细胞冻存浓度,加入低温冻存液重悬细胞(细胞浓度调整至(1-2)*107/ml),并将冻存终细胞悬液分装至冻存管中,编号并按照程序降温(1℃/min)冻存细胞;
(10)液氮中取需要复苏细胞,迅速解冻,离心洗去冻存液,将细胞按1*106/ml加入无血清淋巴细胞培养基接种细胞于T175培养瓶中,并按照培养体系加入INF-γ、IL-2,放入二氧化碳培养箱培养;
(11)复苏第3天,根据细胞生长状态,补加含IL-2的无血清淋巴细胞培养基使细胞密度控制在1*106/ml,并将CIK细胞诱导体系中的全部细胞悬液转移到一个1.8升容量的细胞培养袋中进行培养;
(12)复苏第5天、第7天、第9天、第11天,根据细胞生长状态,补加含IL-2的无血清淋巴细胞培养基,使之一倍于原培养体系或使细胞密度控制在1*106/ml;
(13)复苏第13天,将细胞培养袋中的所有细胞收获,计算细胞总数并通过流式细胞检测方法确定其中CIK细胞的比例。
所述步骤(1)中预包被T175培养瓶使用0.5-1ug/ml的Retronectin和2-5ug/ml CD3mAb蛋白联合包被。
所述步骤(5)中培养第0天补加INF-γ终浓度为500-1000U/ml,加入自体血浆为培养体系的5-10%(体积分数)。
所述步骤(6)中培养第一天使用IL-1α终浓度为0.05-0.2U/ml、IL-2终浓度为500-1000U/ml。
所述步骤(8)中细胞冻存液采用自体血清和DMSO按照体积比例9:1配制。
所述步骤(9)中冻存细胞终浓度确定为(1-2)*107/ml。
所述步骤(10)中复苏细胞按照培养体系加入INF-γ终浓度为500-1000U/ml、IL-2终浓度为500-1000U/ml,并确定复苏细胞接种密度为(5-10)*105/ml。
所述步骤(12)中培养后期加入的淋巴细胞培养基始终含500-1000U/ml的IL-2,并确定补液时间为隔天补液。
所述步骤(13)中,所述CIK细胞的比例是指CD3+CD56+达到25%以上,台盼蓝拒染率≥90%。
上述使用无血清淋巴细胞培养基培养及冻存CIK细胞的方法得到的CIK细胞。
本发明的培养方案中采用无血清淋巴细胞培养基及包被技术,结合细胞因子扩增目的细胞。冻存方案采用培养第五天的细胞,分离出的单核细胞经过刺激培养,不单提高了CIK细胞CD3+CD56+的阳性率,且减少了杂细胞冻存复苏带来的干扰。冻存时间的选择不但使冻存细胞处于对数生长期更适宜冻存,冻存复苏后活率更高,且控制了冻存细胞数量,便于操作,为后期刺激培养提供条件;本发明采用10%的DMSO+90%的自体血清作为冻存液,能够提高细胞膜对水的通透性,保证细胞外结晶水短时间冻住,避免水分渗入对细胞造成损伤,且不引入动物源血清。本方法适用于CIK细胞的长期冻存,与现有直接冻存白膜层细胞比较,显著提高了目的细胞冻存比例,节省了冻存成本,复苏后细胞活性显著高于直接冻存白膜层细胞,实现了CIK细胞的长期保存。
下面结合具体实施方式对本发明作进一步详细说明:
实施例1
(1)用10ml含Retronectin(1ug/ml)和CD3mAb(5ug/ml)蛋白的无血清淋巴细胞培养基包被一个T175培养瓶,CO2培养箱孵育2小时。
(2)采集常规脐带血约60ml,Ficoll-Hypaque密度梯度离心,2000rpm/min离心25min(离心参数中加速度调整为1、刹车调整为1)。
(3)收集步骤(2)中上层血浆于50ml离心管并编号,将收集的血浆置于56℃水浴锅30min以灭活补体。之后,3000rpm/min离心6min除去血浆中析出物,并将上层血清27ml转移至新的离心管,并放置于4℃冰箱备用。
(4)收集步骤(2)中的白膜层细胞,洗两次,最终获得4.6*107个单核细胞。
(5)取包被的T175培养瓶。按照细胞密度3*105/ml加入133ml无血清淋巴细胞培养基至T175细胞培养瓶中,并按照培养体系补加自体血清7.6ml、INF-γ(终浓度500U/ml)。将细胞培养液混合均匀后放置在二氧化碳培养箱中培养。
(6)培养第1天,加入IL-1α(终浓度0.1U/ml)、IL-2(终浓度500U/ml)。
(7)培养第5天,取刚进入对数期生长的CIK细胞,制备单细胞悬液,并对细胞进行计数。计数结果为:2.9*108。计数后以1500rpm/min,离心6min,倒弃上清液。
(8)取(3)步骤中备用自体血清,按体积10%的DMSO+90%的自体血清配制细胞冻存液15ml,即血清13.5ml+DMSO 1.5ml。
(9)按照冻存细胞终浓度2*107/ml加入14.5ml低温冻存液,并将冻存终细胞悬液分装至2ml冻存管中,每管1.5ml,并按照程序降温(1℃/min)冻存细胞。
(10)冻存一个月后,从液氮中取出步骤(9)中的3管细胞,迅速解冻,并将细胞转移至平衡至室温的15ml淋巴细胞培养基中,1500rpm/min 6min离心洗去冻存液,取20ml淋巴细胞培养基重悬细胞,台盼蓝拒染率94%,回收率85%。将细胞按1*106/ml加入72ml无血清淋巴细胞培养基接种细胞于T175培养瓶中。按照培养体系加入INF-γ(终浓度500U/ml)、IL-2(终浓度500U/ml),放入二氧化碳培养箱培养。
(11)复苏第3天,根据细胞生长状态,补加含IL-2(终浓度500U/ml)的无血清淋巴细胞培养基100ml,并将CIK细胞诱导体系中的全部细胞悬液转移到一个1.8升容量的细胞培养袋中进行培养。
(12)复苏第5天、第7天、第9天、第11天,根据细胞生长状态,补加含IL-2的无血清淋巴细胞培养基150ml、300ml、400ml、400ml。
(13)复苏第13天,将细胞培养袋中的所有细胞收获,计算细胞总数为3.8*109,台盼蓝拒染率97%,流式细胞检测方法确定其中CIK细胞(CD3+CD56+)的比例为34%(图1)。
实施例2
(1)用10ml含Retronectin(1ug/ml)和CD3mAb(5ug/ml)蛋白的无血清淋巴细胞培养基包被一个T175培养瓶,4℃过夜。
(2)取采集的常规外周血约60ml,Ficoll-Hypaque密度梯度离心,2000rpm/min离心25min(离心参数中加速度调整为1、刹车调整为1)。
(3)收集步骤(2)中上层血浆于50ml离心管并编号,将收集的血浆置于56℃水浴锅30min以灭活补体。之后,3000rpm/min离心6min除去血浆中析出物,并将上层血清33ml转移至新的离心管,并放置于4℃冰箱备用。
(4)收集步骤(2)中的白膜层细胞,洗两次,最终获得8*107个单核细胞。
(5)取包被的T175培养瓶。按照细胞密度4*105/ml加入180ml无血清淋巴细胞培养基至T175细胞培养瓶中,并按照培养体系补加10ml自体血清、INF-γ(终浓度500U/ml)。将细胞培养液混合均匀后放置在二氧化碳培养箱中培养。
(6)培养第1天,加入IL-1α(终浓度0.1U/ml)、IL-2(终浓度500U/ml)。
(7)培养第5天,取刚进入对数期生长的CIK细胞,制备单细胞悬液,并对细胞进行计数。计数结果为:3.8*108。计数后以1500rpm/min,离心6min,倒弃上清液。
(8)取(3)步骤中备用自体血清,按体积10%的DMSO+90%的自体血清配制细胞冻存液20ml,即血清18ml+DMSO 2ml。
(9)按照冻存细胞终浓度2*107/ml加入19ml低温冻存液,并将冻存终细胞悬液分装至2ml冻存管中,每管1.5ml,并按照程序降温冻存细胞。
(10)冻存3个月后,从液氮中取出步骤(9)中编号的3管细胞,迅速解冻,并将细胞转移至平衡至室温的15ml淋巴细胞培养基中,1500rpm/min 6min离心洗去冻存液,取20ml淋巴细胞培养基重悬细胞,台盼蓝拒染率91%,回收率88%。将细胞按1*106/ml加入72ml无血清淋巴细胞培养基接种细胞于T175培养瓶中。按照培养体系加入INF-γ(终浓度500U/ml)、IL-2(终浓度500U/ml),放入二氧化碳培养箱培养。
(11)复苏第3天,根据细胞生长状态,补加含IL-2(终浓度500U/ml)的无血清淋巴细胞培养基100ml,并将CIK细胞诱导体系中的全部细胞悬液转移到一个1.8升容量的细胞培养袋中进行培养。
(12)复苏第5天、第7天、第9天、第11天,根据细胞生长状态,补加含IL-2的无血清淋巴细胞培养基150ml、300ml、400ml、400ml。
(13)复苏第13天,将细胞培养袋中的所有细胞收获,计算细胞总数为3.2*109,台盼蓝拒染率98%,流式细胞检测方法确定其中CIK细胞(CD3+CD56+)的比例为29%。
本发明立足于免疫细胞CIK细胞的体外大规模诱导方法,其在临床上巨大的应用前景。
综上所述,本发明的内容并不局限在上述的实施例中,相同领域内的有识之士可以在本发明的技术指导思想之内可以轻易提出其他的实施例,但这种实施例都包括在本发明的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!