稳定表达人源TIGAR基因的MDCK细胞系的制作方法
本发明属于生物技术领域,具体地涉及稳定表达人源TIGAR基因的MDCK细胞系,以及该细胞系在提高细胞抗凋亡能力、降低MDCK细胞贴壁性能,对于抗禽流感病毒药物的筛选、中和抗体的测定以及用于MDCK细胞的低血清培养从而大规模生产细胞培养疫苗。
背景技术:
禽流感病毒(AIV)属于正粘病毒科A型流感病毒属,表面糖蛋白血凝素(HA)和神经氨酸酶(NA)分别有16种和9种[Webster RG,Bean WJ,Gorman OT,Chambers TM,&Kawaoka Y(1992)Evolution and ecology of influenza A viruses.Microbiological reviews 56(1):152-179.]。其中,高致病禽流感(H5和H7亚型)在世界范围内给养禽业造成了巨大的经济损失,同时给人类健康带来严重的威胁。哺乳动物中所有流感病毒均来源于水禽,但流感病毒很少发生跨种传播,这是由流感病毒和其受体的相互作用决定的。流感病毒通过其表面的血凝素(HA)与细胞表面唾液酸寡糖受体结合侵染宿主细胞。细胞受体和病毒HA结合位点的结构是决定流感病毒宿主特异性的主要因素。常见的流感病毒表面配体有两种,一种为唾液酸α2,3半乳糖(SAα2,3-GAL),另一种为唾液酸α2,6半乳糖(SAα2,6GAL)半乳糖。虽然所有的流感病毒都识别末端为唾液酸的寡糖,但不同流感病毒HA结合受体特性不同,大多数禽流感病毒优先结合SAα2,3-GAL受体,人流感病毒则优先结合SAα2,6GAL受体[Rogers G,et al.(1983)Single amino acid substitutions in influenza haemagglutinin change receptor binding specificity.Nature 304(5921):76-78.]。
疫苗接种是当前防治流感疫情的有效措施,传统的流感疫苗采用鸡胚法生产,尽管采取了高效的生产工艺,但是仍然存在着许多不足而限制了它的发展。鸡胚来源的灭活疫苗需要大量的SPF鸡胚不仅导致成本昂贵、无法应对快速流行的疫情,而且生产后的鸡胚废料处理面临很大的环境压力,同时鸡胚的残留物可能引起过敏反应。另外,鸡胚培养法生产周期长、操作过程繁琐、生产过程易受污染,无法实现全自动化生产[Tree JA,Richardson C,Fooks AR,Clegg JC,&Looby D(2001)Comparison of large-scale mammalian cell culture systems with egg culture for the production of influenza virus A vaccine strains.Vaccine 19(25):3444-3450.]。而且鸡胚来源的病毒在鸡胚连续传代后常常引起HA的变异,这种变异也可能发生在病毒其它节段[Rocha EP,et al.(1993)Comparison of 10influenza A(H1N1and H3N2)haemagglutinin sequences obtained directly from clinical specimens to those of MDCK cell-and egg-grown viruses.The Journal of general virology 74:2513-2518.],结果使鸡胚来源的疫苗不能与人群中的流行毒株完全匹配。而应用哺乳动物细胞生产的疫苗在动物模型显示出比较好的保护作用[Govorkova E,Murti G,Meignier B,De Taisne C,&Webster R(1996)African green monkey kidney(Vero)cells provide an alternative host cell system for influenza A and B viruses.Journal of virology 70(8):5519-5524.]。因此,科研工作者寻求开发新形式的流感疫苗生产方式。
MDCK细胞是进行流感病毒研究最常用的细胞,被认为是培养甲型和乙型流感病毒最合适的细胞系[Robertson J(1998)An overview of host cell selection.Developments in biological standardization 98:7-11;discussion 73-14.],此细胞系具有感染后迅速产生子代流感病毒的特点,而且MDCK来源的病毒经过连续传代后,保持了抗原的稳定性[Govorkova E,Kodihalli S,Alymova I,Fanget B,&Webster R(1998)Growth and immunogenicity of influenza viruses cultivated in Vero or MDCK cells and in embryonated chicken eggs.Developments in biological standardization 98:39-51;discussion 73-34.]。流感病毒入侵细胞时,首要要与细胞表面的特异性SAα2,3Gal受体结合,但MDCK细胞表面SAα2,3Gal受体丰度较低,导致病毒滴度低,达不到在鸡胚上的复制水平。因此,提高流感病毒在MDCK细胞内的复制能力、提高病毒滴度,细胞基质流感疫苗才具有产业化的价值。
目前,MDCK细胞培养多数采用有血清贴壁培养,然而血清成份复杂,并增加了产物分离纯化的难度,血清来源有限、价格昂贵、生产成本高,血清的质量因动物个体、血清产地、生产批号不同而产生波动,使得实验和生产难以实现标准化。MDCK细胞是贴壁依赖性的细胞,只有贴附到基质表面其才能存活、增殖和表达产物。传统的培养方法采用二维单细胞层培养[Frisch SM&Francis H(1994)Disruption of epithelial cell-matrix interactions induces apoptosis.The Journal of cell biology 124(4):619-626.],由于受到基质表面积限制,加之消化工艺复杂、生产时间长和生产成本高等困扰,难以实现MDCK细胞大规模培养和流感疫苗工业化生产。而哺乳动物细胞悬浮培养体系除了可以突破细胞生长表面限制之外,细胞培养环境更加均一,利于生产规模的放大和监控。因此,迫切的需要能适应悬浮生长的细胞来满足扩大化的工业生产,MDCK全悬浮细胞系的建立对于疫苗生产的产业化进程有着重大的意义。
已有文献报道证实人类的TIGAR基因(TP53-induced glycolysis and apoptosis regulator)能够调节细胞的糖代谢和细胞凋亡。大量实验证实TIGAR基因编码的蛋白与1,6-二磷酸果糖激酶在C端的二磷酸酶结构域相同,产生竞争性抑制作用,即能够减弱6-磷酸果糖转化生成1,6-二磷酸果糖,该过程一方面抑制了糖酵解的关键代谢酶1,6-二磷酸果糖激酶,一方面通过积累6-磷酸果糖促进了戊糖磷酸途径。PPP途径的增强导致细胞内NADPH等还原力增加,进而引起细胞内活性氧族(ROS)的减少[Wanka,C.,Steinbach,J.P.&Rieger,J.P53-induced glycolysis and apoptosis regulator(TIGAR)protectsgliomacells from starvation-induced cell death by up-regulating respiration and improving cellular redox homeostasis.The Journal of biological chemistry287(40):33436-33446.]。研究证实ROS在p53介导的细胞凋亡中有着重要调节作用,可以经由多种途径抑制细胞生长、诱发细胞凋亡[Circu,M.L.&Aw,T.Y.Reactive oxygen species,cellular redox systems and apoptosis.Free radical biology&medicine48(6):749-762.]。因此,TIGAR基因通过ROS的减少可以抑制细胞凋亡。细胞凋亡能力的增强可以抵抗不良的外界环境,进而提供足够的细胞以供流感病毒的复制。
技术实现要素:
本发明的第一个目的在于提供一种MDCK细胞系TG-418-E5。
一株稳定表达人源TIGAR基因的MDCK细胞系TG-418-E5,其含有TIGAR编码基因序列,它的保藏号是CGMCC NO:12983。
构建上述MDCK细胞系TG-418-E5的方法,包括将TIGAR的开放阅读框cDNA克隆到MDCK细胞系中,建成稳定表达TIGAR基因的MDCK细胞系。
本发明中利用人源TIGAR基因的高效真核表达质粒,转染MDCK细胞,经G418抗性和RT-PCR筛选鉴定表达阳性的单克隆细胞株,我们对得到的10株单克隆细胞株进行了实时荧光定量PCR检测,得到了人源TIGAR基因表达量最高的单克隆细胞命名为TG-418-E5。TG-418-E5细胞系传代30代后,通过实时荧光定量PCR检测发现,第30代细胞里的TIGAR基因表达量和原代细胞没有差异,表明人源TIGAR基因在TG-418-E5细胞中得到稳定表达。
本发明的第二个目的在于筛选具有显著抗凋亡能力、降低MDCK细胞贴壁性能和提高禽流感病毒分离株的生长滴度的重组MDCK细胞系。通过流式细胞术检测TG-418-E5细胞系在细胞培养后期和接种流感病毒的情况下的凋亡情况,结果显示相比于母本MDCK细胞,TG-418-E5细胞系具有显著地抗凋亡能力。TG-418-E5细胞系抗凋亡能力的提高,使得细胞在凋亡压力下的存活时间延长,以支持禽流感病毒的增殖。不论是H5亚型禽流感病毒还是H7亚型均对TG-418-E5细胞系更加易感,接种禽流感病毒后病毒血凝价提高了1-2个滴度,尤其是H5亚型禽流感病毒提高了2个滴度。我们发现转染了TIGAR基因的TG-418-E5细胞会失去与相邻细胞形成紧密连接的能力,同时伸展性不如母本细胞,贴壁性显著降低。因此,MDCK细胞贴壁性能的降低为研究MDCK的无血清全悬浮培养的应用及用于大规模生产细胞培养疫苗奠定了基础。
本发明公开了所述细胞系在MDCK的无血清全悬浮培养及抗禽流感病毒药物筛选、疫苗株筛选、大规模生产细胞培养疫苗中的应用。
本发明首次建立了表达人源TIGAR基因的MDCK细胞系(TG-418-E5细胞)的方法。通过在MDCK细胞中稳定表达TIGAR基因,提高了细胞的抗凋亡能力,延长了重组细胞的存活时间。同时,人源TIGAR基因在MDCK细胞中表达影响了细胞间连接通路,从而降低MDCK细胞的贴壁性能。该方法不仅为研究MDCK的无血清全悬浮培养用于大规模生产细胞培养疫苗的应用奠定了基础,同时提高禽流感疫苗株的繁殖滴度节约了生产工艺成本。此外,TG-418-E5细胞系在抗禽流感病毒药物筛选、疫苗株筛选以及细胞培养疫苗的生产方面都展示出较好的应用前景。
附图说明
图1:MDCK与MDCK-TIGAR细胞RT-PCR鉴定结果
注:1-10代表不同单克隆细胞,C代表母本MDCK细胞,M:200bp Marker。
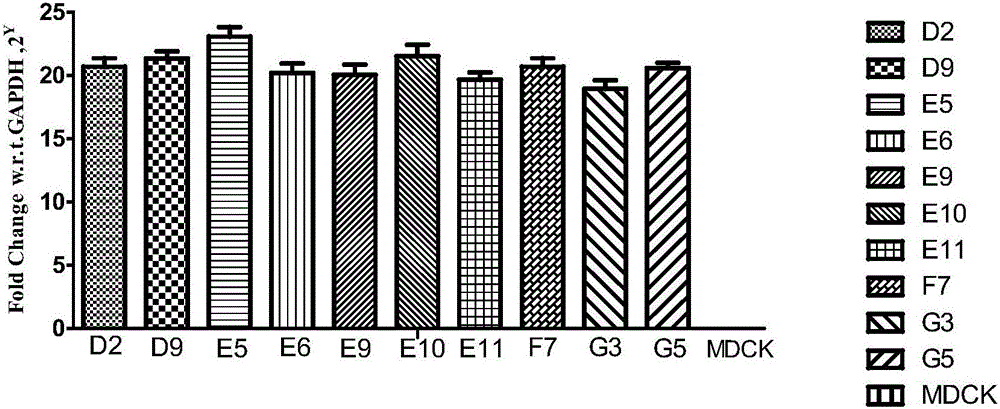
图2:MDCK和10株改造克隆细胞中人源TIGAR基因mRNA的表达情况。
图3:MDCK与TG-418-E5细胞贴壁生长曲线
图4:MDCK与TG-418-E5细胞形态变化
图5:TG-418-E5细胞中TIGAR的遗传稳定性检测
图6:MDCK与TG-418-E5细胞在培养后期的存活情况
图7:MDCK与TG-418-E5细胞在培养后期的凋亡情况
图8:MDCK与TG-418-E5细胞在接毒情况下的存活情况
图9:MDCK与TG-418-E5细胞在接毒情况下的凋亡情况
注:(*)表示与MDCK-SNA相比具有显著差异(p<0.05);
(**)表示与MDCK MAA相比具有显著差异(p<0.05)。
本发明中TG-418-E5细胞克隆株于2016年9月5日保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),分类命名为稳定表达TIGAR基因的犬肾细胞细胞系Madin-Darby canine kindey细胞,保藏号为CGMCC No.12983。
具体实施方式
1、MDCK-TIGAR细胞系的构建
含人源TIGAR基因开放阅读框的真核表达质粒购自Genecopoeia公司(货号:EX-W1314-M02-5-5);人源TIGAR基因的GenBank登录号分别为NM_020 375。所用引物序列见表1。在35mm2细胞培养皿中接种2×105个生长状态良好的MDCK细胞,放置于37℃、6%CO2恒温培养箱中培养。待细胞长至70%-80%时待用于转染。将质粒和转染试剂Lipofectamine 2000Regeant平衡至室温,取浓度为470ng/mL的质粒4.3μL于灭菌的指形管中,加入100μL的无抗无血培养基,混合均匀后加入5μL的转染试剂,室温下作用15-20分钟,使其形成DNA-脂质体复合物。然后将此复合物分点滴加至用无抗无血培养基清洗过两次的待用MDCK细胞上,补加无抗无血培养基至2mL,于37℃、6%CO2环境中培养8小时左右,替换为含5%胎牛血清的DMEM培养基继续培养。
表1.TIGAR和GAPDH基因RT-PCR和qRT-PCR引物
aGAPDH的GenBank登录号为:NM_001003142.1。
待细胞长满,胰酶消化后将其均匀的铺于6孔板中,用含有相应最适浓度抗生素的10%胎牛血清DMEM继续培养,每孔800μL,3天换液一次,持续筛选直至见有抗性的细胞生长,不进行质粒转染的无抗性的细胞组作为阴性对照,全部死亡。
2、目的细胞的单克隆筛选及基因表达的检测
母本MDCK细胞通过脂质体转染法转染了带有G418抗性的TIGAR基因真核表达载体,使用含有0.4mg/mL G418的10%胎牛血清DMEM培养基进行筛选,获得具有G418抗性的细胞克隆,并将获得的抗性细胞以有限稀释法进行亚克隆。用含有相应浓度抗生素的10%胎牛血清DMEM的培养液稀释至细胞密度为0.5-1个/100μL,铺于96孔板中,并补加两滴相应培养基,放置于37℃、6%CO2恒温培养箱中。之后隔天观察一次,逐渐剔除非单克隆细胞株,筛选2周后,挑选得到10株生长状态较好的单克隆细胞株,依次在24孔细胞培养板、6孔细胞培养板、25cm2细胞瓶扩大培养并采用常规方法冻存细胞,保种待用。
按照原平皓生物公司的RNA快速提取试剂盒说明书提取10株单克隆抗性细胞株的RNA,之后使用TAKaRa公司PrimeScriptTMRT reagent Kit去除所提取的RNA中的DNA杂质:
RNA经去除DNA杂质后再反转录成cDNA:
上述试剂经混合后,37℃作用15min,然后85℃5s,最后储存在4℃。
通过普通PCR,以表1所设计的引物定性检测TIGAR有无表达,其反应体系和程序:
PCR结束后配制1%的琼脂糖凝胶,并以EB染色,每孔加入20μL PCR产物,在100V电压下进行电泳,凝胶成像系统检测电泳结果如图1所示所有细胞株均可检测到清晰明亮的810bp目的条带,而母本MDCK细胞没有任何条带,说明10株单克隆细胞株均整合了TIGAR基因。
为了选择人源TIGAR基因表达量最高的单克隆细胞,我们对得到的10株细胞以表1所设计的引物通过实时荧光定量PCR定量检测TIGAR的表达水平,使用TAKaRa公司Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂,其反应体系和程序:
结果(见图2)表明TIGAR基因的mRNA在10株克隆株中均能检测到,但在母本MDCK中检测不到。同时10株细胞中TIGAR基因的表达存在差异,其中TG-418-E5细胞TIGAR基因的表达水平显著高于其他克隆株(p<0.05),因此选取TG-418-E5细胞进行后续研究。
表2.母本MDCK和MDCK-TIGAR细胞贴壁性比较
3、细胞贴壁生长速率分析
为了检测TIGAR基因的进入是否影响细胞的形态及生长,研究中选择母本MDCK细胞和TG-418-E5细胞分别接种于6孔板,每种细胞接种6块细胞板,初始细胞接种密度为2×105/孔,补加含10%胎牛血清的DMEM培养基至2mL,放置在6%CO2、37℃恒温培养箱中培养。每隔12h(12h、24h、36h、48h、60h、72h、84h、96h、108h、120h、144h)取样检测,每种细胞每次均选取3个平行孔,然后用台盼蓝染色,进行活细胞计数,最后绘制细胞的生长曲线。结果如图3所示,TG-418-E5与母本MDCK细胞在相同培养条件和相同接种密度时生长速率和最大细胞数没有显著差异,并未受到TIGAR基因的影响,而且在衰亡期由于TIGAR的抗凋亡作用使得TG-418-E5细胞的活率高于MDCK细胞。
4、TG-418-E5细胞贴壁性能分析
我们以细胞脱落实验检测细胞的贴壁性能,选择TG-418-E5和MDCK细胞接种到6孔板,接种量为100万/孔,补加10%DMEM 2mL,每种细胞做三个重复,放置在6%CO2、37℃恒温培养箱培养。接种细胞12h后待细胞在孔内长成致密单层,将孔内上清吸掉弃去,PBS洗涤两次,之后每孔加入100μL无EDTA的胰酶,放到37℃恒温培养箱消化10min,到时间加入10%DMEM培养基终止消化,并吹打三次,转移到指行管,然后加入PBS将残留的消化下来的细胞尽量收集到指形管。每孔仍然加入100μL无EDTA的胰酶,放到恒温箱继续消化10min,之后同第三步,直至孔内细胞被全部消化下来。将每个时间点消化下来的细胞用台盼蓝染色,进行细胞计数,并计算每个时间点的细胞脱落率,用下面公式推算细胞脱落率:脱落率=(每个时间点的细胞数/细胞总数)×100%。
细胞形态如图4所示,我们发现表达人源TIGAR基因影响MDCK细胞之间的粘连和细胞的伸展性。转染了TIGAR基因的TG-418-E5细胞会失去与相邻细胞形成紧密连接部的能力,同时伸展性不如母本细胞由表2可以看出,相比于母本MDCK细胞,TG-418-E5细胞在前30min消化下来的细胞数较高,另外,TG-418-E5细胞在40min后完全脱落,而母本MDCK细胞在50min后才完全脱落。因此,可以判断出TG-418-E5细胞的贴壁性比MDCK细胞明显弱,通过转染TIGAR基因成功降低了MDCK细胞的贴壁性。为研究MDCK的无血清全悬浮培养及应用于大规模细胞基质禽流感疫苗的研究奠定了基础。
5、TIGAR基因的遗传稳定性检测
我们对高表达TIGAR基因的TG-418-E5细胞以10%DMEM培养基连续传代培养至30代,选取第10代、20代、30代细胞按照步骤3操作提取细胞RNA,之后通过实时荧光定量PCR检测TIGAR的表达量,并比较各代TG-418-E5细胞中TIGAR表达情况有无差异。另外每传10代,对细胞进行细菌和支原体检测,确认无污染后冻存留种并继续传代。结果如图5所示原始代次细胞和第30代次细胞中TIGAR的表达没有差异。这些鉴定结果表明,所得到的TG-418-E5细胞中人源TIGAR基因开放阅读框序列cDNA已经整合到细胞基因组中,能够随着MDCK细胞系传代而稳定持续地转录和表达。
6、流式细胞仪检测TG-418-E5细胞抗凋亡能力
我们选择Annexin V-PI凋亡检测试剂盒检测TG-418-E5细胞分别在培养后期以及接种流感病毒情况下的抗凋亡能力。细胞凋亡早期,细胞膜内的磷脂酰丝氨酸外翻,Annexin V能够特异性地与之结合而指示凋亡细胞。在细胞凋亡晚期,细胞膜破裂,PI能够进入胞内与细胞核结合。
a、选择无污染且状态良好的TG-418-E5和MDCK细胞,接种到6孔板,接种量为100万/孔,补加10%DMEM培养基至2mL,放置在6%CO2、37℃恒温培养箱中培养至120h,中途不补加、更换培养基,接种细胞后每隔24h检测细胞的凋亡情况,检测前拍照记录细胞状态;
b、处理样品时,将六孔板内细胞上清转移至离心管内,标记清楚,PBS洗涤两次,并将洗涤液转移到对应的离心管内。每次TG-418-E5细胞和MDCK细胞检测3孔,再以三个MDCK孔作为单染调节荧光补偿。每孔加2滴含EDTA的胰酶,之后放入37℃恒温培养箱中消化,待细胞成流沙状滑落下来,加入一管10%DMEM培养基终止消化,吹打细胞使之成为单细胞悬液,将细胞悬液转移到对应的离心管,然后再用PBS洗涤两次六孔板,并收集残留的细胞,放到上面的离心管中,在4℃离心机中以1400rpm离心10min;
c、弃去离心上清,每管加入一管PBS,小心吹打细胞,尽量不要对细胞造成损伤,每支离心管的吹打次数保持一致,以减少组内差异,之后放到4℃离心机中以1400rpm离心10min,然后再洗涤一次;
d、弃去离心上清,实验组和对照组每管各加入1mL PBS,小心吹打细胞,使之成为单细胞悬液,吸取少量细胞悬液进行细胞计数。根据计数结果,调整各组细胞密度至100万/mL,然后每管吸取200μL至指形管,放到4℃离心机中以1400rpm离心10min。
e、弃去离心上清,每管加入400μL孵育液,实验组和对照组每管先加入2μLPI染液,再加入2μL FITC标记的Annexin-V染液,另外两组MDCK细胞分别加入2μLPI染液和2μL FITC标记的Annexin-V染液,最后一组MDCK细胞不加任何染液,小心吹打细胞,使之成为细胞悬液,室温避光染色15min,之后通过流式细胞仪检测,并使用SPSS 17.0检测组别间的差异性。
在细胞培养后期情况下抗凋亡能力检测的结果如图6所示,24h时TG-418-E5细胞与母本MDCK细胞存活率没有差别,而之后直至120h,TG-418-E5细胞的存活率都显著高于母本MDCK细胞。由图7可知,两种细胞的凋亡情况大致和存活情况相反,在24h时候二者没有显著差异,在48h、72h时候TG-418-E5细胞的凋亡率均显著低于母本MDCK细胞(P<0.05),而且在96h、120h时候TG-418-E5细胞的凋亡率极显著低于MDCK细胞(P<0.01)。
在细胞接种禽流感病毒情况下抗凋亡能力检测的结果如图8所示,在接毒后3h、6h、12h时候TG-418-E5细胞的存活率均极显著高于MDCK细胞(P<0.01),而在24h时候二者没有显著差异。根据图9可知两种细胞的凋亡情况大致和存活情况完全相反,在接毒后3h、6h、12h时候TG-418-E5细胞的凋亡率均极显著低于母本MDCK细胞(P<0.01),而在24h时候二者没有显著差异。
7、禽流感病毒疫苗株Re-6在TG-418-E5细胞上的增殖特性研究
选择禽流感病毒疫苗株Re-6分别接种到TG-418-E5细胞和母本MDCK细胞,接毒后放置于37℃恒温培养箱中培养96h,中间每隔12h测定HA效价,方法参照WHO标准,检测细胞对病毒增殖的影响。如表3所示,禽流感病毒疫苗株Re-6对TG-418-E5细胞系更加易感,接种禽流感病毒后病毒血凝价提高了2个滴度。上述结果表明TG-418-E5细胞在抗禽流感病毒药物筛选、中和抗体测定中的前景。
表3.Re-6疫苗株在TG-418-E5和MDCK细胞内的增殖能力
SEQUENCE LISTING
<110> 扬州大学
<120> 稳定表达人源TIGAR基因的MDCK细胞系
<130>
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 23
<212> DNA
<213> 人工序列
<400> 1
gtgatgctgg tgctgagtat gtt 23
<210> 2
<211> 21
<212> DNA
<213> 人工序列
<400> 2
ggtcttctgg gtggcagtga t 21
<210> 3
<211> 27
<212> DNA
<213> 人工序列
<400> 3
atggctcgct ttgctctgac tgttgtc 27
<210> 4
<211> 27
<212> DNA
<213> 人工序列
<400> 4
ctagcgagtt tcagtcagtc catttag 27
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<400> 5
gggaagagtg ccctgtgttt 20
<210> 6
<211> 23
<212> DNA
<213> 人工序列
<400> 6
tccgcttctt tcaggattag ttg 23
- 还没有人留言评论。精彩留言会获得点赞!