一种磷酸化肽富集材料及其制备方法与应用与流程
本发明涉及材料分析化学和有机化学领域,尤其涉及一种磷酸化肽富集材料及其制备方法与应用。
背景技术:
蛋白质的磷酸化是生物体内最常见、最重要的蛋白翻译后修饰方式之一,因此磷酸化蛋白质组学研究引起了众多世界科学家的广泛关注。但是由于磷酸化蛋白质在生物体内绝对含量很低,目前,进行磷酸化蛋白质组学研究的技术策略主要是在蛋白质或肽段水平上富集之后进行。已有的磷酸肽富集方法主要有:固定金属离子亲和色谱法,金属氧化物法,离子交换色谱法,以及上述几种技术的联用。但是这些方法存在多磷酸化肽难以洗脱、非特异性吸附酸性肽链或者带碱性残基磷酸化肽难以保留的问题,因此无法实现复杂生物样品大规模富集磷酸化肽的目的。
技术实现要素:
本发明为了解决上述技术问题提供一种对磷酸化肽具有显著识别能力的磷酸化肽富集材料及其制备方法与应用。该材料提供了一种具有高选择性、高吸附量、操作简单和重复性好的磷酸化肽的分离富集方法,能对生物样品中相对低含量的单磷酸化肽和多磷酸化肽进行选择性富集和分离。
本发明采用如下技术方案来实现:
一种双组分共聚物,所述双组份共聚物具有如下所示的分子结构:
其中R为羧基、硝基、甲基、甲酸乙酯基或氢;X=0.01-0.5。
上述方案中,包括基底及形成于基底表面的双组分共聚物层,所述双组分共聚物的分子结构如权利要求1所述,所述双组分共聚物层的厚度为10-80nm。
上述方案中,所述基底的材料为Si、Cu、Ag、Au、Pt、CuO、Fe3O4、多孔SiO2、多孔Al2O3、多孔TiO2或多孔ZrO2中的任意一种或者两种以上任意比例的混合。
所述的磷酸化肽富集材料的制备方法,该制备方法是利用表面引发-原子转移自由基聚合反应机制,将双组分共聚物接枝到基底表面,具体制备方法如下:
1)在反应容器中依次加入异丙基丙烯酰胺和硫脲功能单体,同时加入超纯水及二甲基甲酰胺的混合溶液作溶剂,其中,异丙基丙烯酰胺和硫脲功能单体的摩尔比1-20:1,超纯水与二甲基甲酰胺的体积比为1:1-10;
2)在无氧条件下加入催化剂和配体,将基底浸入前述溶液中,保持氮气气氛,在恒温60-80℃条件下进行原子转移自由基聚合反应4-24小时;
3)反应结束后,洗涤基底表面并在30-80℃下真空干燥,得到所述磷酸化肽富集材料。
所述的磷酸化肽富集材料在磷酸化肽富集分离中的应用方法,采用柱固相萃取模式,具体步骤如下:
1)将磷酸化肽富集材料装入移液枪枪头或者凝胶上样吸头中,形成微固相萃取柱,采用活化液和平衡液活化及平衡微固相萃取柱,将蛋白酶解物溶解于平衡液中,并上到微固相萃取柱上,磷酸化肽富集材料与蛋白酶解物的质量比为100:1-1000:1;
2)采用5-200倍柱体积pH 0-7的有机溶液冲洗萃取柱;
3)采用5-100倍柱体积pH 3-7的有机溶液洗脱得单磷酸化肽;
4)采用5-100倍柱体积pH 0-3的有机溶液洗脱得多磷酸化肽,上述整个过程在10-60℃进行。
所述的磷酸化肽富集材料在磷酸化肽富集分离中的应用方法,采用分散固相萃取模式,具体步骤如下:
1)先采用活化液活化磷酸化肽富集材料,将该磷酸化肽富集材料与蛋白酶解物以质量比为100:1-1000:1混合,孵化0.5分钟-12小时,过滤或者分散固相萃取分离,弃上层清液,收集沉淀;
2)采用pH=0-7的有机溶液对沉淀清洗;
3)将清洗后的沉淀采用pH 3-7有机溶液洗涤,过滤或者分散固相萃取分离,收集上层清液;浓缩得到单磷酸化肽;
4)将清洗后的沉淀采用体积pH 0-3有机溶液洗涤,过滤或者分散固相萃取分离,收集上层清液,得多磷酸化肽,上述整个过程在10-60℃进行。
上述方案中,所述有机溶液、活化液和平衡液均为有机溶剂、有机酸和水的混合液,有机溶剂为乙腈、甲醇或乙醇,有机酸为甲酸、乙酸或三氟乙酸,有机溶剂的体积浓度为10%-95%,有机酸的体积浓度为0.1-5%。
上述方案中,所述有机溶液、活化液和平衡液均为有机溶剂、有机酸和水的混合液,有机溶剂为乙腈、甲醇或乙醇,有机酸为甲酸、乙酸或三氟乙酸,有机溶剂的体积浓度为10%-95%,有机酸的体积浓度为0.1-5%。
上述方案中,所述活化液中有机溶剂体积浓度为10-50%,pH=0-7。
上述方案中,所述平衡液中有机溶剂体积浓度为50-95%,pH=0-7。
本发明的有益效果为:
1、本发明制备的磷酸化肽富集材料在分离富集磷酸化肽时表现出了高选择性和高通量等特点,可以实现多磷酸化肽和单磷酸化肽的有效分离和富集;
2、本发明制备的磷酸化肽富集材料既可以方便的装填成不同长度,不同内径的柱子,又可以直接添加于离心管,操作简单,易于重复。特别适合微量生物样品中磷酸化肽段的分离富集;
3、本发明富集得到的磷酸化肽可直接用于电喷雾-质谱分析(ESI-MS)或者基质辅助激光解吸电离-飞行时间质谱(MALDI-TOF MS),提高了质谱的检测限和灵敏度。
本发明开发了一系列基于硫脲的多氢键受体,并通过表面引发-原子转移自由基聚合的方法分别将它们与温敏性功能单体接枝到各种材料上,得到了厚度十到几十纳米不等的智能响应性聚合物表面。将聚合物修饰的多孔材料与柱固相萃取模式或分散固相萃取模式有机的结合,可实现复杂混合物中磷酸化肽高选择性、高重复性和高通量地富集,从而实现多磷酸化肽和单磷酸化肽的选择性富集,可显著提高磷酸化蛋白鉴定数目。因此,其有望在磷酸化肽富集,进而大规模分离磷酸化蛋白等方面获得广泛的应用。
附图说明
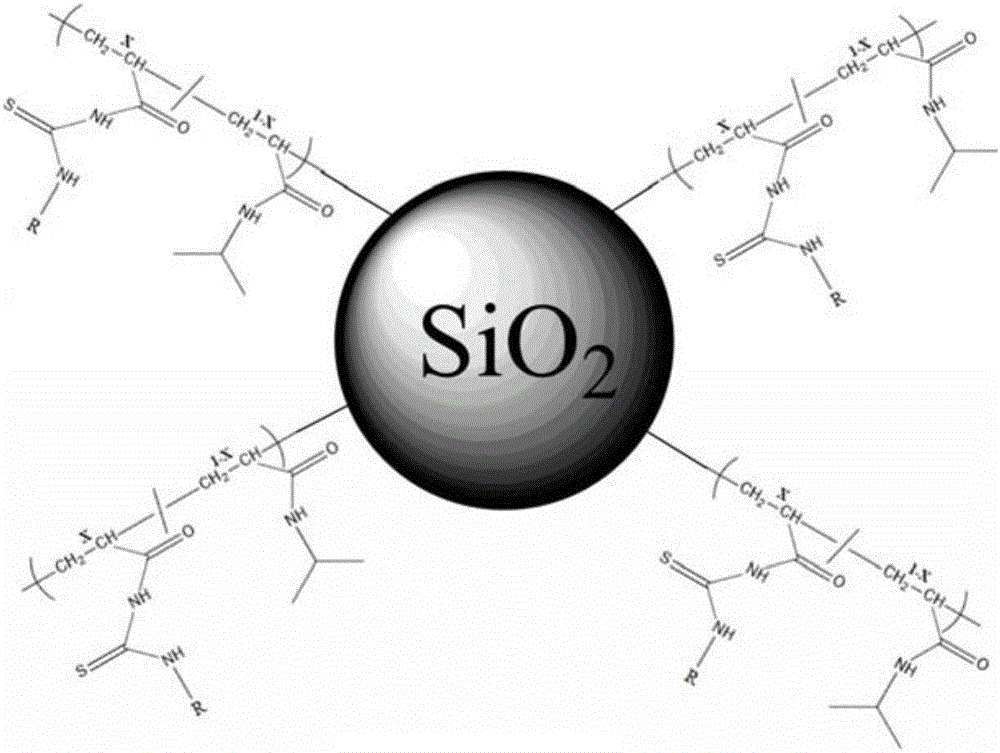
图1为双组分共聚物分子结构示意图。
图2为双组分共聚物接枝到硅胶样品的结构示意图。
图3为硫脲单体合成步骤示意图。
图4为双组分共聚物表面(以硫脲单体末端R为羧基为例)对不同肽链的石英微天平(QCM)吸附曲线。
图5为富集应用实例中使用的固定相结构示意图。
图6为采用SPE模式经磷酸化肽富集材料富集后,α-酪蛋白酶解产物中的单磷酸化肽质谱信号示意图。
图7为采用SPE模式经磷酸化肽富集材料富集后,α-酪蛋白酶解产物中的多磷酸化肽质谱信号示意图。
图8为采用SPE模式经氧化钛材料富集后,α-酪蛋白酶解产物中磷酸化肽质谱信号示意图。
图9为采用离心模式,经磷酸化肽富集材料富集后α-酪蛋白酶解产物中的非磷酸化肽质谱信号示意图。
图10为采用离心模式,经磷酸化肽富集材料富集后α-酪蛋白酶解产物中的单磷酸化肽质谱信号示意图。
图11为采用离心模式,经磷酸化肽富集材料富集后α-酪蛋白酶解产物中的多磷酸化肽质谱信号示意图。
具体实施方式
为使本发明的内容、技术方案和优点更加清楚明白,以下结合具体实施例和附图进一步阐述本发明,这些实施例仅用于说明本发明,而本发明不仅限于以下实施例。
实施例中所用原料及设备:
HPLC柱色谱填料硅胶(氨基修饰)由上海月旭公司购得。溴化亚铜(CuBr,99.999%),联吡啶类配体,有机碱,异丙基丙烯酰胺,丙烯酰氯,对氨基苯甲酸乙酯由Sigma-Aldrich公司购得。丙酮,甲醇,二甲基甲酰胺(DMF),氢氧化钠由阿尔法公司购得。各种测试用的肽链由上海强耀生物科技有限公司购得。异丙基丙烯酰胺在使用前用正己烷重结晶三次,放置在真空干燥器中备用。其他试剂均使用市售分析纯。1H spectra在Bruker ARX300spectrometer检测获得。石英微天平(QCM)吸附数据由Q-Sense E4system检测获得。质谱分析结果由MALD-TOF MS获得。
实施例1
磷酸化肽富集材料的制备
双组份聚合物结构如图1所示,其中X=0.01-0.5。以X=0.2为例,在25ml三口烧瓶中依次加入0.4mmol异丙基丙烯酰胺,0.1mmol的硫脲功能单体,物质摩尔比为4:1,同时加入6mL超纯水以及6mL DMF作溶剂;在搅拌下通入氮气,待单体充分溶解之后,在氮气保护下加入催化剂CuBr 0.032g以及联吡啶类配体0.16mL,随后反应体系抽真空—充氮气,除去反应体系中残余的氧气;将溴化处理过的基底浸入配置好的反应溶液;将烧瓶的温度控制在60-80℃静置反应4-24小时;反应结束后用N,N’-二甲基甲酰胺(DMF)和去离子水(H2O)依次洗涤聚合物接枝表面,得到磷酸化肽富集材料,此磷酸化肽富集材料表面双组分共聚物膜的厚度为10-80nm,氮气吹干表面后置于真空干燥器中备用。
本发明中,基底材料为Si、Cu、Ag、Au、Pt、CuO、Fe3O4、多孔SiO2、多孔Al2O3、多孔TiO2或多孔ZrO2中的任意一种或者两种以上任意比例的混合。在本实施例中,选用的基底材料为硅胶。图2为双组分共聚物接枝的硅胶样品的结构示意图。
实施例2
功能单体的结构与合成方法
为制备上述的双组分共聚物,需要合成一系列硫脲功能单体,它们具体实施的合成方法类似,合成步骤如图3所示。
以合成末端基R为羧基的硫脲单体为例,在室温环境中,将0.582g(6mmol)溶解在30~50mL无水丙酮中,搅拌条件下,将0.453g(5mmol)丙烯酰氯逐滴滴加至上述溶液中,继续反应12小时。反应结束后离心(4500r/min,5min),取上清液备用。在室温条件下,将0.685g(6mmol)对氨基苯甲酸溶解在30mL无水丙酮中,加2~4mL超纯水,搅拌条件下将备用清液逐滴滴加至上述溶液中,继续反应12小时。反应结束后旋蒸除去溶剂,得黄色油状物。该粗产物用30mL无水丙酮清洗-过滤,重复三遍得到1.02g淡黄色固体目标产物,产率约为80%。产物的结构通过核磁氢谱、核磁碳谱和质谱进行了表征鉴定。产物的结构通过核磁氢谱、核磁碳谱和质谱进行了表征鉴定。其余含不同末端R端基的硫脲单体参照此方法合成。
R端基为羧基的硫脲单体表征数据:1H NMR(300MHz,DMSO):5.99-6.03(d,1H,=CH),6.42-6.66(m,2H,=CH),7.82-7.96(m,4H,Ph-H),11.73(s,1H,CNHCS),12.77(s,1H,CNHCS),12.91(br,1H,COOH);13C NMR(300MHz,d6-DMSO):δ(ppm):126.5,128.7,131.4,135.4,136.0,147.0,157.6,167.2,172.4,176.0;MADLI-MS:m/z calcd for C11H10N2O3S:250.04;found:250.68;FT-IR:σ(cm-1):875,978,1165,1252,1410,1570,1599,1673,2851,2972,3183;Tm:161.5℃。
R端基为硝基的硫脲单体表征数据:1H NMR(300MHz,DMSO):5.70-5.78(m,1H,=CH),6.22-6.43(m,2H,=CH),7.62-7.86(m,4H,Ph-H),11.52(s,1H,CNHCS),12.43(s,1H,CNHCS);13C NMR(300MHz,d6-DMSO):δ(ppm):126.7,128.5,135.3,136.2,138.1,147.6,159.9,170.5;MADLI-MS:m/z calcd for C10H9N3O3S:251.26;found:252.05;FT-IR:σ(cm-1):878,984,1300,1437,1570,1589,1601,1672,2977,3151;Tm:168.4℃。
R端基为甲基的硫脲单体表征数据:1H NMR(300MHz,DMSO):5.99-6.03(d,1H,=CH),6.42-6.66(m,2H,=CH),7.82-7.96(m,4H,Ph-H),11.73(s,1H,CNHCS),12.77(s,1H,CNHCS),12.91(br,1H,COOH);13C NMR(300MHz,d6-DMSO):δ(ppm):23.4,126.9,129.5,131.2,135.4,137.1,147.8,158.9,171.5;MADLI-MS:m/z calcd for C11H12N2OS:220.29;found:220.08;FT-IR:σ(cm-1):877,968,1108,1485,1571,1602,1667,1826,2962,3203;Tm:143.6℃。
R端基为酯基的硫脲单体表征数据:1H NMR(300MHz,DMSO):1.30-1.33(m,3H,CH3),4.33(s,2H,CH2-),5.74-6.85(d,1H,=CH),6.32-6.44(m,2H,=CH),7.81-7.91(m,4H,Ph-H),11.15(s,1H,CNHCS),12.51(s,1H,CNHCS);13C NMR(300MHz,d6-DMSO):δ(ppm):15.3,62.1,127.5,128.9,132.7,137.4,138.3,149.0,158.9,169.5,174.4;MADLI-MS:m/z calcd for C13H14N2O3S:278.33;found:278.98;FT-IR:σ(cm-1):865,988,1367,1406,1571,1601,1668,2981,3173;Tm:184.6℃。
R端基为氢的硫脲单体表征数据:1H NMR(300MHz,DMSO):5.89-5.93(d,1H,=CH),6.40-6.64(m,2H,=CH),7.84-7.96(m,4H,Ph-H),11.83(s,1H,CNHCS),12.67(s,1H,CNHCS);13C NMR(300MHz,d6-DMSO):δ(ppm):126.4,127.6,130.4,136.4,137.0,147.5,157.7,167.6,171.4,;MADLI-MS:m/z calcd for C11H10N2O3S:205.04;found:206.08;FT-IR:σ(cm-1):870,968,1155,1256,1390,1556,1663,2854,2962;Tm:148.5℃。
实施例3
通过QCM-D吸附量测定的方法,以R端基为羧基的硫脲单体为例评价了双组分共聚物表面对磷酸化肽的特异性吸附。按实施例1所述将该双组分共聚物接枝到QCM-D芯片表面,在控温20℃条件下,以体积浓度80%乙腈/水+20mM甲酸铵为载液,对非磷酸化肽及单、双和三磷酸化肽分别进行吸附实验。图4显示了该双组分共聚物表面对不同肽链的吸附曲线,充分展现出了此类聚合物出色的特异性吸附磷酸化肽,并且有效区分磷酸化位点个数的能力,在磷酸化肽的富集和分离领域具有非常广阔的应用前景。000000
富集应用实例
实施例4
按实施例1所述方法将上述双组分共聚物接枝到多孔硅胶表面,然后以其为柱填料制成SPE柱备用。以硫脲单元末端基R为羧基为例,固定相结构见图5。
样品溶液的制备:1.0mg的α-酪蛋白溶解在1mL碳酸氢铵溶液中(50mM,pH=8.0),按照胰蛋白酶与α-酪蛋白的质量比1:40(w/w)的比例加入胰蛋白酶进行酶解,37℃反应12小时,所得蛋白酶解液进行下述实验操作。
将1mg聚合物修饰硅胶材料装入凝胶吸头中,1μL蛋白酶解液(其中含多肽1μg)上样后,分别用30μL的体积浓度为85%乙腈/0.1%甲酸(pH=3)的水溶液洗脱两次;然后用30μL含有70%乙腈/0.1%甲酸(pH 3)的水溶液洗脱两次;最后用20μL50%乙腈/3%三氟乙酸(pH 2)的水溶液洗脱。洗脱液直接在质谱上进行分析。上述整个过程在20℃条件下进行。
由图6和图7可见,α-酪蛋白酶解产物中的单磷酸化肽和多磷酸化肽可以依次从磷酸化肽富集材料上洗脱下来,并通过ESI-MS直接进行检测。相比于氧化钛富集得到的磷酸化肽(图8),采用磷酸化肽富集材料得到的磷酸化肽选择性更好,多磷酸化肽的个数更多,说明磷酸化肽富集材料能特异性的富集和纯化磷酸化肽。
实施例5-8
调整磷酸化肽富集材料的重量为2mg、3mg、4mg、5mg,其他条件同实施例4,富集后得到的磷酸化肽进行质谱分析,实验结果表明在萃取模式操作模式下1mg的材料即可以有效地保留和富集1μg的α-酪蛋白中的磷酸化肽。
实施例9-11
调整α-酪蛋白酶解液的上样量为2μg、4μg和8μg,其他条件同实施例4,富集后得到的磷酸化肽进行质谱分析,实验结果表明在固相萃取模式操作模式下1mg的材料最多可以有效地保留和富集2μg的α-酪蛋白中的磷酸化肽。
实施例12-14
调整最后一步洗脱多磷酸化肽时的洗脱溶液的pH为3、4和5,其他条件同实施例4,进行选择性富集和质谱分析。结果表明洗脱溶液pH为2时能将更多的多磷酸化肽从富集材料上洗脱下来,是为最佳pH值条件。
实施例15
调整富集的操作模式为离心,将1mg磷酸化肽富集材料装入离心管中,2μL(其中含多肽2μg)α-酪蛋白酶解液溶于30μL的30%CH3CN/0.1%甲酸的水溶液(pH=3)并与材料混合,孵化5min,离心后收集上清液,沉淀再用30%乙腈/0.1%甲酸的水溶液(pH 2)孵化5min,离心后合并上清液。沉淀与30μL含有5mM的甲酸铵的50%CH3CN/0.1%甲酸的水溶液(pH 2)孵化5min,离心后收集上清液,重复此孵化和离心步骤,离心后合并上清液;最后沉淀与30μL含有20mM的甲酸铵的80%CH3CN/0.1%甲酸的水溶液(pH 2)孵化5min,离心后收集上清液。各上清液直接在MALDI-TOF分析。
由图9至11可见,α-酪蛋白酶解产物中的非磷酸化肽没有被磷酸化肽富集材料保留,直接被洗脱出来(图9);单磷酸化肽可以被磷酸化肽富集材料保留,在较低浓度的盐可以洗脱出(图10);而多磷酸化肽与材料的作用最强最后被洗脱出来(图11),说明磷酸化肽富集材料能特异性的富集和纯化磷酸化肽。
实施例16-19
调整富集材料的重量为2mg、3mg、4mg、5mg,其他条件同实施例15,富集后得到的磷酸化肽进行质谱分析,实验结果表明在离心操作模式下1mg的材料即可以有效地保留和富集2μg的α-酪蛋白中的磷酸化肽。
实施例20-22
调整α-酪蛋白酶解液的上样量为4μg、6μg和8μg,其他条件同实施例15,富集后得到的磷酸化肽进行质谱分析,实验结果表明在离心操作模式下1mg的材料最多可以有效地保留和富集4μg的α-酪蛋白中的磷酸化肽。
实施例23-25
调整最后一步洗脱多磷酸化肽时的洗脱溶液的pH为3、4和5,其他条件同实施例15,进行选择性富集和质谱分析。实验结果表明在离心操作模式下,后一步洗脱溶液pH为2时可以洗脱出更多的多磷酸化肽,是为最佳pH条件。
通过以上实例所述方法,采用本发明的磷酸化肽富集材料对胰蛋白酶酶解后的α-酪蛋白溶液进行选择性富集,所得磷酸化肽经ESI-MS和MALDI-TOF检测后可得其多肽序列结构以及磷酸化位点数目,如下表所示:
表1 ESI-MS和MALDI-TOF检测到的α-酪蛋白酶解液中富集所得磷酸化肽信息
综上所述,本发明的磷酸化肽富集材料对于多磷酸化肽和单磷酸化肽具有很好的选择性富集性能,和常规的金属氧化物相比,聚合物修饰硅胶材料富集磷酸化肽具有更高选择性,更高多磷酸化肽回收率和更好的重复性。利用聚合物修饰硅胶材料对于磷酸化肽的高效的特异性吸附能力,可以将其应用于复杂体系中磷酸化肽的选择性分离富集,结合质谱,该材料在翻译后修饰蛋白质组学研究等领域具有广阔的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!