硝基还原酶的特异性荧光探针及其制备和用于肿瘤靶向荧光成像和监测肿瘤缺氧程度的应用的制作方法
本发明属于生物医学
技术领域:
,涉及一类检测试剂及其制备方法和应用,具体为硝基还原酶的特异性荧光探针及其制备方法和用于肿瘤靶向荧光成像和监测肿瘤缺氧程度的应用。
背景技术:
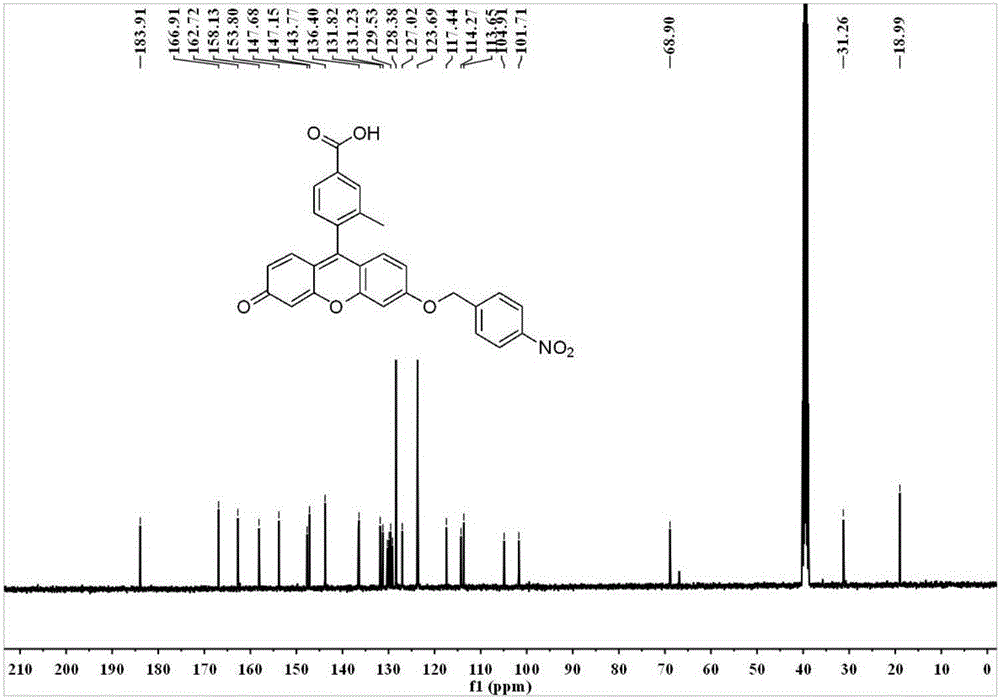
:细胞的生长和增殖有赖于充分的氧气和能量供应,在供氧量正常的组织中,细胞的能量来源约90%依赖于线粒体的有氧氧化。然而,肿瘤组织内,肿瘤细胞失控性生长和增殖消耗大量的营养和氧气,其内部不能及时、有效的建立新生血管网,或新生血管网的结构和功能异常,存在暂时性封闭或“盲端”;并且通透性较高,液体外渗至组织间隙导致血流黏滞阻力增加。这些因素使肿瘤内部血流减少,氧的供应远少于氧的需求,肿瘤细胞处于缺氧状态。此外,恶性肿瘤的自身进程以及抗肿瘤治疗所造成的贫血亦加剧了肿瘤的缺氧,肿瘤内部缺氧微环境由此产生。硝基还原酶家族属黄素酶,可以在辅酶烟酰胺腺嘌呤二核苷酸磷酸存在下代谢芳香族硝基化合物或者硝基取代的杂环化合物。研究表明缺氧组织或细胞以及肿瘤中硝基还原酶的含量相对正常状态呈现升高趋势。在缺氧条件下以还原型烟酰胺腺嘌呤二核苷酸NADH作为电子供体细胞内的硝基还原酶可催化多种外源硝基芳香族化合物发生单电子转移,生成硝基阴离子自由基,随后进一步被还原成羟胺或氨基。研究发现,硝基还原酶通常存在于细菌中,如大肠杆菌,在人的正常细胞中几乎不存在,而在恶性肿瘤中大量存在。因此,硝基还原酶可以作为肿瘤的生物标记物。小分子荧光探针被广泛的应用于化学分析,生物分析以及生物动态过程实时、非侵入性监测。因此,小分子荧光探针被广泛用于药物筛选和治疗效果的评估,实现了肿瘤治疗效果的早期监测。RGD(Arg-Gly-Asp,精氨酸-甘氨酸-天冬氨酸)氨基酸序列是多种生物细胞外基质和血浆蛋白结构中常见的基本成分,也是纤维细胞黏附的主要位点。人的基因组可产生24个不同的已知的整合素,大约有1/3的整合素在不同程度上识别RGD序列。肿瘤新生血管内皮细胞膜表面表达高水平的αvβ3/α5β1和α5β1整合素,因此含有RGD序列的蛋白,作为整合素配体,能够靶向性到达肿瘤局部新生血管内皮。外源性RGD多肽及其类似物可与体内含RGD序列的物质竞争结合,从而阻断血管上皮细胞增殖的信使传递,终止细胞增殖,使血管不能生长,导致肿瘤组织供氧系统中断,最终细胞萎缩、凋亡。研究发现RGD环状多肽比线状多肽有更高的受体结合特异性。基于上述原因,大量含RGD序列的线性或环状多肽被作为αvβ3拮抗剂合成,部分已成功制成荧光探针。技术实现要素:针对上述问题,本发明的目的在于制备了一类硝基还原酶的特异性荧光探针及制备方法和应用。该探针本体和被硝基还原酶还原后的产物,荧光强度具有明显的差别,且产物荧光可由荧光检测器检测,利用该探针反应可对多种生物体系中硝基还原酶的分布和反应效率进行评价。本发明第二个目的提供一种肿瘤靶向荧光成像和监测肿瘤转移的试剂。本发明第三个目的提供所述硝基还原酶的特异性荧光探针在制备用于肿瘤靶向荧光成像和监测肿瘤转移的试剂上的应用。本发明第四个目的提供提供一种监测肿瘤缺氧程度的试剂。本发明第五个目的提供所述硝基还原酶的特异性荧光探针在制备用于监测肿瘤缺氧程度的试剂上的应用。本发明的技术方案如下:硝基还原酶的特异性荧光探针,该探针由检测基团sensor、荧光基团dye、肿瘤靶向基团target通过化学键连接而成;其结构为:结构I型sensor-dye或结构II型sensor-dye-target。进一步,所述检测基团sensor结构为:所述荧光基团dye可以为荧光素类似物,其结构为:所述肿瘤靶向基团target的结构为:本发明所述硝基还原酶的特异性荧光探针,优选,所述结构I型sensor-dye的结构为下式FBN-1或FBN-2所示:所述结构II型sensor-dye-target的结构为下式FBN-3或FBN-4所示:本发明所述硝基还原酶的特异性荧光探针,本身没有荧光,探针中的硝基被硝基还原酶特异性还原,还原后的荧光产物具有很高的荧光量子产率,可采用荧光检测器实现底物荧光变化的快速、灵敏检测。本发明所述硝基还原酶的特异性荧光探针,作为硝基还原酶的特异性底物,通过定量检测单位时间内的底物消除率或其产物的生成率来定量测定不同生物体系中硝基还原酶的活性。本发明还提供所述硝基还原酶的特异性荧光探针的制备方法,该方法为:a)通过在碱性条件下用对硝基苄溴将荧光素(化合物(1))羟基烷基化制备得到硝基还原酶的特异性荧光探针FBN-1;b)通过还原FBN-1的酮羰基得到羟基后,再用对硝基苄溴将其烷基化得到硝基还原酶的特异性荧光探针FBN-2。c)FBN-3和FBN-4分别由FBN-1,FBN-2和RGD环肽缩合而成。本发明还提供一种肿瘤靶向荧光成像和监测肿瘤转移的试剂,所述试剂含有上述硝基还原酶的特异性荧光探针。本发明还提供所述硝基还原酶的特异性荧光探针在制备用于肿瘤靶向荧光成像和监测肿瘤转移的试剂上的应用。本发明还提供所述硝基还原酶的特异性荧光探针在制备用于肿瘤靶向荧光成像和监测肿瘤转移的试剂上的应用,可作为手术导航的试剂。本发明还提供一种监测肿瘤缺氧程度的试剂,所述试剂含有上述硝基还原酶的特异性荧光探针。本发明还提供所述硝基还原酶的特异性荧光探针在制备用于监测肿瘤缺氧程度的试剂上的应用。发明详述该探针由检测团和荧光基团通过化学键连接而成,概述为结构I型,其可表示为sensor-dye。硝基还原酶的特异性荧光探针具体实例为:结构I型:dye-sensorI型探针作为硝基还原酶的特异性底物,本身由于硝基的强吸电子效应,导致d-PET效应而猝灭分子荧光,当其被硝基还原酶还原后,释放出化合物(1),荧光强度大大增强。通过定量检测单位时间内还原产物的生成量来测定酶或细胞制备液等生物样品及细胞中硝基还原酶的活性。识别机理如下:1)在PBS或Tris-HCl等常用缓冲液中,反应温度为20℃至45℃之间,优选37℃为最优反应时间;孵育体系pH介于5.0~8.5之间,优选pH7.4为最优反应pH值;反应时间为5~30分钟,优选反应时间为20min。2)通过测定单位时间荧光强度的增加倍数评价硝基还原酶的活性,可采用荧光检测器实现产物及底物的快速灵敏检测;荧光检测条件为:激发波长490nm,在510~550nm进行荧光发射谱的检测。本发明中的硝基还原酶的荧光探针具有以下特点:该特异性探针底物在生物体中仅和硝基还原酶发生还原反应,其他常见的生物体系基质及杂质例如:无机盐、糖类、氨基酸、维生素、生物巯基物种、氧化物种不产生干扰。该探针的相对荧光量子效率达到荧光量子产率较高,且激发波长为490nm,该波长较常见,可用荧光光谱法检测,测定限可达0.65ng/mL。该探针对生物体的毒性较低,可用于动物生物体中和细菌生长过程中产生硝基还原酶含量的检测。本发明的又一目的,提供了一种手术导航的试剂和方法。该试剂可以由I型试剂连接肿瘤靶向基团(target)制备而成,可实时靶向荧光成像肿瘤细胞或组织,该试剂可概述为结构II型,其可表示为sensor-dye-target。实时靶向荧光成像肿瘤细胞或组织的试剂具体实例为:结构II型:target-dye-sensor上述荧光探针的制备方法如下:FBN-1的制备方法:FBN-2的制备方法:FBN-3的制备方法:FBN-4的制备方法:研究发现,缺氧是肿瘤的特征微环境,硝基还原酶在缺氧肿瘤中高表达,而没有发现其存在于正常细胞和组织中。在生物体中,II型试剂既是硝基还原酶的特异性底物,又可以特异性靶向集聚到肿瘤组织。所以II型试剂可应用在外科肿瘤切除手术过程中,肿瘤边界鉴别,残余肿瘤组织识别和肿瘤转移淋巴结的追踪,为肿瘤外科手术的荧光导航系统提供了一种新的荧光导航试剂。该试剂注射入患有肿瘤疾病的活体后,机体手术视野杂特定波长光波照射下,肿瘤细胞或组织会发出一定波长的荧光,在成像系统下指导医生进行外科手术,有效提高手术治疗效果,降低肿瘤患者死亡率。本发明试剂做为外科手术荧光导航试剂在荷瘤小鼠内实施的技术方案如下:1)II型试剂可溶于含DMSO0%-5%的PBS溶液或生理盐水溶液,配制成工作液,尾静脉注射或局部注射至小鼠体内;2)II型试剂经血液循环,可特异性聚集靶向到肿瘤部位;3)II型试剂在非肿瘤组织区域无荧光信号或荧光信号强度较弱,在肿瘤组织部位荧光信号强度很强。4)利用活体荧光成像技术,根据荧光信号,精确成像肿瘤位置,为外科手术提供导航。本发明的再一个目的提供了一种靶向监测肿瘤细胞或组织缺氧程度的试剂。利用本发明的结构II型探针通过荧光成像技术检测肿瘤缺氧区域的硝基还原酶含量可于评价和研究肿瘤缺氧区域的缺氧水平。缺氧是肿瘤的特征微环境,研究发现硝基还原酶的含量和肿瘤的缺氧程度呈正相关关系,所以II型试剂可用于监测肿瘤的缺氧程度。II型试剂作为硝基还原酶的特异性底物,在生物体中,通过靶向基团靶向到肿瘤组织,在缺氧程度不同的肿瘤中,硝基还原酶的浓度也不同,荧光探针的还原量也不同。通过定量检测相同时间内还原产物的荧光强度来间接测定肿瘤细胞和组织的缺氧程度。分别以人肺癌细胞(A549),人卵巢癌细胞(SKOV-3)和人肝癌细胞(HepG-2)作为肿瘤细胞模型,活体肝癌肿瘤荷瘤小鼠模型作为活体生物模型探究II型试剂检测癌细胞缺氧程度的能力。在肿瘤细胞中的具体测定方法为:1)在四个共聚焦培养皿中接种细胞,过夜,使其贴壁;2)II型试剂预孵育细胞30min;3)分别把四皿细胞放入缺氧程度不同的环境中培养8h;4)荧光显微镜观察四皿细胞的荧光强度强弱。在活体荷瘤小鼠中的具体测定方法为:1)II型试剂可溶于含DMSO0%-5%的PBS溶液或生理盐水溶液,配制成工作液,尾静脉注射小鼠体内;2)II型试剂经血液循环,可特异性聚集靶向到肿瘤部位;3)因肿瘤缺氧程度不同,肿瘤部位的荧光强度也不同,利用活体荧光成像技术检测肿瘤位置的荧光强度;4)根据荧光强度的强弱和肿瘤缺氧程度的正相关关系,不同肿瘤的荧光强度的强弱间接表示其缺氧程度的大小。本发明有益技术效果:本发明提供了硝基还原酶的特异性荧光探针,该特异性探针可以被生物体系中的硝基还原酶还原,因此可用于检测生物体内的硝基还原酶;该探针可特异性靶向到肿瘤组织,别硝基还原酶还原后,荧光增强,因此该探针可以用于肿瘤靶向荧光成像,又因为在不同缺氧程度中,硝基还原酶的表达量不同,该探针又可以用于检测肿瘤缺氧程度。实验发现,探针本身的荧光强度较弱,被硝基还原酶还原后,荧光显著增强;在缺氧程度较高的环境中,探针被硝基还原酶时,荧光强度的增强倍数更高本发明基于肿瘤的缺氧性和硝基还原酶在缺氧肿瘤中的高表达,可在具有缺氧微环境,并高表达硝基还原酶的肿瘤中应用,结合荧光成像仪,可用于肿瘤靶向荧光成像,肿瘤缺氧程度监测和监测肿瘤转移等应用。本发明中,检测肿瘤靶向试剂识别肿瘤后荧光信号变化,操作简单、对身体无害;该试剂在应用中实现了高灵敏度,高特异性,为医学上研究肿瘤和临床上监测、治疗肿瘤转移提供了有效的工具,因此在肿瘤靶向荧光成像,肿瘤缺氧程度监测和监测肿瘤转移等具有良好的应用前景。附图说明图1为探针FBN-1的核磁1HNMR图谱;图2为探针FBN-1的核磁13CNMR图谱;图3为探针FBN-3的高效液相色谱(HPLC)和飞行时间质谱分析谱图;图4为探针FBN-1(5μM)与硝基还原酶反应前后的吸收光谱图;图5为探针FBN-1(5μM)与硝基还原酶反应前后的发射光谱图;图6为探针FBN-2(5μM)与硝基还原酶反应前后的吸收光谱图;图7为探针FBN-2(5μM)与硝基还原酶反应前后的发射光谱图;图8为探针FBN-1与硝基还原酶作用的动力学实验。其中激发波长为490nm;探针的浓度:5μM。硝基还原酶浓度分别为0、0.01、0.02、0.04、0.07、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55μg/mL;图9为探针FBN-2与硝基还原酶作用的动力学实验。其中激发波长为490nm;探针的浓度:5μM。硝基还原酶浓度分别为0、0.01、0.03、0.06、0.10、0.15、0.2、0.25、0.3、0.4、0.5μg/mL;图10为探针FBN-1与各种干扰物种和硝基还原酶反应的荧光发射光谱;图11为探针FBN-3在20%,15%,8%,0.1%氧气条件下与人肺癌细胞,人卵巢癌细胞和人肝癌细胞共孵育8小时的荧光共聚焦图;图12为探针FBN-3在肝癌荷瘤小鼠模型中,对直径6mm和14mm肿瘤的时间依赖荧光成像。具体实施方式为了更好地理解本发明,下面结合附图和实施例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的实施例。本发明所用试剂:本发明所用仪器:仪器厂家高效液相色谱仪GE,AKTA荧光光谱仪VarianCaryEclipse基质辅助激光解吸电离飞行时间质谱仪ABSCIE,4800Plus活体成像仪PerkinElmer实施例1.FBN-1荧光探针的合成工艺为:称取0.40mmol化合物(1),0.60mmol化合物(2),1.20mmol,K2CO3于50mL三口瓶中,加入12mLDMF溶解,Ar保护,40℃搅拌5小时。减压蒸馏,除去溶剂,粗产物通过硅胶柱提纯,得产物FBN-1.产率81.8%。1HNMR(400MHz,CDCl3)δ8.29(d,J=8.7Hz,2H),8.03(s,1H),8.00(d,J=7.9Hz,1H),7.64(d,J=8.7Hz,2H),7.25(d,J=7.9Hz,1H),7.03(d,J=2.4Hz,1H),6.94(d,J=8.9Hz,1H),6.88(d,J=9.7Hz,1H),6.84(dd,J=8.9,2.4Hz,1H),6.56(dd,J=9.7,1.9Hz,1H),6.45(d,J=1.8Hz,1H),5.30(s,2H),2.13(s,3H),1.65(s,9H);13CNMR(101MHz,CDCl3)δ185.76,165.13,162.63,158.59,154.41,147.95,147.89,142.77,136.58,136.54,133.30,131.53,130.56,130.18,129.30,129.22,127.76,127.22,124.05,118.50,114.48,113.83,106.13,101.61,81.71,69.29,28.20,19.61;FT-IR:ν[cm-1]3425,3045,2978,2922,1712,1643,1600,1513,1442,1347,1300,1260,1205,1165,1100,1030,905,850,764,725,600,495;实施例2.FBN-3荧光探针的合成工艺为:称取0.20mmolRGD环肽,0.20mmolFBN-1,0.6mmolDIEA,0.6mmolEDC·HCl于50mL三口瓶中,加入25mLDMF溶解,Ar保护,室温搅拌10小时。减压蒸馏,除去溶剂,粗产物加入96%三氟乙酸,室温搅拌3小时后,减压蒸馏,除去溶剂,得黄色粘稠状粗产物,高效液相色谱分离提纯,通过硅胶柱提纯,得产物FBN-1.产率50.1%。HPLC纯度99%,MALDI-TOF(m/z):理论值1082.4134,实验值[M+H]+1083.55。实施例3.探针FBN-1与硝基还原酶反应前后吸收光谱与荧光发射光谱变化称取1.9mg试剂FBN-1,配成2ml的2mM二甲基亚砜母液。将2.5μl的上述母液滴加到一定量的含有500μM烟酰胺腺嘌呤二核苷酸(NADH)的10mM磷酸盐缓冲溶液中,然后加入60μL的100μg/mL的硝基还原酶溶液,再用10mM的磷酸盐缓冲溶液定容到1ml。37℃下反应25min后,测量其吸收光谱和荧光发射光谱。荧光发射光谱测定时激发波长为490nm;激发和发射的狭缝宽度为5nm;电压500V。图4和图5结果表明,本发明中的试剂FBN-1具有以下特点:1)探针在溶液中呈淡黄色并且无荧光,吸收光谱在456nm和479nm处有两个吸收带,荧光光谱在515nm处有较弱的荧光。2)随着硝基还原酶的加入,吸收光谱中原有吸收带强度变弱,493nm处产生了一个新的吸收带;该探针的荧光光谱在515nm处产生绿色荧光,且荧光强度增强了约11倍。实施例4.探针FBN-2与硝基还原酶反应前后吸收光谱与荧光发射光谱变化称取2.8mg试剂FBN-1,配成2ml的2mM二甲基亚砜母液。将2.5μl的上述母液滴加到一定量的含有500μM烟酰胺腺嘌呤二核苷酸(NADH)的10mM磷酸盐缓冲溶液中,然后加入60μL的100μg/mL的硝基还原酶溶液,再用10mM的磷酸盐缓冲溶液定容到1ml。37℃下反应25min后,测量其吸收光谱和荧光发射光谱。荧光发射光谱测定时激发波长为490nm;激发和发射的狭缝宽度为5nm;电压600V。图6和图7结果表明,本发明中的试剂FBN-1具有以下特点:1)探针在溶液中呈淡黄色并且无荧光,吸收光谱在460nm和485nm处有两个吸收带,荧光光谱几乎无荧光荧光。2)随着硝基还原酶的加入,吸收光谱中原有吸收带强度变弱,497nm处产生了一个新的吸收带;该探针的荧光光谱在515nm处产生绿色荧光,且荧光强度增强了约255倍。实施例5.FBN-1与不同浓度硝基还原酶反应的荧光光谱性质将2.5μL的上述母液滴加到一定量的含有500μMNADH的10mM磷酸盐缓冲溶液中,然后加入不同浓度的硝基还原酶溶液,再用10mM的磷酸盐缓冲溶液定容到1ml。37℃下反应20min后,测量其吸收光谱和荧光发射光谱。荧光发射光谱测定时激发波长为490nm;激发和发射的狭缝宽度为5nm;电压500V。图8结果表明,本发明中的试剂FBN-1具有以下特点:1)探针在溶液中呈淡黄色并且无荧光,但随着硝基还原酶的加入,该探针在515nm处产生绿色荧光;2)515nm处,绿色荧光强度随硝基还原酶浓度的增加而增加;3)使用5μM的FBN-1时,荧光增强与硝基还原酶的浓度在0-100ng/mL范围内呈线性关系。实施例6.FBN-2与不同浓度硝基还原酶反应的荧光光谱性质将2.5μL的上述母液滴加到一定量的含有500μMNADH的10mM磷酸盐缓冲溶液中,然后加入不同浓度的硝基还原酶溶液,再用10mM的磷酸盐缓冲溶液定容到1ml。37℃下反应20min后,测量其吸收光谱和荧光发射光谱。荧光发射光谱测定时激发波长为490nm;激发和发射的狭缝宽度为5nm;电压600V。图9结果表明,本发明中的试剂FBN-1具有以下特点:1)探针在溶液中呈淡黄色并且无荧光,但随着硝基还原酶的加入,该探针在515nm处产生绿色荧光;2)515nm处,绿色荧光强度随硝基还原酶浓度的增加而增加;3)使用5μM的FBN-1时,荧光增强与硝基还原酶的浓度在0-150ng/mL范围内呈线性关系。实施例7.试剂FBN-1与生物体中其他物种反应情况(选择性研究)在5μM的探针FBN-1溶液中分别加入各种物质:氯化钙(2.5mM),氯化钠(2.5mM),氯化钾(50mM)葡萄糖(10mM),维生素C(1mM),维生素B6(1mM),人血清白蛋白(100μM),双氧水(10μM),羟基自由基(10μM),谷氨酸(1mM),精氨酸(1mM),酪氨酸(1mM),谷氨酸(1mM),丝氨酸(1mM),半胱氨酸(1mM),二硫苏糖醇(1mM),谷胱甘肽还原酶(5mM),牛血清蛋白(100mg/mL,超氧化钾(1mM),双氧水(1mM)次氯酸钠(1mM)和硝基还原酶(0.6μg/mL)。在37℃下反应20min后,测量其荧光发射光谱。荧光发射光谱测定激发波长为490nm;激发和发射的狭缝宽度为5nm;电压为500V。图10结果表明,只有硝基还原酶可引起探针FBN-1产生明显的光信号响应,证明该试剂对硝基还原酶具有高度的选择性,而其他物种的存在不干扰硝基还原酶的测定。实施例8.FBN-3试剂对肿瘤细胞缺氧程度的检测将密度为3×105个/mL的癌细胞接种到灭菌的铺有盖玻片的四个35mm培养皿中,在CO2培养箱(温度为37℃,5%CO2)中培养过夜,待细胞贴壁后,10μMFBN-3预孵育30min,然后四皿细胞分别在四种条件(37℃,5%CO2,20%O2;37℃,5%CO2,15%O2;)中培养;37℃,5%CO2,8%O2;)中培养;37℃,5%CO2,0.1%O2;)中培养)中培养8小时,弃去细胞培养液,PBS缓冲液洗涤细胞5遍后,在荧光共聚焦显微镜下成像,比较四皿细胞的荧光强度,图11结果表明在37℃,5%CO2,0.1%O2条件下培养的细胞荧光强度最强。实施例9通过定量检测相同时间内还原产物的荧光强度来间接测定肿瘤细胞和组织的缺氧程度。分别以人肺癌细胞(A549),人卵巢癌细胞(SKOV-3)和人肝癌细胞(HepG-2)作为肿瘤细胞模型,活体肝癌肿瘤荷瘤小鼠模型作为活体生物模型探究II型试剂检测癌细胞缺氧程度的能力。在肿瘤细胞中的具体测定方法为:1)在四个共聚焦培养皿中接种细胞,过夜,使其贴壁;2)II型试剂预孵育细胞30min;3)分别把四皿细胞放入缺氧程度不同的环境中培养8h;4)荧光显微镜观察四皿细胞的荧光强度强弱。在活体荷瘤小鼠中的具体测定方法为:1)II型试剂可溶于含DMSO0%-5%的PBS溶液或生理盐水溶液,配制成工作液,尾静脉注射小鼠体内;2)II型试剂经血液循环,可特异性聚集靶向到肿瘤部位;3)因肿瘤缺氧程度不同,肿瘤部位的荧光强度也不同,利用活体荧光成像技术检测肿瘤位置的荧光强度;4)根据荧光强度的强弱和肿瘤缺氧程度的正相关关系,不同肿瘤的荧光强度的强弱间接表示其缺氧程度的大小。实施例10FBN-3试剂在肝癌荷瘤小鼠模型中对肿瘤的靶向成像和其对不同大小肿瘤缺氧程度的检测首先建立人肺癌小鼠模型,大量培养人肺癌HepG-2细胞,收集对数生长期的细胞,去除培养液,用PBS洗涤两次,将细胞密度调整到1×107/ml,在裸鼠的右侧腋下注射0.2ml约2×106细胞,然后继续饲养,每天观察裸鼠的生长情况,并观察是否有实体瘤生成。确认小鼠荷瘤后,当肿瘤直径分别达到6mm和14mm后,尾静脉注射FBN-3探针。分别在注射探针后1min,5min,10min,15min,20min,25min对小鼠进行荧光成像,观察比较小鼠肿瘤荧光强度,结果见图12。从荧光像数据可以看出,肿瘤组织荧光强度逐渐增强,直径14mm的肿瘤最终荧光强度大于直径6mm肿瘤的荧光强度。结果说明,探针FBN-3可以在活体生物层面作为手术导航试剂,且可以表征肿瘤组织的缺氧程度。本发明试剂做为外科手术荧光导航试剂在荷瘤小鼠内实施的技术方案如下:1)II型试剂可溶于含DMSO0%-5%的PBS溶液或生理盐水溶液,配制成工作液,尾静脉注射或局部注射至小鼠体内;2)II型试剂经血液循环,可特异性聚集靶向到肿瘤部位;3)II型试剂在非肿瘤组织区域无荧光信号或荧光信号强度较弱,在肿瘤组织部位荧光信号强度很强。4)利用活体荧光成像技术,根据荧光信号,精确成像肿瘤位置,为外科手术提供导航。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1