基于特异序列的大肠杆菌和志贺菌检测引物、试剂盒及检测方法与流程
本发明涉及一种基于特异序列的大肠杆菌和志贺菌检测引物,同时还涉及包含该引物的试剂盒以及大肠杆菌、志贺菌检测方法,属于分子生物学技术领域。
背景技术:
大肠杆菌(Escherichia coli)是临床上最常见的致病菌之一,也是近年来食品卫生和流行病学领域的重要研究对象。由于该菌经常出现在粪便污染的地方,因此被作为水源和食品粪便污染的指示菌。虽然大多数的大肠杆菌是人和动物的肠道兼性厌氧寄居菌群,在正常情况下不具有致病能力,但是某些特殊血清型的大肠杆菌具有致病性。这些致病性菌一般携带有特定的毒力基因,可以编码相应的毒性物质,引起腹泻、尿路感染、败血症和脑膜炎等病症,使寄主的健康遭受威胁(Gao Q,Wang X,Xu H,Xu Y,Ling J,Zhang D,Gao S.&Liu X.(2012).Roles of iron acquisition systems in virulence of extraintestinal pathogenic Escherichia coli:salmochelin and aerobactin contribute more to virulence than heme in a chicken infection model.BMC Microbiol 12:143.)。严重的甚至引起血性腹泻和溶血性尿毒综合征等(Genotypic and phenotypic changes in the emergence of Escherichia coli O157:H7.J Infect Dis 177:1750-3;Cheung,M.K.,Li,L.,Nong,W.&Kwan,H.S.(2011).2011 German Escherichia coli O104:H4outbreak:whole-genome phylogeny without alignment.BMC Res Notes 4:533.)。
志贺菌是引起夏、秋季细菌性痢疾的主要病原体,传染性极强,20~100个CFU便能引起感染(封会茹,曲梅,耿荣,秦萌,余红,尉秀霞,赵伟,邢洪光,杨军勇,董晓根,赵建忠.2010-2012年北京市丰台区感染性腹泻病原菌分布及耐药性分析[J].疾病监测,2013,02:96-100.)。该病主要在发展中国家流行,在我国属于常见病,发病率位于我国传染病发病率的前三位(Wang Y,Song C,Duan G,et al.Transposition of ISEcp1 modulates blaCTX-M-55-mediated Shigella flexneri resistance to cefalothin[J].Int J Antimicrob Agents,2013,42(6):507-512.)。
目前,大肠杆菌和志贺菌的检测方法主要有常规检测法和分子生物学检测法,常规检测法又包括形态学鉴定和生化试验鉴定,其中形态学鉴定辅以生化试验在细菌鉴定中具有重要意义,但是该方法也存在一些缺点,比如重现率低,辨识能力低,相似的表型特征无法等同于相似或者关系密切的基因型等。所以对于那些通过表型特征难以区别的菌种,常规的检测方法就不能准确鉴定到种,并且该方法操作繁琐,实验周期长(邓梅葵,孙迎,韩雯晴.细菌鉴定方法[J].生物医学工程学进展,2014(02):84-88)。分子生物学检测法包括DNA(G+C)mol%、核酸杂交、16S rRNA序列分析、MLST(多位点序列分型,Multi Locus SequenceTyping)、全基因组测序以及核酸指纹图谱等(-Sánchez B,Priego-Capote F,de Castro M L.Metabolomics analysis I.Selection of biological samples and practical aspects preceding sample preparation[J].TrAC Trends in Analytical Chemistry,2010,29(2):111-119.),具有快速、简便等特点,且能从本质上阐明细菌间的亲缘关系。
技术实现要素:
本发明的目的是提供一种基于特异序列的大肠杆菌和志贺菌检测引物。
同时,本发明还提供一种包含上述引物的检测试剂盒。
最后,本发明再提供一种基于特异序列的大肠杆菌和志贺菌检测方法。
为了实现以上目的,本发明所采用的技术方案是:
大肠杆菌(种系B2除外,下同)和志贺菌检测引物,根据特异序列或者与该序列同源性达96%以上的同源序列设计合成,特异序列如SEQ ID NO.3所示,同源序列如SEQ ID NO.4所示。引物设计遵循本领域通用准则,采用常规引物设计软件完成。
具体的,大肠杆菌和志贺菌检测引物如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3';
下游引物:5'-ACTGGATGCGATGATGGATA-3'。
基于特异序列的大肠杆菌和志贺菌检测试剂盒,包含以下引物:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3';
下游引物:5'-ACTGGATGCGATGATGGATA-3'。
所述试剂盒还可以包括:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)、灭菌超纯水、阳性对照(大肠杆菌、志贺菌全基因组DNA)、10×PCR菌落增强剂以及DNA Marker DL 2000等。
基于特异序列的大肠杆菌和志贺菌检测方法,包括以下步骤:
1)以待测样本基因组DNA或单菌落为模板,利用引物进行PCR扩增,扩增产物经电泳分析与阳性对照有相同条带的判定为疑似阳性;
2)回收疑似阳性的扩增产物,进行测序分析,与SEQ ID NO.3(252bp)所示序列相同或同源性达96%以上的判定为细菌阳性;
步骤1)中引物如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3';
下游引物:5'-ACTGGATGCGATGATGGATA-3'。
步骤1)中待测样本基因组DNA可采用煮沸法或DNA提取试剂盒提取。
步骤1)中PCR扩增的反应体系为:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,10~20ng/μL待测样本基因组DNA 2μL,灭菌超纯水8.5μL,总计25μL。
或者,PCR扩增的反应体系为:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,单菌落,1×PCR菌落增强剂2.5μL,灭菌超纯水补足至25μL。
步骤1)中PCR扩增的反应程序为:94℃预变性5min;94℃变性30s,52℃退火30s,72℃延伸30s,共32个循环;72℃继续延伸10min。
步骤1)中阳性对照为大肠杆菌和/或志贺菌。
本发明的有益效果:
本发明通过对CRISPR database数据库中大肠杆菌和志贺菌全基因组测序结果进行分析以及对实验室保存的大肠杆菌和志贺菌检测发现,其具有一段共同的特异序列。针对该特异序列设计上、下游引物,PCR扩增后进行电泳分析,与阳性对照有相同条带的判定为疑似阳性,回收疑似阳性的扩增产物,进行测序分析,与SEQ ID NO.3所示序列相同或同源性达96%以上的判定为大肠杆菌、志贺菌阳性。该检测方法操作简单,敏感性和特异性高,与大肠杆菌、志贺菌的种属结果一致,检测费用低,具有良好的推广应用价值。
附图说明
图1为试验例1中大肠杆菌、志贺菌扩增产物的电泳图;
图2为试验例2中扩增产物的电泳图。
具体实施方式
下述实施例仅对本发明作进一步详细说明,但不构成对本发明的任何限制。
实施例1
本实施例中基于特异序列的大肠杆菌和志贺菌检测引物如SEQ ID NO.1、SEQ ID NO.2所示。
实施例2
本实施例中基于特异序列的大肠杆菌和志贺菌检测试剂盒,包含:2×Taq PCR Master Mix(0.1U/μL Taq DNAPolymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)20mL,灭菌超纯水30mL,阳性对照DNA(大肠杆菌和志贺菌各一支)100μL、8μmol/L上、下游引物各5mL,DNA Marker DL 2000(250μL)及试剂盒说明书一份;
所述上、下游引物为:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3';
下游引物:5'-ACTGGATGCGATGATGGATA-3'。
检测原理:试剂盒中含有聚合酶链式反应所需的各种试剂组分,如引物、dNTPs、缓冲液、Taq酶等,在PCR反应液中加入检测样品,进行PCR扩增,扩增产物经电泳分析出现与阳性对照相同条带的判定为疑似阳性,胶回收扩增产物,进行测序分析,与SEQ IDNO.3所示序列相同的判定为细菌阳性。可用于获知各种待检测样本(如粪便、食物等)中大肠杆菌、志贺菌的污染状况。
操作说明:
1)提取待检测样本的基因组DNA或者挑取单菌落;
2)利用上、下游引物进行PCR扩增,配制如下反应体系:
2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,10~20ng/μL待测样本基因组DNA 2μL,灭菌超纯水8.5μL,总计25μL;
或者,2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,单菌落,1×PCR菌落增强剂(市售商品,主要成分为甜菜碱,为10倍浓度,使用时需稀释为1倍浓度)2.5μL,灭菌超纯水补足至25μL;
反应程序:94℃预变性5min;94℃变性30s,52℃退火30s,72℃延伸30s,共32个循环;72℃继续延伸10min;
3)PCR产物凝胶电泳分析,条件:2.0%琼脂糖凝胶,电压5V/cm,时间20min;在紫外灯下观察结果,若出现与阳性对照相同的条带即为疑似阳性,阴性对照没有特异性扩增条带或者条带不一致;
4)回收疑似阳性的扩增产物,进行测序分析,与SEQ ID NO.3(252bp)所示序列相同或同源性达96%以上的判定为细菌阳性,即样本中包含大肠杆菌和/或志贺菌阳性。
实施例3
本实施例中基于特异序列的大肠杆菌和志贺菌检测方法,包括以下步骤:
(1)样本的收集和预处理
将500μL待检测样本(食物)加入到10mL增菌液中,37℃增菌5h(4~6h均可),台式高速离心机12000rpm/min离心5分钟,弃上清,沉淀用作检测模板;
(2)PCR扩增
利用上、下游引物进行PCR扩增,引物如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3',
下游引物:5'-ACTGGATGCGATGATGGATA-3';
PCR扩增的反应体系为:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,增菌沉淀2μL,1×PCR菌落增强剂2.5μL,无菌超纯水补足至25μL;
PCR扩增反应程序:94℃预变性5min;94℃变性30s,52℃退火30s,72℃延伸30s,共32个循环;72℃继续延伸10min;
(3)检测结果
取5μL PCR扩增产物,于20g/L琼脂糖凝胶中电泳,用DNA Marker DL 2000作分子量标记,电压5V/cm,电泳20min后,在紫外灯下观察结果,出现与阳性对照相同的条带,也即疑似阳性;
回收疑似阳性的扩增产物,进行测序分析,结果显示与SEQ ID NO.3所示序列相同,判定该样本受到大肠杆菌和/或志贺菌污染。
试验例1
一、试验中使用的细菌菌株
大肠杆菌2002001和2014001分别分离于河南睢县和河南新乡,志贺菌2014030分离于河南睢县。
二、试验中使用的试剂及仪器
(1)LB培养基
LB液体培养基:称取1.0g胰蛋白胨、0.5g酵母浸粉、1.0g氯化钠,溶于100mL蒸馏水中,用10mol/L NaOH调pH值至7.2,121℃高压灭菌20min,置4℃保存备用。
LB固体培养基:称取1.0g胰蛋白胨、0.5g酵母浸粉、1.0g氯化钠、1.5g琼脂粉,溶于100mL蒸馏水中,用10mol/L NaOH调pH值至7.2,121℃高压灭菌20min,冷却至约50℃时倾注平板,保存备用。
(2)PCR反应试剂盒购自生工生物工程(上海)股份有限公司,琼脂糖为BIOWEST公司进口分装,酵母浸粉、胰蛋白胨购自英国Oxoid公司,琼脂粉购自Sigma公司,其他常用试剂均为国产分析纯级试剂。
PTC-100型基因体外扩增仪购自MJRESEARCH公司,DYY-8C型稳压稳流定时电泳仪购自北京六一仪器厂,Gene snap图像扫描仪购自美国Syngene公司。
未作特别说明的试验材料和方法均为公知技术,可在常用工具书包括《分子克隆实验指南》(J.萨姆布鲁克、D.W拉塞尔著,第三版,科学出版社,2002)等中查找。
三、大肠杆菌和志贺菌特异序列基因的检测
采用煮沸法从大肠杆菌和志贺菌菌液中提取全基因组DNA,具体操作为:从-80℃冰箱内取出大肠杆菌和志贺菌冻存保种管,置于4℃冰箱复温5小时(4~6小时均可),超净台中用无菌接种环快速取菌液,以分段划线法转种于LB固体培养基平板上,37℃恒温箱孵育21小时(18~24小时均可),挑取LB琼脂平板上单菌落,接种于LB液体培养基中,37℃振荡培养7小时(6~8小时均可),取1mL菌液于1.5mL的Eppdorf管中,转速14000r/min下离心1分钟,弃上清,加入超纯水100μL,震荡混匀,煮沸10min,转速14000r/min下再次离心10分钟,取上清,即得大肠杆菌和志贺菌基因组DNA,置于-20℃贮存备用。
(2)PCR引物设计与合成
根据大肠杆菌和志贺菌的特异序列基因设计引物,如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3',
下游引物:5'-ACTGGATGCGATGATGGATA-3';
引物由上海生工生物工程有限责任公司合成,预期扩增产物长度为252bp。
(3)PCR扩增
参照PCR反应试剂盒(上海生工生物工程有限责任公司)产品说明,配制25μL反应体系:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,大肠杆菌或志贺菌基因组DNA 2μL,加灭菌超纯水至25μL。
反应程序为:94℃预变性5min;94℃变性30s,52℃退火30s,72℃延伸30s,共32个循环;72℃继续延伸10min。
(4)PCR扩增产物分析
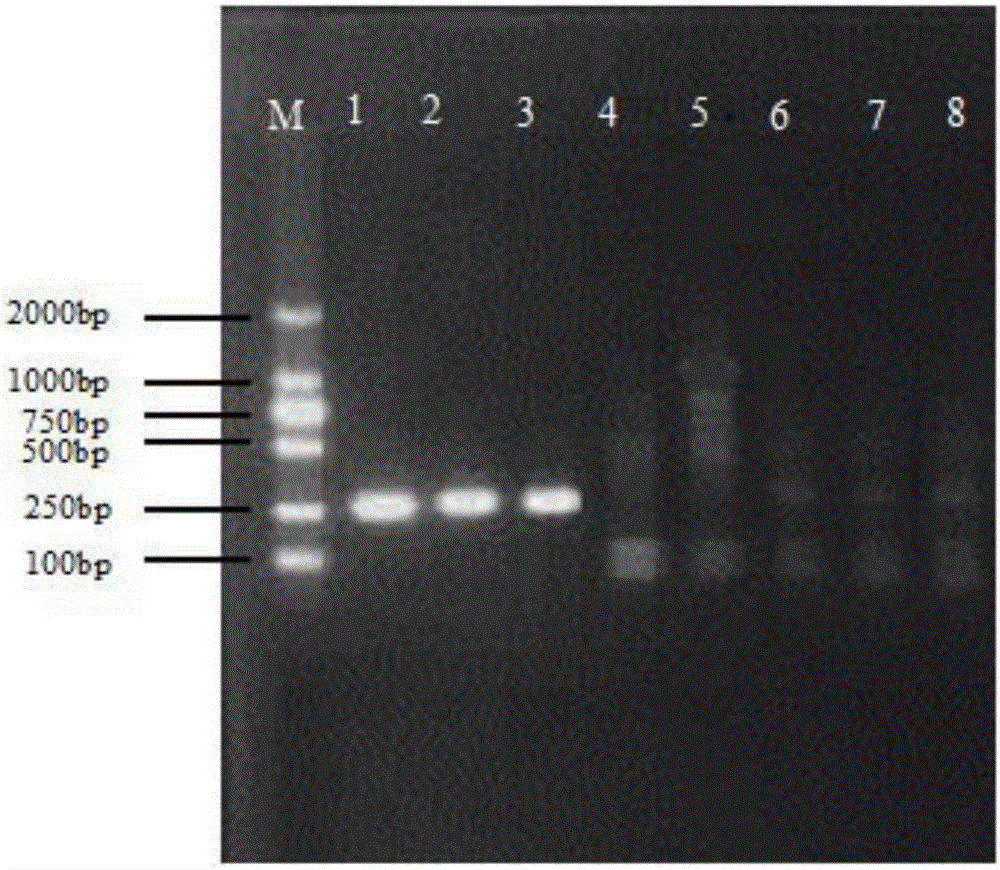
取5μL PCR扩增产物,于20g/L琼脂糖凝胶中电泳,用DNA Marker DL2000作分子量标记,电压5V/cm,电泳20min后,用凝胶图像扫描仪进行分析,电泳结果见图1(图中M:DL2000 marker,1:大肠杆菌e2014001,2:大肠杆菌e2002002,3:志贺菌sh2014030)。
从图1中可以看出,PCR扩增产物的长度与预期长度(252bp)符合,证实PCR扩增特异序列成功。
(5)PCR扩增产物测序鉴定
将PCR扩增产物交由生工生物工程(上海)股份有限公司进行测序,测序结果如SEQ ID NO.3所示。
试验例2
模拟样品的的检测,包括以下步骤:
1)模拟样品的制备
将10g全脂奶粉溶于90mL生理盐水中,灭菌,然后分别加入8种细菌的菌液(8中细菌分别为:1:大肠杆菌e2014001,2:大肠杆菌e2002002,3:志贺菌sh2014030,4:沙门菌sa2014001,5:肺炎克雷伯杆菌kl2015001,6:铜绿假单胞菌pa2014002,7:柠檬酸杆菌cr2015001,8:金黄色葡萄球菌sau2014001),混匀作为样品原液,放置2h;再吸取5mL混合液加入到45mL营养肉汤中,于37℃温箱中培养,设置两组平行对照,一组阴性对照,8h后各取10mL混合液进行检测;
2)提取待检测样本的基因组DNA,利用上、下游引物进行PCR扩增,引物如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3',
下游引物:5'-ACTGGATGCGATGATGGATA-3';
PCR扩增的反应体系为:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反应缓冲液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,10~20ng/μL细菌基因组DNA 2μL,灭菌超纯水8.5μL,总计25μL;
PCR扩增的反应程序为:94℃预变性5min;94℃变性30s,52℃退火30s,72℃延伸30s,共32个循环;72℃继续延伸10min;
3)PCR产物凝胶电泳分析,条件:2.0%琼脂糖凝胶,电压5V/cm,时间20min;在紫外灯下观察结果(见图2,图中M:DL2000marker;1:大肠杆菌e2014001,2:大肠杆菌e2002002,3:志贺菌sh2014030,4:沙门菌sa2014001,5:肺炎克雷伯杆菌kl2015001,6:铜绿假单胞菌pa2014002,7:柠檬酸杆菌cr2015001,8:金黄色葡萄球菌sau2014001);
结果显示:1~3出现与阳性对照相同的条带,为疑似阳性,其他没有出现特异性条带或者条带不一致;
4)回收疑似阳性的扩增产物,经测序均与SEQ ID NO.3所示序列相同。
对比例
本对比例采用API生化鉴定各种细菌,原理为:每种细菌具有各自独特的酶系统,因而对底物的分解能力不同,其代谢产物也不同。用生物化学方法测定这些代谢产物,可用来区别和鉴定细菌的种类。
具体操作如下:
1)细菌分离和培养:在无菌操作台中用灼烧过的无菌接种环蘸取少量样本(同试验例2),以三步划线法接种在伊红美蓝培养皿上,放入隔水恒温式培养箱中37℃过夜培养21小时(18~24小时均可),目标菌株为伊红美蓝培养基上显示为黑色带有金属光泽或者只为黑色的单菌落;
2)革兰染色:挑取疑似菌落进行革兰染色,镜下可见为红色或粉红色的杆状细菌;
3)氧化酶试验:在洁净的载玻片上放置无菌滤纸片,移液器吸取少量灭菌生理盐水,滴一滴至滤纸上,用灼烧过的接种环挑取单菌落涂在滤纸上,加一滴氧化酶试剂,迅速观察滤纸的变化,如果1~2min内呈现深紫色为阳性反应,无变化为阴性,并将结果记录于试纸条上;
4)API20E生化鉴定
a.分别准备一个培养盘和培养盖,移液器转移5mL灭菌生理盐水于培养盘的蜂窝小凹中,将试纸条放入培养盘中,在培养盘侧面记录菌株编号;
b.用灼烧过的接种环挑取同一个菌落,加入试剂盒中配套的0.85%NaCl中,仔细研磨以得到均匀的细菌悬液;
c.用1mL移液器吸取细菌悬液加入并充满CIT、VP、GEL管中,其余管中液体仅充满管部即可,向ADH、LDC、URE、ODC、H2S中加入矿物油覆盖,盖上培养盖,置于隔水恒温培养箱中37℃培养21小时(18~24小时均可);
d.根据参考说明表判读其结果;
e.在配套软件中输入结果即可得出细菌鉴定结果。
结果显示为:1~2均为大肠杆菌,3~8依次为志贺菌、沙门菌、肺炎克雷伯杆菌、铜绿假单胞菌、柠檬酸杆菌和金黄色葡萄球菌。
序列表
SEQUENCE LISTING
<110> 郑州大学、新乡医学院
<120> 基于特异序列的大肠杆菌和志贺菌检测引物、试剂盒及检测方法
<170> PatentIn version 3.5
<211> 20
<212> DNA
<213> 人工序列
<221> 上游引物
<222> (1)..(20)
<400> 1
GTTATCAGCA ACGCGCAAAA 20
<211> 20
<212> DNA
<213> 人工序列
<221> 下游引物
<222> (1)..(20)
<400> 2
ACTGGATGCG ATGATGGATA 20
<211> 252
<212> DNA
<213> 序列
<221> 特异序列
<222> (1)..(252)
<400> 3
GTTATCAGCA ACGCGCAAAA ACAGCCGCAT TCCCTGCGGG AAATAGCTGG CATGACGTAA 60
GACTGGATAA TCAACAGCAT ATTGATAAGG CACTTCCTGG AAGAATAGAA CGTCGCTGCC 120
GTGACGTTAT GCGGATAATG CTACCTCTGG TGAAGGAGTT GGCGAAGGCG TCTTGATGGG 180
TTTGAAAATG GGAGCTGGGT GTTCTACCGC AGGGGCGGGG AATTCTAAGT GATATCCATC 240
ATCGCATCCA GT 252
<211> 252
<212> DNA
<213> 序列
<221> 96%同源序列
<222> (1)..(252)
<400> 4
GTTATCAGCA ACGCGCAAAA ACACCTGCCT TCCCGGCGGG AAATAGCTGG CATGACGTAA 60
GACTGGATAA TCAACAACAT ATTGATAAGG CACTTCCTGG AAGAATAGAA CGTCGCTGCC 120
GTGACGTTAT GCGGATAATG CTACCGTTGG TGAAGGAGCT GGCGAAGGCG TCTTGATGGG 180
TTTGAAAATG GGAGCTGGGA GTTCTACCGC AGGGGCGGGG AATTCTAAGT GATACCCATC 240
ATCGCATCCA GT 252
- 还没有人留言评论。精彩留言会获得点赞!