基于表面活性剂改性PDMS的数字PCR芯片和方法与流程
本发明涉及一种用于核酸定量检测的数字PCR芯片和方法,更确切地说涉及基于表面活性剂改性PDMS的数字PCR芯片和方法,有望应用于生物学、医学及环境科学等领域。
背景技术:
上世纪90年代后期提出的荧光定量PCR(Fluorescence Quantitative Polymerase Chain Reaction,FQ-PCR,qPCR)已发展成为分子生物学领域的一项关键技术和常规技术,极大地推动了生命科学各个领域的发展。但是,影响PCR扩增效率的因素很多,很难保证实际样品与标准样品以及不同样品之间的扩增效率是否相同,由此导致其定量分析所依赖的基础—循环阈值(Cycling Threshold Value,Ct)不是恒定不变的。因此qPCR的定量只是“相对定量”,其准确度和重现性依然不能够满足分子生物学定量分析的要求。另外,由于PCR扩增产物对酶催化反应的抑制作用,目前基于PCR技术的基因变异检测方法对体细胞中低丰度的基因变异的检测常常无能为力。
20世纪末提出的数字PCR(Digital PCR,dPCR)是一种基于单分子PCR方法来进行计数的核酸定量方法,是一种绝对定量的方法。主要采用当前分析化学热门研究领域的微液滴或微阵列方法,将大量稀释后的核酸溶液分散至芯片的微液滴或微反应腔中,每个反应器的核酸模板数少于或者等于1个。这样经过PCR循环之后,有一个核酸分子模板的反应器就会给出荧光信号,没有模板的反应器就没有荧光信号。根据相对比例和反应器的体积,就可以推算出原始溶液的核酸浓度。与传统定量PCR不同,数字PCR通过直接计数的方法,可以实现起始DNA模板的绝对定量。此外,数字PCR还可以在大量的野生型DNA背景中鉴定出微量突变体的方法。由于数字PCR技术可以将模板DNA分子事先分隔开来单独进行扩增,就避免了高丰度等位基因核酸对变异核酸的扩增抑制,因此其在检测和定量稀有突变方面其灵敏度和准确度是普通PCR和qPCR所无法匹及的。
数字PCR提出至今,因其绝对定量的独特优势,其相关技术和产业化发展都非常迅速。迄今,已有报道的数字PCR平台主要有两大类:液滴式和阵列式。
最早的液滴式数字PCR采用油相液相高速混合的方式制备微液滴,制备的液滴尺寸均一性差,后来随着微流控技术的发展,利用T型、十字型等微通道水油两相切割实现了更小体积,更高通量的单分散微液滴数字PCR平台。例如已经商品化的BioRad公司的QX100TM微滴式dPCR系统等,但是这些平台一般都需要液滴产生、收集、转移、反应、快速读出分析等步骤,相关仪器操作繁琐,成本过高,不利于产品和研究的普及。另外液滴易受环境因素的影响,相互融合,稳定性较差。
阵列式数字PCR平台发展至今可大致分为微孔板,集成流路微阀和集成流路微腔结构。微孔板平台从早期的与传统qPCR相同的96/384孔板到Life technology公司的OpenArray刻蚀孔板,虽然灵敏度提高,样品耗量降低,但是人工移液器加样易产生污染也无法快速精确取样,若借助自动点样仪或机械手等设备,又增加了仪器成本,而且较少的液滴分解数目始终限制了其精度和可测的动态范围,应用受限。以微电子技术为基础的微流控芯片加工技术的发展实现了微流控芯片的微型化、集成化、迅速高效、耗样少以及适于现场检测,令数字PCR拥有了更大的发展空间。典型的技术成果包括Fluidigm公司的BioMarkTM系统,系统外接机械泵,加压控制芯片中的微阀隔断通道,形成独立的反应器,属于在芯片中集成微阀的数字PCR平台,但外接泵使芯片操作变得复杂,不利于快速、现场检测。另外一种集成流路微腔结构,是利用各种设计原理,如玻璃滑片、离心作用、油相阻隔等,实现无阀式微腔,在拥有集成微型、迅速高效等所有优势的同时,更加简化了操作,是未来数字PCR技术发展的趋势。
PDMS(polydimethylsiloxane,聚二甲基硅氧烷)是一种具有弹性的高分子聚合物,因其成本低,使用简单,而且具有良好的光学特性,良好的绝缘性,良好的化学惰性以及良好的透气性等特点,成为一种广泛应用于微流控等领域的聚合物材料。在数字PCR领域,PDMS被广泛用于制作液滴生成芯片,直接在PDMS芯片上进行数字PCR扩增及分析的例子较少,主要原因是一PDMS透气性强,易造成样本挥发,二是PDMS表面强疏水性,易吸附生物大分子,降低生物反应的效率。
近几年来也有少数无阀式微腔PDMS芯片,并直接在片上进行PCR扩增的例子,他们针对PDMS挥发性问题主要采用两种方法,旋涂聚对二甲苯或者在芯片上制备循环水压力装置防止挥发。旋涂聚对二甲苯所需工艺条件较为复杂,一般实验室无法满足该条件,且其水蒸气透过率远大于玻璃的水蒸气透过率;而在芯片上制备循环水压力装置一方面大大提高芯片的成本,且增加了芯片制备及数字PCR反应操控的难度。针对PDMS表面性质问题目前的方法主要采用预先充盈BSA进行预封闭或者在PCR预混液中添加BSA和表面活性剂的方式。对基于微管道的数字PCR芯片预先充盈BSA进行预封闭的方法会因预封闭液去除不净影响PCR反应液进样,而在PCR预混液中添加BSA和表面活性剂会影响PCR反应效率,且封闭效果不佳。
本发明拟提供一种基于表面活性剂改性PDMS、无源进样和“三明治”封装结构的薄型数字PCR芯片及制作方法。本发明利用PDMS掺杂表面活性剂对PDMS进行改性,克服芯片表面对生物、化学分子的静电吸附作用,利用PDMS天然空气泵的特性将液体样品自动进样和分割成独立反应单元,制备薄型PDMS及玻璃-改性PDMS-玻璃夹心结构,达到良好的抗水分挥发效果,与目前已有的数字PCR芯片技术相比,成本低,操作简便,应用前景广泛。
技术实现要素:
本发明的目的在于提供一种基于表面活性剂改性PDMS的数字PCR芯片、制备方法和应用,建立一种基于PDMS材料的数字PCR方法,简化制作方法和样品操作,降低数字PCR成本,以利于该技术的推广运用。
所述的PCR芯片是用一定量表面活性剂掺杂的PDMS材料制备PDMS数字PCR阵列芯片,利用预脱气薄型PDMS芯片自身的高空气溶解特性实现进样和分配过程,并且制成玻璃-改性PDMS-玻璃的“三明治”夹心结构抑制水分挥发。
本发明所述的芯片的制备包括芯片的制备、样品的自动进样分离以及PCR扩增。所叙述的芯片制备材料为玻璃可用一般的载玻片或盖玻片、PDMS、表面活性剂以及矿物油(如液体石蜡等)。具体制作步骤包括:
1.芯片的制备
由于芯片上进行PCR扩增的反应器是一个个独立的柱形反应腔,所以PCR样品会与四周的PDMS表面接触,疏水表面的静电吸附作用成为抑制PCR扩增的巨大障碍。另外,PDMS的高透气性特点促使样品透过其发生严重挥发,导致扩增失败。
表面活性剂(surfactant)是一类两亲性分子,一端为亲水基团,另一端为疏水基团;亲水基团常为极性基团,如羧酸、磺酸、硫酸、氨基或胺基及其盐,羟基、酰胺基、醚键等也可作为极性亲水基团;而疏水基团常为非极性烃链,如8个碳原子以上烃链。表面活性剂在溶液的表面能定向排列,加入少量就能使溶液体系的界面状态发生明显变化。本发明先将一定量的表面活性剂混合在PDMS单体中,具体是每100gPDMS单体中掺入0.1~1g表面活性剂,混合均匀,PDMS芯片交联固化后,表面活性剂的疏水基团与PDMS结合,亲水基团朝向外侧在PDMS表面形成一层单分子层,降低表面张力,从而提高表面亲水性,减少对生物分子的吸附。这里常规生物反应中使用的表面活性剂均可,包括Triton 100,Tween 20,span 80或甜菜碱等。
玻璃的水蒸气透过率5.0×10-21cm2/(s·mmHg)远小于聚对二甲苯的水蒸气透过率2.3×10-7,所以本发明直接使用玻璃-薄型PDMS-玻璃的夹心结构,如图1所示,顶层盖玻片与底层载玻片的厚度分别为150~570μm,中间为有图形结构的PDMS芯片,芯片层厚度为0.5~2mm,PDMS底面分布有微通道和微反应腔,下面的PDMS涂层是涂抹在底层载玻片上的,作为微通道和微反应腔的底面,目的是使微通道和微反应腔的底整个封闭环境保持相同的表面性质。该夹心结构有效降低水分挥发作用,且操作更加简单。
2.样品进样分离
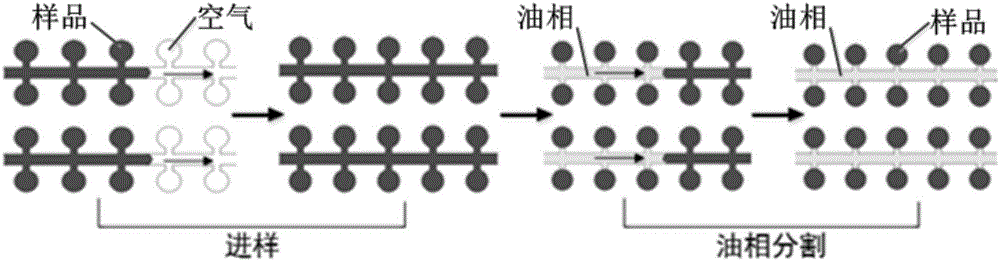
微流控芯片包括进样、微腔阵列、出样三个区域,其中的微腔阵列区是有微通道衔接各个独立的柱形反应腔。利用PDMS的高透气性特点,直接将键合在载玻片上的芯片抽真空,取出后,PDMS芯片自身的高负压可实现液体样品的自动进样和跟随其后的油相对反应腔的自动阻断隔离,从而形成稳定的独立反应腔室。为降低PDMS侧面对样品的挥发同时又要使其自身负压值满足完整进样,芯片的厚度必须控制在一定范围内。经过实验发现,设计多个出样口通道和腔,有利于在出口形成更大的负压,增大进样的动力。PDMS芯片厚度约0.5-2mm,能达到无源进样的效果。
3.PCR扩增
将进样完毕的芯片平放在具有原位PCR功能的PCR仪上进行扩增,扩增的变性温度与复性、扩增温度均与反应腔内所包裹PCR混合液的条件相同,或者根据原位PCR仪的性能进行适当调整。
本发明所述的PCR扩增的方法与常规数字PCR方法比,耗材成本低,操作简单,扩增结果易于观察和统计分析,所需实验设备一般实验室即可满足。
综上所述,本发明提供了一种基于表面活性剂改性PDMS、无源进样和“三明治”封装结构的数字PCR芯片方法。本发明具有以下先进性:
[1]本发明在PDMS中掺入表面活性剂,改变了PDMS表面性质,减少芯片对酶、核酸、荧光染料等的吸附能力,提高了芯片上PCR扩增效率,提高了检测结果的信噪比。
由于PDMS材料表面的高疏水性及对非极性物质的强吸附性,在生物反应中,一定要对其进行表面修饰。常规数字PCR芯片在PCR预反应液里添加表面活性剂,以达到PDMS表面优先吸附活性剂,抑制对生物分子的吸附,但是低浓度的表面活性剂很难达到足够的封闭效果,而高浓度的表面活性剂通常对PCR反应的酶反应会产生抑制作用。所以本发明人直接将表面活性剂掺杂在PDMS单体中,待其固化后,表面活性剂就会聚集在PDMS表面,以降低表面张力,提高表面亲水性,从而减少对生物分子的吸附,保证了实验的稳定性。
[2]简易玻璃-薄层PDMS-玻璃夹心封装方法,实现高抗水分挥发性。
已报道的集成流路微腔数字PCR芯片的抗挥发方法一般是在微阵列芯片层上喷涂一层聚对二甲苯防挥发层,所需工艺条件较为复杂,且它的抗挥发性能较玻璃弱。本发明直接利用载玻片和盖玻片将一薄层PDMS芯片夹在中间,由此,只要控制芯片的厚度,上下两层玻璃可以达到很好的抗挥发性,满足PCR扩增的需要,且操作简单。
[3]本发明所涉及的数字PCR方法与目前数字PCR芯片技术相比,成本低,操作简便,与常规PCR试剂兼容性强,且实验室常规试验设备即可满足试验需要。
目前市售的数字PCR芯片,无论液滴式还是阵列式,多采用特制的仪器设备产生液滴、分孔加样或加压产生腔体,扩增后读取信号,整套设备价格昂贵,非一般实验室可以承受,不利于数字PCR技术的普及。本发明所涉及数字PCR方法,无需各种外界动力泵实现进样和分液,数据读取只需一般的荧光显微镜即可满足需要,且芯片材料采用PDMS,成本很低,整个芯片制备方法非常简单,在同一芯片上完成进样分离、PCR扩增、结果观察,有利于推广数字PCR技术的应用。
总之,本发明提供的数字PCR芯片设计方法降低了PDMS对生物分子的静电吸附,有效提高了液滴的稳定性和抗挥发性,从而提高了PCR的扩增效率。而且与目前已报道的数字PCR芯片技术相比,成本低,操作简便,应用前景非常广泛。
附图说明
图1:数字PCR微阵列芯片结构。
图2:液体样品自动进样和油相分离过程。
图3:数字PCR微阵列芯片检测EGFR基因的荧光结果。
具体实施方式
下面通过具体的实施例来解释本发明的实质性的特点和显著进步,但本发明决非仅局限于实施例。
实施例1:模具的设计和制作
本发明在研究了多种芯片腔体形状、微通道尺寸、键合和进样方式对液体流阻和稳定性的影响基础上,最后发现微通道衔接柱形腔体,芯片热键合后,利用其自身真空负压进样的方式,样品能快速导入、自动分离,且微反应腔中样品稳定性较好。
芯片结构是由进样区、阵列区及出样区三部分组成(见图1中的PDMS微阵列芯片层)。首先用CAD软件设计图案打印掩膜板,然后利用负性光刻胶SU8 3050在硅片上分层制作微管道和微反应腔。进样区和出样区微管道宽度160微米,尽量令进样口到达每条主通道的距离相等,从而具有相同的流阻,同样的设计宗旨应用在出样区;此芯片阵列区微通道尺寸如下,但不仅限于此:主干线宽度80微米,衔接主干线和微腔的支线宽度30微米,柱形微反应腔直径100微米,腔与腔之间距离为100微米,腔的总数为10000个,芯片图形结构的高度为100微米。
实施例2:PDMS芯片的制备
在硅片模具制作完成后,通过软刻蚀模塑法浇铸PDMS芯片。首先将PDMS预聚体与固化剂按10:1(质量比)混合,搅匀,然后再将该混合物按每100g加入0.1~2.0g表面活性剂(如tween 20、span 80、Triton100或甜菜碱等生物反应中常用的表面活性剂均可)的比例再次混合,搅匀,抽真空除气,倾倒于上述模具上,另外在载玻片上薄涂一层同样的混合液PDMS,一起静置1h,固化后将模具上的PDMS剥离,打孔,将有管道面与涂层后的玻璃涂层面贴合在一起,排出贴面中的空气,最后将贴合好的PDMS放入85℃的热板上加热10min,使其完全键合。本发明将表面活性剂直接掺杂在PDMS单体中,固化后表面活性剂聚集在PDMS表面。
实施例3:液体样品的自动进样和微滴阵列的生成
PCR预混液:此处PCR反应液与常规PCR反应液兼容,所述的PCR反应体系为:20μL预混液中包含10ul Roche 480Probe Premix,各250nM EGFR基因21外显子上下游引物,200nM TaqMan探针,10ng基因组DNA。
首先制备PCR预混液即样品,将样品注入抽真空脱气后的芯片进样口,利用抽真空后PDMS芯片自身负压作用抽吸样品,样品顺着微通道逐渐注满微通道及其两边的腔体(见图2:进样过程),待所有反应腔中均注满样品后,在进样口注入预先混合的油相,将一小块脱气的PDMS空白块贴在芯片出样口,为油相的导入提供动力,由于油相与水相界面张力的作用,油相进入微管道,将微管道多余样品推出并填充微管道,实现微反应腔的分割(见图2:油相分割过程),使其成为一个个独立的反应单元,形成圆形微滴阵列,杜绝了样品交叉污染,同时掺了PDMS的油相在热循环初期即受热固化在微调通道内,确保了反应液的稳定性。在油相顺利到达出样口时,揭掉PDMS块,用PDMS封闭进样口及出样口,并盖上盖玻片,防止PCR反应过程中的水分挥发。
实施例4:PCR扩增
将该芯片立即放入PCR仪上进行在片的原位PCR扩增(in situ PCR),PCR循环程序为:95℃10min预变性,94℃15s,60℃30s循环,15个循环,94℃15s,58℃30s循环,25个循环,共40个循环。采用荧光显微镜观察结果,CCD照相,计数荧光信号阳性微腔(见图3)。可见每个圆柱形反应腔内样本保存完整,EGFR基因阳性模板检测芯片有少量反应腔内发出明亮的绿色荧光,阴性对照无荧光信号,说明发出明亮的绿色荧光的反应腔内发生了PCR扩增,其反应结果为阳性。表明该芯片结构和实验方法能确保样本的稳定性和抗挥发性,杜绝微反应室间发生交叉污染,成功实现微反应腔中单个分子的PCR扩增。
实施例5
①如图1所示,下层的载玻片上预涂一薄层PDMS,该层PDMS与带有微腔阵列的PDMS层有管道的一面键合。芯片管道包括三部分,进样口区、微腔阵列区域和出样口区。最后在最上面盖上一层载玻片或盖玻片防止水分挥发。
②如图2所示,将样品(黑色)注入抽真空脱气后的芯片进样口,在抽真空后PDMS芯片在自身负压作用下,样品自动注满微腔体;然后在进样口注入预先混合的油相(无色),油相在负压作用下进入微管道,并将微管道多余样品推出并填满管道,从而实现微反应腔中样品的分割,使其成为一个个独立的反应单元,形成圆形微滴阵列。
③如图3所示,亮绿色圆点为PCR扩增阳性的微腔体,说明微腔体中含有至少一个拷贝的DNA模板;暗绿色圆点为PCR扩增阴性的微腔体,说明其中不含模板。亮绿色圆点的数量随着芯片上模板浓度的升高而增多。阴性对照整个芯片未见扩增阳性信号。
- 还没有人留言评论。精彩留言会获得点赞!