新的有机化合物,含有该化合物的近红外荧光造影剂以及用于制备纳米颗粒化造影剂的方法与流程
本发明涉及一种新颖的有机化合物,含有该有机化合物的近红外荧光造影剂以及制备纳米颗粒造影剂的方法。
背景技术:
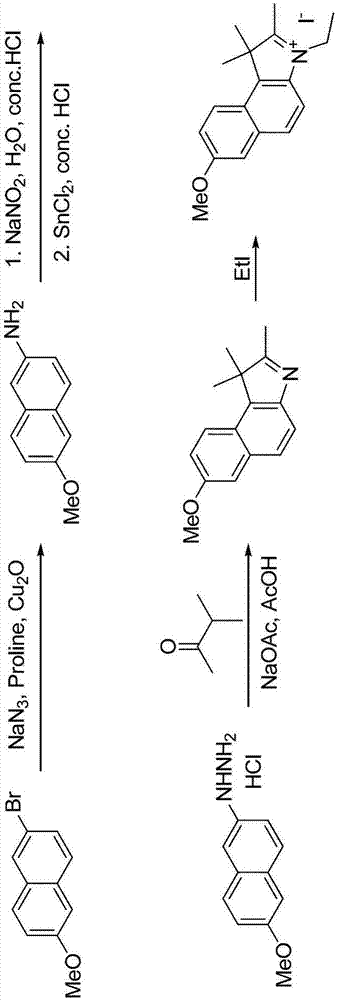
:在疾病治疗的早期阶段检测由体内疾病引起的形态学和功能变化是重要的。特别是在治疗癌症时,肿瘤的大小和位置是有效治疗方案的关键决定因素。为此目的已知的方法包括通过穿孔等的活体组织检查,以及影像诊断方法,例如x射线成像,mri(核磁共振成像)和超声成像。活体组织检查在最终诊断中是有效的,但是同时,活组织检查对测试对象造成沉重的负担,并且不适合跟踪病变随时间的变化。x射线成像和mri不可避免地会使受试者暴露于辐射和电磁波。此外,如上所述,常规的成像诊断方法需要复杂的操作并且需要长时间进行测量和诊断。而且,用于该目的的大多数设备在操作期间难以应用这些方法。荧光成像是成像检测方法之一(参见lipspnr.l.etal.,j.natl.cancerinst.,26,1-11(1961))。在这种方法中,当暴露于具有特定波长的激发光时发射荧光的材料被用作造影剂。因此,身体暴露于体外的激发光下,并且检测从身体中的荧光造影剂引发的荧光。例如荧光造影剂可以是卟啉化合物,如血卟啉,聚集在肿瘤中,并用于光动力疗法(pdt)。其它实例是光芴和苯并卟啉(参见lipspnr.l.等人;mengt.s.等人;spie,1641,90-98(1992),wo84/04665等)。虽然这些化合物是光动力疗法(pdt)所必需的,但是这些化合物最初被用于pdt时还保留光毒性。因此,最终这些化合物不是优选的诊断试剂。同时,视网膜循环微血管造影术使用已知的荧光染色剂,例如已知的荧光素、荧光胺和核黄素(美国专利号4,945,239)。荧光染料在400-600nm的可见光区域发射荧光。在这个区域,光透过生物组织的透过率非常低,因此,检测身体的较深部分的病变几乎是不可能的。此外,使用花青化合物作为荧光造影剂包括靛青绿(以下简称为“icg”),来确定肝脏功能和心脏脉搏,并且这些事实在文献中已被公开(haglundm.m.etal。,neurosurgery,35,930(1994);和li,x等人,spie,2389,789-797(1995))。花青化合物在近红外光区域(700-1300nm)显示出吸光度。近红外光显示透过生物组织的透射率高,并可以通过大约10mm的颅骨骨组织。由于这个原因,近红外光在临床医学领域逐渐受到关注。例如,使用光传输介质的光学ct技术是一项新技术,在临床领域一直受到关注。原因是近红外光可以通过生物体,可用于监测体内氧气的浓度和循环。花青化合物在近红外区域发射荧光。该范围内的荧光可以通过生物组织,因此具有作为荧光造影剂的潜力。最近开发了多种花青化合物,并且已经尝试作为荧光造影剂(wo1996/17628)。然而,不存在在水中具有足够溶解度,在生物体中是安全的,并且具有能力将病变组织与正常组织(选择靶位点通过成像)区分开的试剂。技术实现要素:技术问题本发明一方面提供一种新颖的化合物,该化合物在近红外线区域具有吸收波长和发射波长。本发明另一方面提供一种造影剂,该造影剂在水中具有充分的溶解度,在生物体内是安全的,并且具有成像和选择靶点的能力。技术方案本发明涉及由化学式1所示的化合物或其盐,[化学式1]其中,r1各自独立地选自-br,-so3h或–ome;r2是-r5,(其中,r5是-h,-co2h,c1-c3烷基或c1-c4烷基酯)r3各自独立地选自-so3h,-co2h,或–me;r4为-cl或-s-r6(其中,r6为);其中:n=0-4。而且本发明涉及近红外荧光造影剂,该造影剂含有化学式1所示的化合物或药学上可接受的盐作为活性成分。有益效果本发明的新的化合物与现有存在的靛青绿(icg)化合物相比的优点是具有更长的吸收和发射波长。因此,含有本发明新化合物的造影剂,通过生物组织时具有优异的透射性,并且在用作造影剂时具有优异的图像深度,从而允许检测生物体的较深部位的损伤。附图简要说明图1-6是本发明实施方式中化学式1所示化合物的合成方案图。图7是本发明实施方式中近红外荧光造影剂制备方法的示意图。图8是根据制备实施例1制备的核-壳结构的纳米粒子的tem图像。图9显示出根据制备实施例1制备的纳米近红外造影剂的吸收波长和发射波长图。图10是根据制备实施例1-4制备的纳米近红外造影剂的归一化强度图。图11是根据制备实施例1-4制备的纳米近红外造影剂在水中的分散性的评价结果。图12是插入根据制备实施例1制备的近红外造影剂尖端的鸡胸肉的图像。图13是应用光声光谱仪测定鸡胸肉插入制备实施例1制备的近红外造影剂尖端的荧光分析结果。具体实施方式以下,对本发明进行详细说明。然而,本发明可以以各种不同的形式实现,因此不限于这里描述的实施例。本发明涉及由化学式1所表示的化合物或其盐:[化学式1]其中,r1各自独立地选自-br,-so3h,或–ome;(这里,r5是-h,-co2h,c1-c3烷基或c1-c4烷基酯);r3各自独立地选自-so3h,-co2h或–me;r4为-cl或-s-r6,(其中,r6为并且n=0-4)。当r4为-s-r6时,r2可以是并且r3可以是-me。当r4为-cl时,r1可以是-ome,并且r2可以是优选地,化学式1所示的化合物选自2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(4-(甲氧羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-7-磺酸盐;7-溴-2-((e)-2-((e)-3-((e)-2-(7-溴-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-氯-5-(4-(甲氧羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]碘化吲哚;2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(4-(甲氧基羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]碘化吲哚;2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-7-磺酸盐;7-溴-2-((e)-2-((e)-3-((e)-2-(7-溴-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-氯-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]碘化吲哚;2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]碘化吲哚;2-((e)-2-((e)-2-(4-羧基苯硫基)-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚鎓-7-磺酸盐;4-((e)-6-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2-基)乙烯基)-4-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)硫代苯甲酸盐;2-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯基硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物;3-乙基-2-((e)-2-((e)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-(4-(2-异硫氰基乙基氨甲酰基)苯硫基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-7-甲氧基-1,1-二甲基-1h-苯并[e]碘化吲哚;2-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯基硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]碘化吲哚;3-乙基-2-((e)-2-((e)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-(4-(2-异硫氰基乙基氨基甲酰基)苯基硫基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚碘化物;2-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯基硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物;或2-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯硫基)-5-叔丁基-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]碘化吲哚。表1如上表所示,所引用的本发明化合物的吸收波长为830nm以上,优选为855nm以上,发射波长为860nm,优选为890nm。同时,本发明的由化学式1所表示的化合物可以通过各种方法制备,例如可以通过下面的1-6的合成方案制备。合成方案1合成方案2合成方案3合成方案4合成方案5合成方案6在另一个实施方案中,本发明涉及含有化学式1所示化合物或其药学上可接受的盐作为活性成分的近红外荧光造影剂。本发明的近红外荧光造影剂是在近红外区域发射荧光的造影剂。本发明的近红外荧光造影剂可以单独地或组合地含有化学式1所示的化合物或其药学上可接受的盐。其药学上可接受的盐可以包括铵盐,钾盐,碘盐等,但本发明不限于此。本发明的近红外荧光造影剂可以是用于肿瘤成像或血管造影术的近红外荧光造影剂。本发明的近红外荧光造影剂优选为在溶液中含有核-壳结构的颗粒,每个颗粒包括:含有化合物或其药学上可接受的盐的核心;和含有脂质的壳。这里,核-壳纳米粒子的尺寸可以为10~500nm,更优选为10~100nm。当颗粒是纳米尺寸时,这种颗粒对癌细胞的靶向增加了荧光强度(增强的渗透性和滞留性(epr,高通透性和滞留效应)),并且光漂白减少,从而显示出优异的光学性质。核-壳结构的颗粒的尺寸为10-500nm。本发明的含有的化学式1所示化合物的近红外荧光造影剂比现有已知的材料具有更长的吸收和发射波长,因此可以进一步增加成像深度,并且可以用作诊断和操作深层癌细胞或组织的造影剂。同时,造影剂可以含有分散或溶解在溶剂中的化学式1所示化合物或其药学上可接受的盐,例如注射用蒸馏水,药物盐水或林格氏溶液。如果需要,可以加入药学上可接受的添加剂,例如载体或赋形剂。这样的添加剂包括药理学上可接受的电解质,缓冲剂,洗涤剂,渗透压调节物质和提高稳定性和溶解性的材料(例如环糊精,脂质体等)。也可以使用通常用于相关领域的各种添加剂。本发明的近红外荧光造影剂在用于药物用途时优选通过灭菌方法制备。在另一个实施方案中,本发明涉及一种制备近红外荧光造影剂的方法,所述方法包括以下步骤:将权利要求1至8中任一项所述的化合物或其药学上可接受的盐溶解于有机溶剂中;将得到的溶解产物滴加到其中分散有伯胺基的脂质的水溶液中以制备乳液,然后从乳液中除去有机溶剂以制备得到核-壳结构的纳米颗粒;并用4-(n-马来酰亚胺基甲基)环己烷-1-羧酸磺基琥珀酰亚胺酯(sulfo-smcc)对制备的核-壳结构的纳米颗粒的表面进行改性处理。制备方法将逐步详细描述。首先,将化学式1所表示的化合物或其药学上可接受的盐溶解在有机溶剂中。其原因在于化学式1所表示的化合物不易溶于水。有机溶剂优选为挥发性有机溶剂,以便后续除去溶剂。挥发性有机溶剂的实例可包括甲醇,乙醇,丙酮,乙腈,二氯甲烷,丙醇,四氯化碳,氯甲基,dmso,dmf,thf或其混合物,但不限于此。然后,将得到的溶解产物滴加到其中分散有伯胺基的脂质水溶液中以制备乳液,然后从乳液中除去有机溶剂以制备核-壳结构的纳米颗粒。具有伯胺基的脂质的实例是磷脂,更具体地,可以是选自dppc(1,2-二癸酰基-sn-甘油-3-磷酸胆碱),depe(1,2-二椰油酰-sn-甘油-3-磷酸乙醇胺),dlpe(1,2-二月桂酰基-sn-甘油-3-磷酸乙醇胺),dmpe(1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺),dope(1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺),dspe(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺)或pope(1-棕榈酰基-2-油酰基-sn-甘油基-3-磷酸乙醇胺)中的至少一种。脂质必须具有伯胺基的原因是通过化学键合作用引入癌细胞特异性和可识别的抗体,肽等。核-壳结构纳米颗粒的尺寸优选为10-500nm,更优选为10-100nm。当颗粒为纳米尺寸时,这种颗粒对癌细胞的靶向增加了荧光强度(增强的渗透性和滞留性(epr,高通透性和滞留效应)),并且光漂白减少,从而显示出优异的光学性能。然后,用马来酰亚胺基,羧基或叠氮基中的至少一种对所制备的核-壳结构的纳米颗粒进行表面改性处理。这里,可以使用选自4-(n-马来酰亚胺基甲基)环己烷-1-羧酸磺基琥珀酰亚胺酯(sulfo-smcc),3,6,9-三氧杂十二烷-11-月桂酸甲酯或11-叠氮基-3,6,9-三氧杂-1-十一烷醇甲磺酸酯中的至少一种进行表面改性处理。另一方面,造影剂可以通过注射,喷雾,涂覆或静脉内(静脉内,动脉),口服,腹膜内,透皮,皮下,囊内或肿瘤内施用给予生物体。优选地,试剂以溶液剂,乳剂或混悬剂的形式血管给药。本发明的近红外线荧光造影剂的施用并不特别限于能够通过给药最终诊断的病变部位的检查。根据使用的发射近红外荧光的化合物的种类,受治疗者的年龄,体重和目标器官适当地控制给药。通常,基于化合物的量,剂量为0.1-100mg/kg体重,优选为0.5-20mg/kg体重。本发明的造影剂也适用于除人以外的各种动物。剂型,途径和剂量根据目标动物的体重和疾病状态适当确定。本发明的近红外荧光造影剂通常施用于被检测目标,并且被检测对象暴露于来自激发光源的激发光下。此后,使用荧光检测器检测来自由激发光引起的近红外荧光造影剂的荧光。用于激发的波长根据所使用的近红外荧光造影剂的不同而不同。本发明的化合物在近红外区有效地发射荧光,因此具有优异的生物传播性。实施例12-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-1-2(3h)-亚基)亚乙基)-5-(4-(甲氧羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-7-磺酸盐化合物a1-1:合成1,1,2-三甲基-1h-苯并[e]吲哚-7-磺酸将1,1,2-三甲基-1h-苯并[e]吲哚(1.00g,4.78mmol)和硫酸(3.69ml,69.3mmol)的混合物在140℃下搅拌1小时。将搅拌的溶液冷却至室温后,加入冰水混合物,并使用6n的naoh水溶液调节混合溶液的ph至ph3。将生成的固体过滤,然后用水和et2oh洗涤。将所得固体真空干燥,得到白色固体的1,1,2-三甲基-1h-苯并[e]吲哚-7-磺酸(682mg,2.36mmol,49.3%)1h-nmr(dmso-d6,varian400mhz):δ1.63(6h,s),2.62(3h,d,j=6.4hz),7.78(1h,d,j=8.4hz),7.87(1h,d,j=8.4hz),8.14-8.18(1h,m),8.21(1h,d,j=8.8hz),8.32(1h,s).1-2:合成3-乙基-1,1,2-三甲基-1h-苯并[e]吲哚-7-磺酸盐将1,1,2-三甲基-1h-苯并[e]吲哚-7-磺酸(100mg,0.346mmol),碘代乙烷(0.279ml,3.46mmol)和k2co3(48mg,0.346mmol)加入到二甲基甲酰胺(1ml)中,将混合物在100℃下搅拌6小时。将搅拌的溶液冷却至室温,然后真空浓缩,浓缩溶液用乙醇重结晶,得到3-乙基-1,1,2-三甲基-1h-苯并[e]吲哚-7-磺酸盐(190mg,0.429mmol)。所得化合物不经单独纯化即可用于随后的反应。1h-nmr(dmso-d6,varian400mhz):δ1.50(3h,t,j=7.2hz),1.75(6h,s),2.92(3h,s),4.61(2h,q,j=7.3hz),7.95(1h,d,j=8.4hz),8.15(1h,d,j=8.8hz),,8.32-8.37(2h,m),8.41(1h,s).1-3:合成1,4-二氧杂螺[4.5]癸-7-烯-8-基三氟甲磺酸酯将1,4-二氧杂螺[4.5]癸烷-8-酮(2.00g,12.8mmol)溶于四氢呋喃中,然后冷却至-78℃,滴加浓度为1.06m的双(三甲基硅烷基)氨基锂/四氢呋喃(14.5ml,15.4mmol)。将反应溶液在-78℃下搅拌2小时,然后在-78℃下滴加溶解在四氢呋喃(10ml)中的1,1,1-三氟-n-苯基-n-(三氟甲磺酰基)甲磺酰胺(4.80g,13.5mmol)。将反应溶液的温度缓慢升至0℃后,将反应溶液在0℃下搅拌2小时。然后,向反应溶液中加入水,用乙酸乙酯萃取。分离的有机层用饱和nacl水溶液洗涤,用硫酸钠干燥,然后真空浓缩。浓缩溶液使用硅胶柱色谱法(己烷:乙酸乙酯=9:1)进行纯化,得到黄色油状的1,4-二氧杂螺[4.5]癸-7-烯-8-基-三氟甲磺酸酯(3.55g,12.3mmol,96%)。1h-nmr(cdcl3,varian400mhz):δ1.91(2h,t,j=6.6hz),2.40-2.42(2h,m),2.53-2.56(2h,m),3.99(4h,s),5.65-5.67(1h,m).1-4:合成4-(1,4-二氧杂螺[4.5]癸-7-烯-8-基)苯甲酸甲酯将csf(氟化铯,1.58g,10.4mmol)和pdcl2(dppf)-ch2cl2添加剂(142mg,0.173mmol)加入到溶于1,4-二恶烷(17ml)中的1,4-二氧杂螺[4.5]癸-7-烯-8-基三氟甲磺酸酯(1.00g,3.47mmol)中,然后在90℃加热3小时。将反应溶液真空浓缩后,将浓缩溶液溶于乙酸乙酯中,将溶解的溶液通过硅藻土过滤。过滤的溶液再次真空浓缩,然后使用硅胶柱色谱法纯化(己烷:乙酸乙酯=4:1)的浓缩溶液,得到白色固体4-(1,4-二氧杂螺[4.5]癸烷-7-烯-8-基)苯甲酸甲酯(697mg,2.54mmol,73.2%)。1h-nmr(cdcl3,varian400mhz):δ1.94(2h,t,j=6.4hz),2.48-2.52(2h,m),2.66-2.70(2h,m),3.91(3h,s),4.03(4h,s),6.00-6.13(1h,m),7.45(2h,d,j=8.4hz),7.97(2h,d,j=6.0hz).1-5:合成4-(1,4-二氧杂螺[4.5]癸烷-8-基)苯甲酸甲酯将4-(1,4-二氧杂螺[4.5]癸-7-烯-8-基)苯甲酸甲酯(697mg,2.54mmol)和10%pd/c(174mg)加入到乙酸乙酯和甲醇(1:2)的混合物(25.5ml)中,然后在室温下,在氢气氛中,在45psi的压力下搅拌3小时。将反应溶液通过硅藻土溶解,然后将滤液真空浓缩,得到灰色固体甲基4-(1,4-二氧杂螺[4.5]癸烷-8-基)苯甲酸甲酯(675mg,2.44mmol,96%)。所得化合物不经单独纯化即可用于随后的反应。1h-nmr(cdcl3,varian400mhz):δ1.66-1.88(8h,m),2.60-2.65(1h,m),3.90(3h,s),3.99(4h,s),7.31(2h,d,j=8.0hz),7.96(2h,d,j=8.0hz).1-6:4-(4-氧代环己基)苯甲酸甲酯的合成将1m盐酸(6.11ml,6.11mmol)滴加到于室温下溶于四氢呋喃(12ml)的4-(1,4-二氧杂螺[4.5]癸烷-8-基)苯甲酸甲酯(675mg,2.44mmol)中。将反应溶液在室温下搅拌39小时,然后真空浓缩。将浓缩液溶于乙酸乙酯中,然后用饱和碳酸氢钠水溶液洗涤。分离的有机层用硫酸钠干燥,然后真空浓缩。浓缩液使用硅胶柱色谱(己烷:乙酸乙酯=4:1)纯化,得到4-(4-氧代环己基)苯甲酸甲酯白色固体(352mg,1.52mmol,62.1%)。1h-nmr(cdcl3,varian400mhz):δ1.91-2.02(2h,m),2.20-2.26(2h,m),2.50-2.56(4h,m),3.09(1h,t,j=12.2hz),3.91(3h,s),7.32(2h,d,j=8.0hz),8.00(2h,d,j=8.0hz).1-7:(e)-4-(4-氯-3-甲酰基-5-(羟基亚甲基)环己-3-烯基)苯甲酸甲酯的合成将三氯化磷(0.161ml,1.72mmol)缓慢滴加到冷却至0℃的无水二甲基甲酰胺(0.167ml,2.15mmol)中。将反应溶液在室温下搅拌30分钟后,将稀释于二甲基甲酰胺(2.15ml)中的4-(4-氧代环己基)苯甲酸甲酯(100mg,0.431mmol)溶液滴加到反应液中。将反应溶液在55℃下搅拌2小时,然后加入冰水混合物。将混合溶液在室温下搅拌24小时后,过滤产生的沉淀,然后用二异丙醚洗涤。将所得固体真空干燥,得到黄色固体的(e)-甲基-4-(4-氯-3-甲酰基-5-(羟基亚甲基)环己-3-烯基)苯甲酸甲酯(50mg,0.163mmol,37.9%)。1h-nmr:(dmso-d6,varian400mhz):δ2.35-2.42(2h,m),2.73-2.94(3h,m),3.85(3h,s),7.46(2h,d,j=8.0hz),7.91(2h,d,j=8.0hz),11.05(1h,s).1-8:(e)-n-(((e)-2-氯-5-(4-(甲氧基羰基)苯基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)氯化苯胺将溶于乙醇和二甲基甲酰胺(0.2ml)中的(e)-4-(4-氯-3-甲酰基-5-(羟基亚甲基)环己-3-烯基)苯甲酸甲酯(50mg,0.163mmol)溶液冷却至0℃后,滴加浓盐酸(0.120ml,1.39mmol)。在0℃下将苯胺(0.033ml,0.359mmol)滴加到反应溶液中,然后在0℃下搅拌30分钟。将反应液加入到冰-水混合物中,然后将生成的固体过滤并用水和二异丙醚洗涤。将过滤的固体真空干燥,得到紫色固体(e)-n-(((e)-2-氯-5-(4-(甲氧基羰基)苯基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯胺氯化物(69.8mg,0.141mmol,87%)。1h-nmr(dmso-d6,varian400mhz):δ2.73(2h,t,j=13.2hz),3.16(1h,t,j=11.6hz),3.25(2h,d,j=14.8hz),3.66(1h,brs),3.87(3h,s),7.25-7.30(2h,m),7.44-7.48(4h,m),7.54-7.59(4h,m),7.68(2h,d,j=7.6hz),8.01(2h,d,j=7.6hz),8.62(2h,s),11.29(1h,brs).1-9:合成2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(4-(甲氧羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-7-磺酸盐将(e)-n-(((e)-2-氯-5-(4-(甲氧基羰基)苯基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯氯化铵(20mg,0.041mmol)和3-乙基-1,1,2-三甲基-1h-苯并[e]吲哚鎓-7-磺酸盐(54mg,0.122mmol),溶于乙醇(0.8ml),溶液在90℃加热3小时。将反应溶液真空浓缩,然后使用硅胶柱色谱(二氯甲烷:甲醇:乙酸=4:1:0.05)纯化浓缩溶液,得到深蓝色固体2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(4-(甲氧基羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-7-磺酸盐(21.9g,0.024mmol,59.7%)。实施例27-溴-2-((e)-2-((e)-3-((e)-2-(7-溴-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-氯-5-(4-(甲氧羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]碘化吲哚化合物b2-1:7-溴-3-乙基-1,1,2-三甲基-1h-苯并[e]碘化吲哚的合成将溶解在乙腈(1ml)中的7-溴-1,1,2-三甲基-1h-苯并[e]吲哚(300mg,1.04mmol)和碘乙烷(0.252ml,3.12mmol)的混合物于90℃下加热11小时。将反应溶液冷却至室温后,过滤生成的固体,然后用乙腈和et2o洗涤,得到灰色固体7-溴-3-乙基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物(343mg,0.772mmol,74.2%)。1h-nmr(dmso-d6,varian400mhz):δ1.50(3h,t,j=7.2hz),1.75(6h,s),2.93(3h,s),4.61(2h,q,j=7.2hz),7.88(1h,d,j=8.8hz),8.23(1h,d,j=9.2hz),8.30(1h,d,j=8.8hz),8.36(1h,d,j=9.2hz),8.55(1h,s).2-2:合成7-溴-2-((e)-2-((e)-3-((e)-2-(7-溴-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-氯-5-(4-(甲氧羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]碘化吲哚在(e)-n-(((e)-2-氯-5-(4-(甲氧基羰基)苯基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)氯化苯胺(0.02g,0.041mmol)和7-溴-3-乙基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物(40mg,0.089mmol)的混合溶液中加入乙酸钠(9.98mg,0.122mmol)溶液后,溶解于乙醇(0.811ml)中,溶液在90℃加热3小时。将反应溶液真空浓缩,然后浓缩溶液通过硅胶柱色谱(二氯甲烷:甲醇:乙酸=95:5)纯化,得到深蓝色固体7-溴-2-((e)-2-((e)-3-((e)-2-(7-溴-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-氯-5-(4-(甲氧基羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(32.5mg,0.032mmol,78%)。1h-nmr(dmso-d6,varian400mhz):δ1.26(6h,t,j=6.8hz),1.91(12h,s),2.73(2h,t,j=13.6hz),3.15-3.20(2h,m),3.85(3h,s),4.28-4.34(4h,m),6.37(2h,d,j=14.4hz),7.64(2h,d,j=8.0hz),7.72(2h,d,j=9.2hz),7.79(2h,d,j=8.8hz),7.98(2h,d,j=8.4hz),8.07(2h,d,j=8.8hz),8.25(2h,d,j=9.2hz),8.34,(2h,s),8.41(2h,d,j=14.0hz).实施例32-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(4-(甲氧羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物----参见合成方案1和2化合物c3-1:6-甲氧基萘-2-胺的合成在2-溴-6-甲氧基萘(200mg,0.844mmol),叠氮化钠(110mg,1.69mmol),脯氨酸(126mg,1.10mmol)和氧化铜(i)(121mg,0.844mmol)加入到将脱气的dmso(1.7ml)中后,将该混合物在100℃下加热11小时。将反应溶液冷却至室温,然后向其中加入乙酸乙酯和水。将混合溶液过滤以除去固体,然后将过滤的液体进行层分离(layer-separated)。分离的有机层用饱和碳酸氢钠水溶液洗涤,硫酸钠干燥,然后真空浓缩。浓缩溶液通过硅胶柱色谱法(己烷:乙酸乙酯=2:1)纯化,得到橙色固体6-甲氧基萘-2-胺(77.9g,0.450mmol,53.3%)。1h-nmr(cdcl3,varian400mhz):δ3.73(2h,brs),3.88(3h,s),6.93-6.97(2h,m),7.04-7.08(2h,m),7.51(1h,d,j=8.8hz),7.57(1h,d,j=8.8hz)3-2:(6-甲氧基萘-2-基)肼盐酸盐的合成将6-甲氧基萘-2-胺(300mg,1.732mmol),水(5.6ml)和浓盐酸(2.17ml,26.0mmol)的混合物冷却至-6℃,然后加入溶于水(1.3ml)中的氮化钠(137mg,1.99mmol)溶液。将反应溶液在0℃下搅拌45分钟后,缓慢滴加溶解在浓盐酸中的氯化锡(ii)(657mg,3.46mmol)溶液。将反应溶液的温度缓慢升至室温,然后过滤产生的固体,用水和叔丁基甲基醚洗涤。将所得固体真空干燥,得到灰色固体(6-甲氧基萘-2-基)肼盐酸盐(32mg,1.42mmol,82%)的。1h-nmr(dmso-d6,varian400mhz):δ3.84(3h,s),7.14(1h,dd,j=8.8,2.4hz),7.20(1h,d,j=9.6hz),7.26(2h,s),7.65(1h,d,j=8.8hz),7.75(1h,d,j=8.8hz),8.40(1h,brs),10.31(3h,brs).3-3:7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚的合成将3-甲基丁-2-酮(58mg,0.668mmol)和乙酸钠(73mg,0.89mmol)加入到溶于乙酸(1ml)中的(6-甲氧基萘-2-基)肼盐酸盐(100mg,0.445mmol)的溶液中,将混合物在110℃下加热2小时。将混合物冷却,然后将反应溶液用甲苯稀释,再次浓缩以除去残留的乙酸。浓缩溶液通过硅胶柱色谱法(己烷:乙酸乙酯=2:1)纯化,得到棕色固体7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚(67mg,0.280mmol,62.9%)。1h-nmr(cdcl3,varian400mhz):δ1.52(6h,s),2.37(3h,s),3.93(3h,s),7.21-7.26(2h,m),7.72-7.77(2h,m),7.92(1h,d,j=9.2hz).3-4:3-乙基-7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物的合成将乙腈(2.1ml),乙基碘(0.507ml,6.27mmol)和7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚(500mg,2.09mmol)的混合物回流12小时,然后冷却至室温。向反应溶液中加入乙腈(2ml)和乙醚(约10ml)后,将生成的固体过滤,并用乙酸乙酯洗涤,得到白色固体3-乙基-7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物(733mg,1.85mmol,89%)。1h-nmr(dmso-d6,varian400mhz):δ1.49(3h,t,j=7.2hz),1.73(6h,s),2.90(3h,s),3.94(3h,s),4.59(2h,q,j=7.2hz),7.42(1h,dd,j=9.2,1.2hz),7.65(1h,s),8.09(1h,d,j=8.8hz),8.17(1h,d,j=8.8hz),8.30(1h,d,j=9.2hz).3-5:2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(4-(甲氧羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]碘化吲哚的合成在(e)-n-(((e)-2-氯-5-(4-(甲氧基羰基)苯基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)氯化苯胺(100mg,0.203mmol)和3-乙基-7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物(176mg,0.446mmol)的溶液中加入乙酸钠(50mg,0.608mmol)溶液后,溶于乙醇(4ml)中,将溶液在90℃下加热3小时。将反应溶液真空浓缩,然后浓缩溶液通过硅胶柱色谱法(二氯甲烷:甲醇:乙酸=95:5)进行纯化,得到深兰色固体的2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(4-(甲氧基羰基)苯基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(162mg,0.174mmol,86%)。1h-nmr(dmso-d6,varian400mhz):δ1.26(3h,t,j=7.0hz),1.90(12h,s),2.68-2.74(2h,m),3.10-3.17(3h,m),3.85(3h,s),3.87(6h,s),4.26-4.33(4h,m),6.31(2h,d,j=14.0hz),7.29(2h,dd,j=9.2,2.4hz),7.48(2h,d,j=2.0hz),7.65(4h,dd,j=17.6,8.4hz),7.96and7.98(2h,abq,jab=6.2hz),8.20(2h,d,j=9.2hz),8.37(2h,d,j=14.4hz).实施例42-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚鎓-7-磺酸盐----参见合成方案3化合物d4-1:甲基2-(8-羟基-1,4-二氧杂螺[4.5]癸烷-8-基)-2-甲基丙酸甲酯的合成将用四氢呋喃(40ml)稀释的二异丙基胺(6.98ml,49.0mmol)溶液冷却至-78℃后,缓慢滴加2.5m的n-buli(正丁基锂,19.6ml,49.0mmol)。向反应溶液中加入异丁酸甲酯(1.12ml,9.79mmol)后,在-78℃下搅拌20分钟。将溶于四氢呋喃(9ml)中的1,4-二氧杂螺[4.5]癸烷-8-酮(1.53g,9.79mmol)溶液在-78℃加入到反应溶液中,在-78℃下搅拌3小时。向反应溶液中加入饱和氯化铵水溶液,用乙酸乙酯萃取。分离的有机层用盐水洗涤后用无水硫酸钠干燥,然后真空浓缩。浓缩溶液通过硅胶柱色谱法(己烷:乙酸乙酯=3:2)纯化,得到黄色油状物甲基2-(8-羟基-1,4-二氧杂螺[4.5]癸烷-8-基)-2(1.53g,5.91mmol,60.4%)。1h-nmr(cdcl3,varian400mhz):δ1.25(6h,s),1.50-1.59(4h,m),1.72-1.79(1h,m),1.88-2.05(3h,m),2.52(1h,t,j=6.8hz),3.72(3h,s),3.91-3.97(4h,m).4-2:甲基2-甲基-2-(1,4-二氧杂螺[4.5]癸-7-烯-8-基)丙酸甲酯的合成将甲基2-(8-羟基-1,4-二氧杂螺[4.5]癸烷-8-基)-2-甲基丙酸甲酯(1.53g,5.91mmol)和吡啶(59ml)的混合物冷却至0℃,缓慢滴加亚硫酰氯(2.46ml,33.7mmol)。将反应溶液在室温下搅拌14小时,然后加入水-冰混合物,然后用二氯甲烷萃取。分离的有机层用盐水洗涤,用无水硫酸钠干燥,然后真空浓缩。浓缩液通过硅胶柱色谱法(己烷:乙酸乙酯=7:3)纯化,得到有机油状物甲基2-甲基-2-(1,4-二氧杂螺[4.5]癸-7-烯-8-基)(1.15g,4.79mmol,81%)。1h-nmr(cdcl3,varian400mhz):δ1.32(6h,s),1.75(2h,t,j=6.4hz),2.14-2.18(2h,m),2.30-2.35(2h,m),3.67(3h,s),3.95-4.00(4h,m),5.50(1h,s).4-3:甲基2-甲基-2-(4-氧代环己-2-烯基)丙酸酯的合成将对甲苯磺酸吡啶盐(1.46g,5.83mmol)加入到溶于丙酮(12.5ml)和水(1.4ml)中的甲基2-甲基-2-(1,4-二氧杂螺[4.5]癸-7-烯-8-基)丙酸甲酯(1.00g,4.16mmol)溶液中,将该反应溶液在100℃下搅拌3天。将反应溶液真空浓缩后,浓缩液用乙酸乙酯稀释,然后用水和盐水洗涤。分离的有机层用硫酸钠干燥,然后真空浓缩。浓缩液用二氯甲烷(13.9ml)稀释,然后向其中加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(1.694ml,11.24mmol)。将反应溶液在50℃下搅拌3小时,然后冷却至室温,用2m磷酸二氢钠水溶液萃取3次。合并的水层用二氯甲烷萃取两次,然后与有机层合并,然后用无水硫酸钠干燥并真空浓缩。浓缩液通过硅胶柱色谱法(己烷:乙酸乙酯=4:1)纯化,得到黄色油状物甲2-甲基-2-(4-氧代环己-2-烯基)丙酸甲酯的(290mg,1.48mmol,35.5%)。1h-nmr(cdcl3,varian400mhz):δ1.21(3h,s),1.30(3h,s),1.72-1.83(1h,m),1.99-2.02(1h,m),2.38(1h,td,j=15.4,4.8hz),2.50-2.58(1h,m),2.78-2.86(1h,m),3.72(3h,s),6.05(1h,dd,j=10.4,1.6hz),6.82(1h,d,j=10.4hz).4-4:2-甲基-2-(4-氧代环己基)丙酸甲酯的合成在氢气氛下(1atm),将2-甲基-2-(4-氧代环己-2-烯基)丙酸甲酯(290mg,1.48mmol),10%pd/c(30mg)和四氢呋喃(15ml)的混合物在室温下搅拌过夜。将反应的溶液通过硅藻土过滤,并用乙酸乙酯洗涤。真空浓缩滤液,浓缩液通过硅胶柱色谱法(己烷:乙酸乙酯=4:1)纯化,得到白色固体2-甲基-2-(4-氧代己基)丙酸甲酯(269mg,1.36mmol,92%)。1h-nmr(cdcl3,varian400mhz):δ1.15(6h,s),1.42-1.56(2h,m),1.86-1.92(2h,m),2.04-2.10(1h,m),2.28-2.42(4h,m),3.67(3h,s).4-5:(e)-2-(4-氯-3-甲酰基-5-(羟基亚甲基)环己-3-烯基)-2-甲基丙酸甲酯的合成将三氯化磷(0.506ml,5.43mmol)缓慢滴加到冷却至0℃的无水二甲基甲酰胺(0.525ml,6.78mmol)中。将反应溶液在室温下搅拌30分钟后,将在二甲基甲酰胺(6.8ml)中稀释的2-甲基-2-(4-氧代环己基)丙酸甲酯(269mg,1.36mmol)的溶液滴加到反应溶液。将反应溶液在55℃下搅拌2小时,然后加入冰水混合物。将混合溶液在室温下搅拌24小时后,过滤生成的沉淀物,然后用水洗涤。将所得固体真空干燥,得到黄色固体的(e)-2-(4-氯-3-甲酰基-5-(羟基亚甲基)环己-3-烯基)-2-甲基丙酸甲酯(292mg,1.07mmol,79%)。1h-nmr(dmso-d6,varian400mhz):δ1.14(6h,s),1.67-1.86(3h.m),2.61(2h,d,j=15.2hz),3.61(3h,s),11.01(1h,d,j=12.4hz).4-6:(e)-n-(((e)-2-氯-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯胺氯化物的合成在(e)-2-(4-氯-3-甲酰基-5-(羟基亚甲基)环己-3-烯基)-2-甲基丙酸甲酯(292mg,1.07mmol)溶于乙醇和二甲基甲酰胺(1.3ml)后的溶液冷却至0℃,滴加浓盐酸(0.791ml,9.11mmol)。在0℃下将苯胺(0.215ml,2.36mmol)滴加到反应溶液中,将反应溶液在0℃下搅拌30分钟。将反应溶液加入到冰水混合物中,然后过滤生成的固体,并用水和二异丙醚洗涤。将过滤的固体真空干燥,得到紫色固体(e)-n-(((e)-2-氯-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯胺氯化物(483mg,1.05mmol,98%)。1h-nmr(dmso-d6,varian400mhz):δ1.31(6h,s),2.00-2.05(1h,m),2.24(2h,t,j=13.8hz),2.97(2h,d,j=14.4hz),3.69(3h,s),7.27-7.35(2h,m),7.46-7.50(4h,m),7.57-7.59(4h,m),8.53(2h,brs).4-7:2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-7-磺酸盐的合成在溶于乙醇(4.4ml)的(e)-n-(((e)-2-氯-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯胺氯化物(100mg,0.218mmol)和3-乙基-1,1,2-三甲基-1h-苯并[e]吲哚-7-磺酸盐(276mg,0.871mmol)溶液中加入乙酸钠(54mg,0.653mmol),将混合物加热回流3小时。将反应溶液真空浓缩,然后浓缩液通过硅胶柱色谱法(二氯甲烷:甲醇:乙酸=95:5:0.05)纯化,得到深蓝色固体2-((e)-2-((e)-2--氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-7-磺酸盐(43.8mg,0.044mmol,20.2%)。1h-nmr(dmso-d6,varian400mhz):δ1.33(6h,s),1.39(6h,t,j=7.0hz),1.95(12h,s),2.05-2.09(1h,m),2.32(2h,t,j=14.0hz),2.83(2h,d,j=13.2hz),3.70(3h,s),4.35-4.42(4h,m),6.32(2h,d,j=14.4hz),7.79(2h,d,j=8.8hz),7.85(2h,d,j=8.8hz),8.18(2h,d,j=8.8hz),8.27-8.29(4h,m),8.38(2h,d,j=14.0hz).实施例57-溴-2-((e)-2-((e)-3-((e)-2-(7-溴-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-氯-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]碘化吲哚----参见合成方案3化合物e在(e)-n-(((e)--2-氯-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯氯化铵(100mg,0.218mmol)和7-溴-3-乙基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物(213mg,0.479mmol)溶于乙醇(4.35ml)的溶液中加入乙酸钠(54mg,0.653mmol)溶液,将混合物加热回流3小时。将反应溶液真空浓缩,然后浓缩溶液通过硅胶柱色谱(二氯甲烷:甲醇=95:5)纯化,得到深蓝色固体7-溴-2-((e)-2-((e)-3-((e)-2-(7-溴-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-氯5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(102mg,0.102mmol,46.9%)。1h-nmr(dmso-d6,varian400mhz):δ1.33(6h,s),1.37(6h,t,j=7.2hz),1.94(12h,s),2.04(1h,t,j=12.2hz),2.32(2h,t,j=14.0hz),2.83(2h,d,j=13.2hz),3.70(3h,s),4.35-4.48(4h,m),6.34(2h,d,j=14.4hz),7.76(2h,d,j=8.8hz),7.86(2h,d,j=8.8hz),8.12(2h,d,j=9.2hz),8.28(2h,d,j=9.2hz),8.36-8.39(4h,m).实施例62-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]碘化吲哚----参见合成方案3化合物f在(e)-n-(((e)-2-氯-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯氯化铵(0.1g,0.218mmol)和3-乙基-7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物(946mg,2.394mmol)溶于乙醇(22ml)的溶液中加入乙酸钠(268mg,3.27mmol)溶液后,将混合物加热回流3小时。将反应溶液真空浓缩,然后浓缩溶液通过硅胶柱色谱(二氯甲烷:甲醇=95:5)纯化,得到深蓝色固体2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1--甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(859mg,0.956mmol,88%)。1h-nmr(dmso-d6,varian400mhz):δ1.33(6h,s),1.37(6h,t,j=7.0hz),1.93(12h,s),2.00-2.07(1h,m),2.30(2h,t,j=13.8hz),2.81(2h,d,j=13.2hz),3.70(3h,s),3.91(6h,s),4.35-4.40(4h,m),6.28(2h,d,j=14.4hz),7.33(2h,dd,j=8.8,1.6hz),7.52(2h,s),7.75(2h,d,j=11.2hz),8.01(2h,d,j=8.8hz),8.24(2h,d,j=9.6hz),8.33(2h,d,j=10.4hz).实施例72-((e)-2-((e)-2-(4-羧基苯基硫基)-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚-7-磺酸盐----参见合成方案4化合物g在2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚鎓-7-磺酸盐(100mg,0.115mmol)溶于二甲基甲酰胺(1.2ml)的溶液中加入4-巯基苯甲酸(28.3mg,0.184mmol),将该混合物在室温下搅拌过夜。将反应溶液真空浓缩,然后向所得固体中加入乙醇,然后在室温下搅拌。过滤固体,用乙醇洗涤得到深蓝色固体2-((e)-2-((e)-2-(4-羧基苯基硫基)-3-((e)-2-(3-乙基-1,1-二甲基-7-磺基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-1,1-二甲基-1h-苯并[e]吲哚鎓-7-磺酸盐(92mg,0.093mmol,81%)。1h-nmr(dmso-d6,varian400mhz):δ1.34-1.38(12h,m),1.66,1.75(12h,s,s),2.10-2.20(1h,m),2.38(2h,t,j=13.6hz),2.90(2h,d,j=13.2hz),3.73(3h,s),4.30-4.40(4h,m),6.34(2h,d,j=14.8hz),7.46(2h,d,j=8.4hz),7.74(2h,d,j=8.8hz),7.80(2h,d,j=8.8hz),7.92(2h,d,j=8.4hz),8.14(2h,d,j=8.8hz),8.19(2h,d,j=8.8hz),8.24(2h,s),8.68(2h,d,j=14.0hz).实施例84-((e)-6-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2-基)乙烯基)-4-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基硫代)苯甲酸盐----参见合成方案4化合物h在2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(100mg,0.111mmol)溶于二甲基甲酰胺(0.6ml)的溶液中加入4-巯基苯甲酸(51.4mg,0.334mmol),该混合物在室温下搅拌过夜。将反应溶液真空浓缩,浓缩液通过硅胶柱色谱法(二氯甲烷:甲醇=97:3)纯化,得到深蓝色固体4-((e)-6-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2-基)乙烯基)-4-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基硫代)苯甲酸甲盐(85.3mg,0.096mmol,86%)。1h-nmr(dmso-d6,varian400mhz):δ1.30(6h,t,j=7.2hz),1.33(6h,s),1.59,1.68(12h,s,s),2.05-2.11(1h,m),2.32(2h,t,j=13.8hz),2.84(2h,d,j=13.6hz),3.69(3h,s),3.85(6h,s),4.25-4.35(4h,m),6.26(2h,d,j=14.4hz),7.23(2h,dd,j=9.2,2.4hz),7.40(2h,d,j=8.4hz),7.45(2h,d,j=2.4hz),7.66(2h,d,j=8.8hz),7.86(2h,d,j=8.4hz),7.93(2h,d,j=8.8hz),8.12(2h,d,j=9.2hz),8.60(2h,d,j=14.8hz).实施例92-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯基硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]碘化吲哚----参见合成方案5混合物i9-1:2-氨基乙基氨基甲酸叔丁酯的合成将溶解在二氯甲烷(400ml)中的boc2o(二碳酸二叔丁酯,6.49ml,27.9mmol)的溶液在室温下滴加到用二氯甲烷(50ml)稀释的乙二胺(11.32ml,168mmol)溶液中6小时。将反应溶液在室温下搅拌24小时,然后真空浓缩。浓缩液用2m碳酸钠水溶液(300ml)中稀释,然后用二氯甲烷(300ml)萃取两次。合并的有机层用硫酸镁干燥,真空浓缩,得到无色油状物2-氨基乙基氨基甲酸叔丁酯(4.28g,26.7mmol,96%)。1h-nmr(cdcl3,varian400mhz):δ1.16(2h,brs),1.45(9h,s),2.80(2h,t,j=5.8hz),3.15-3.23(2h,m),4.88(1h,brs).9-2:4,4'-二硫醚二苯甲酸的合成将碘溶于95%乙醇中至饱和后,将溶液在室温下缓慢滴加到溶于乙醇(32ml)的4-巯基苯甲酸(500mg,3.24mmol)溶液中。反应进行时,碘的红棕色消失,形成晶体,连续加入碘直到反应溶液的黄色不再消失。将生成的固体过滤,并用乙醇洗涤。过滤的晶体在50℃真空干燥,得到灰色固体4,4'-二硫基二苯甲酸(413mg,1.348mmol,41.6%)。1h-nmr(dmso-d6,varian400mhz):δ7.64(4h,d,j=7.6hz),7.93(4h,d,j=8.0hz),13.06(2h,s).9-3:n-[2-[[4-[[4-[2-(叔丁氧羰基氨基)乙基氨甲酰基]苯基]二硫烷基]苯甲酰基]氨基]乙基]氨基甲酸叔丁酯的合成将4,4'-二硫基二苯甲酸(200mg,0.653mmol)溶于二甲基甲酰胺(6.5ml),1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(375mg,1.96mmol),羟基苯并三唑(300mg,1.96mmol)和4-二甲基氨基吡啶(7.98mg,0.065mmol)中。将反应溶液在0℃下搅拌30分钟,然后向其中加入叔丁基-2-氨基乙基氨基甲酸酯(314mg,1.96mmol),在室温下搅拌3天。将反应溶液用乙酸乙酯稀释,然后依次用10%柠檬酸水溶液,饱和碳酸氢钠水溶液和盐水洗涤,然后真空浓缩。将所得固体用乙酸乙酯洗涤,得到白色固体n-[2-[[4-[[4-[2-(叔丁氧基羰基氨基)乙基氨甲酰基]苯基]二硫基]苯甲酰基]氨基]乙基]氨基甲酸叔丁酯(349mg,0.591mmol,90%)。1h-nmr(dmso-d6,varian400mhz):δ1.35(18h,s),3.04-3.10(4h,m),3.07(4h,q,j=6.0hz),3.26(4h,q,j=5.9hz),6.89(2h,t,j=5.4hz),7.60(4h,d,j=8.4hz),7.82(4h,d,j=8.0hz),8.44-8.53(2h,m).9-4:2-(4-巯基苯甲酰氨基)乙基氨基甲酸叔丁酯的合成在n-[2-[[4-[[4-[2-(叔丁氧基羰基氨基)乙基氨基甲酰基]苯基]二硫烷基]苯甲酰基]氨基]乙基]氨基甲酸叔丁酯(200mg,0.339mmol)溶于乙醇(3.4ml)和四氢呋喃(3.4ml)中后,在0℃下将nabh4(51.2mg,1.354mmol)分二次加入其中。将反应液的温度升至室温,然后搅拌2小时。将反应溶液真空浓缩后,向浓缩液中加入水和乙酸乙酯,然后使用2n盐酸将混合物酸化至ph4。分离的有机层用盐水洗涤后用硫酸钠干燥,然后真空浓缩,得到白色固体2-(4-巯基苯甲酰氨基)乙基氨基甲酸叔丁酯(218mg,0.736mmol)。所得化合物不经单独纯化用于下一步骤。1h-nmr(dmso-d6,varian400mhz):δ1.37(9h,s),3.08(2h,q,j=6.0hz),3.26(2h,q,j=6.3hz),,5.76(1h,d,j=13.2hz),6.91-6.93(1h,m),7.35(2h,d,j=8.4hz),7.70(2h,d,j=8.0hz),8.34-8.40(1h,m).9-5:n-(2-氨基乙基)-4-巯基苯甲酰胺盐酸盐的合成在0℃下,将4mhcl/1,4-二恶烷(sigma-aldrich,0.843ml,3.37mmol)溶液滴加到溶解于二氯甲烷(6.8ml)的2-(4-巯基苯甲酰氨基)乙基氨基甲酸叔丁酯(200mg,0.675mmol)溶液中。将反应溶液在室温下搅拌5小时,然后真空浓缩。向剩余的固体中加入乙醚(5ml)后,过滤固体,用乙醚洗涤,得到灰色固体n-(2-氨基乙基)-4-巯基苯甲酰胺盐酸盐(138mg,0.593mmol,88%)。1h-nmr(dmso-d6,varian400mhz):δ2.87(2h,q,j=5.9hz),3.49(2h,q,j=6.0hz),5.85(1h,s),7.38(2h,d,j=8.4hz),7.77(2h,d,j=8.4hz),7.95(3h,brs),8.65(1h,s).9-6:2-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯基硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物将n-(2-氨基乙基)-4-巯基苯甲酰胺盐酸盐(62.1mg,0.267mmol)和4-二甲基氨基吡啶(32.6mg,0.267mmol)加入到溶于二甲基甲酰胺(1.3ml)的2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(240mg,0.267mmol)溶液中,将混合物在室温下搅拌1小时。将反应溶液真空浓缩,然后浓缩液通过硅胶柱色谱法(二氯甲烷:甲醇=98:2至95:5)进行纯化,得到深蓝色固体2-((e)-2-((e)-2-(4-(2-氨基乙基甲酰胺基)苯硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(247mg,0.233mmol,87%)。1h-nmr(dmso-d6,varian400mhz):δ1.32-1.37(12h,m),1.65,1.72(12h,s,s),2.01-2.13(2h,m),2.35(3h,t,j=13.6hz),2.61(2h,t,j=6.4hz),2.86(2h,d,j=13.6hz),3.17-2.21(2h,m),3.72(3h,s),3.89(6h,s),4.30-4.40(4h,m),6.29(2h,d,j=14.4hz),7.27(2h,dd,j=9.2,2.4hz),7.41(2h,d,j=8.4hz),7.49(2h,d,j=2.4hz),7.70(2h,d,j=8.8hz),7.81(2h,d,j=8.4hz),7.97(2h,d,j=9.2hz),8.16(2h,d,j=9.6hz),8.33(1h,t,j=5.2hz),8.66(2h,d,j=14.4hz).实施例103-乙基-2-((e)-2-((e)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-(4-(2-异硫氰基乙基氨甲酰基)苯基硫基)-5-(1-甲氧基-2-甲基-1-氧代丙烷-2-基)环己-1-烯基)乙烯基)-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物----参见合成方案6化合物j在室温下,将二(1h-咪唑-1-基)甲硫酮(18mg,0.099mmol)加入到溶解于二甲基甲酰胺(1ml)的2-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯基硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(46mg,0.049mmol)的溶液中,将该混合物在室温下搅拌30分钟。将反应溶液真空浓缩,然后浓缩液通过硅胶柱色谱(二氯甲烷:甲醇=97:3至95:5)进行纯化,得到深蓝色固体3-乙基-2-((e)-2-((e)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)-2-(4-(2-异硫氰基乙基氨甲酰基)苯硫基)-5-(1-甲氧基-2-甲基-1-氧代丙-2-基)环己-1-烯基)乙烯基)-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(24.6mg,0.022mmol,45.3%)。1h-nmr(dmso-d6,varian400mhz):δ1.34(6h,t,j=7.2hz),1.37(6h,s),1.64,1.72(12h,s,s),2.08-2.16(1h,m),2.36(2h,t,j=14.4hz),2.92(2h,d,j=18.8hz),3.43-3.48(2h,m),3.72(3h,s),3.70-3.77(2h,m),3.89(6h,s),4.28-4.38(4h,m),6.29(2h,d,j=14.4hz),7.27(2h,dd,j=9.2,2.4hz),7.44(2h,d,j=8.0hz),7.48(2h,d,j=2.4hz),7.69(2h,d,j=9.2hz),7.82(2h,d,j=8.8hz),7.97(2h,d,j=8.8hz),8.14(2h,d,j=9.6hz),8.63-8.68(3h,m).实施例112-((e)-2-((e)-2-(4-(2-氨基乙基氨基甲酰基)苯硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物化合物k11-1:(e)-2-氯-3-(羟基亚甲基)环己-1-烯甲醛的合成将二甲基甲酰胺(11.8ml,153mmol)缓慢滴加到冷却至0℃的三氯化磷(11.4ml,122mmol)中,将反应溶液在室温下搅拌30分钟。向反应溶液中滴加在二甲基甲酰胺(61ml)中稀释的环己酮(3g,30.6mmol),混合物在55℃下搅拌2小时。将反应溶液冷却至室温,然后加入冰水混合物,接着搅拌24小时。将生成的固体过滤并用水和二异丙醚洗涤,得到黄色固体(e)-2-氯-3-(羟基亚甲基)环己-1-烯甲醛(3.07g,17.8mmol,58.2%)。1h-nmr(cdcl3,varian400mhz):δ1.55-1.62(2h,m),2.20-2.50(4h,m),3.35(1h,s),7.53(1h,s),10.09(1h,s),10.85(1h,s).11-2:(e)-n-(((e)-2-氯-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯胺氯化物的合成将(e)-2-氯-3-(羟基亚甲基)环己-1-烯甲醛(3.07g,17.8mmol)的乙醇(35.6ml)和二甲基甲酰胺(23.7ml)溶液冷却至0℃后,然后滴加浓盐酸(13.1ml,151mmol)。将苯胺(4.87ml,53.4mmol)在0℃下滴加到反应液中,并在0℃下搅拌30分钟。将反应溶液加入到冰水混合物中,然后过滤生成的固体,并用水和二异丙醚洗涤。过滤的固体真空干燥,得到紫色固体(e)-n-(((e)-2-氯-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯胺氯化物(6.69g,18.6mmol)。所得固体不分开纯化直接用于下一步骤。1h-nmr(dmso-d6,varian400mhz):δ1.82-1.90(2h,m),2.72-2.78(4h,m),7.25-7.92(3h,m),7.47(4h,t,j=8.0hz),7.60(4h,d,j=8.0hz),8.56(2h,s).11-3:合成2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物将乙酸钠(68.5mg,0.835mmol)溶液加入到溶解在乙醇(5.6ml)中的(e)-n-(((e)-2-氯-3–((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯胺氯化物(100mg,0.278mmol)和3-乙基-7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物(242mg,0.612mmol)的溶液中后,混合物加热回流3小时。将反应溶液真空浓缩,然后浓缩液通过硅胶柱色谱(二氯甲烷:甲醇=20:1,在100%二氯甲烷中)进行纯化,得到深蓝色固体2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(240mg,0.300mmol)。将所得化合物用于下一步骤,无需额外纯化。1h-nmr(dmso-d6,varian400mhz):δ1.36(6h,t,j=7.0hz),1.85-1.93(2h,m),1.93(12h,s),2.72-2.78(4h,m),3.91(6h,s),4.32-4.40(4h,m),6.33(2h,d,j=14.0hz),7.32(2h,dd,j=9.2,2.8hz),7.52(2h,d,j=2.8hz),7.73(2h,d,j=9.2hz),8.00(2h,d,j=8.8hz),8.23(2h,d,j=8.8hz),8.34(2h,d,j=14.8hz)11-4:合成2-((e)-2-((e)-2-(4-(2-氨基乙基氨基甲酰基)苯硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物将n-(2-氨基乙基)-4-巯基苯甲酰胺盐酸盐(69.9mg,0.300mmol)和4-二甲基氨基吡啶(32.7mg,0.3mmol)加入到溶于二甲基甲酰胺(6ml)中的2-((e)-2-((e)-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(240mg,0.300mmol)的溶液中后,将混合物在室温下搅拌1小时。将反应溶液真空浓缩,然后浓缩液通过氨基硅胶柱色谱(二氯甲烷:甲醇=20:1,在100%二氯甲烷中)进行纯化,得到深蓝色固体2-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯基硫基)-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(122mg,0.147mmol,48.8%)。1h-nmr(dmso-d6,varian400mhz):δ1.33(6h,t,j=7.0hz),1.69(12h,s),1.93-2.00(2h,m),2.59(2h,t,j=6.6hz),2.68-2.75(4h,m),3.12-3.20(2h,m),3.89(6h,s),4.27-4.35(4h,m),6.34(2h,d,j=14.8hz),7.27(2h,d,j=11.6hz),7.40(2h,d,j=8.4hz),7.48(2h,s),7.68(2h,d,j=8.8hz),7.81(2h,d,j=8.4hz),7.96(2h,d,j=9.2hz),8.15(2h,d,j=9.2hz),8.30-8.36(1h,m),8.67(2h,d,j=14.4hz).实施例122-((e)-2-((e)-2-(4-(2--氨基乙基氨基甲酰基)苯基硫基)-5-叔丁基-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h--苯并[e]吲哚鎓碘化物化合物l12-1:(e)-5-叔丁基-2-氯-3-(羟基亚甲基)环己-1-烯甲醛的合成将二甲基甲酰胺(5.02ml,64.8mmol)缓慢滴加到冷却至0℃的三氯化磷(4.83ml,51.9mmol)中,将反应溶液在室温下搅拌30分钟。将在二甲基甲酰胺(30ml)中稀释的4-叔丁基环己酮(2g,12.97mmol)滴加到反应溶液中,将混合物在55℃下搅拌2小时。将反应溶液冷却至室温后,加入冰水混合物,然后搅拌24小时。将生成的固体过滤,然后用水和二异丙醚洗涤,得到黄色固体的(e)-5-叔丁基-2-氯-3-(羟基亚甲基)环己-1-烯甲醛(2.71g,11.85mmol,91%)。1h-nmr(dmso-d6,varian400mhz):δ0.90(9h,s),1.21(1h,tt,j=12.2,3.8hz),1.76(2h,dd,j=15.6,12.4hz),2.75(2h,d,j=14.8hz),10.86(1h,s)12-2:((e)-n-(((e)-5-叔丁基-2-氯-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)氯化苯胺的合成将溶于乙醇(23.6ml)和二甲基甲酰胺(15.7ml)中的(e)-5-叔丁基-2-氯-3-(羟基亚甲基)环己-1-烯甲醛(2.7g,11.8mmol)的溶液冷却至0℃后,滴加浓盐酸(13.1ml,151mmol)。在0℃下将苯胺(3.23ml,35.4mmol)滴加到反应溶液中后,将反应溶液在0℃下搅拌30分钟。将反应溶液加入到冰水混合物中,然后过滤生成的固体,并用水和二异丙醚洗涤。将过滤的固体真空干燥,得到紫色固体(e)-n-(((e)-5-叔丁基-2-氯-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)氯化苯铵(3.0g,7.22mmol,61.2%)。1h-nmr(dmso-d6,varian400mhz):δ1.07(9h,s),1.49(2h,t,j=12.8hz),2.16(2h,t,j=14.0hz),3.05(2h,d,j=15.2hz),7.28(2h,t,j=7.2hz),7.48(4h,t,j=7.8hz),7.52-7.60(4h,m),8.52(2h,brs),11.23(1h,brs).12-3:2-((e)-2-((e)-5-叔丁基-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物的合成将乙酸钠(59.2mg,0.722mmol)溶液加入到溶解于乙醇(4.8ml)中的(e)-n-(((e)-5-叔丁基-2-氯-3-((苯基氨基)亚甲基)环己-1-烯基)亚甲基)苯胺氯化物(100mg,0.241mmol)和3-乙基-7-甲氧基-1,1,2-三甲基-1h-苯并[e]吲哚鎓碘化物(209mg,0.530mmol)的溶液中后,混合物加热回流3小时。将反应溶液真空浓缩,然后浓缩液通过硅胶柱色谱(二氯甲烷:甲醇=20:1,在100%二氯甲烷中)进行纯化,得到深蓝色固体2-((e)-2-((e)-5-叔丁基-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(254mg,0.297mmol)。将所得化合物用于下一步骤,无需额外纯化。1h-nmr(dmso-d6,varian400mhz):δ1.09(9h,s),1.37(6h,t,j=7.0hz),1.93(12h,s),2.21(2h,t,j=14.0hz),2.97(3h,d,j=12.8hz),3.91(6h,s),4.35-4.42(4h,m),6.34(2h,d,j=14.0hz),7.32(2h,dd,j=9.2,2.8hz),7.52(2h,d,j=2.4hz),7.73(2h,d,j=8.8hz),8.00(2h,d,j=8.8hz),8.23(2h,d,j=9.6hz),8.34(2h,d,j=14.8hz)12-4:2-((e)-2-((e)-2-(4-(2-氨基乙基氨基甲酰基)苯基硫基)-5-叔丁基-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h--苯并[e]吲哚鎓碘化物的合成将n-(2-氨基乙基)-4-巯基苯甲酰胺盐酸盐(69.1mg,0.297mmol)和4-二甲基氨基吡啶(36.3mg,0.297mmol)加入到溶于二甲基甲酰胺(6ml)中的2-((e)-2-((e)-5-叔丁基-2-氯-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(254mg,0.297mmol)的溶液中后,混合物在室温下搅拌1小时。然后将反应溶液真空浓缩后通过氨基硅胶柱色谱(二氯甲烷:甲醇=20:1,在100%二氯甲烷中)纯化浓缩液,得到深蓝色固体2-((e)-2-((e)-2-(4-(2-氨基乙基氨甲酰基)苯基硫基)-5-叔丁基-3-((e)-2-(3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚-2(3h)-亚基)亚乙基)环己-1-烯基)乙烯基)-3-乙基-7-甲氧基-1,1-二甲基-1h-苯并[e]吲哚鎓碘化物(74mg,0.083mmol,28.1%)。1h-nmr(dmso-d6,varian400mhz):δ1.13(9h,s),1.33(6h,t,j=7.0hz),1.69,1.72(12h,s,s),2.23-2.32(2h,m),3.02(2h,d,j=13.6hz),3.15-3.20(2h,m),3.89(6h,s),4.30-4.40(4h,m),6.35(2h,d,j=14.0hz),7.27(2h,dd,j=9.0,2.2hz),7.40(2h,d,j=8.4hz),7.48(2h,d,j=2.4hz),7.68(2h,d,j=9.2hz),7.81(2h,d,j=8.4hz),7.96(2h,d,j=8.8hz),8.15(2h,d,j=8.8hz),8.31(1h,t,j=5.2hz),8.67(2h,d,j=14.8hz).制备实施例1----制备纳米近红外荧光造影剂将实施例8的化合物h(2mg)分散在有机溶剂thf(5ml)中后,分散体系以缓慢滴加(0.1mg/sec)的方式加入到100ml的溶解10mg脂质的溶液中,进行杂交诱导反应,均质混合物杂交诱导处理30min以上,此后,进行超声处理10分钟,然后使用蒸发器快速除去有机溶剂,由此制备得到核-壳结构的纳米颗粒。在制备核-壳结构的颗粒中,实施例6的化合物f位于核心处,脂质位于壳体处,而脂质的疏水基团朝向核芯,并且其亲水基团朝向外部(参见图7的中间部分)。核-壳结构的颗粒的粒径为约50nm(参见图8)。为了将马来酰亚胺化学反应基团引入到制备的核-壳结构的纳米颗粒的表面,用6.874mm4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc)处理核-壳结构的纳米颗粒。马来酰亚胺化学反应基团可以容易地与硫醇基(-sh)形成共价键,从而可以容易地将所需的抗体,肽等引入到表面。然后,为了诱导癌细胞特异性识别和结合,癌细胞特异性抗体被引入到马来酰亚胺化学反应基团上,由此制备得到纳米近红外造影剂。根据本制备实施例制备的纳米近红外造影剂的吸收波长和发射波长示于图9。制备实施例2通过将实施例8的化合物h本身溶解在各种有机溶剂中制备造影剂,不制备成核-壳纳米颗粒。制备实施例3通过将实施例8的化合物h引入葡聚糖聚合物中制备造影剂(dex染料)。制备实施例4通过将实施例8的化合物h引入sio2中制备造影剂(sio2np-染料)。试验例1-评价制备实施例2的造影剂的光学性质制备实施例2中制备的造影剂的吸收强度,吸收波长,发射波长和量子产率(φf)示于表2中。表2如上表2所示,本发明的化合物的吸收波长和发射波长的波长带长,因此当用作造影剂时,可以进一步增加成像深度和深层组织诊断(深层组织成像)。此外,目前应用于临床实践的常规的吲哚菁绿基荧光造影剂具有2.58的量子效率(φf),但是通过分析显示本发明的化合物具有更高的量子效率,因而比常规造影剂具有更好的光学特性。试验例2–评估制备实施例1的造影剂的光学性质测量制备实施例1的纳米近红外造影剂的吸收强度,吸收波长,发射波长和量子产率(φf),测量结果示于表3中。如下表3所示,与制备实施例2不制造成纳米颗粒相比,含有核-壳结构的纳米颗粒造影剂的量子效率提高。表3溶剂吸收强度(a.u)吸收波长(nm)发射波长(nm)φf去离子水0.498509003.5试验例3--纳米近红外造影剂的光安全性评价确定制备实施例1-4中制备的造影剂的归一化强度。归一化强度是指在连续光照射下,经过一段时间后的荧光物质发射的强度与荧光物质最初发射的的强度的比值,因此,归一化强度是发光强度被削弱的程度的度量。测定结果证实:制备实施例1中制备的造影剂的光降解现象更多地减少(光漂白被抑制)而不是制备实施例2-4中制备的造影剂(如图10)。试验例4-纳米近红外造影剂的溶剂安全性评价作为通过uv-vis光谱分析评价制备例1~4中制备的纳米近红外造影剂的分散性的结果,将纳米近红外造影剂容易地长时间分散在水中(参照图11)。试验例5-纳米近红外造影剂的成像深度评价鸡胸肉中插入根据制备实施例1制备的近红外造影剂尖端(如图12),然后通过应用光声光谱仪(visualsonics,vevo3100产品)进行荧光分析。分析结果证实了本发明的造影剂的对比能力(对比度在10mm或更高,见图13)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1