与白介素-33(IL-33)介导的疾病有关的生物标志物及其用途的制作方法
本申请通过引用并入作为文件10187WO01-Sequence.txt(其创建于2016年10月4日且含有159,920字节)以计算机可读形式呈交的序列表。
技术领域
本发明涉及与IL-33的表达有关的哺乳动物中的特定生物标志物的鉴别和这些生物标志物用于鉴别患者的用途,所述患者具有或可能发生IL-33介导的疾病或障碍且其更可能对使用IL-33拮抗剂的疗法做出应答。本发明也涉及通过将IL-33拮抗剂施用给有此需要的患者和使用本文描述的生物标志物监测疗法的有效性来治疗患者中的IL-33介导的疾病或障碍的方法。
背景技术:
白介素-33(IL-33)是细胞因子的IL-1超家族的一个成员,主要由间质细胞(诸如上皮和内皮细胞)在促炎症性刺激后表达。IL-33是ST2的配体,所述ST2是一种与辅助蛋白IL-1RAcP相关的toll-样/白介素-1受体超家族成员(关于综述,参见,例如,Kakkar和Lee,Nature Reviews-Drug Discovery 7(10):827-840(2008),Schmitz等人,Immunity 23:479-490(2005);Liew等人,Nature Reviews-Immunology 10:103-110(2010);US 2010/0260770;US 2009/0041718)。在ST2/IL-1RAcP被IL-33活化后,通过下游分子诸如MyD88(骨髓细胞样分化因子88)和TRAF6(TNF受体相关因子6)触发信号传递级联,从而导致NFκB(核因子-κB)的活化,以及其它。
IL-33信号传递已经作为一种因子涉入多种疾病和障碍(Liew等人,Nature Reviews-Immunology 10:103-110(2010))。例如,当IL-33在宿主中保护免于蠕虫感染并且也通过促进TH2-型免疫应答来减少动脉粥样硬化时,它还可以通过扩增TH2细胞而促进哮喘的发病机制和通过肥大细胞活化而介导关节炎症、特应性皮炎和过敏反应。这样,IL-33可以是多种疾病的治疗干预的新靶标;例如,IL-33信号传递的阻断可以提供改善某些炎性疾病的多种致病特征的潜力。
在以下文献中描述了IL-33拮抗剂:美国专利号5,576,191;7,666,622;8,119,771;8,187,596;9,090,694;9,212,227;9,382,318;美国专利公开号2007/0042978;2009/0041718;2010/0260770;2012/0207752;2012/0263709;2014/0140954;2014/0271642;2014/0212412;欧洲专利或专利申请号1725261B1;2069784A1;2152740A1;2283860A2;2475388A1;和PCT公开号WO05/079844;WO08/132709;WO08/144610;WO09/053098;WO11/031600;WO14/152195和WO14/164959。
降钙素(CT)是一种多肽激素,据信主要由甲状腺的滤泡旁细胞产生(Foster,G.V.,等人,(1964),Nature 202:1303-1305)。CT是位于染色体11上的CALCA基因的产物。CALCA基因编码多肽原降钙素(PCT)和PCT基因相关肽α(proCGRPα),它们通过选择性剪接而差别表达(Christ-Crain,M.等人(2008),Crit Care Med 36:1684-1687;Hoff,AO,等人(2002),J.Clin.Invest.110:1849-1857)。降钙素(CT)源自较大前体原降钙素(PCT,116个氨基酸),后者被切割成未成熟的降钙素(33个氨基酸)并然后被切割成成熟的降钙素,即由32个氨基酸组成的3.5-kd肽的单体。CT主要由神经内分泌细胞诸如甲状腺的C细胞和肺的神经内分泌细胞(PNEC)通过蛋白水解性裂解在生产细胞的分泌颗粒中产生,然后作为成熟的CT多肽释放。表达calca基因的其它细胞包括肥大细胞、背路神经节细胞(dorsal route ganglion cell,DRG)和脊髓细胞。循环降钙素前体的多种形式存在于健康和患病个体的血清中(Becker K.等人(2004),J Clin Endocrinol Metab 89:1512-1525)。
降钙素基因相关肽(CGRP)是降钙素家族肽的一个成员。α-CGRP是从位于染色体11上的降钙素/CGRP基因的选择性剪接形成的37-氨基酸肽(Amara,SG,等人,(1982),Nature,298(5871):240-244)。
CT起减少血液钙的作用,抑制破骨细胞和骨质吸收,与甲状旁腺激素(PTH)的活性相反(Naot,D.和J.Cornish(2008),Bone 43(5):813-818)。体内和体外实验提示,CT的主要生理功能是在钙应激状态(诸如在妊娠、生长或哺乳过程中)与高钙血症做斗争(Hoff,A.O.,等人,(2002),J Clin Invest 110(12):1849-1857;Zaidi,M.,等人,(2002),J Clin Invest 110(12):1769-1771)。在诊断上,CT被用作甲状腺髓样癌(MTC)的生物标志物。CT肽的正常循环水平较低,但是在生理条件下,这些水平全身性地或局部地增加。高CT水平指示MTC的存在,并且被用于评价外科手术摘除的效力和复发。CT也在C-细胞增生、肺和胰腺肿瘤、肾功能衰竭和甲状腺自身免疫病中升高(Becker,K.L.,等人,(2004).J Clin Endocrinol Metab 89(4):1512-1525)。
迄今为止,尚未鉴别出这样的生物标志物,其用于鉴别具有或易于发生IL-33介导的疾病或障碍的患者,或确定患者对使用IL-33拮抗剂的疗法做出应答的可能性。尽管已经鉴别出在炎性病症或变态反应的治疗中表现出希望的IL-33拮抗剂,但是需要可以预测抗-IL-33疗法的效力的生物标志物来有效地鉴别和选择对抗-IL-33疗法做出有利应答的患者亚群。因此,在本领域中存在一个未得到满足的关于鉴别和验证施用抗-IL-33疗法的具有炎性病症或变态反应的患者中的预测和预后生物标志物的需要。
技术实现要素:
根据本发明的某些方面,提供了用于治疗、预防和/或减轻受试者中白介素-33(IL-33)介导的疾病或障碍的症状的严重程度或持续时间的方法。本发明的方法包括给有此需要的受试者施用包含治疗有效量的白介素-33(IL-33)拮抗剂的药物组合物。
在本发明的一个实施方案中,所述IL-33拮抗剂是特异性地结合IL-33的抗体或其抗原结合片段。
在本发明的一个实施方案中,所述IL-33拮抗剂是如本文中所述的基于受体的IL-33的拮抗剂,诸如IL-33阱。
本发明还提供了特定生物标志物的鉴别,所述特定生物标志物与遭受IL-33介导的疾病或障碍的受试者中的IL-33的表达有关。在本发明的上下文中可以评价和/或测量的与IL-33介导的疾病或障碍有关的示例性生物标志物包括、但不限于由CALCA基因编码的多肽,包括降钙素、原降钙素和降钙素基因相关肽(CGRP)。在一个实施方案中,在本发明的上下文中可以评价和/或测量的与IL-33介导的疾病或障碍有关的生物标志物是降钙素。在本发明的上下文中可以评价和/或测量的与IL-33介导的疾病或障碍有关的其它生物标志物包括、但不限于:抵抗素-样α(RETNA);趋化因子(C-C基序)配体8(Ccl8);血清淀粉样蛋白A3(Saa3);Gm1975(BC117090);杀伤细胞凝集素-样受体(Kirg1);stefin A1(Csta);跨膜4-结构域(Ms4a8a);趋化因子(C-C基序)配体11(Ccl11);和丝氨酸(或半胱氨酸)肽(Serpina3f)。
在一个有关的方面,本发明提供了遭受IL-33介导的疾病或障碍的受试者的血清中的至少一种生物标志物的表达,所述生物标志物与来自所述受试者的至少一个组织样品中的IL-33表达水平相关。
在一个实施方案中,所述与至少一个组织样品中的IL-33表达水平有关的血清生物标志物是降钙素。
在一个特定实施方案中,所述与至少一个组织样品中的IL-33表达水平有关的血清生物标志物是原降钙素。
在一个有关的实施方案中,所述与至少一个组织样品中的IL-33表达水平有关的血清生物标志物是降钙素基因相关肽(CGRP)。
在另一个有关的方面,本发明提供了一种用于治疗受试者中白介素-33(IL-33)介导的疾病或障碍的方法,所述方法包括:(a)选择受试者,其在治疗之前或在治疗时表现出升高的与IL-33介导的疾病或障碍有关的至少一种生物标志物的水平,和(b)给所述受试者施用包含治疗有效量的白介素-33拮抗剂的药物组合物。
根据本发明的一个有关方面,提供了用于治疗IL-33介导的疾病或障碍的方法,其包括给受试者施用包含治疗有效量的IL-33拮抗剂的药物组合物,其中所述药物组合物向所述受试者的施用导致所述受试者中与IL-33介导的疾病或障碍有关的至少一种生物标志物的减少。
在一个实施方案中,所述在遭受IL-33介导的疾病或障碍的受试者中升高的生物标志物是降钙素,且所述IL-33拮抗剂是特异性地结合IL-33的单克隆抗体。
本发明还提供了用于降低受试者中一种或多种IL-33介导的疾病或障碍相关的生物标志物的水平的方法,其导致改善受试者中一种或多种IL-33介导的疾病或障碍相关的参数,其中所述方法包括给有此需要的受试者施用单个初始剂量的包含IL-33拮抗剂的药物组合物。在某些实施方案中,本发明提供了施用一个或多个第二剂量的包含IL-33拮抗剂的药物组合物,其中所述施用导致受试者中一种或多种本文描述的生物标志物的水平的进一步下降和一种或多种IL-33介导的疾病或障碍相关的参数的进一步改善。在一个实施方案中,在存在于具有IL-33介导的疾病或障碍的受试者的血清中的生物标志物的水平和疾病或障碍相关的参数(例如嗜酸性粒细胞或嗜中性粒细胞向受试者的肺中的浸润或受试者的肺中的细胞因子水平(例如IL-5)的增加)的严重程度之间存在强关联。在某些实施方案中,所述组织(例如肺)中的IL-33的水平与疾病或障碍相关的参数的严重程度相关。在一个实施方案中,所述IL-33拮抗剂是特异性地结合IL-33的人单克隆抗体。在一个实施方案中,所述IL-33拮抗剂是如本文中所述的IL-33阱。
在一个有关的方面,本发明提供了用于治疗受试者中的IL-33介导的疾病或障碍的方法,所述方法包括给所述受试者施用药物组合物,其包含治疗有效量的特异性地结合IL-33的抗体或其抗原结合片段,其中所述受试者已经被诊断出具有IL-33介导的疾病或障碍且还已经被选择进行治疗,所述选择基于与生物标志物的参比水平(例如,诊断出具有IL-33介导的疾病或障碍的受试者子集中的生物标志物的表达和/或健康受试者中的生物标志物的表达)相比,所述受试者在治疗之前表现出升高的至少一种IL-33介导的疾病或障碍相关的生物标志物的水平。
在另一个有关的方面,本发明还提供了通过给所述受试者施用药物组合物来治疗IL-33介导的疾病或障碍的方法,所述药物组合物包含治疗有效量的特异性地结合IL-33的抗体或其抗原结合片段,其中所述受试者已经被诊断出具有IL-33介导的疾病或障碍,已经用抗-IL33拮抗剂治疗了确定的时间段,且已经被选择用IL-33拮抗剂进一步治疗,所述选择基于在治疗确定的时间段以后表现出至少一种生物标志物(例如,降钙素、原降钙素或降钙素基因相关肽(CGRP))的表达,其中基于与在用抗-IL-33拮抗剂治疗之前受试者中的相应生物标志物的表达水平的对比来确定所述生物标志物的表达。
本发明还提供了一种用于鉴别遭受IL-33介导的疾病或障碍的受试者的方法,所述受试者可能对使用IL-33拮抗剂的疗法做出有利应答,所述方法包括从所述受试者获得样品和测量所述样品中的降钙素水平;其中与没有遭受IL-33介导的疾病或障碍的受试者中的较低降钙素水平相比升高的降钙素水平将所述患者鉴别为可能对使用IL-33拮抗剂的疗法做出有利应答的患者。
在某些实施方案中,通过测量组织样品中原降钙素或降钙素基因相关肽(CGRP)的水平,可以鉴别可能对使用IL-33拮抗剂的疗法做出有利应答的受试者,其中与没有遭受IL-33介导的疾病或障碍的受试者中的较低原降钙素或CGRP水平相比升高的原降钙素或降钙素基因相关肽(CGRP)的水平将该患者鉴别为可能对使用IL-33拮抗剂的疗法做出有利应答的患者。
在另一个有关的方面,本发明提供了一种确定受试者是否可能具有或可能发生IL-33介导的疾病或障碍的方法,所述方法包括从所述受试者获得样品和测量所述样品中的降钙素水平;其中与参比标准相比升高的降钙素水平将所述患者鉴别为可能具有或发生IL-33介导的疾病或障碍的患者。
在某些实施方案中,本发明提供了一种确定受试者是否可能具有或可能发生IL-33介导的疾病或障碍的方法,所述方法包括从所述受试者获得样品和测量所述样品中的原降钙素或CGRP的水平;其中与两种生物标志物中的任一种的参比标准相比升高的原降钙素或CGRP水平将所述患者鉴别为可能具有或发生IL-33介导的疾病或障碍的患者。用于测量以上生物标志物中的任一种的水平的方法是本领域技术人员已知的。
来自所述受试者的样品可以是固体组织样品、细胞样品或血液样品。所述固体组织样品可以选自心脏、肾、肝、肺、结肠和脾。所述细胞样品可以是背根神经节细胞样品、痰细胞样品、支气管肺泡灌洗细胞样品、鼻息肉细胞样品、粪便细胞样品、肺、结肠、心脏、肾、皮肤活组织检查或脾活组织检查细胞样品。所述血液样品可以是全血、血浆或血清。
在一个实施方案中,要用在本发明的方法中的IL-33拮抗剂是分离的特异性地结合人白介素-33(IL-33)的人单克隆抗体或其抗原结合片段,其中所述抗体或抗原结合片段包含:(a)重链可变区(HCVR)的互补性决定区(CDR),其具有选自SEQ ID NO:2、18、34、50、66、82、98、114、130、146、162、178、194、210、226、242、258、274、290和308的氨基酸序列;和(b)轻链可变区(LCVR)的CDR,其具有选自SEQ ID NO:10、26、42、58、74、90、106、122、138、154、170、186、202、218、234、250、266、282、298和316的氨基酸序列。
在一个实施方案中,要用在本发明的方法中的IL-33拮抗剂是分离的特异性地结合人白介素-33(IL-33)的人单克隆抗体或其抗原结合片段,其中所述抗-IL-33抗体或其抗原结合片段包含选自SEQ ID NO:2/10、18/26、34/42、50/58、66/74、82/90、98/106、114/122、130/138、146/154、162/170、178/186、194/202、210/218、226/234、242/250、258/266、274/282、290/298和308/316的HCVR/LCVR氨基酸序列对的重链和轻链CDR。
在一个实施方案中,要用在本发明的方法中的IL-33拮抗剂是分离的特异性地结合人白介素-33(IL-33)的人单克隆抗体或其抗原结合片段,其中所述抗体或抗原结合片段包含分别选自SEQ ID NO:4-6-8-12-14-16、20-22-24-28-30-32、36-38-40-44-46-48、52-54-56-60-62-64、68-70-72-76-78-80、84-86-88-92-94-96、100-102-104-108-110-112、116-118-120-124-126-128、132-134-136-140-142-144、148-150-152-156-158-160、164-166-168-172-174-176、180-182-184-188-190-192、196-198-200-204-206-208、212-214-216-220-222-224、228-230-232-236-238-240、244-246-248-252-254-256、260-262-264-268-270-272、276-278-280-284-286-288、292-294-296-300-302-304、和310-312-314-318-320-322的HCDR1-HCDR2-HCDR3-LCDR1-LCDR2-LCDR3结构域。
在一个实施方案中,要用在本发明的方法中的IL-33拮抗剂是分离的特异性地结合人白介素-33(IL-33)的人单克隆抗体或其抗原结合片段,其中所述抗体或抗原结合片段包含:(a)重链可变区(HCVR),其具有选自SEQ ID NO:2、18、34、50、66、82、98、114、130、146、162、178、194、210、226、242、258、274、290和308的氨基酸序列;和(b)轻链可变区(LCVR),其具有选自SEQ ID NO:10、26、42、58、74、90、106、122、138、154、170、186、202、218、234、250、266、282、298和316的氨基酸序列。
在一个实施方案中,要用在本发明的方法中的IL-33拮抗剂是分离的基于IL-33受体的拮抗剂(例如IL-33阱),其包含与多聚化结构域(M)连接的第一个IL-33结合结构域(D1),其中D1包含ST2蛋白的IL-33-结合部分。在一个实施方案中,所述IL-33阱还包含一个或多个另外的选自D2、D3和D4的IL-33结合结构域。
在一个实施方案中,所述基于IL-33受体的拮抗剂包含ST2蛋白的IL-33-结合部分、IL-1RAcP蛋白的细胞外结构域或其它IL-33结合结构域。
在一个实施方案中,所述基于IL-33受体的拮抗剂是包含选自SEQ ID NO:323、324、325、326和335的氨基酸序列的IL-33阱。
在一个实施方案中,本发明的方法提供了有效量的第二种治疗剂的施用,所述第二种治疗剂可用于减少IL-33介导的疾病或障碍的至少一种症状。
在一个实施方案中,所述第二种治疗剂选自非甾体类抗炎剂(NSAID)、皮质类固醇、支气管扩张剂、抗组胺剂、肾上腺素、解充血药、胸腺基质淋巴细胞生成素(TSLP)拮抗剂、IL-13拮抗剂、IL-4拮抗剂、IL-4/IL-13双拮抗剂、IL-5拮抗剂、IL-6拮抗剂、IL-12/23拮抗剂、IL-22拮抗剂、IL-25拮抗剂、IL-17拮抗剂、IL-31拮抗剂、口服PDE4抑制剂和另一种IL-33拮抗剂或不同的基于抗体或受体的IL-33拮抗剂。
在一个实施方案中,本发明提供了用选自抗-IL-33抗体或IL-33阱的IL-33拮抗剂对遭受IL-33介导的疾病或障碍的受试者的治疗,其可以与上面指出的第二种治疗剂中的任意一种或多种联合使用,其中通过评估选自降钙素(Calca)、原降钙素、降钙素基因相关肽(CGRP)、抵抗素-样α(RETNA)、趋化因子(C-C基序)配体8(Ccl8)、血清淀粉样蛋白A 3(Saa3)、Gm1975(BC117090)、杀伤细胞凝集素-样受体(Kirg1)、stefin A1(Csta)、跨膜4-结构域(Ms4a8a)、趋化因子(C-C基序)配体11(Ccl11)和丝氨酸(或半胱氨酸)肽(Serpina3f)的至少一种生物标志物的水平可以监测这些药剂的治疗的有效性。
在一个实施方案中,所述生物标志物是具有IL-33介导的疾病或障碍的受试者的血清中的降钙素和降钙素水平增加,且血清降钙素的增加与受试者的肺中增加的降钙素和IL-33水平相关。
在一个实施方案中,在用抗-IL-33拮抗剂治疗以后,具有IL-33介导的疾病或障碍的受试者的血清中增加的降钙素水平降低至参比范围水平。
在一个实施方案中,基于在治疗之前或在治疗时表现出大于约5pg/ml、大于约10pg/ml、大于约50pg/ml或大于约100pg/ml的平均血清降钙素水平,选择遭受IL-33介导的疾病或障碍的受试者用IL-33拮抗剂治疗。
在一个实施方案中,基于在治疗之前或在治疗时表现出大于约0.15ng/ml、大于约1.0ng/ml、大于约5ng/ml、大于约10ng/ml、大于约50ng/ml或大于约100ng/ml的平均血清原降钙素水平,选择遭受IL-33介导的疾病或障碍的受试者用IL-33拮抗剂治疗。
在一个实施方案中,基于在治疗之前或在治疗时表现出大于约45pg/ml、大于约100pg/ml、大于约250pg/ml或大于约500pg/ml的平均血清降钙素基因相关肽(CGRP)水平,选择遭受IL-33介导的疾病或障碍的受试者用IL-33拮抗剂治疗。
在某些实施方案中,本发明的方法提供了IL-33介导的疾病或障碍的治疗,所述IL-33介导的疾病或障碍是选自哮喘、变态反应、变应性鼻炎、变应性气道炎症、特应性皮炎(AD)、慢性阻塞性肺疾病(COPD)、炎性肠病(IBD)、多发性硬化、关节炎、银屑病、嗜酸性粒细胞性食管炎、嗜酸性粒细胞性肺炎、嗜酸性粒细胞性银屑病、嗜酸细胞增多综合征、移植物抗宿主病、葡萄膜炎、心血管疾病、疼痛、多发性硬化、狼疮、血管炎、慢性特发性荨麻疹和伴有多血管炎的嗜酸性粒细胞性肉芽肿病(丘斯综合征)的炎性疾病或障碍。
在一个实施方案中,要治疗的IL-33介导的疾病或障碍是变态反应,且基于超过正常的降钙素水平的增加(例如基于生物标志物的参比水平,如通过健康受试者的确定值与诊断出IL-33介导的疾病或障碍的受试者的对比所确定的)选择为IL-33拮抗剂治疗而选择的受试者,其中所述IL-33拮抗剂治疗包括施用药物组合物,其包含治疗有效量的特异性地结合IL-33的单克隆抗体且包含SEQ ID NO:274/282的HCVR/LCVR氨基酸序列对,且其中所述施用导致至少一种与IL-33疾病或障碍有关的症状的改善或至少一种疾病相关参数的改善;且其中所述降钙素水平恢复至通过与参比标准的对比所确定的正常范围。
在一个实施方案中,要治疗的IL-33介导的疾病或障碍是变态反应,且基于血清降钙素水平的增加(如通过与参比标准的对比所确定的)选择为IL-33拮抗剂治疗而选择的受试者,其中所述降钙素水平与所述受试者中IL-33水平的增加相关,或与所述受试者中至少一种疾病参数的增加相关,且其中使用包含抗体的结合测定确定IL-33水平的增加,所述抗体特异性地结合人IL-33且包含SEQ ID NO:274/282的HCVR/LCVR氨基酸序列对。
本发明还包括在上面或在本文中讨论的IL-33拮抗剂(例如,IL-33阱)、抗-IL-33抗体和药物组合物用于治疗IL-33介导的疾病或障碍、或减轻IL-33介导的疾病或障碍的症状的用途。本发明还包括在上面或在本文中讨论的IL-33拮抗剂(例如,IL-33阱)、抗-IL-33抗体和药物组合物在药物制备中的用途,所述药物用于治疗IL-33介导的疾病或障碍、或减轻IL-33介导的疾病或障碍的症状。
本发明还包括在上面或在本文中讨论的实施方案的任意组合。本发明的特定实施方案将从接下来的详细描述的综述显而易见。
附图说明
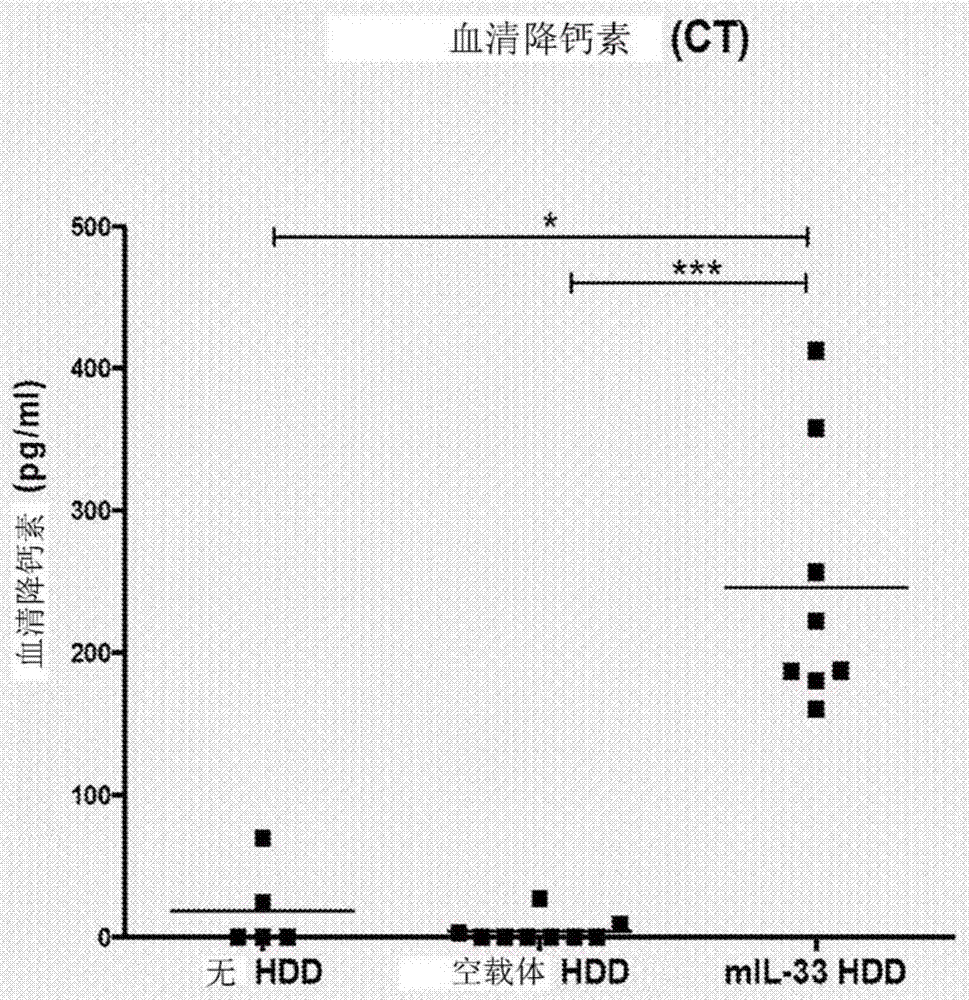
图1A和1B:显示了在小鼠IL-33HDD实验中的小鼠血清IL-33(图1A)和小鼠降钙素(CT)水平(图1B)。
图2:显示了慢性HDM模型中的小鼠降钙素(Calca)基因表达。
图3:显示了在慢性HDM模型中血清和肺降钙素(CT)水平之间的关联。
图4:显示了在慢性HDM模型中血清降钙素(CT)和肺IL-33水平的关联。
图5A、5B和5C:显示了在慢性HDM模型中受抗-IL-33治疗影响的参数。图5A:肺嗜中性粒细胞的频率;图5B:肺嗜酸性粒细胞的频率;图5C:肺IL-5水平。
图6A、6B和6C:显示了在慢性HDM模型中血清降钙素(CT)和受抗-IL-33治疗影响的参数的关联。图6A:血清CT水平和肺嗜中性粒细胞的频率之间的关联;图6B:血清CT水平和肺嗜酸性粒细胞的频率之间的关联;图6C:血清CT和肺IL-5蛋白水平之间的关联。
图7A、7B和7C:显示了在慢性HDM模型中肺IL-33水平和受抗-IL-33治疗影响的参数的关联。图7A:肺IL-33水平和肺嗜中性粒细胞的频率之间的关联;图7B:肺IL-33水平和肺嗜酸性粒细胞的频率之间的关联;图7C:肺IL-33和肺IL-5蛋白水平之间的关联。
具体实施方式
在描述本发明之前,应当理解,本发明不限于描述的特定方法和实验条件,因为这样的方法和条件可以变化。还应当理解,在本文中使用的术语仅仅用于描述具体实施方案的目的,无意成为限制性的,因为本发明的范围仅由所附权利要求书限定。
除非另外定义,在本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解相同的含义。如本文中使用的,当参考特定列举的数值使用时,术语“约”是指,所述值可以从列举的值变化不超过1%。例如,如本文中使用的,表述“约100”包括99和101和在之间的所有值(例如,99.1、99.2、99.3、99.4等)。本文中使用的术语“治疗”、“处理”等是指减轻症状、消除症状的原因(暂时地或永久地)、或预防或减慢提及的障碍或病症的症状的出现。
尽管与本文描述的那些类似或等同的任何方法和材料可以用于实践本发明,但是现在描述优选的方法和材料。
与IL-33介导的疾病或障碍有关的生物标志物
本发明包括涉及与IL-33介导的疾病或障碍有关的生物标志物的使用、定量和分析的方法。
“IL-33介导的疾病或障碍”可以选自任何炎性疾病或障碍,例如,但不限于,哮喘、变态反应、变应性鼻炎、变应性气道炎症、特应性皮炎(AD)、慢性阻塞性肺疾病(COPD)、炎性肠病(IBD)、多发性硬化、关节炎、银屑病、嗜酸性粒细胞性食管炎、嗜酸性粒细胞性肺炎、嗜酸性粒细胞性银屑病、嗜酸细胞增多综合征、移植物抗宿主病、葡萄膜炎、心血管疾病、疼痛、多发性硬化、狼疮、血管炎、慢性特发性荨麻疹和伴有多血管炎的嗜酸性粒细胞性肉芽肿病(丘斯综合征)。
所述哮喘可以选自变应性哮喘、非变应性哮喘、严重的顽固性哮喘、哮喘恶化、病毒诱导的哮喘或病毒诱导的哮喘恶化、类固醇抵抗型哮喘、类固醇敏感型哮喘、嗜酸性粒细胞性哮喘或非嗜酸性粒细胞性哮喘和以气道炎症或气道高反应性(AHR)为特征的其它有关障碍。
所述COPD可以是部分地与香烟烟气、空气污染、职业性化学物质、变态反应或气道高反应性有关或由其造成的疾病或障碍。
所述变态反应可以与食品、花粉、霉菌、尘螨、动物或动物毛皮垢屑有关。
所述IBD可以选自溃疡性结肠炎、克罗恩氏病、胶原性结肠炎、淋巴细胞性结肠炎、缺血性结肠炎、改道性结肠炎、贝赫切特综合征、感染性结肠炎、不确定性结肠炎和以大肠或结肠的粘膜层炎症为特征的其它障碍。
所述关节炎可以选自骨关节炎、类风湿性关节炎和银屑病关节炎。
本文中使用的术语“IL-33介导的疾病或障碍相关的生物标志物”、或“与IL-33介导的疾病或障碍有关的生物标志物”是指在遭受IL-33介导的疾病或障碍的患者中存在的或可检测的任何生物应答、细胞类型、参数、蛋白、多肽、酶、酶活性、代谢物、核酸、碳水化合物或其它生物分子,其水平或量不同于(例如,大于或小于)在非-IL-33介导的疾病或障碍患者中存在的或可检测的标志物的水平或量。示例性的IL-33介导的疾病或障碍相关的生物标志物包括、但不限于,例如,由CALCA基因编码的多肽,包括降钙素、原降钙素或降钙素基因相关肽(CGRP)。其它的与IL-33介导的疾病或障碍有关的生物标志物包括、但不限于:抵抗素-样α(RETNA);趋化因子(C-C基序)配体8(Ccl8);血清淀粉样蛋白A 3(Saa3);Gm1975(BC117090);杀伤细胞凝集素-样受体(Kirg1);stefin A1(Csta);跨膜4-结构域(Ms4a8a);趋化因子(C-C基序)配体11(Ccl11);和丝氨酸(或半胱氨酸)肽(Serpina3f)。
用于检测和/或定量这样的生物标志物的方法是本领域已知的;用于测量这样的生物标志物的试剂盒可得自多种商业来源;并且多种商业诊断实验室提供服务,它们也提供这样的生物标志物的测量。
在一个实施方案中,所述生物标志物是降钙素,且降钙素的水平在遭受或易于发生IL-33介导的疾病或障碍的受试者中增加。在一个实施方案中,所述生物标志物是原降钙素,且原降钙素的水平在遭受或易于发生IL-33介导的疾病或障碍的受试者中增加。在一个有关的实施方案中,所述生物标志物是降钙素基因相关肽(CGRP),且CGRP的水平在遭受或易于发生IL-33介导的疾病或障碍的受试者中增加。使用本领域技术人员已知的任意方法可以评估降钙素、原降钙素或CGRP的水平。检测方法包括使用任何检测标记(诸如放射性同位素标记、酶标记或化学发光标记)的免疫测定。结果的解释必须考虑使用的方法、受试者的年龄、性别和重量(参见d′Herbomez,M.等人,(2007),Eur.J.Endocrinology 157:749-755)。通常,男性中的降钙素的“正常”参考值小于约16pg/mL,且对于女性而言小于约8pg/mL。近年来,Camacho等人开发了一种新的针对血清降钙素的免疫荧光测定,并且已经在来自794位患者的样品中验证了它。使用该测定得到的结果表明,男性的正常截止范围小于11.1pg/mL,且对于女性而言小于5.5pg/mL(参见Camacho,等人,(2014),Eur.Thyroid J.,Jun;3(2):117-24。成年人和大于72小时的儿童中的原降钙素的“参比”范围是约0.15ng/mL或更低。在健康的成年人中,原降钙素的参比范围低于检测水平(参见Dandona,P.等人(1994),J.Clin.Endocrino1.Metab.Dec.79(6):1605-8.)。健康个体中的CGRP的正常范围通常低于约45pg/ml。这样,在此以上的值可以视作指示疾病或障碍的存在。
“IL-33有关的疾病参数”可以包括、但不限于嗜中性粒细胞、嗜酸性粒细胞或ST2+CD4T细胞向组织(例如肺)的浸润的增加,杯形细胞组织转化,组织中ST2水平的增加,或组织中细胞因子(诸如IL-1β、IL-4、IL-5、IL-6、IL-9、IL-13、IL-33、MCP-1、TNFα)的水平的增加。
根据本发明的某些方面,提供了用于治疗IL-33介导的疾病或障碍的方法,其包括:(a)选择受试者,其在治疗之前或在治疗时表现出预示疾病状态的至少一种生物标志物的水平,和(b)给所述受试者施用包含治疗有效量的IL-33拮抗剂的药物组合物。在本发明的该方面的一个实施方案中,基于升高的降钙素水平选择受试者。在一个实施方案中,所述IL-33拮抗剂是分离的特异性地结合IL-33的单克隆抗体或基于受体的IL-33拮抗剂(如本文中所述的IL-33阱)。
根据本发明的其它方面,提供了用于治疗IL-33介导的疾病或障碍的方法,其包括给受试者施用包含治疗有效量的IL-33拮抗剂的药物组合物,其中所述药物组合物向所述受试者的施用导致与所述施用之前所述受试者中的生物标志物的水平相比,在所述药物组合物施用以后的时间至少一种生物标志物(例如,降钙素(Calca)、原降钙素、降钙素基因相关肽(CGRP)、抵抗素-样α(RETNA)、趋化因子(C-C基序)配体8(Ccl8)、血清淀粉样蛋白A 3(Saa3)、Gml975(BC117090)、杀伤细胞凝集素-样受体(Kirg1)、stefin A1(Csta)、跨膜4-结构域(Ms4a8a)、趋化因子(C-C基序)配体11(Ccl11)和丝氨酸(或半胱氨酸)肽(Serpina3f)等)的减少。
如本领域普通技术人员会明白的,通过对比以下(i)和(ii),可以确定与IL-33介导的疾病或障碍有关的生物标志物的增加或减少:(i)在施用包含IL-33拮抗剂的药物组合物以后的确定时间点,在受试者中测得的生物标志物的水平,(ii)在施用包含IL-33拮抗剂的药物组合物之前,在患者中测得的生物标志物的水平(即,“基线测量”)。测量生物标志物的确定时间点可以是,例如,在施用包含IL-33拮抗剂的药物组合物以后约4小时、8小时、12小时、1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、14天、15天、20天、35天、40天、50天、55天、60天、65天、70天、75天、80天、84天、85天或更久。
根据本发明的某些特定实施方案,在施用包含IL-33拮抗剂(例如,抗-IL-33抗体或基于IL-33受体的拮抗剂(IL-33阱)的药物组合物以后,受试者可以表现出降钙素、原降钙素、CGRP、抵抗素-样α(RETNA)、趋化因子(C-C基序)配体8(Ccl8)、血清淀粉样蛋白A3(Saa3)、Gml975(BC117090)、杀伤细胞凝集素-样受体(Kirg1)、stefin A1(Csta)、跨膜4-结构域(Ms4a8a)、趋化因子(C-C基序)配体11(Ccl11)和丝氨酸(或半胱氨酸)肽(Serpina3f)中的一种或多种的水平的下降。例如,在施用第一、第二、第三或第四剂包含约抗-hIL-33拮抗剂的药物组合物以后约第4天、第8天、第14天、第15天、第22天、第25天、第29天、第36天、第43天、第50天、第57天、第64天、第71天、第84天或第85天。施用给患者的抗-IL-33拮抗剂的剂量可以随患者的年龄和大小、靶疾病、状况、施用途径等而变化。通常根据体重或体表面积计算优选剂量。当将IL-33拮抗剂用于治疗成年患者中与IL-33活性有关的病症或疾病时,可能有利的是静脉内地施用抗-IL-33拮抗剂,通常在约0.01至约20mg/kg体重的剂量,更优选约0.02至约7、约0.03至约5、或约0.05至约3mg/kg体重。
根据本发明的受试者可以表现出下述生物标志物中的至少一种的减少:由CALCA基因编码的多肽,其选自降钙素、原降钙素和CGRP,或可以表现出下述生物标志物中的至少一种的减少:抵抗素-样α(RETNA);趋化因子(C-C基序)配体8(Ccl8);血清淀粉样蛋白A 3(Saa3);Gm1975(BC117090);杀伤细胞凝集素-样受体(Kirg1);stefin A1(Csta);跨膜4-结构域(Ms4a8a);趋化因子(C-C基序)配体11(Ccl11);和丝氨酸(或半胱氨酸)肽(Serpina3f),所述减少是相对于基线的约1%、2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多(其中将“基线”定义为在即将第一次施用之前受试者中的生物标志物的水平)。类似地,在施用第一、第二、第三或第四剂抗-hIL-33拮抗剂的药物组合物以后约第4天、第8天、第14天、第15天、第22天、第25天、第29天、第36天、第43天、第50天、第57天、第64天、第71天、第84天或第85天,根据本发明的受试者可以表现出至少一种上述生物标志物相对于基线约1%、2%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多的减少(其中将“基线”定义为在即将第一次施用之前受试者中的生物标志物的水平)。
本发明还包括用于确定受试者是否是包含IL-33拮抗剂的药物组合物的施用将对其有益的合适受试者(例如,可能对使用IL-33拮抗剂的疗法做出有利应答的受试者)的方法。例如,如果个体在接受包含IL-33拮抗剂的药物组合物之前表现出预示疾病状态的与IL-33介导的疾病或障碍有关的生物标志物的水平,因此将所述个体鉴别为本发明的药物组合物(包含抗-IL-33拮抗剂的组合物)的施用将对其有益的合适患者。根据某些示例性实施方案,如果个体表现出以下一种或多种,可以将个体鉴别为抗-IL-33疗法的好候选人:(i)大于约5pg/mL、大于约10pg/mL、大于约20pg/mL、大于约30pg/mL、大于约40pg/mL、大于约50pg/mL、大于约60pg/mL、大于约70pg/mL、大于约80pg/mL、大于约90pg/mL、大于约100pg/mL或大于约200pg/mL的降钙素水平。另外的标准(诸如IL-33介导的疾病或障碍的其它临床指标)可以与本文描述的生物标志物中的任一种联合使用,以将个体鉴别为如本文别处所述的抗-IL-33疗法的合适候选人(例如,嗜中性粒细胞、嗜酸性粒细胞或ST2+CD4T细胞向组织(例如肺)的浸润的增加,杯形细胞组织转化,组织中ST2水平的增加,或组织中细胞因子(诸如IL-1β、IL-4、IL-5、IL-6、IL-9、IL-13、IL-33、MCP-1、TNFα)以及干扰素γ的水平的增加)。
在本发明的其它方面,使用治疗的生物标志物的水平和/或生物标志物的水平的变化可以具有使用特定抗-IL33药剂的抗-IL33疗法的效力的预测价值。
本发明的另一个方面提供了确定受试者是否可能具有或可能发生IL-33介导的疾病或障碍的方法,其中所述方法包括从所述受试者得到生物样品和测量本文描述的生物标志物中的至少一种的水平;其中与来自不具有IL-33介导的疾病或障碍或不可能发生IL-33介导的疾病或障碍的受试者的生物标志物的水平相比升高的至少一种生物标志物的水平将所述受试者鉴别为可能具有或发生IL-33介导的疾病或障碍的受试者。
本发明的另一个方面表征了包括施用抗-IL33拮抗剂的治疗受试者中的IL-33介导的疾病或障碍的方法,其中所述受试者已经被诊断出具有IL-33介导的疾病或障碍,已经用抗-IL33拮抗剂治疗,且已经被选择用IL-33拮抗剂进一步治疗,所述选择基于表现出减少的生物标志物(例如降钙素)的表达,其中基于与在用抗-IL-33拮抗剂治疗之前所述受试者中的相应生物标志物的表达水平的对比来确定所述减少的生物标志物表达。本发明的一个特定方面表征了包括施用抗-IL33拮抗剂的治疗受试者中的IL-33介导的疾病或障碍的方法,其中所述受试者已经被诊断出具有IL-33介导的疾病或障碍,已经用抗-IL33拮抗剂治疗,且已经被选择用IL-33拮抗剂进一步治疗,所述选择基于表现出减少的生物标志物表达,其中与治疗前表达水平相比减少的生物标志物表达等于或大于生物标志物表达的约10%、20%、30%、40%、50%、60%、70%、80%或90%减少。
白介素-33拮抗剂
如上面详细公开的,本发明包括方法,其包括给有此需要的受试者施用包含IL-33拮抗剂的治疗组合物。本文中使用的“IL-33拮抗剂”是,当IL-33在体外或体内细胞上表达时,结合IL-33或者与IL-33相互作用、或者结合它的受体或与它的受体相互作用并抑制IL-33的正常生物信号传递功能的任何药剂。IL-33拮抗剂的类型的非限制性例子包括小分子IL-33拮抗剂、抗-IL-33适体、基于肽的IL-33拮抗剂(例如,“肽体(peptibody)”分子)、特异性地结合人IL-33的抗体或抗体的抗原结合片段、或基于受体的IL-33拮抗剂(例如IL-3trap),诸如本文描述的那些。
在一个实施方案中,本发明包括方法,其包括给患者施用特异性地结合hIL-33的人抗体或其抗原结合片段。本文中使用的术语“hIL-33”是指特异性地结合它的受体ST2的人细胞因子。人ST2的氨基酸序列显示在SEQ ID NO:334中。人IL-33的氨基酸序列显示在SEQ ID NO:306中。编码人IL-33的核酸显示在SEQ ID NO:305中。抗-IL-33抗体可以选自具有在表1中所述的氨基酸序列的那些抗体中的任意一种或多种。
在一个实施方案中,本发明包括方法,其包括给患者施用基于受体的IL-33拮抗剂,例如,IL-33阱,诸如本文描述的那些。使用标准的分子生物学技术,构建了5种不同的示例性的本发明的IL-33阱。表2a阐述了不同的IL-33阱和它们的组成部分的总结性描述。表2b阐述了IL-33阱和它们的组成部分的氨基酸序列。
本文中使用的术语“抗体”意图表示包含通过二硫键相互连接的四个多肽链(2个重(H)链和2个轻(L)链)的免疫球蛋白分子及其多聚体(例如,IgM)。每个重链包含重链可变区(在本文中缩写为HCVR或VH)和重链恒定区。重链恒定区包含三个结构域,CH1、CH2和CH3。每个轻链包含轻链可变区(文中缩写为LCVR或VL)和轻链恒定区。轻链恒定区包含一个结构域(CL1)。VH和VL区可以进一步细分为被称为互补性决定区(CDR)的高变异性区域,其散布有更保守的被称为框架区(FR)的区域。每个VH和VL由3个CDR和4个FR组成,从氨基端至羧基端以下列顺序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。在本发明的不同实施方案中,抗-IL-33抗体(或其抗原结合部分)的FR可以与人种系序列相同,或可以是天然地或人工地修饰的。可以基于两个或更多个CDR的并排(side-by-side)分析来定义氨基酸共有序列。
本文中使用的术语“抗体”也包括完整抗体分子的抗原结合片段。本文中使用的术语“抗体的抗原结合部分”、“抗体的抗原结合片段”等包括特异性地结合抗原以形成复合物的任何天然存在的、酶促可获得的、合成的或遗传工程改造的多肽或糖蛋白。使用任意合适的标准技术诸如蛋白水解消化或重组基因工程技术(其涉及操作和表达编码抗体可变结构域和任选的恒定结构域的DNA),可以从例如完整抗体分子衍生出抗体的抗原结合片段。这样的DNA是已知的,和/或可以容易地从例如商业来源、DNA文库(包括,例如噬菌体-抗体文库)获得,或者可以被合成。可以对DNA测序,并化学地或通过使用分子生物学技术进行操作,例如,以将一个或多个可变结构域和/或恒定结构域排列为合适的构型,或导入密码子,产生半胱氨酸残基,修饰、添加或删除氨基酸等。
抗原结合片段的非限制性例子包括:(i)Fab片段;(ii)F(ab′)2片段;(iii)Fd片段;(iv)Fv片段;(v)单链Fv(scFv)分子;(vi)dAb片段;和(vii)由模拟抗体高变区的氨基酸残基组成的最小识别单位(例如,分离的互补性决定区(CDR)诸如CDR3肽)或受限制的FR3-CDR3-FR4肽。在本文中使用的表述“抗原结合片段”内还涵盖其它经工程改造的分子,诸如结构域-特异性抗体、单结构域抗体、结构域缺失的抗体、嵌合抗体、CDR-移植抗体、双体、三体、四体、微体、纳米抗体(例如,单价纳米抗体、二价纳米抗体等)、小模块免疫药物(SMIP)和鲨鱼可变IgNAR结构域。
抗体的抗原结合片段通常包括至少一个可变结构域。所述可变结构域可以具有任何大小或氨基酸组成,并且通常包含至少一个CDR,所述CDR与一个或多个框架序列相邻或同框。在具有与VL结构域结合的VH结构域的抗原结合片段中,VH和VL结构域可以相对于彼此以任何适合的排列定位。例如,所述可变区可以是二聚体并含有VH-VH、VH-VL或VL-VL二聚体。可替换地,抗体的抗原结合片段可以含有单体VH或VL结构域。
在某些实施方案中,抗体的抗原结合片段可以含有与至少一个恒定结构域共价连接的至少一个可变结构域。可在本发明的抗体的抗原结合片段中找到的可变结构域和恒定结构域的非限制性示例性构型包括:(i)VH-CH1;(ii)VH-CH2;(iii)VH-CH3;(iv)VH-CH1-CH2;(v)VH-CH1-CH2-CH3;(vi)VH-CH2-CH3;(vii)VH-CL;(viii)VL-CH1;(ix)VL-CH2;(x)VL-CH3;(xi)VL-CH1-CH2;(xii)VL-CH1-CH2-CH3;(xiii)VL-CH2-CH3;和(xiv)VL-CL。在可变结构域和恒定结构域的任何构型(包括上面列出的任何示例性构型)中,可变结构域和恒定结构域可以彼此直接连接或者可以通过全长或部分铰链或接头区相连。铰链区可以由至少2个(例如5、10、15、20、40、60或更多个)氨基酸组成,其导致在单个多肽分子中的相邻可变结构域和/或恒定结构域之间的柔性的或半柔性的连接。此外,本发明的抗体的抗原结合片段可以包含彼此和/或与一个或多个单体VH或VL结构域非共价地结合的上面列出的可变结构域和恒定结构域构型中的任一种的同二聚体或异二聚体(或其它多聚体)(例如,通过二硫键)。
与完整抗体分子一样,抗原结合片段可以是单特异性的或多特异性的(例如,双特异性的)。抗体的多特异性抗原结合片段通常包含至少两个不同的可变结构域,其中每个可变结构域能够特异性地结合单独的抗原或相同抗原上的不同表位。任何多特异性抗体形式可以使用本领域可利用的常规技术改造,使其适用于本发明的抗体的抗原结合片段的背景。
抗体的恒定区在抗体的固定补体并介导细胞依赖性细胞毒性的能力中是重要的。因此,可以基于是否需要抗体介导细胞毒性来选择抗体的同种型。
本文中使用的术语“人抗体”意图包括非天然存在的人抗体。该术语包括在非人哺乳动物中、或在非人哺乳动物的细胞中重组地生产的抗体。该术语无意包括从人受试者分离或在人受试者中产生的抗体。
本文中使用的术语“重组人抗体”意图包括通过重组方式制备、表达、建立或分离的所有人抗体,诸如使用转染进宿主细胞中的重组表达载体(在下面进一步描述)表达的抗体,从重组的组合人抗体文库(在下面进一步描述)分离的抗体,从人免疫球蛋白基因转基因的动物(例如小鼠)分离的抗体(参见例如,Taylor等人(1992)Nucl.Acids Res.20:6287-6295),或通过涉及将人免疫球蛋白基因序列剪接至其它DNA序列的任何其它方式制备、表达、建立或分离的抗体。这样的重组人抗体具有从人种系免疫球蛋白序列衍生出的可变区和恒定区。但是,在某些实施方案中,对这样的重组人抗体进行体外诱变(或,当使用人Ig序列转基因的动物时,体内体细胞诱变),且因而重组抗体的VH和VL区域的氨基酸序列是这样的序列:其尽管源自人种系VH和VL序列和与人种系VH和VL序列有关,但是不可能天然存在于体内人抗体种系谱系内。
人抗体可以以与铰链异质性相关的两种形式存在。在一种形式中,免疫球蛋白分子包含大约150-160kDa的稳定四链构建体,其中二聚体通过链间重链二硫键保持一起。在第二种形式中,二聚体不通过链间二硫键连接,并且约75-80kDa的分子由共价地偶联的轻链和重链组成(半抗体)。这些形式极难以分离,即使在亲和纯化以后。
所述第二种形式在各种完整IgG同种型中的出现频率是由于、但不限于与抗体的铰链区同种型相关的结构差异。在人IgG4铰链的铰链区中的单个氨基酸置换可以显著地减少第二种形式的出现(Angal等人(1993)Molecular Immunology 30:105)至使用人IgG1铰链通常观察到的水平。本发明涵盖在铰链、CH2或CH3区域中具有一个或多个突变的抗体,所述突变可以例如在生产中是合乎需要的,以提高所需抗体形式的收率。
本文中使用的“分离的抗体”是指已经被鉴定并从它的天然环境的至少一种组分分离和/或回收的抗体。例如,已经从生物体的至少一种组分、或从抗体天然地存在于其中或在其中天然地产生抗体的组织或细胞分离或移出的抗体,是就本发明的目的而言“分离的抗体”。分离的抗体还包括在重组细胞内的原位抗体。分离的抗体是已经进行至少一个纯化或分离步骤的抗体。根据某些实施方案,分离的抗体可以基本上不含有其它细胞物质和/或化学物质。
术语“特异性地结合”等是指,抗体或其抗原结合片段与抗原形成在生理条件下相对稳定的复合物。用于确定抗体是否特异性地结合抗原的方法是本领域众所周知的,且包括,例如,平衡透析、表面等离子体共振等。例如,在本发明的上下文中使用的“特异性地结合”IL-33的抗体包括以小于约1000nM、小于约500nM、小于约300nM、小于约200nM、小于约100nM、小于约90nM、小于约80nM、小于约70nM、小于约60nM、小于约50nM、小于约40nM、小于约30nM、小于约20nM、小于约10nM、小于约5nM、小于约4nM、小于约3nM、小于约2nM、小于约1nM或小于约0.5nM的KD结合IL-33或其部分的抗体,如在表面等离子体共振测定中所测得的。但是,分离的特异性地结合人IL-33的抗体可以具有与其它抗原(诸如来自其它(非-人)物种的IL-33分子)的交叉反应性。
在本发明的方法中有用的抗-IL-33抗体可以包含与衍生出所述抗体的对应种系序列相比在重链和轻链可变结构域的框架区和/或CDR区中的一个或多个氨基酸置换、插入和/或缺失。通过将本文公开的氨基酸序列与可得自例如公共抗体序列数据库的种系序列进行对比,可以容易地确定这样的突变。本发明包括方法,其涉及使用从本文中公开的任何氨基酸序列衍生出的抗体及其抗原结合片段,其中在一个或多个框架区和/或CDR区内的一个或多个氨基酸被突变成衍生出所述抗体的种系序列的对应残基,或被突变成另一个人种系序列的对应残基,或被突变成对应种系残基的保守氨基酸置换(这样的序列变化在本文中统称为“种系突变”)。本领域普通技术人员从本文公开的重链和轻链可变区序列出发可容易地产生众多包含一个或多个单独种系突变或其组合的抗体和抗原结合片段。在某些实施方案中,在VH和/或VL结构域内的所有框架和/或CDR残基被回复突变为在衍生出所述抗体的原始种系序列中发现的残基。在其它实施方案中,仅某些残基被回复突变为原始种系序列,例如,仅在FR1的前8个氨基酸内或FR4的后8个氨基酸内存在的突变残基,或仅在CDR1、CDR2或CDR3内存在的突变残基。在其它实施方案中,框架和/或CDR残基中的一个或多个被突变成不同种系序列的对应残基(即,与最初衍生出所述抗体的种系序列不同的种系序列)。此外,本发明的抗体可以在框架区和/或CDR区内含有两个或更多个种系突变的任何组合,例如,其中某些单独残基被突变成特定种系序列的对应残基,而与原始种系序列不同的某些其它残基被维持或被突变成不同种系序列的对应残基。一旦获得,可以针对一种或多种期望的性质容易地试验含有一个或多个种系突变的抗体和抗原结合片段,例如提高的结合特异性、增加的结合亲和力、提高或增强的拮抗或激动生物学特性(视情况而定)、降低的免疫原性等。本发明的应用包括以该一般方式得到的抗体和抗原结合片段。
本发明还包括涉及使用抗-IL-33抗体的方法,所述抗-IL-33抗体包含本文中公开的HCVR、LCVR和/或CDR氨基酸序列中的任一种的变体,其具有一个或多个保守置换。例如,本发明包括具有HCVR、LCVR和/或CDR氨基酸序列的抗-IL-33抗体的应用,所述HCVR、LCVR和/或CDR氨基酸序列相对于本文中公开的HCVR、LCVR和/或CDR氨基酸序列中的任一个具有例如10个或更少、8个或更少、6个或更少、4个或更少等的保守氨基酸置换。
本文中使用的术语“表面等离子体共振”表示光学现象,其允许通过检测生物传感器基质内的蛋白浓度的改变来分析实时相互作用,例如使用BIAcoreTM系统(Biacore Life Sciences division of GE Healthcare,Piscataway,NJ)。
本文中使用的术语“KD”意图表示特定抗体-抗原相互作用的平衡解离常数。
术语“表位”表示与抗体分子的可变区中被称为互补位的特定抗原结合位点相互作用的抗原决定簇。单个抗原可具有不止一个表位。因而,不同的抗体可以结合抗原上的不同区域并可以具有不同的生物学效应。表位可以是构象的或线性的。构象表位由线性多肽链的不同区段的在空间上邻接的氨基酸产生。线性表位是由多肽链中的相邻氨基酸残基产生的表位。在某些情况下,表位可以包括在抗原上的糖类部分、磷酰基或磺酰基。
人抗体的制备
用于在转基因小鼠中产生人抗体的方法是本领域已知的。任何这样的已知方法可以用在本发明的上下文中以制备特异性地结合人IL-33的人抗体。
使用VELOCIMMUNETM技术(参见,例如,US 6,596,541,Regeneron Pharmaceuticals)或用于产生单克隆抗体的任意其它已知方法,最初分离出具有人可变区和小鼠恒定区的针对IL-33的高亲和力嵌合抗体。技术涉及制备转基因小鼠,其具有与内源性小鼠恒定区基因座可操作地连接的包含人重链和轻链可变区的基因组,使得所述小鼠响应于抗原刺激产生包含人可变区和小鼠恒定区的抗体。将编码抗体的重链和轻链的可变区的DNA分离,并可操作地连接至编码人重链和轻链恒定区的DNA。然后将所述DNA在能够表达全人抗体的细胞中表达。
通常,用目标抗原攻击小鼠,并从表达抗体的小鼠回收淋巴细胞(诸如B-细胞)。可以将所述淋巴细胞与骨髓瘤细胞系融合以制备永生的杂交瘤细胞系,并筛选和选择这样的杂交瘤细胞系以鉴别产生对目标抗原特异性的抗体的杂交瘤细胞系。可以将编码重链和轻链的可变区的DNA分离并连接至重链和轻链的合乎需要的同种型恒定区。可以在细胞、诸如CHO细胞中生产这样的抗体蛋白。可替换地,可以从抗原特异性的淋巴细胞直接分离编码抗原特异性嵌合抗体或轻链和重链的可变结构域的DNA。
最初,分离具有人可变区和小鼠恒定区的高亲和力嵌合抗体。使用本领域技术人员已知的标准操作,针对合乎需要的特征(包括亲和力、选择性、表位等)表征和选择所述抗体。将小鼠恒定区用期望的人恒定区替换以产生本发明的全人抗体,例如野生型或经修饰的IgG1或IgG4。尽管选择的恒定区可以随特定用途变化,高亲和力抗原结合和靶标特异性特征存在于可变区中。
一般而言,当通过与固定化在固相上或在溶液相中的抗原的结合测量时,可以用在本发明的方法中的抗体具有高亲和力,如上所述。将小鼠恒定区用期望的人恒定区替换以产生本发明的全人抗体。尽管选择的恒定区可以随特定用途变化,高亲和力抗原结合和靶标特异性特征存在于可变区中。
可以用在本发明的方法的上下文中的特异性地结合IL-33的人抗体或抗体的抗原结合片段的具体例子包括包含三个重链CDR(HCDR1、HCDR2和HCDR3)的任何抗体或抗原结合片段,所述重链CDR被包含在重链可变区(HCVR)内且具有选自SEQ ID NO:2、18、34、50、66、82、98、114、130、146、162、178、194、210、226、242、258、274、290和308的氨基酸序列。所述抗体或抗原结合片段可以包含三个轻链CDR(LCVR1、LCVR2、LCVR3),所述轻链CDR被包含在轻链可变区(LCVR)内且具有选自SEQ ID NO:10、26、42、58、74、90、106、122、138、154、170、186、202、218、234、250、266、282、298和316的氨基酸序列。用于鉴别在HCVR和LCVR氨基酸序列内的CDR的方法和技术是本领域众所周知的,且可以用于鉴别在本文公开的指定HCVR和/或LCVR氨基酸序列内的CDR。可以用于鉴别CDR的边界的示例性惯例包括,例如,Kabat定义、Chothia定义和AbM定义。一般而言,Kabat定义是基于序列变异性,Chothia定义是基于结构环区域的位置,且AbM定义是Kabat和Chothia方案之间的折中。参见,例如,Kabat,“Sequences of Proteins of Immunological Interest,”National Institutes of Health,Bethesda,Md.(1991);A1-Lazikani等人,J.Mol.Biol.273:927-948(1997);和Martin等人,Proc.Natl.Acad.Sci.USA 86:9268-9272(1989)。公开的数据库也可用于鉴别抗体内的CDR序列。
在本发明的某些实施方案中,所述抗体或其抗原结合片段包含六个CDR(HCDR1、HCDR2、HCDR3、LCDR1、LCDR2和LCDR3),它们来自选自SEQ ID NO:2/10、18/26、34/42、50/58、66/74、82/90、98/106、114/122、130/138、146/154、162/170、178/186、194/202、210/218、226/234、242/250、258/266、274/282、290/298和308/316的重链和轻链可变区氨基酸序列对(HCVR/LCVR)。
在本发明的某些实施方案中,所述抗体或其抗原结合片段包含选自SEQ ID NO:2/10、18/26、34/42、50/58、66/74、82/90、98/106、114/122、130/138、146/154、162/170、178/186、194/202、210/218、226/234、242/250、258/266、274/282、290/298和308/316的HCVR/LCVR氨基酸序列对。
在附带的实施例中总结的研究利用了被称作H4H9675P的抗-hIL-33抗体。该抗体包含具有SEQ ID NO:274/282的HCVR/LCVR氨基酸序列对和由SEQ ID NO:276-278-280/SEQ ID NO:284-286-288表不的HCDR1-HCDR2-HCDR3/LCDR1-LCDR2-LCDR3结构域。但是,使用本文中公开的任何抗-IL-33抗体、以及这样的抗体的变体和抗原结合片段,可以实践本发明的方法。
药物组合物
本发明包括方法,其包括将IL-33拮抗剂施用给患者,其中所述IL-33拮抗剂被包含在药物组合物内。用合适的载体、赋形剂和提供合适转移、递送、耐受性等的其它试剂来配制本发明的药物组合物。可以在所有药物化学家已知的处方中发现大量的许多适当的制剂:Remington′s Pharmaceutical Sciences,Mack Publishing Company,Easton,PA。这些制剂包括,例如,粉剂、糊剂、软膏剂、凝胶剂、蜡状物、油、脂质、含脂质(阳离子的或阴离子的)的囊泡(诸如LIPOFECTINTM)、DNA缀合物、无水吸收糊剂、水包油和油包水乳剂、乳剂碳蜡(不同分子量的聚乙二醇)、半固体凝胶和含有碳蜡的半固体混合物。也参见Powell等人.“Compendium of excipients for parenteral formulations”PDA(1998)J Pharm Sci Technol 52:238-311。
根据本发明的方法施用给患者的抗体的剂量可以随患者的年龄和大小、症状、状况、施用途径等而变化。通常根据体重或体表面积计算所述剂量。取决于病症的严重程度,可以调节治疗的频率和持续时间。可以经验地确定关于施用包含抗-IL-33抗体的药物组合物的有效剂量和计划;例如,通过定期评估可以监测患者进展,并相应地调节剂量。此外,使用本领域众所周知的方法(例如,Mordenti等人,1991,Pharmaceut.Res.8:1351),可以执行剂量的种间缩放。在本文别处公开了可以用在本发明的上下文中的抗-IL33抗体的具体示例性剂量和包含它们的施用方案。
多种递送系统是已知的,并且可以用于施用本发明的药物组合物,例如,包囊在脂质体、微粒、微胶囊中、能够表达突变体病毒的重组细胞、受体介导的胞吞作用(参见,例如,Wu等人,1987,J.Biol.Chem.262:4429-4432)。施用方法包括、但不限于真皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。可以通过任何方便的途径施用所述组合物,例如通过输注或快速推注,通过经上皮或皮肤粘膜内衬(例如,口腔粘膜、直肠粘膜和肠粘膜等)的吸收,且可以与其它生物活性剂一起施用。
可以用标准针头和注射器皮下地或静脉内地递送本发明的药物组合物。另外,就皮下递送而言,笔式递送装置容易地在递送本发明的药物组合物中具有用途。这样的笔式递送装置可以是可重复使用的或一次用弃的。可重复使用的笔式递送装置通常利用含有药物组合物的可替换筒。一旦所述筒内的所有药物组合物已经被施用且所述筒是空的,可以将空筒容易地抛弃和用含有药物组合物的新筒替换。然后可以重复使用笔式递送装置。在一次用弃的笔式递送装置中,不存在可替换的筒。相反,一次用弃的笔式递送装置是预填充的,其中将药物组合物保持在所述装置内的蓄池中。一旦蓄池被排空药物组合物,就抛弃整个装置。
众多可重复使用的笔式和自动注射器递送装置在本发明的药物组合物的皮下递送中具有用途。例子包括、但不限于AUTOPENTM(Owen Mumford,Inc.,Woodstock,UK)、DISETRONICTM笔(Disetronic Medical Systems,Bergdorf,瑞士)、HUMALOG MIX 75/25TM笔、HUMALOGTM笔、HUMALIN 70/30TM笔(Eli Lilly and Co.,Indianapolis,IN)、NOVOPENTMI、II和III(Novo Nordisk,哥本哈根,丹麦)、NOVOPEN JUNIORTM(Novo Nordisk,哥本哈根,丹麦)、BDTM笔(Becton Dickinson,Franklin Lakes,NJ)、OPTIPENTM、OPTIPEN PROTM、OPTIPEN STARLETTM和OPTICLIKTM(sanofi-aventis,法兰克福,德国),仅举几个例子。在本发明的药物组合物的皮下递送中具有用途的一次用弃的笔式递送装置的例子包括、但不限于SOLOSTARTM笔(sanofi-aventis)、FLEXPENTM(Novo Nordisk)和KWIKPENTM(Eli Lilly)、SURECLICKTM自动注射器(Amgen,Thousand Oaks,CA)、PENLETTM(Haselmeier,斯图加特,德国)、EPI笔(Dey,L.P.)和HUMIRATM笔(Abbott Labs,Abbott Park IL),仅举几个例子。
在某些情形下,可以在控释系统中递送药物组合物。在一个实施方案中,可以使用泵(参见Langer,出处同上;Sefion,1987,CRC Crit.Ref.Biomed.Eng.14:201)。在另一个实施方案中,可以使用聚合材料;参见,MedicalApplications of Controlled Release,Langer和Wise(编),1974,CRC Pres.,Boca Raton,Florida。在另一个实施方案中,可以将控释系统放在所述组合物的靶标附近,因而仅需要全身剂量的一部分(参见,例如,Goodson,1984,Medical Applications of Controlled Release,出处同上,第2卷,第115-138页)。在Langer,1990,Science 249:1527-1533的综述中讨论了其它控释系统。
所述可注射制剂可以包括用于静脉内、皮下、皮内和肌肉内注射、点滴输注等的剂型。这些可注射制剂可以通过已知方法制备。例如,可以如下制备可注射制剂:例如,将上述抗体或其盐溶解、悬浮或乳化在常规地用于注射剂的无菌水性介质或油性介质中。作为用于注射剂的水性介质,存在例如生理盐水、包含葡萄糖和其它助剂的等渗溶液等,其可与适当的增溶剂组合使用,所述增溶剂是诸如醇(例如,乙醇)、多元醇(例如,丙二醇、聚乙二醇)、非离子表面活性剂[例如,聚山梨醇80、HCO-50(氢化蓖麻油的聚氧乙烯(50mol)加成化合物)]等。作为油性介质,使用例如芝麻油、大豆油等,其可与增溶剂(诸如苯甲酸苄酯、苯甲醇等)组合使用。如此制备的注射剂可以装填在适当的安瓿中。
有利地,将用于上述口服或胃肠外使用的药物组合物制备成适合配合活性成分的剂量的单位剂量的剂型。这样的单位剂量的剂型包括,例如,片剂、丸剂、胶囊剂、注射剂(安瓿)、栓剂等。
在例如美国专利申请公开号2014/0271658中公开了可以用在本发明的上下文中的包含抗-IL-33抗体的示例性药物组合物。
剂量
根据本发明的方法施用给受试者的IL-33拮抗剂(例如,抗-IL-33抗体)的量通常是治疗有效量。本文中使用的短语“治疗有效量”是指导致IL-33介导的疾病或障碍的一种或多种症状或指标的可检测改善的IL-33拮抗剂的量。“治疗有效量”也包括抑制、预防、减轻受试者中这样的疾病或障碍、或者延迟其进展的IL-33拮抗剂的量。
在抗-IL-33抗体的情况下,治疗有效量可以是约0.05mg至约600mg,例如,约0.05mg、约0.1mg、约1.0mg、约1.5mg、约2.0mg、约10mg、约20mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg或约600mg、ofthe抗-IL-33抗体。在某些实施方案中,将75mg、150mg、200mg或300mg抗-IL-33抗体施用给受试者。
可以以毫克抗体/千克患者体重(即,mg/kg)的方式表达在各个剂量中所含的IL-33拮抗剂的量。例如,可以以约0.0001至约10mg/kg患者体重的剂量将IL-33拮抗剂施用给患者。
联合治疗
根据某些实施方案,本发明的方法包括给所述受试者施用与IL-33拮抗剂组合的一种或多种另外的治疗剂。本文中使用的表述“与......组合”是指,在包含IL-33拮抗剂的药物组合物之前、之后或同时施用另外的治疗剂。
例如,当在包含IL-33拮抗剂的药物组合物“之前”施用时,可以在施用包含IL-33拮抗剂的药物组合物之前约72小时、约60小时、约48小时、约36小时、约24小时、约12小时、约10小时、约8小时、约6小时、约4小时、约2小时、约1小时、约30分钟、约15分钟或约10分钟施用另外的治疗剂。当在包含IL-33拮抗剂的药物组合物“之后”施用时,可以在施用包含IL-33拮抗剂的药物组合物之后约10分钟、约15分钟、约30分钟、约1小时、约2小时、约4小时、约6小时、约8小时、约10小时、约12小时、约24小时、约36小时、约48小时、约60小时或约72小时施用另外的治疗剂。
与包含IL-33拮抗剂的药物组合物“同时”施用是指,在施用包含IL-33拮抗剂的药物组合物的小于5分钟(之前、之后或同时)内在单独剂型中将另外的治疗剂施用给受试者,或作为包含另外的治疗剂和IL-33拮抗剂的单一组合剂量制剂施用给受试者。
本发明包括治疗IL-33介导的疾病或障碍的方法,所述方法包括给需要这种治疗的患者施用与至少一种另外的治疗剂组合的抗-hIL-33抗体或IL-33阱。可以在本发明的方法的实践中与抗-hIL-33抗体组合施用的另外的治疗剂的例子包括、但不限于非甾体类抗炎剂(NSAID)、类固醇、皮质类固醇(吸入的或局部的)、免疫抑制剂(例如环磷酰胺)、抗胆碱能剂(例如噻托溴铵)、毒蕈碱样药剂(例如格隆铵(glycopyrronium))、磷酸二酯酶抑制剂(例如茶碱、罗氟司特、西洛司特)、β阻滞剂、环孢菌素、他克莫司、吡美莫司、硫唑嘌呤、甲氨蝶呤、色甘酸钠、蛋白酶抑制剂、支气管扩张剂、β-2-激动剂、抗组胺剂、肾上腺素、解充血药、白三烯抑制剂、肥大细胞抑制剂、胸腺基质淋巴细胞生成素(TSLP)拮抗剂、TNF拮抗剂、IgE拮抗剂、IL-1拮抗剂、IL-4或IL-4R拮抗剂、IL-13或IL-13R拮抗剂、IL-4/IL-13双拮抗剂、IL-5拮抗剂、IL-6或IL-6R拮抗剂、IL-8拮抗剂、IL-9拮抗剂、IL-12/23拮抗剂、IL-22拮抗剂、IL-17拮抗剂、IL-31拮抗剂、口服PDE4抑制剂、IL-25拮抗剂和另一种IL-33拮抗剂或不同的基于抗体或受体的IL-33拮抗剂,和已知治疗、预防或改善人受试者中的IL-33介导的疾病或障碍的任意其它化合物。例如,对于同时施用,可以制备含有抗-hIL-33抗体和至少一种另外的治疗剂的药物制剂。使用本领域中已知的和容易得到的常规方法,可以容易地确定在本发明的方法的实践中与抗-hIL-33抗体组合施用的另外的治疗剂的量。
施用方案
本发明包括方法,其包括以每周约4次、每周2次、每周1次、每2周1次、每3周1次、每4周1次、每5周1次、每6周1次、每8周1次、每12周1次的给药频率或更低频率将包含IL-33拮抗剂的药物组合物施用给受试者,只要实现治疗应答。在某些涉及施用包含抗-IL-33抗体的药物组合物的实施方案中,以约0.01至约20mg/kg体重、更优选约0.02至约7、约0.03至约5、或约0.05至约3mg/kg体重的量每周1次给药。
根据本发明的某些实施方案,可以在确定的时程中将多剂量的IL-33拮抗剂施用给受试者。根据本发明的该方面的方法包括依次给受试者施用多剂量的IL-33拮抗剂。本文中使用的“依次施用”是指,在不同的时间点,例如,在被预定间隔(例如,数小时、数天、数周或数月)隔开的不同天,将每剂IL-33拮抗剂施用给受试者。本发明包括方法,其包括依次给患者施用单个初始剂量的IL-33拮抗剂,继之以一个或多个第二剂量的IL-33拮抗剂,并任选地继之以一个或多个第三剂量的IL-33拮抗剂。
术语“初始剂量”、“第二剂量”和“第三剂量”表示IL-33拮抗剂的施用的时间顺序。因而,“初始剂量”是在治疗方案开始时施用的剂量(也被称作“基线剂量”);“第二剂量”是在初始剂量之后施用的剂量;且“第三剂量”是在第二剂量之后施用的剂量。初始剂量、第二剂量和第三剂量可以都含有相同量的IL-33拮抗剂,但是通常可以在施用频率方面彼此不同。但是,在某些实施方案中,在初始剂量、第二剂量和/或第三剂量中所含的IL-33拮抗剂的量在治疗过程中彼此不同(例如,在适当时向上或向下调节)。在某些实施方案中,两个或更多个(例如,2、3、4或5个)剂量是在治疗方案开始时作为“负荷剂量”,随后是以更低频率施用的后续剂量(例如,“维持剂量”)。
在本发明的一个示例性实施方案中,在紧挨着的前一个剂量之后1-14(例如,1、11/2、2、21/2、3、31/2、4、41/2、5、51/2、6、61/2、7、71/2、8、81/2、9、91/2、10、101/2、11、111/2、12、121/2、13、131/2、14、141/2或更多)周施用每个第二和/或第三剂量。本文中使用的短语“紧挨着的前一个剂量”是指,在多次施用的顺序中,在所述顺序中在接着的下一个剂量施用之前施用给患者的IL-33拮抗剂的剂量,没有插入剂量。
根据本发明的该方面的方法可以包括,给患者施用任意数目的第二和/或第三剂量的IL-33拮抗剂。例如,在某些实施方案中,将仅单个第二剂量施用给患者。在其它实施方案中,将两个或更多个(例如,2、3、4、5、6、7、8或更多个)第二剂量施用给患者。同样地,在某些实施方案中,将仅单个第三剂量施用给患者。在其它实施方案中,将两个或更多个(例如,2、3、4、5、6、7、8或更多个)第三剂量施用给患者。
在涉及多个第二剂量的实施方案中,每个第二剂量可以以与其它第二剂量相同的频率施用。例如,每个第二剂量可以在紧挨着的前一个剂量之后1-2周施用给患者。类似地,在涉及多个第三剂量的实施方案中,每个第三剂量可以以与其它第三剂量相同的频率施用。例如,每个第三剂量可以在紧挨着的前一个剂量之后2-4周施用给患者。可替换地,将第二和/或第三剂量施用给患者的频率可以在治疗方案过程中变化。医师也可以在治疗过程中调节施用频率,取决于在临床检查以后各个患者的需要。
本发明包括包含向上滴定选项(在本文中也被称作“剂量改变”)的施用方案。本文中使用的“向上滴定选项”是指,在接受特定数目的IL-33抑制剂剂量以后,如果患者尚未实现一个或多个确定的治疗参数的特定改善(例如,至少20%改善),或以其它方式表现出在医师或保健提供者的判断下效力的明确缺乏,那么此后增加IL-33抑制剂的剂量。例如,就包含以每2周1次的频率给患者施用150mg剂量的抗-IL-33抗体的治疗方案而言,如果在8、10、12、14、16或更多周以后,所述患者尚未实现一个参数的至少20%改善,或如果所述患者表现出在医师或保健提供者的判断下效力的明确缺乏,那么将抗-IL-33抗体的剂量增加至例如此后(例如,在第10、12、14、16、18周或以后开始)每2周1次施用的200mg、300mg或更多。
治疗群体
本发明包括方法,其包括给有此需要的受试者施用包含IL-33拮抗剂的治疗组合物。本文中使用的表述“有此需要的受试者”是指这样的人或非人动物,其表现出IL-33介导的疾病或障碍的一种或多种症状或指标,诸如本文描述的那些(例如,炎症、肺中的嗜酸性粒细胞增多症、向肺中的嗜中性粒细胞浸润、肺中升高的某些细胞因子水平,例如,但不限于IL-5等),和/或其已经被诊断出具有本文描述的IL-33介导的疾病或障碍中的任一种。
实施例
提出下述实施例从而给本领域普通技术人员提供如何制备和使用本发明的方法和组合物的完整公开和描述,且无意将发明人考虑的内容的范围限制为他们的发明。已经做出努力来确保关于使用的数字(例如,量、温度等)的准确度,但是应当考虑一些实验误差和偏差。除非另外指出,否则份数是重量份,分子量是平均分子量,温度是以摄氏度为单位,且压强是在或接近大气压。
实施例1.针对人IL-33的人抗体的制备
将包含人IL-33的免疫原与佐剂(以刺激免疫应答)一起直接施用给包含编码人免疫球蛋白重链和κ轻链可变区的DNA的小鼠。通过IL-33-特异性的免疫测定监测抗体免疫应答。当实现期望的免疫应答时,将脾细胞收获并与小鼠骨髓瘤细胞融合以维持它们的生存力和形成杂交瘤细胞系。将杂交瘤细胞系筛选和选择以鉴别产生IL-33-特异性抗体的细胞系。使用该技术,得到几种抗-IL-33嵌合抗体(即,具有人可变结构域和小鼠恒定结构域的抗体);如下命名以此方式产生的示例性抗体:H1M9559N、H1M9566N、H1M9568N和H1M9565N。随后将来自嵌合抗体的人可变结构域克隆到人恒定结构域上以制备如本文中所述的全人抗-IL-33抗体。
如在US 2007/0280945A1中所述,还从没有与骨髓瘤细胞融合的抗原阳性的B细胞直接分离抗-IL-33抗体。使用该方法,得到几种全人抗-IL-33抗体(即,具有人可变结构域和人恒定结构域的抗体);如下命名以此方式产生的示例性抗体:H4H9629P、H4H9633P、H4H6940P、H4H9659P、H4H9660P、H4H9662P、H4H9663P、H4H9664P、H4H9665P、H4H9666P、H4H9667P、H4H9670P、H4H9671P、H4H9672P、H4H9675P和H4H9676P。
在下面阐述的实施例中详细描述了根据本实施例的方法制备的示例性抗-IL-33抗体的某些生物学特性。
实施例2.重链和轻链可变区氨基酸序列
表1阐述了选择的抗-IL-33抗体的重链和轻链可变区氨基酸序列对和CDR序列、以及它们的对应抗体标识符。
表1
在本文中通常根据下述命名法提及抗体:Fc前缀(例如“H1M”或“H4H”),继之以数字标识符(例如“9559”、“9566”或“9629”,如在表1中所示),继之以“P”或“N”后缀。因而,根据该命名法,抗体在本文中可以被称作,例如,“H1M9559N”、“H1M9566N”、“H4H9629P”等。在本文使用的抗体命名上的H1M和H4H前缀指示所述抗体的特定Fc区同种型。例如,“H1M”抗体具有小鼠IgG1 Fc,而“H4H”抗体具有人IgG4Fc。如本领域普通技术人员会明白的,具有特定Fc同种型的抗体可以转化成具有不同Fc同种型的抗体(例如,具有小鼠IgG1 Fc的抗体可以转化成具有人IgG4的抗体,等),但是在任何情况下,可变结构域(包括CDR)-其用表1中所示的数字标识符指示-将保持相同,且预期结合性质是相同的或基本上类似的,不论Fc结构域的性质。
实施例3.IL-33阱的构建
使用标准的分子生物学技术构建本发明的5种不同的示例性IL-33拮抗剂(IL-33阱)。第一种IL-33拮抗剂(hST2-hFc,SEQ ID NO:323)由在它的C-端与人IgG1 Fc区(SEQ ID NO:331)的N-端融合的人ST2(SEQ ID NO:327)的可溶性细胞外区域组成。第二种IL-33拮抗剂(hST2-mFc,SEQ ID NO:324)由在它的C-端与小鼠IgG2a Fc区(SEQ ID NO:332)的N-端融合的人ST2(SEQ ID NO:327)的可溶性细胞外区域组成。第三种IL-33拮抗剂(hST2-hIL1RAcP-mFc,SEQ ID NO:325)由线内融合体组成,所述线内融合体具有在它的N-端处的人ST2(SEQ ID NO:327),继之以人IL-1RAcP(SEQ ID NO:329)的细胞外区域,继之以在它的C-端处的小鼠IgG2a Fc(SEQ ID NO:332)。第四种IL-33拮抗剂(mST2-mIL1RAcP-mFc,SEQ ID NO:326)由线内融合体组成,所述线内融合体具有在它的N-端处的小鼠ST2(SEQ ID NO:328),继之以小鼠IL-1RAcP(SEQ ID NO:330)的细胞外区域,继之以在它的C-端处的小鼠IgG2a Fc(SEQ ID NO:332)。第五种IL-33拮抗剂(hST2-hIL1RAcP-hFc,SEQ ID NO:335)由线内融合体组成,所述线内融合体具有在它的N-端处的SEQ ID NO:327的人ST2,继之以人IL-1RAcP(SEQ ID NO:329)的细胞外区域,继之以在它的C端处的人IgG1 Fc(SEQ ID NO:331)。表2a阐述了不同IL-33拮抗剂和它们的组成部分的总结性描述。表2b阐述了IL-33拮抗剂和它们的组成部分的氨基酸序列。
表2a:IL-33拮抗剂(IL-33阱)的总结
表2b:氨基酸序列
实施例4:IL-33活性的生物标志物
进行研究来确定哪些基因在过表达IL-33的小鼠中升高。下述的研究总结了用于确定哪些基因与体内IL-33表达相关和哪些基因在用IL-33拮抗剂治疗动物以后受到调节的方法和动物模型。
流体动力学DNA递送
通过流体动力学DNA递送(HDD)在野生型(WT)小鼠中过表达小鼠IL-33。对于HDD实验,给WT小鼠注射50μg或25ug表达全长小鼠IL-33的质粒(参见GenBank登录号NM_001164724;mIL-33)或50μg或25ug不含编码序列的相同质粒(空载体)。在HDD注射以后7天处死小鼠,并收集血液、背根神经节(DRG)、心脏、肾、肝、肺和脾。在这些组织中表达的前10个基因显示在下面表4中。
收集的组织的微阵列分析
使用QuickAmp RNA Amplification Kit(Agilent)将Cy3-CTP掺入来自500ng总RNA的扩增的cRNA中。然后将来自每个样品的Cy3标记的cRNA与包含43538个覆盖小鼠转录组的60聚体寡物的定制Agilent阵列杂交。根据Agilent方案执行阵列的杂交和洗涤,并在Agilent Microarray扫描仪上扫描阵列。使用Agilent Feature Extraction Software 9.5从扫描的阵列图像提取数据。
血清收集
在研究结束时通过心脏穿刺将全血收集进试管中。通过将血液在室温静置至少30分钟,允许血液凝结。通过在冷却离心机中在18,000x g在4℃离心10分钟,使凝结的血液和细胞沉淀。将得到的上清液(命名为血清)转移进干净的聚丙烯平板中并适当地处理或储存。
血清或细胞裂解物提取物中的IL-33蛋白浓度的确定
根据生产商的说明书,使用来自R&D系统的ELISA试剂盒确定人(DY3625)和小鼠(DY3626)IL-33的IL-33浓度。
血清或细胞裂解物提取物中的小鼠降钙素(CT)浓度的确定
使用来自CusaBio(Through ARP)(目录号CSB-E05133m)的小鼠降钙素(CT)ELISA试剂盒,在小鼠血清中测量小鼠降钙素。根据与试剂盒一起提供的生产商的说明书进行测定操作。
细胞裂解物提取物中的小鼠IL-5浓度的确定
根据生产商的说明书,使用V-Plex定制小鼠多路免疫测定试剂盒(MesoScale Discovery,#K152A41)测量肺蛋白提取物中的细胞因子浓度。
屋尘螨诱导的慢性肺部炎症模型
给IL-33HumIn小鼠鼻内地施用在20μL 1X磷酸盐缓冲盐水(PBS)中稀释的50μg屋尘螨提取物(HDM;Greer,#XPB70D3A2.5)或20μL 1X PBS,每周3天共15周。给IL33HumIn小鼠的第二个对照组施用在20μL 1X PBS中稀释的50μgHDM提取物,每周3天共4或11周,以评估在抗体治疗开始时疾病的严重程度。在HDM攻击的4或11周以后开始给两组HDM攻击的小鼠皮下地注射25mg/kg的抗-IL-33抗体、H4H9675P或同种型对照抗体,然后每周2次直到HDM攻击结束(8或4周的抗体治疗)。在研究的第85天,将所有小鼠处死,并收获它们的肺。小鼠组的实验性给药和治疗方案显示在表3中。
给IL-33HumIn小鼠鼻内地施用在20μL 1X磷酸盐缓冲盐水(PBS)中稀释的50μg屋尘螨提取物(HDM;Greer,#XPB70D3A2.5)或20μL 1X PBS,每周3天共15周。给IL33HumIn小鼠的第二个对照组施用在20μL 1X PBS中稀释的50μgHDM提取物,每周3天共11周,以评估在抗体治疗开始时疾病的严重程度。在HDM攻击的11周以后开始给两组HDM攻击的小鼠皮下地注射25mg/kg的抗-IL-33抗体、H4H9675P或同种型对照抗体,并然后每周2次直到HDM攻击结束(8周的抗体治疗)。在研究的第85天,将所有小鼠处死,并收获它们的肺。小鼠组的实验性给药和治疗方案显示在表3中。
表3:小鼠组的实验性给药和治疗方案
组织收获用于基因表达分析
在放血以后,将肺取出,放入含有400μL RNA Later(Ambion,目录号AM720)的试管中,并在处理之前在-20℃储存。将组织在TRIzol中匀浆化,并将氯仿用于相分离。根据生产商的说明书,使用用于Microarrays Total RNA Isolation Kit的MagMAXTM-96纯化含有总RNA的水相。使用来自上面列出的MagMAX试剂盒的MagMAXTMTurboTMDNase Buffer和TURBO DNase,除去基因组DNA。使用VILOTMMaster Mix将mRNA(多达2.5μg)反转录成cDNA。将cDNA稀释至2ng/μL,并使用ABI 7900HT Sequence Detection System(Applied Biosystems)用Gene Expression Master Mix和有关的探针(小鼠B2m,小鼠Calca,人IL33)扩增10ng cDNA。使用B2m探针扩增β-2microblobulin(B2m)基因作为内部对照,以便将cDNA输入差异归一化。使用Microsoft Excel和GraphPad PrismTM软件执行数据分析。将每个基因的表达归一化至相同样品内的B2m表达。
肺收获用于细胞因子分析
在放血以后,从每只小鼠取出右肺的前叶和中叶(cranial and middle lobes),并放入含有补充了1X Halt蛋白酶抑制剂混合液(Pierce,#78430)的组织蛋白提取试剂(1X T-PER试剂;Pierce,#78510)的溶液的试管中。在冰上执行所有其它步骤。为每个样品调节T-PER试剂(含有蛋白酶抑制剂混合液)的体积以匹配1∶8(w/v)的组织:T-PER比率。使用Tissue Lyser II(Qiagen,目录号85300),将肺样品在试管中匀浆化。将得到的裂解物离心以沉淀碎片。将含有可溶性蛋白提取物的上清液转移至新鲜试管并在进一步分析之前在4℃储存。
使用Bradford测定来测量肺蛋白提取物中的总蛋白质含量。对于测定,将10μL稀释的提取物样品一式两份地放入96孔板中,并与200μL 1X Dye Reagent(Biorad,#500-0006)混合。将牛血清白蛋白(BSA;Sigma,#A7979)在1X T-Per试剂中的系列稀释物(在700μg/mL开始)用作标准以确定提取物的蛋白浓度。在室温温育5-分钟以后,在Molecular Devices SpectraMax M5平板读数器上测量在595nm的吸光度。使用GraphPad PrismTM软件执行数据分析以基于BSA标准确定总肺提取物蛋白质含量。
将来自每组的所有小鼠的肺总蛋白提取物中的每种细胞因子浓度归一化至通过Bradford测定测得的提取物的总蛋白质含量,并为每组表达为平均pg细胞因子/mg总肺蛋白(pg/mg肺蛋白,±SD)。
表4:前列IL-33紊乱基因
肺收获用于肺细胞浸润分析
在放血以后,从每只小鼠取出右肺的尾叶,放入含有在汉克平衡盐溶液(HBSS)中稀释的20μg/mL DNA酶和0.7U/mL Liberase TH的溶液的试管中,并切成大约2-3mm大小的碎块。然后将含有切碎的肺的试管在37℃水浴中温育20分钟。通过以10mM的终浓度加入乙二胺四乙酸(EDTA),停止反应。然后将样品转移至gentleMACS C Tubes。用MACS缓冲液使C Tubes中的体积达到3mL,并随后使用gentleMACS (Miltenyi Biotec)解离样品以形成单细胞悬浮液。然后将试管离心并将得到的沉淀再悬浮于4mL 1X红血细胞裂解缓冲液中以裂解红血细胞。在室温温育3分钟以后,将10mL 1X DPBS加入以灭活红血细胞裂解缓冲液。然后将细胞悬浮液离心,并将得到的细胞沉淀物再悬浮于1mL 1X DPBS中。将再悬浮的样品穿过100μm过滤板离心过滤(在400x g离心1分钟),并将大约1.5x106个细胞/孔铺板在96-孔U-底板中。然后将细胞离心,并将细胞沉淀物再悬浮于100μL在1X DPBS中1∶500稀释的Near-IR Fixable Dead Cell Stain(Invitrogen目录号:L34976,批号:1647137)中以确定细胞生存力。将细胞与生存力染料一起在室温温育20分钟,同时避光。在1X DPBS中洗涤1次以后,将细胞在50μμL含有10μμg/mL纯化的大鼠抗-小鼠CD16/CD32 Fc Block的MACS缓冲液中在4℃温育10分钟。然后将细胞于在亮蓝缓冲液(在表5中描述)中稀释的适当2x抗体混合物中在4℃温育30分钟,同时避光。抗体温育以后,将细胞在MACS缓冲液中洗涤2次,再悬浮于已经在1X DPBS中1∶4稀释的BDCytoFix中,并然后在4℃温育15分钟,同时避光。随后将细胞洗涤并再悬浮于MACS缓冲液中。然后将细胞悬浮液穿过AcroPrep Advance 96Filter Plate 30-40μm过滤进新U-底板中。使用HTS连接(BD Biosciences)在LSR Fortessa X-20细胞分析仪上获取样品数据。使用FlowJo X Software(Tree Star,OR)执行数据分析,并使用GraphPad PrismTM(GraphPad Software,CA)执行统计分析。将嗜酸性粒细胞定义为活的(细胞生存染料阴性的),单峰,CD45+,F4/80+,Ly6G-,CD11clo-Int,SiglecFhi。将嗜中性粒细胞定义为活的,单峰,CD45+,F4/80-,Ly6G+。将嗜酸性粒细胞和嗜中性粒细胞的数据表达为活细胞的频率。
表5:用于流式细胞计量术分析的抗体
统计分析
使用GraphPad PrismTM6.0版(GraphPad Software,CA)执行统计分析。
使用Kolmogorov-Smimov检验评价数据的正态性。如果数据通过正态性检验并且不同组的标准差没有统计上不同于彼此(如通过Brown-Forsythe检验评估的),则通过单向方差分析(ANOVA)、继之以Tukey事后检验来解释结果进行多重比较。如果数据没有通过正态性检验或标准差是显著不同的,则使用Kruskal-Wallis检验、继之以Dunn氏事后检验来解释结果进行多重比较。当P值<0.05时,认为差异是统计上显著的。
使用双尾Spearman非参数相关计算相关系数和显著性。当P值<0.05时,认为相关是统计上显著的。
结果的总结:
结果证实,在过表达IL-33的动物中紊乱的前10个基因是降钙素(Calca)、抵抗素-样α(RETNA)、趋化因子(C-C基序)配体8(Ccl8)、血清淀粉样蛋白A 3(Saa3)、Gm1975(BC117090)、杀伤细胞凝集素-样受体(Kirg1)、stefin A1(Csta)、跨膜4-结构域(Ms4a8a)、趋化因子(C-C基序)配体11(Ccl11)和丝氨酸(或半胱氨酸)肽(Serpina3f)(参见表4)。此外,数据也表明,血清IL-33和血清降钙素在该小鼠模型中显著升高(关于血清IL-33水平,参见图1A;关于血清降钙素水平,参见图1B)。血清IL-33的增加与降钙素的血清水平的增加相关。
另外,慢性屋尘螨(HDM)攻击模型(其用作暴露于变应原以后严重进行性肺部炎症的模型)表明,降钙素基因表达在慢性HDM攻击后在小鼠的肺中上调,但是降钙素表达在已经用IL-33拮抗剂(H4H9675P抗-IL-33抗体)治疗过的小鼠的肺中显著地减少。使用同种型匹配的阴性对照抗体的治疗对降钙素基因表达的水平没有影响(图2)。
另外,血清降钙素也在该HDM小鼠模型中升高,并且血清降钙素的水平与在这些小鼠的肺中看到的降钙素水平相关(参见图3)。此外,血清降钙素的水平与在该HDM小鼠模型中观察到的升高的IL-33水平相关(参见图4),从而提示,降钙素可以用作IL-33介导的疾病过程(例如变应性应答)中的IL-33的潜在生物标志物。
关于IL-33介导的疾病参数,在该HDM模型中研究了肺嗜中性粒细胞、肺嗜酸性粒细胞的频率和IL5水平。在用屋尘螨变应原攻击以后15周之前,发现所有三个参数都升高(参见图5A(嗜中性粒细胞)、5B(嗜酸性粒细胞)和5C(IL-5))。但是,与用变应原攻击并保持不治疗或施用阴性同种型对照抗体的小鼠相比,接受IL-33抗体H4H9675P的小鼠表现出在它们的肺中显著更少的嗜中性粒细胞、嗜酸性粒细胞和IL-5(参见图5A、5B和5C)。
此外,在血清降钙素水平和研究的三种疾病参数之间存在显著的关联。图6A显示了血清降钙素和肺嗜中性粒细胞之间的关联。图6B显示了血清降钙素和肺嗜酸性粒细胞之间的关联,且图6C显示了血清降钙素和肺IL-5水平之间的关联。
另外,在肺IL-33水平和肺嗜中性粒细胞的频率(图7A)、肺嗜酸性粒细胞(图7B)和肺IL-5水平(图7C)之间存在显著的关联。
总之,从屋尘螨模型得到的数据指示,在IL-33的水平、与该慢性变态反应的模型有关的至少三种疾病参数的频率和降钙素的表达之间存在显著关联。这样,该信息提示,降钙素可以是哺乳动物中的疾病严重程度和/或进展的一种生物标志物,且此外,所述数据提示,降钙素可以用于评估如本文中所述的使用IL-33拮抗剂的疗法的有效性。
本发明在范围上不受本文描述的具体实施方案限制。实际上,除了本文描述的那些内容以外,本领域技术人员从前述描述和附图会明白本发明的不同改变。这样的改变意图落入所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!