一种产细胞色素P450酶及其电子传递系统工程菌的构建及其应用的制作方法
技术领域:
本发明属于生物技术生物转化领域,具体涉及一种共表达细胞色素p450及其电子传递系统工程菌株的构建并应用此工程菌株生物转化生产左旋紫堇达明等天然产物的方法和应用。
背景技术:
:
细胞色素p450酶系(简称为cyp),是作为一种能与co结合的蛋白质而被发现的。1958年klingenberg在大鼠肝微粒体中发现了这种能与co结合的色素蛋白。也正是由于其还原态与co结合时在450nm波长处有最大吸收值,因而命名为细胞色素p450。p450作为最为庞大的氧化还原酶超家族,广泛分布于绝大部分生物中,目前其广泛用于药物代谢研究以及工业生物转化领域。因细胞色素p450具备在温和条件下,还原大气中的氧分子,将底物进行区域选择性和手性专一性氧化的优势,如今p450在生物转化中扮演了重要的角色。但是由于细胞色素p450催化过程中需要高效的电子传递系统,需要辅酶的供应以及自身的不稳定性导致其至今并没有很多的成功案例应用于工业生物转化中。而电子传递系统在细胞色素p450催化过程中扮演了最为重要的角色之一,因此筛选合适高效的细胞色素p450电子传递系统对提高细胞色素p450的生物转化起到至关重要的作用。
大肠杆菌作为第一个用于工业生产的菌株,凭借其结构简单,遗传学背景清晰,容易培养,生长速度快,目标基因表达水平高,培养周期短,抗污染能力强等特点,目前已成为最为常用的原核表达系统,因此大肠杆菌也做为全细胞生物转化的最常用的底盘生物,随着代谢工程与发酵工程领域的研究不断深入,利用大肠杆菌大量表达酶并利用工程菌株全细胞生物催化相关化合物以获得高附加值化合物等被广泛应用。
左旋四氢巴马亭(l-tetrahydropalmatine,l-thp)是由防己科植物华千金藤(stephaniasinicadiels)中分离得到的一种异喹啉类生物碱,具有镇痛、镇静、抗心律失常、抗脂质过氧化以及神经保护活性。左旋紫堇达明(l-corydalmine,l-cdl)是l-thp10位o-去甲基化产物,其镇痛活性明显高于l-thp,且镇静催眠作用较弱。l-cdl自然来源极其有限,由于其具有复杂的稠环结构,所以难以通过化学合成或结构修饰方法制备。因此利用生物转化的方法合成l-cdl为实现l-cdl大规模生产提供支撑。
在生物转化生产左旋紫堇达明的现有技术中(专利号cn102242164a)是利用灰色链霉菌atcc13273全细胞经发酵生物转化而得到。本发明专利在前期专利成果基础上,进一步构建了表达灰色链霉菌atcc13273中转化左旋四氢巴马汀的关键酶cyp105d1,及其电子传递体系的基因工程菌。
技术实现要素:
:
本发明提供一种工程菌,即基于细胞色素p450-cyp105d1进行生物催化的工程菌株,较以往已发明或报道的利用cyp105d1进行生物催化的工程菌株,其支撑其催化反应的电子传递系统可更高效地为cyp105d1提供电子,从而提升了催化反应的效率。
本发明所提供的工程菌株,是在大肠杆菌或其衍生菌株中过表达细胞色素p450-cyp105d1基因,同时共表达电子传递系统的铁氧还蛋白和铁氧还蛋白还原酶。
本发明的目的是提供一种共表达细胞色素p450及其电子传递系统的工程菌株,并利用该工程菌株其实现生物转化生产左旋紫堇达明、7-羟基香豆素等天然产物。
上述工程菌中,所述过表达细胞色素p450酶基因的方法是将所述细胞色素p450酶基因的全部序列置于外源表达质粒中的启动子之后进行表达。
上述工程菌中,所述共表达电子传递系统铁氧还蛋白和铁氧还蛋白还原酶基因的方法,是利用与上述表达p450酶选用质粒兼容的双表达质粒,分别将其全部序列置于启动子之后进行表达。
所述铁氧还蛋白和铁氧还蛋白还原酶可以是异源电子传递系统,也可以为同源电子传递系统。
所述异源电子传递系统是来自于恶臭假单胞菌中的铁氧还蛋白putidaredoxin(camb)及铁氧还蛋白还原酶putidaredoxinreductase(cama),其核苷酸序列是根据大肠杆菌密码子偏爱性进行密码子优化过的序列。
所述同源电子传递系统,其铁氧还蛋白是来自于灰色链霉菌atcc13273中的铁氧还蛋白,以fdx1表示;其铁氧还蛋白还原酶是来自于灰色链霉菌atcc13273中的铁氧还蛋白还原酶,经过基因组挖掘一共获得6条序列,本专利公开3条可有效传递电子的铁氧还蛋白还原酶,分别以fdr1,fdr2,fdr3表示。
所述在大肠杆菌或其衍生菌株中过表达细胞色素p450酶基因,同时共表达电子传递系统铁氧还蛋白及铁氧还蛋白还原酶的方法为如下所示:
将含有细胞色素p450酶的编码基因和电子传递系统铁氧还蛋白和铁氧还蛋白还原酶编码基因的片段导入所述大肠杆菌或其衍生菌株中;
所述片段是通过重组表达载体导入的;
所述重组表达载体具体是将所述细胞色素cyp105d1片段插入pet22b(+)的多克隆位点间得到cyp105d1表达载体,将电子传递系统蛋白fdx和fdr片段插入pacycduet-1的多克隆位点间得到fdx及fdr双表达载体(图1)。
所述重组表达载体具体构建过程如下:将含有细胞色素p450蛋白的编码基因的片段插入pet22b(+)的ndei和ecori酶切位点间,得到重组表达载体pet-cyp105d1;将包含铁氧还蛋白编码基因的片段插入pacycduet-1的ndei和kpni位点间得到重组表达载体pduet-fdx,再将包含铁氧还蛋白还原酶编码基因的片段插入上述重组表达载体2的bamhi和hindiii位点间得到重组表达载体pduet-fdx-fdr。
所述细胞色素p450-cyp105d1的核苷酸序列如seqidno.1所示;
所述铁氧还蛋白putidaredoxin(camb)的核苷酸序列为seqidno.2所示;
所述铁氧还蛋白putidaredoxinreductase(cama)的核苷酸序列为seqidno.3所示;
所述铁氧还蛋白fdx1的核苷酸序列如seqidno.4所示;
所述铁氧还蛋白还原酶fdr1的核苷酸序列如seqidno.5所示;
所述铁氧还蛋白还原酶fdr5的核苷酸序列如seqidno.6所示;
所述铁氧还蛋白还原酶fdr6的核苷酸序列如seqidno.7所示;
上述所述的工程菌中,所述大肠杆菌为e.colibl21(de3)或e.colic43(de3)。
一种制备左旋紫堇达明的方法也属于本发明的保护范围,包括如下步骤:将上述任一所述的工程菌在含有抗生素的lb液体培养基中培养,得到种子液;将种子液接入发酵转化培养基中,发酵培养;加入血红素合成前体物质氨基乙酰丙酸(ala)进行前体合成,同时补充铁元素fecl3,一定时间后添加诱导剂诱导表达,诱导至细胞色素p450蛋白一定时间后,再加入底物左旋四氢巴马汀开始全细胞催化,催化20小时,即可转化生成左旋紫堇达明,如图2所示,含不同电子传递体系的菌种转化率范围在5%-70%之间。
所述诱导剂具体为iptg或乳糖;
所述底物左旋四氢巴马汀形式可为左旋四氢巴马汀原始粉末,左旋四氢巴马汀硫酸盐等。
所述改进蛋白表达培养基中每升含有胰蛋白胨12g;酵母提取物6g;氯化钠8g;d-山梨醇10g;d-葡萄糖1g,k2hpo4.3h2o,1.14g/lkh2po4,10g/l(nh4)2s04,0.3g/lmgso4·7h2o,余量为水,初始ph值调节为7.5。并于灭菌后添加50mg/l氨苄青霉素,50mg/l氯霉素。
上述方法中,所述lb液体培养基中氨苄青霉素的浓度可以为5-200mg/l,具体为50mg/l,氯霉素的浓度可以为5-200mg/l,具体为50mg/l。
所述种子液的od600为5-20;
所述种子液接入发酵培养基的比例为0.5-30%,具体为2%;
所述菌体生长培养的温度为25℃-45℃,具体为37℃;
所述发酵培养的do在50%以上;
所述发酵培养的ph为4.0-9.0;
所述ala的终浓度为0.01-10mm,具体为0.1mm
所述ala加入时间为发酵培养后2-40小时,具体为2.5h
所述iptg的终浓度为0.01-10mm,具体为0.1mm;
所述iptg加入的时间为发酵培养后2-40小时,具体为3h;
所述加入底物左旋四氢巴马汀开始全细胞催化的时间为诱导开始后的0.5-30h,具体为6h。
所述催化过程中ph维持在7.0-8.0之间,具体为7.4-8.0之间,具体用磷酸钠缓冲液调节。
本发明提供的工程菌是在大肠杆菌衍生菌株中过量表达细胞色素p450基因cyp105d1并同时表达其最适电子传递系统铁氧还蛋白和铁氧还蛋白还原酶基因构建的可用于全细胞催化天然产物生物转化的工程菌;本发明进一步提供了一种利用该工程菌催化生产左旋紫堇达明的方法,该方法可以实现高转化率,高生产强度和高产量地催化生产左旋紫堇达明,产量为100-300mg/l,降低了左旋紫堇达明的生产成本,提升了工艺效率从而在实践上可用于左旋紫堇达明大规模生产,便于推广应用。
附图说明:
1.图1为用于表达p450酶cyp105d1及其电子传递体系重组质粒的构建示意图。
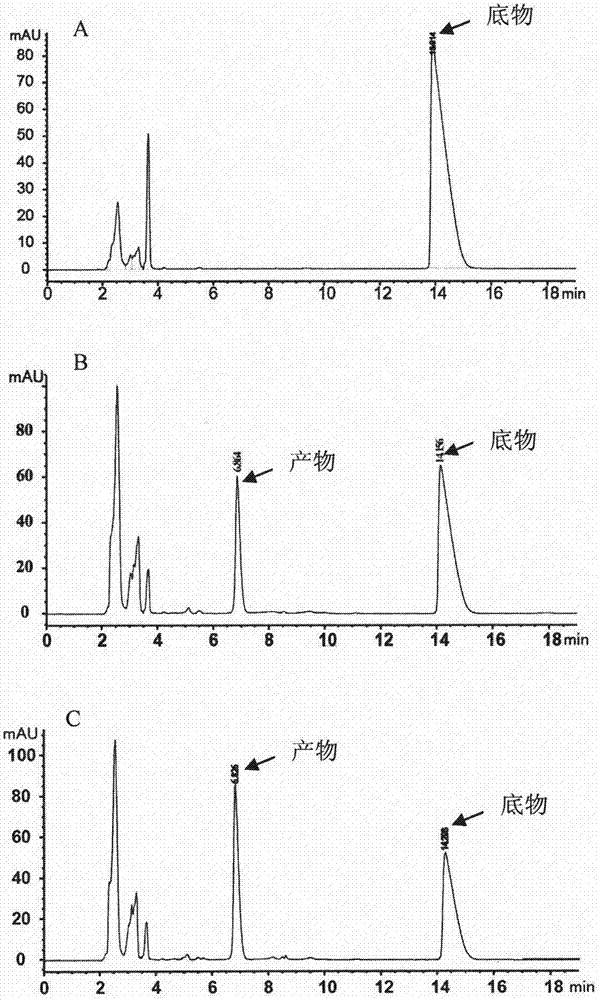
2.图2为利用重组表达工程菌生物转化合成紫堇达明的hplc鉴定图。其中a为阴性对照(利用未转基因的空白菌株进行转化);b为利用外源电子传递系统构建的工程菌株转化底物;c为利用内源最佳电子传递系统构建的工程菌株转化底物。
3.图3为利用共表达cyp105d1及不同电子传递系统的工程菌对底物l-thp转化效率比较图。
4.图4为利用重组工程菌转化7-乙氧基香豆素生成7-羟基香豆素的tlc鉴定图。其中,1:7-乙氧基香豆素标准品;2:7-羟基香豆素标准品;3:转化结果)。
具体实施方式:
根据下述实施例,可以更好地理解本发明,然而,本领域的技术人员容易理解,实施例所描述的内容仅限于说明本发明,而不应该也不会限制权力要求书中所详细描述的本发明。本发明中的生物材料来源如下
灰色链霉菌atcc13273菌株购于中国微生物菌种保藏中心,储存于中国药科大学中药生物技术研究室。
载体pet22b:商业载体,购于novagen
载体pacycduet-1:商业载体,购于novagen
dna聚合酶gflexpolymerese购自takara大连宝生物有限公司
下述实施例中所使用的实验方法如无特殊说明,均为常规方法
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、cyp105d1及其电子传递系统共表达工程菌株的构建
一、pet22b-cyp105d1质粒的获得
(一)以灰色链霉菌streptomycesgriseusatcc13273的基因组dna为模板,使用高保真聚合酶tksgflexdnapolymerase,以p1和p2为引物进行pcr扩增。pcr程序为:94℃预变性2min,98℃变性15秒,60℃退火15秒,68℃延伸90秒,30个循环,获得长度为1239bp的含有细胞色素p450单加氧酶基因cyp105d1的片段,该片段的核苷酸序列如seqidno.1所示。
p1:5’-ggaattccatatgacggaatccacgacggacc-3’
(下划线表示为ndei酶切识别位点)
p2:5’-ggaattctcaccaggccacgggcaggt-3’
(下划线表示为ecori酶切识别位点)
(二)ndei和ecori双酶切seqidno.1所示的dna分子,得到基因片段;ndei和ecori双酶切pet22b(+)质粒,得到载体大片段;将基因片段与载体大片段连接,得到重组质粒,将其命名为pet22b-cyp105d1,进测序验证结果正确。成功构建pet22b-cyp105d1质粒。
二共表达cama/camb电子传递系统的重组质粒pduet-cama-camb的获得
(一)以质粒pjet-camb为模板,使用高保真聚合酶tksgflexdnapolymerase,以p3和p4为引物进行pcr扩增。pcr程序为:94℃预变性2min,98℃变性15秒,60℃退火15秒,68℃延伸30秒,30个循环,获得长度为324bp的含有铁氧还蛋白camb基因的片段,该片段的核苷酸序列如seqidno.2所示。
p3:ggaattccatatgagcaaggtggtttacgtgag
(下划线表示为ndei酶切识别位点)
p4:ggggtaccttaccattgacgatccggaacg
(下划线表示为kpni酶切识别位点)
(二)ndei和kpni双酶切seqidno.2所示的dna分子,得到基因片段;ndei和kpni双酶切pacycduet-1质粒,得到载体大片段;将基因片段与载体大片段连接,得到重组质粒,将其命名为pduet-camb,将其送测序,结果正确。
(三)以puc57-cama为模板,使用高保真聚合酶gflexpolymerase,以p5和p6为引物进行pcr扩增。pcr程序为:94℃预变性2min,98℃变性15秒,60℃退火15秒,68℃延伸90秒,30个循环,获得长度为1269bp的含有铁氧还蛋白还原酶基因cama的片段,该片段的核苷酸序列如seqidno.3所示。
p5:5’-cgcggatccgatgaacgcgaacgacaacgtg-3’
(下划线表示为bamhi酶切识别位点)
p6:5’-cccaagctttacgcgctgctcagttccg-3’
(下划线表示为hindiii酶切识别位点)
(四)bamhi和hindiii双酶切seqidno.3所示的dna分子,得到基因片段;bamhi和hindiii双酶切pduet-camb质粒,得到载体大片段;将基因片段与载体大片段连接,得到重组质粒,将其命名为pduet-cama-camb,将其送测序,结果正确。成功构建双表达质粒pduet-cama-camb。
三共表达fdx/fdr电子传递系统的pduet-fdx-fdr质粒的获得
(一)以灰色链霉菌streptomycesgriseusatcc13273的基因组dna为模板,使用高保真聚合酶tksgflexdnapolymerase,以p7和p8为引物进行pcr扩增。pcr程序为:94℃预变性2min,98℃变性15秒,60℃退火15秒,68℃延伸30秒,30个循环,获得长度为207bp的含有铁氧还蛋白基因fdx1的片段,该片段的核昔酸序列如seqidno.4所示。
p7:5’-ggaattccatatgagcggcgtgggagtccaggtcg-3’
(下划线表示为ndei酶切识别位点)
p8:5’-ggggtacctcagtcggaggagaggaccaccag-3’
(下划线表示为kpni酶切识别位点)
(二)ndei和kpni双酶切seqidno.4所示的dna分子,得到基因片段;ndei和kpni双酶切pacycduet-1质粒,得到载体大片段;将基因片段与载体大片段连接,得到重组质粒,将其命名为pduet-fdx1,将其送测序,结果正确。
(三)以灰色链霉菌streptomycesgriseusatcc13273的基因组dna为模板,使用高保真聚合酶tksgflexdnapolymerase,以p9和p10为引物进行pcr扩增。pcr程序为:94℃预变性2min,98℃变性15秒,60℃退火15秒,68℃延伸90秒,30个循环,获得长度为1245bp的含有铁氧还蛋白还原酶基因fdr1的片段,该片段的核苷酸序列如seqidno.5所示。
以灰色链霉菌streptomycesgriseusatcc13273的基因组dna为模板,使用高保真聚合酶tksgflexdnapolymerase,以p11和p12为引物进行pcr扩增。pcr程序为:94℃预变性2min,98℃变性15秒,60℃退火15秒,68℃延伸90秒,30个循环,获得长度为1362bp的含有铁氧还蛋白还原酶基因fdr5的片段,该片段的核苷酸序列如seqidno.6所示。
以灰色链霉菌streptomycesgriseusatcc13273的基因组dna为模板,使用高保真聚合酶tksgflexdnapolymerase,以p13和p14为引物进行pcr扩增。pcr程序为:94℃预变性2min,98℃变性15秒,60℃退火15秒,68℃延伸90秒,30个循环,获得长度为1650bp的含有铁氧还蛋白还原酶基因fdr6的片段,该片段的核苷酸序列如seqidno.7所示。
p9:5’-cgcggatccgatgagcgagcagacggaacacc-3’
(下划线表示为bamhi酶切识别位点)
p10:5’-cccaagctttcacagggcggtggacttcagcgg-3’
(下划线表示为hindiii酶切识别位点)
p11:5’-cgcggatccgatgacacgccccgtccgcgtcgc-3’
(下划线表示为bamhi酶切识别位点)
p12:5’-cccaagctttcaggcgccggaggcgtcgagc-3’
(下划线表示为hindiii酶切识别位点)
p13:5’-cgcggatccgatgacctacgccatcacccagacc-3’
(下划线表示为bamhi酶切识别位点)
p14:5’-cccaagctttcagccgggcgtcttccagcgg-3’
(下划线表示为hindiii酶切识别位点)
(四)bamhi和hindiii双酶切seqidno.5、seqidno.6、seqidno.7所示的dna分子,得到基因片段;bamhi和hindiii双酶切pduet-fdx1质粒,得到载体大片段;分别将上述酶切的基因片段与载体大片段连接,得到重组质粒,分别将其命名为pduet-fdx1-fdr1,pduet-fdx1-fdr5,pduet-fdx1-fdr6将其送测序,结果正确。证明成功构建双表达质粒。
四、质粒共转化至大肠杆菌bl21(de3)中
1)大肠杆菌bl21(de3)化学感受态细胞制作,挑取新鲜的大肠杆菌bl21(de3)单菌落,接种于含新鲜的5mllb液体培养基试管中,37℃,200rpm,振荡培养过夜,取过夜培养物按1%接种量转接入50ml新鲜的lb培养基中,37℃剧烈震荡(250-300rpm)培养约2.5-3小时。将0.1m氯化钙溶液置于冰上预冷,下述操作需在超净台和冰上。吸取1.5ml培养好的菌液至1.5ml离心管中,在冰浴上冷却10min,4℃下3000g冷冻离心5min;弃上清,加入100μl预冷的0.1m氯化钙溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮,冰浴放置20min;4℃3000g冷冻离心5min;弃上清,加入100μl预冷的0.1m氯化钙溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮;细胞悬浮液可立即用于转化实验或添加冷冻保护剂(如甘油)后超低温冷冻储存备用。
2)将感受态细胞在冰浴中融化,按50μl感受态细胞+5μl质粒pet22b-cyp105d1,轻轻快速加入,用手指轻弹,冰浴30min,立刻42℃热激90秒,立刻冰浴2min,加入500μllb培养基,37℃220rpm震荡45min。随后将其5000rpm离心1min,去上清300μl,剩余200μl,重悬,全部涂布含有氨苄青霉素和氯霉素平板;30min后倒置培养15h后,挑取10个单菌落,转接含氨苄青霉素和氯霉素的lb液体培养基,提基因组pcr验证正确(正确的菌落基因组扩增片段大小分别在1300bp),挑取一个正确的菌落,用于后续细胞色素p450及其电子传递系统的共表达。
实施例2、共表达cyp105d1及其电子传递系统基因工程菌的诱导表达
菌株:重组工程菌大肠杆菌bl21(de3)(pet22b-105d1pduet-fdx1-fdr1)
种子培养基(g/l):蛋白陈10;酵母膏5;nacl10;氨节青霉素50mg/ml,氯霉素50mg/ml
发酵培养基(g/l):胰蛋白胨12;酵母提取物6;氯化钠8;d-山梨醇10;d-葡萄糖1,初始ph值调节为7.5。
种子培养:甘油管保藏的菌种转接新鲜的lb液体培养基,37℃200rpm活化16h;接1环活化的菌种划线于具有相应抗生素的lb固体培养基,37℃培养12h;从新鲜平板上挑取单菌落至装有50ml种子培养基的250ml三角瓶中,37℃200rpm条件下培养12h,作为一级种子;再将一级种子液以5%的接种量接至另一50ml/250ml种子培养基,37℃200rpm条件下培养12h,作为二级种子。
发酵培养与酶诱导表达:
将二级种子液以1%接种量接种于100ml发酵表达培养基中,37℃250rpm进行摇床震荡培养,3小时后添加血红素合成前体——氨基乙酰丙酸(δ-ala),使之终浓度为0.1mm,并降低培养温度为25℃,继续培养30min后,添加诱导剂iptg,使之终浓度为0.05mm,25℃,150rpm诱导表达。诱导表达12h后收集菌体,该菌体可作为对多种天然产物进行全细胞生物转化的工具。
1.检测方法:
(1)菌体浓度测定:发酵液经合适倍数的稀释后,用紫外分光光度计在λ-600nm处测吸光值,其与稀释倍数的乘积即发酵液的菌体浓度(od600)。
(2)细胞干重(dcw)测定:取30ml发酵液,离心收集,弃去上清,菌体于105℃烘至恒重,测定即为细胞干重。
(3)细胞色素p450检测
据还原态cyp与co结合后在波长450nm处有特殊吸收峰的特性,对分离纯化得到的cyp105d1蛋白进行了co结合差光谱检测。以bradford法测定蛋白浓度,粗蛋白溶液稀释至500μg/ml后取1ml,加入5mg连二亚硫酸钠混匀,3min后等分倒入对照池和样品池中,在分光光度计上扫描基线,然后向样品池中通co约1min,静置4min后在波长400-500nm间进行扫描,并记录吸收光谱即为cyp-co结合差光谱,同时记录450nm及490nm处的吸光值(a),根据下式计算p450含量。
p450(nmol·mg-1)=a(450-490)*1000(um)*1/91mm-1*蛋白终浓度(mg·ml-1)
2.结果
测定重组大肠杆菌工程菌的菌体密度,在相应的发酵培养基中最高菌体密度可达到106.7g/l,测定工程菌胞内的活性cyp105d1高达425nmol/l。
实施例3利用共表达cyp105d1及其电子传递系统基因工程菌生物转化合成左旋紫堇达明
菌株:重组工程菌大肠杆菌bl21(de3)(pet22b-105d1pduet-fdx-fdr);
种子培养基(g/l):蛋白陈10;酵母膏5;nacl10;氨节青霉素50mg/ml,氯霉素50mg/ml;
发酵培养基(g/l):胰蛋白胨12;酵母提取物6;氯化钠8;d-山梨醇10;d-葡萄糖1,初始ph值调节为7.5。
种子培养:甘油管保藏的菌种转接新鲜的lb液体培养基,37℃200rpm活化16h;接1环活化的菌种划线于具有相应抗生素的lb固体培养基,37℃培养12h;从新鲜平板上挑取单菌落至装有50ml种子培养基的250ml三角瓶中,37℃200rpm条件下培养12h,作为一级种子;再将一级种子液以5%的接种量接至另一50ml/250ml种子培养基,37℃200rpm条件下培养12h,作为二级种子。
发酵培养与酶诱导表达:
将二级种子液以1%接种量接种于100ml发酵表达培养基中,37℃250rpm进行摇床震荡培养,3小时后添加血红素合成前体——氨基乙酰丙酸(δ-ala),使之终浓度为0.1mm,并降低培养温度为25℃,继续培养30min后,添加诱导剂iptg,使之终浓度为0.05mm,25℃,150rpm诱导表达。诱导表达6h后添加细胞通透剂多粘菌素b使细胞膜通透性增加,处理30min后,底物左旋四氢巴马汀利用丙酮助溶后,加入发酵液中,进入生物转化阶段。转化至20h后可收集发酵液,其底物的转化率最高可达75%。
生物转化检测:利用hplc方法进行检测,利用美国安捷伦高效液相色谱仪agilent1260,dad紫外检测器。c18反向色谱柱。柱温为28℃。流动相水相为0.6%乙酸-0.06%三乙胺,有机相为乙腈,水相有机相比为77∶23,流速为1ml/min。结果如图2所示,其中a为未转基因的空白菌不能对底物进行转化;b为利用共表达cyp105d以及外源电子传递体系cama/camb的工程菌能够明显的对底物进行转化;c为利用共表达cyp105d以及灰色链霉菌13273内源电子传递体系fdx1/fdr1的工程菌能够明显的对底物进行转化。图3所示,利用共表达cyp105d以及不同电子传递体系工程菌转化l-thp转化效率的比较,结果显示不同电子传递体系均能够对底物进行转化,转化效率在5%-70%之间。
实施例4利用重组工程菌株生物转化合成7-羟基香豆素
菌株:重组工程菌大肠杆菌bl21(de3)(pet22b-105d1pduet-fdx-fdr);
种子培养基(g/l):蛋白陈10;酵母膏5;nacl10;氨节青霉素50mg/ml,氯霉素50mg/ml;
发酵培养基(g/l):胰蛋白胨12;酵母提取物6;氯化钠8;d-山梨醇10;d-葡萄糖1,初始ph值调节为7.5。
种子培养:甘油管保藏的菌种转接新鲜的lb液体培养基,37℃200rpm活化16h;接1环活化的菌种划线于具有相应抗生素的lb固体培养基,37℃培养12h;从新鲜平板上挑取单菌落至装有50ml种子培养基的250ml三角瓶中,37℃200rpm条件下培养12h,作为一级种子;再将一级种子液以5%的接种量接至另一50ml/250ml种子培养基,37℃200rpm条件下培养12h,作为二级种子。
发酵培养与酶诱导表达:
将二级种子液以1%接种量接种于100ml发酵表达培养基中,37℃250rpm进行摇床震荡培养,3小时后添加血红素合成前体-氨基乙酰丙酸(δ-ala),使之终浓度为0.1mm,并降低培养温度为25℃,继续培养30min后,添加诱导剂iptg,使之终浓度为0.05mm,25℃,150rpm诱导表达。诱导表达6h后添加底物7-乙氧基香豆素后进入生物转化阶段。
转化产物的检测利用tlc薄层板,展开剂为:正己烷∶乙酸乙酯=6∶4。
结果如图4所示,利用共表达cyp105d1及最佳同源电子传递系统的工程菌能够转化7-乙氧基香豆素生成7-羟基香豆素的。
- 还没有人留言评论。精彩留言会获得点赞!
- 修饰细胞色素p450酶的编码核酸和其应用方法
- 一种改进细胞色素p450酶家族体外表达的方法
- 含有(e)-7-[4-(4-氟苯基)-6-异丙基-2-[甲基(甲基磺酰基)氨基]嘧啶-5基 ...的制作方法
- 含三氮杂螺[5.5]十一烷衍生物与细胞色素p450同工酶3a4抑制剂和/或p-糖蛋白抑制剂 ...的制作方法
- 细胞色素p450 bm-3 d168s变体酶以及应用其制备靛玉红的方法
- 细胞色素p450 bm-3 d168r变体酶以及应用其制备靛玉红的方法
- 用于检测人细胞色素p450相关的基因多态位点的引物系统及其用途的制作方法
- 人细胞色素p450 3a5酶及nadph-细胞色素p450氧化还原酶共表达体系的制作方法
- 一种检测黄鳝芳香化酶p450基因等位基因甲基化状态的方法
- 四翅滨藜细胞色素p450基因克隆及其应用的制作方法