一种初始状CD4+T细胞和/或其分化而成的调节性T细胞的特异性生物标志物的制作方法
本发明涉及生物技术和医学领域,具体地说,是一种长链非编码rna——lnc-smad3作为初始状cd4+t细胞和/或其分化而成的调节性t细胞的鉴别、成熟状态和/或功能确定的新型特异性生物标志物中的用途和应用方法。
背景技术:
哺乳动物基因组可转录多种长非编码rna(longnoncodingrna,lncrna),然而其中仅有少数lncrna的序列和功能被明确。近年来,lncrna在生命生理过程以及疾病进程中的作用不断受到关注,但是关于lncrna与免疫系统之间的研究并不多,尤其是lncrna在调节性t细胞参与的免疫稳态维持中的报道几乎空白。
调节性t细胞是免疫稳态中重要的调控细胞,它可以从初始状cd4+t细胞分化而来。调节性t细胞可以通过抑制效应性t细胞的活化和增殖,负向调控过激的免疫应答,控制炎症反应,维持机体的免疫稳态。调节性t细胞的成熟和功能状态决定了免疫应答的走向和强度,因此在众多免疫相关疾病如感染,炎症,自身免疫性疾病,肿瘤的发生发展和干预治疗中发挥着重要作用。
过去的研究已证实多种转录因子和细胞因子等(如foxp3、tgf-β)在初始状cd4+t细胞往调节性t细胞的分化发育中发挥着重要作用,也确定了很多与调节性t细胞成熟和功能相关的蛋白分子(如cd25、ctla4、gitr等)。然而,若要确定由初始状cd4+t细胞分化而来的调节性t细胞的功能和成熟状态,则需要联合检查数个标志物,如联合检测到cd25+foxp3+,才能确定其已转化为调节性t细胞并确定其功能和成熟状态。
为方便临床和科研应用,本领域中迫切需要研究和开发出针对初始状cd4+t细胞和/或其分化而成的调节性t细胞的鉴别、成熟和功能的特异性表达生物标志物。
技术实现要素:
本发明的目的在于提供一种鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞的生物标志物:lnc-smad3及其杂交或同源序列。本发明的另一目的在于提供检测lnc-smad3及其杂交或同源序列的试剂在制备鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞的试剂盒中的应用。本发明的第三个目的在于提供一种鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞的方法和试剂盒。
本发明从小鼠smad3的基因位点附近筛选出了由初始状cd4+t细胞特异性表达的长链非编码rna(longnoncodingrna,lncrna)分子lnc-smad3(loc102639582,geneid:102639582,genbankaccessionnumber:ky652933,seqidno:1)。该分子在初始状cd4+t细胞中的特异性高表达,能够将初始状cd4+t细胞更好的与其他免疫细胞,如cd8+t细胞、b细胞、树突状细胞、巨噬细胞等区分开来。并且,lnc-smad3的表达量能够反映初始状cd4+t细胞往调节性t细胞方向的分化程度,并能够反映分化出的调节性t细胞的成熟和功能状态。这在临床和科研中对初始状cd4+t细胞和/或其分化而成的调节性t细胞的鉴定,其成熟和/或其功能状态的判断以及相关疾病的诊断中有广泛的应用前景,可用于例如对象中免疫功能判断、免疫治疗方案选择(例如针对临床感染、炎症、自身免疫性疾病以及肿瘤等免疫相关性疾病的治疗方案选择)和/或预后评估(例如免疫功能的预后评估)。在此基础上,完成了本发明。
本发明的第一方面,提供选自下组的rna序列在制备鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞和/或其成熟状态以及功能的试剂或试剂盒中的应用:
(a)seqidno:1所示的长非编码rna;
(b)在严格条件下与(a)限定的序列杂交的序列;
(c)与(a)或(b)中序列具有90%以上序列相同性的rna序列;和
(d)(a)或(b)中序列在非小鼠哺乳动物中的同源序列。
本发明的第二方面,提供检测选自下组的rna序列水平的试剂在制备鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞和/或其成熟状态以及功能的试剂盒中的应用:
(a)seqidno:1所示的长非编码rna;
(b)在严格条件下与(a)限定的序列杂交的序列;
(c)与(a)或(b)中序列具有90%以上序列相同性的rna序列;和
(d)(a)或(b)中序列在非小鼠哺乳动物中的同源序列。
在本发明的优选实施方式中,所述rna序列是seqidno:1所示的长非编码rna。
在本发明的一些实施方式中,所述初始状cd4+t细胞和/或其分化而成的调节性t细胞来源于哺乳动物,优选小鼠、人、大鼠、犬、猴、猩猩、猪、马、牛或羊,更优选小鼠。
在本发明的一些实施方式中,所述成熟状态选自:细胞表面淋巴细胞归巢受体cd44/cd62l的表达、抑制性受体cd25/clta4/gitr的表达、免疫抑制性细胞因子il-10的产生;所述功能选自:抑制效应性细胞的增殖和活化、负向调控免疫应答、抑制炎症、维持免疫稳态。lnc-smad3的表达量与调节性t细胞的成熟功能状态呈负相关。当lnc-smad3表达量降低时,代表初始状cd4+t细胞往调节性t细胞方向成功分化,当lnc-smad3表达量降低85%时,代表调节性t细胞分化成熟,能有效的抑制效应性细胞的增殖和活化,维持免疫稳态。
在本发明的一些实施方式中,所述rna序列的水平用于免疫功能判断、免疫治疗方案选择和/或预后评估。
在本发明的一些实施方式中,若待鉴别细胞中所述rna序列的水平高于非初始状cd4+t细胞,则表明该待鉴别细胞是初始状cd4+t细胞;若待鉴别细胞为初始状cd4+t细胞,且处理后所述rna序列的水平较处理前降低,则表明所述待鉴别细胞正往成熟调节性t细胞方向转化,且表明所述处理能诱导向成熟调节性t细胞的转化,并使得待鉴别细胞具有或正趋于具有选自下组的一种或多种功能:抑制效应性t细胞的增殖和活化、负向调控免疫应答、抑制炎症、维持免疫稳态。
在本发明的一些实施方式中,所述非初始状cd4+t细胞为选自下组中的一种或两种以上:cd8+t细胞、b细胞、树突状细胞、巨噬细胞。
在本发明的一些实施方式中,所述鉴别通过选自下组中的一种或两种以上方法进行:qrt-pcr、rna印迹法、原位杂交、生物芯片技术、流式细胞术、二代测序rna-seq,优选qrt-pcr。
在本发明的一些实施方式中,所述试剂为选自下组中的一种或两种以上:针对所述rna序列的探针或引物、或其他以此序列为指示的检测方法。
在本发明的一些实施方式中,所述引物是qrt-pcr检测用的定量引物,优选seqidno:2和seqidno:3所示的引物。
在本发明的一些实施方式中,所述试剂盒还包含:其它鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞的试剂,例如cd4、cd62l/cd44、cd25/foxp3、ctla4、gitr检测试剂。
本发明的第三方面,提供一种用于鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞的试剂盒,其包含:
i)检测选自下组的rna序列水平的试剂:
(a)seqidno:1所示的长非编码rna;
(b)在严格条件下与(a)限定的序列杂交的序列;
(c)与(a)或(b)中序列具有90%以上序列相同性的rna序列;和
(d)(a)或(b)中序列在非小鼠哺乳动物中的同源序列;
ii)容纳所述试剂的容器。
在本发明的一些实施方式中,所述鉴别通过选自下组中的一种或两种以上方法进行:qrt-pcr、rna印迹法、原位杂交、生物芯片技术、流式细胞术、二代测序rna-seq,优选qrt-pcr。
在本发明的一些实施方式中,所述试剂为选自下组中的一种或两种以上:针对所述rna序列的探针或引物、或其他以此序列为指示的检测方法。
在本发明的一些实施方式中,所述引物是qrt-pcr检测用的定量引物,优选seqidno:2和seqidno:3所示的引物。
在本发明的一些实施方式中,所述试剂盒还包含:其它鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞的试剂,例如cd4、cd62l/cd44、cd25/foxp3、ctla4、gitr检测试剂。
本发明的第四方面,提供一种鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞的方法、或鉴别能诱导产生调节性t细胞或使其成熟的试剂或体系的方法,所述方法包括检测待鉴别细胞中选自下组的rna序列的水平的步骤:
(a)seqidno:1所示的长非编码rna;
(b)在严格条件下与(a)限定的序列杂交的序列;
(c)与(a)或(b)中序列具有90%以上序列相同性的rna序列;和
(d)(a)或(b)中序列在非小鼠哺乳动物中的同源序列;
在本发明的一些实施方式中,所述方法还包括:
将待鉴别细胞中所述rna序列的水平与非初始状cd4+t细胞中所述rna序列的水平比较,或将处理前的待鉴别细胞中所述rna序列的水平与不同时间段或处理阶段的待鉴别细胞中的所述rna序列水平比较;
其中,若待鉴别细胞中所述rna序列的水平高于非初始状cd4+t细胞,则表明该所测细胞是初始状cd4+t细胞;
若待鉴别细胞为初始状cd4+t细胞,该所测细胞中所述rna序列的水平较处理前降低,则表明该所测细胞趋于往调节性t细胞方向分化;
若采用候选试剂或体系处理初始状cd4+t细胞后,所测细胞中的所述rna序列水平与处理前相比降低,则表明所述候选试剂或体系能诱导初始状cd4+t细胞往调节性t细胞方向分化成熟。
lnc-smad3的表达量与调节性t细胞的分化、成熟和功能状态呈负相关。当lnc-smad3表达量降低时,代表初始状cd4+t细胞成功往调节性t细胞分化,分化产生的调节性t细胞更加成熟,更能有效的抑制效应性t细胞应答,负向调控免疫应答。
本文中提供的所有数值范围旨在清楚地包括落在范围端点之间的所有数值及它们之间的数值范围。可对本发明提到的特征或实施例提到的特征进行组合。本说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。
如本文所用,“含有”、“具有”或“包括”包括了“包含”、“主要由……构成”、“基本上由……构成”、和“由……构成”;“主要由……构成”、“基本上由……构成”和“由……构成”属于“含有”、“具有”或“包括”的下位概念。
如本文所用,术语“表达”在描述lnc-smad3是指其rna水平。
lnc-smad3及其杂交和同源序列
如本文所用,术语“lnc-smad3”是指(a)由初始状cd4+t细胞特异性表达的长链非编码rna分子(lncrna),其序列如seqidno:1所示;(b)在严格条件下与(a)限定的序列杂交的序列;(c)与(a)或(b)中序列具有90%以上序列相同性的rna序列;和(d)(a)或(b)中序列在非小鼠哺乳动物中的同源序列。
在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2×ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。
本发明的rna全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。
试剂盒
本发明中还提供了用于鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞的试剂盒,其中包含(i)检测本发明分子标志物lnc-smad3的一种或多种试剂;和(ii)容纳所述试剂的容器。
用于本发明中的检测方法可采用本领域中常用的rna检测方法,只要该方法可检测出lnc-smad3的水平或水平变化,这些方法包括但不限于:qrt-pcr、rna印迹法、原位杂交、生物芯片技术、流式细胞术等检测方法,本领域技术人员可根据需要进行选择。
可根据多种检测原理和方法,按照需要在试剂盒中配备检测lnc-smad3平的试剂或试剂组。在本发明中,“试剂组”是指包含了检测所需的多种试剂的试剂组合。
此外,本发明的试剂盒还可根据需要包括:容器、对照物(包括阳性或阴性对照)、使用说明书、缓冲剂等,本领域技术人员可根据具体情况对其进行选择。
本发明优点在于:
1、确定了一种能鉴别初始状cd4+t细胞和/或其分化而成的调节性t细胞和/或其成熟及功能状态的特异性分子标志物——lnc-smad3;
2、为临床和科研中涉及初始状cd4+t细胞和/或其分化而成的调节性t细胞的应用和研究提供了简便而有效的工具和方法,具有广泛的应用前景。
附图说明
图1:lnc-smad3在各类免疫细胞中的表达量的qrt-pcr检测。图中,一个点代表一个样品重复。
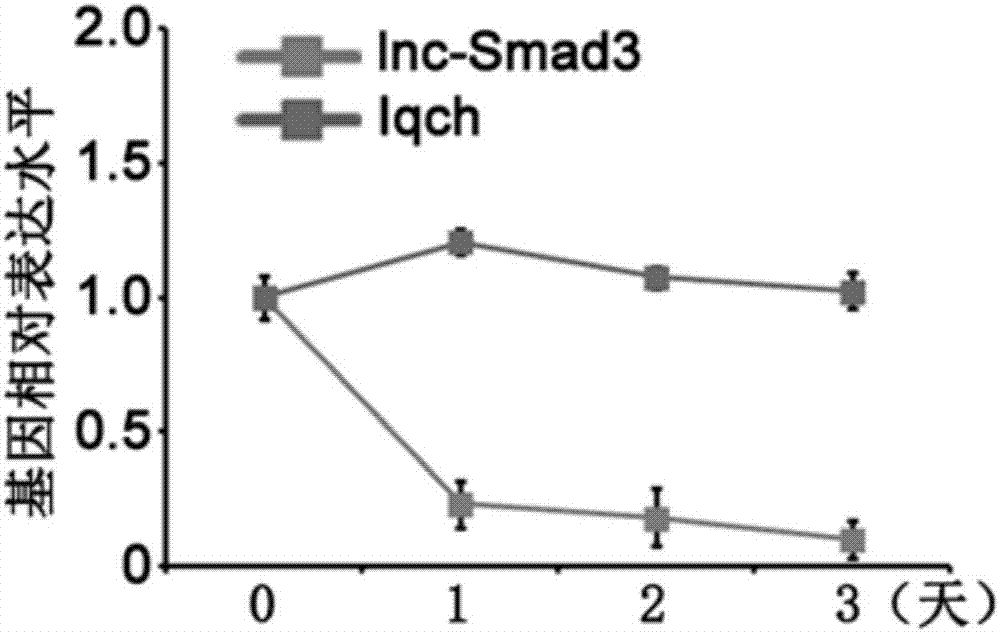
图2:lnc-smad3在初始状cd4+t细胞向成熟调节性t细胞分化成熟过程中表达量的qrt-pcr检测。图中所示结果为平均值±标准差(n=3)。
图3:qrt-pcr检测初始状cd4+t细胞分化来的调节性t细胞中lnc-smad3的rna水平,从而证实lnc-smad3慢病毒(lenti-lnc-smad3)的过表达效率;结果显示为平均值±标准差(n=3)。
图4:qrt-pcr检测初始状cd4+t细胞分化来的调节性t细胞中foxp3的rna水平,从而证实在利用lnc-smad3慢病毒增加了lnc-smad3的表达后,调节性t细胞的关键转录因子的表达受到明显抑制;结果显示为平均值±标准差(n=3)。
图5:流式检测初始状cd4+t细胞分化来的调节性t细胞中foxp3的蛋白水平,从而证实在利用lnc-smad3慢病毒增加了lnc-smad3的表达后,初始状cd4+t细胞往调节性t细胞的分化发育受阻碍。
图6:流式检测调节性t细胞表面受体的表达,证实在利用lnc-smad3慢病毒增加了lnc-smad3的表达后,调节性t细胞功能相关的表面受体的表达受到明显抑制;结果显示为平均值±标准差(n=3)。
图7.elisa检测在利用lnc-smad3慢病毒增加了lnc-smad3的表达后,调节性t细胞分泌的il-10的水平降低;结果显示为平均值±标准差(n=3)。
图8.调节性t细胞抑制实验检测调节性t细胞在过表达lnc-smad3后抑制效应性t细胞增殖的能力;结果显示为平均值±标准差(n=3)。
以上图中,lenti-ctr=对照。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。本领域技术人员可对本发明做出适当的修改、变动,这些修改和变动都在本发明的范围之内。
下列实施例中未注明具体条件的实验方法,可采用本领域中的常规方法,例如参考《分子克隆实验指南》(第三版,纽约,冷泉港实验室出版社,newyork:coldspringharborlaboratorypress,1989)或按照供应商所建议的条件。dna的测序方法为本领域常规的方法,也可由商业公司提供测试。
除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1.初始状cd4+t细胞分化成调节性t细胞的培养过程
根据文献记载在体外使小鼠来源的初始状cd4+t细胞分化培养成调节性t细胞(roychoudhuri,r.etal.bach2represseseffectorprogramstostabilizet(reg)-mediatedimmunehomeostasis.nature498,506-510(2013).)。
利用初始状cd4+t细胞分离试剂盒(stemcell)从小鼠脾脏细胞中分离出初始状cd4+t细胞。将分选得到的初始状cd4+t细胞培养于37℃的细胞培养箱中[24孔板,1×106个细胞/孔,1ml/孔rpmi-1640(paa)细胞培养液,其中含10%(v/v)fcs(paa),外加anti-cd3(1μg/ml),anti-cd28mabs(1μg/ml),anti-ifn-γ(10μg/ml),anti–il-4(10μg/ml),il-2(5ng/ml)以及重组人tgf-β(10ng/ml)]。培养置第三天时,初始状cd4+t细胞分化成成熟的调节性t细胞。
实施例2:lnc-smad3及其基因组附近基因的定量实时pcr(qrt-pcr)检测
取实施例1中利用试剂盒分选得到的初始状cd4+t细胞(图1)或往调节性t细胞分化培养的各个时间点的细胞(图2),采用trizol(invitrogen公司)提取其中的rna样品。qrt-pcr使用sybrrt-pcr试剂盒(takara公司,sybrgreenrealtimepcrmastermixcode:qpk-201),并在lightcycler(roche公司)实时定量pcr仪上进行操作。
lnc-smad3的qrt-pcr检测用的定量引物为:
5'-aggccaacgatccaggttta-3'(上游,seqidno:2);
5'-acatgtctggaggcaatgga-3'(下游,seqidno:3)。
作为无变化对照的lnc-smad3基因组附近基因iqchqrt-pcr检测用的定量引物为:
5'-tgggcatgttaacaatcggtg-3'(上游,seqidno:4);
5'-tcttcctcctctttgctctgt-3'(下游,seqidno:5)。
反转录反应参数:42℃20分钟,99℃5分钟。
qrt-pcr反应参数:95℃15秒,57℃10秒,68℃2秒读板,72℃30秒,40循环。
rna的相对定量使用2-δδct法计算(以gapdh为内参)。
gapdhqrt-pcr检测用的定量引物为:
5'-aggtcggtgtgaacggatttg-3'(上游,seqidno:6);
5'-tgtagaccatgtagttgaggtca-3'(下游,seqidno:7)。
测试结果如图1和图2所示。
图1中的数据显示:lnc-smad3仅在初始状cd4+t细胞中高表达,而在其它免疫细胞亚群中不表达或表达量很低。
cd8+t细胞是采用抗cd8磁珠(miltenyibiotech)从小鼠脾脏细胞中分离而出;b细胞是采用抗b220磁珠(miltenyibiotech)从小鼠脾脏细胞中分离而出;树突状细胞是利用小鼠骨髓细胞外加100ng/ml小鼠gm-csf和10ng/ml小鼠il-4细胞因子(r&dsystems,minneapolis,mn)培养七天而获得;巨噬细胞是往小鼠腹腔注射肉汤,三天后抽取腹水而获得。
图2中的数据显示:lnc-smad3在初始状cd4+t细胞分化为调节性t细胞的过程中(第0天~第3天)表达量显著下调,在调节性t细胞分化成熟时(第3天)达到最低值,低于初始状cd4+t细胞(第0天)中表达量的10%。而作为无关对照的其它基因iqch的表达量在cd4+t细胞分化为调节性t细胞的过程没有明显变化。
以上结果表明:
lnc-smad3可以作为鉴别初始状cd4+t细胞的特异性生物标记物,其表达水平可用于区别初始状cd4+t细胞与其它免疫细胞。
并且,lnc-smad3也可以作为鉴别调节性t细胞成熟状态的特异性生物标记物,其表达水平的高低,可用于确定调节性t细胞的成熟状态,并可进一步用于确定与调节性t细胞成熟状态相对应的免疫功能。
实施例3:lnc-smad3的定量实时pcr(qrt-pcr)检测
用小鼠cd4+t细胞的cdna为模板,设计引物分别pcr扩增出小鼠lnc-smad3序列;将扩增片段引入pcdh-cmv-mcs-ef1-puroegfp载体中,利用lentivectors表达体系(systembiosciences)构建表达lnc-smad3的慢病毒(lenti-lnc-smad3)。
在初始状cd4+t细胞分化发育为调节性t细胞的过程中,用表达lnc-smad3的慢病毒及其对照载体(lenti-ctr)感染细胞(moi=100)。第三天收细胞采用trizol(invitrogen公司)提取其中的rna样品。qrt-pcr使用sybrrt-pcr试剂盒(takara公司,sybrgreenrealtimepcrmastermixcode:qpk-201),并在lightcycler(roche公司)实时定量pcr仪上进行操作。
lnc-smad3的qrt-pcr检测用的定量引物为:
5'-aggccaacgatccaggttta-3'(上游,seqidno:2);
5'-acatgtctggaggcaatgga-3'(下游,seqidno:3)。
反转录反应参数:42℃20分钟,99℃5分钟。
qrt-pcr反应参数:95℃15秒,57℃10秒,68℃2秒读板,72℃30秒,40循环。
rna的相对定量使用2-δδct法计算(以gapdh为内参)。
gapdhqrt-pcr检测用的定量引物为:
5'-aggtcggtgtgaacggatttg-3'(上游,seqidno:6);
5'-tgtagaccatgtagttgaggtca-3'(下游,seqidno:7)。
测试结果如图3所示。
实施例4:foxp3的定量实时pcr(qrt-pcr)检测
在初始状cd4+t细胞分化发育为调节性t细胞的过程中,用表达lnc-smad3的慢病毒及其对照载体(lenti-ctr)感染细胞(moi=100)。第三天收细胞采用trizol(invitrogen公司)提取其中的rna样品。qrt-pcr使用sybrrt-pcr试剂盒(takara公司,sybrgreenrealtimepcrmastermixcode:qpk-201),并在lightcycler(roche公司)实时定量pcr仪上进行操作。
foxp3的qrt-pcr检测用的定量引物为:
5'-cccatccccaggagtcttg-3'(上游,seqidno:8);
5'-accatgactaggggcactgta-3'(下游,seqidno:9)。
反转录反应参数:42℃20分钟,99℃5分钟。
qrt-pcr反应参数:95℃15秒,57℃10秒,68℃2秒读板,72℃30秒,40循环。
rna的相对定量使用2-δδct法计算(以gapdh为内参)。
gapdhqrt-pcr检测用的定量引物为:
5'-aggtcggtgtgaacggatttg-3'(上游,seqidno:6);
5'-tgtagaccatgtagttgaggtca-3'(下游,seqidno:7)。
测试结果如图4所示。
实施例5:调节性t细胞内foxp3的流式检测
在初始状cd4+t细胞分化发育为调节性t细胞的过程中,用表达lnc-smad3的慢病毒及其对照载体(lenti-ctr)感染细胞(moi=100)。第三天收细胞,并采用流式细胞术检测细胞胞内foxp3的蛋白水平。
所用细胞流式抗体标记是cytofix/cytoperm试剂盒(ebioscience),按照其标准操作流程进行。流式细胞检测用的是facslsrii流式细胞仪,软件为facsiva(bdbiosciences)。具体步骤可参见本实验室之前发表的论文(liu,j.等rhbdd3controlsautoimmunitybysuppressingtheproductionofil-6bydendriticcellsviak27-linkedubiquitinationoftheregulatornemo.natureimmunology.2014;15:612-622.)
实验结果如图5所示。结果显示:过表达lnc-smad3后调节性t细胞的关键性转录因子foxp3的表达有明显的降低,说明调节性t细胞的分化发育受到阻碍。
实施例6:调节性t细胞表面抑制性受体cd25/ctla-4/gitr的流式检测
在初始状cd4+t细胞分化发育为调节性t细胞的过程中,用表达lnc-smad3的慢病毒及其对照载体(lenti-ctr)感染细胞(moi=100)。第三天收细胞,并采用流式细胞术检测细胞表面抑制性受体cd25/ctla-4/gitr的水平。检测方法同实施例5。
实验结果如图6所示。结果显示:过表达lnc-smad3后调节性t细胞的表面抑制性受体cd25/ctla-4/gitr的水平均有明显的降低,说明调节性t细胞的成熟受到阻碍。
实施例7:调节性t细胞分泌il-10的功能检测
在初始状cd4+t细胞分化发育为调节性t细胞的过程中,用表达lnc-smad3的慢病毒及其对照载体(lenti-ctr)感染细胞(moi=100)。第三天收细胞培养上清,采用elisa(r&d公司)检测il-10,具体步骤参照elisa试剂盒说明书。
实验结果如图7所示。该结果显示:lnc-smad3过表达后调节性t细胞分泌il-10的能力明显下降。
由于分泌il-10以及表达抑制性受体cd25/ctla-4/gitr是调节性t细胞成熟并具有免疫抑制功能的显著特征,因此上述结果表明lnc-smad3参与抑制调节性t细胞的成熟和功能。
实施例8:调节性t细胞抑制效应性t细胞增殖功能的检测
5×104cfse标记后的cd4+效应t细胞(来自cd45.1小鼠)与1×104cd11c+dc共培养于96孔圆底板中。按照实例3-7处理的调节性t细胞以2.5×104的细胞量加入体系中。给予anti-cd3(1μg/ml)刺激3天后,用流式细胞术通过检测cd45.2+的t细胞数量,来分析t细胞的增殖情况,从而评估体系中调节性t细胞所发挥的抑制作用。
实验结果如图8所示。结果显示:过表达lnc-smad3后调节性t细胞抑制效应性t细胞增殖的能力明显减弱。
综上所述,实施例3-8中的结果表明,在初始状cd4+t细胞往调节性t细胞分化发育的过程中,lnc-smad3表达的下降是调节性t细胞正常分化、成熟和具备功能是必需的。对lnc-smad3进行过表达后能够实现对调节性t细胞成熟和功能的调控,以及对调节性t细胞介导的相关免疫应答的调控。因此,lnc-smad3可作为鉴定初始状cd4+t细胞和/或其分化而成的调节性t细胞和/或其成熟状态以及功能的特异性生物标志物,且可应用于免疫相关性疾病的诊断、干预和预后检测。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
sequencelisting
<110>中国人民解放军第二军医大学
<120>一种初始状cd4+t细胞和/或其分化而成的调节性t细胞的特异性生物标志物
<130>/
<160>9
<170>patentinversion3.3
<210>1
<211>1260
<212>dna
<213>小鼠(musmusculus)
<400>1
cggcgcgtgcgcacaggacgggacgggagggcggagcgactgcgcagatcaggaaaattg60
tcacctctggcctcagggaaactgaggctctgagcagttaagaggccaacgatccaggtt120
tatgctatcagtgtctgagatacaattaagtcacctttttgggtgacatttcccttgact180
agtacctcaagattatgatccaggtggaccatccctccattgcctccagacatgtctatg240
acgctacctagggattgtgaagatttaccacctggtggaaaattaaaaaaaaagacttat300
tctgcaaattgaccaagcttaagagatacagcactgagaattcacccactacagagctgg360
taaccaggccttcagagtaagctgtgatgtatagccattctcctcagcagcctgtttgac420
tgagggatataggaatgactgcccttacccatgtttttgttcagatttatggttctaaat480
ctgatggaaaatctatcattggaccatttgattcttcctaaagaaaggccaaaccacctg540
tcaaacccacgagcaacacagcaatggctaagctgaagaagccaagttatatgtctagct600
cctctgtgggtggcaggatccagctgtggggagtccaaggttccttgtgttcttctggct660
tgactatgatatttccaatttggaggcacaaagaattgagaacttggggatccactgagg720
tctgaggcatggtggtaccagaagaaataaaggggccatcagcatgaagctggtctccca780
ttgacagcaccctgacttctccatcaggttctatcagcatgtctactgtgaggttggtga840
cgctgtctgcaggtgggtatgcttcaatcacgccacctggtcaggaaaccatggagtaga900
ggaaaagacacagtcaagggaatgctatgcttatagcaggaggaaatgctctgtgtttta960
gcaagggaacttagactatctcacacctgtcatatcctgggaaactttgggtgagtagtt1020
caacctttggcctccttttccttatttatagaatggaggcataatatctaccttgccaag1080
cttttgtgaagtttgagaaactgagtctatggtatttagcctggtacttggaacatggga1140
gggctcaatgaacagtaagtagtctttattatgatcataattacaaatattacaaatact1200
ttataaaagccatacttagaacaactcattacgttaataaagaatccaaggattgtggtc1260
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
aggccaacgatccaggttta20
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
acatgtctggaggcaatgga20
<210>4
<211>21
<212>dna
<213>人工序列
<400>4
tgggcatgttaacaatcggtg21
<210>5
<211>21
<212>dna
<213>人工序列
<400>5
tcttcctcctctttgctctgt21
<210>6
<211>21
<212>dna
<213>人工序列
<400>6
aggtcggtgtgaacggatttg21
<210>7
<211>23
<212>dna
<213>人工序列
<400>7
tgtagaccatgtagttgaggtca23
<210>8
<211>19
<212>dna
<213>人工序列
<400>8
cccatccccaggagtcttg19
<210>9
<211>21
<212>dna
<213>人工序列
<400>9
accatgactaggggcactgta21
- 还没有人留言评论。精彩留言会获得点赞!
- 用于血癌分析与临床处理的细胞抗原及靶信号转导蛋白的复合分布的制作方法
- 鳞状细胞癌抗原阴性宫颈癌血清蛋白质检测的质谱试剂盒的制作方法
- 鳞状细胞癌抗原(scc)定量测定试剂盒及其检测方法
- 一种从血清代谢轮廓筛选恶性卵巢肿瘤标志物的方法
- 一种癌抗原ca15-3的纳米磁微粒化学发光测定试剂盒及其制备方法和检测方法
- 鳞状细胞癌抗原化学发光免疫分析定量测定试剂盒及其制备方法
- 全防紫外线抗疲劳及防恶性黑色素细胞癌光学防护材料的制作方法
- 用于产生针对细胞相关抗原如p2x7、cxcr7或cxcr4的免疫球蛋白的基因免疫的制作方法
- 抗人前列腺特异性膜抗原胞外区单链抗体及其应用的制作方法
- 用于单独测定scca同形异构体的免疫测定法的制作方法