蛋白质TaVRS1‑2B及其编码基因与应用的制作方法
本发明属于生物技术领域,具体涉及蛋白质TaVRS1-2B及其编码基因与应用。
背景技术:
小麦是世界上主要的粮食作物之一,全世界35-40%的人口以它为主要的食物来源。目前,在有限耕地面积的情况下,选育单产突出的小麦新品种是稳定和提高小麦产量最经济有效的途径。因此,小麦的结实性器官“小麦穗”一直是小麦育种学家研究的重要对象。
花在花序柄上有规律的排列方式称为花序,花序发育是植物形态建成的重要组成,花序分生组织由茎尖分生组织分化、发育而来,侧部器官由幼叶、侧枝进一步发育成为花及花序(即小穗)。小麦为复穗状花序,穗轴上着生若干轴节,每个轴节基部着生一个小穗。每个小穗产生3-10朵小花。穗型性状包括穗粒数、小穗数和小花数。于振文等研究表明,穗粒重与籽粒产量之间有极显著的正相关。因此,高产田可以侧重于改善单株的生长发育条件,提高单穗生产力。每穗粒数与每穗粒重之间存在极显著的正相关,千粒重与每穗粒重间仅表现一定的正向关系,说明在一定的栽培条件下,通过增加每穗粒数的途径提高穗粒重是一种可行的途径。
技术实现要素:
本发明所要解决的技术问题是如何调控小麦穗型性状和/或幼穗发育时间。
为解决上述技术问题,本发明首先提供了蛋白质TaVRS1-2B。
本发明所提供的蛋白质TaVRS1-2B,来源于小麦(Triticum aestivum L.),可为a1)或a2)或a3):
a1)氨基酸序列是序列表中序列2所示的蛋白质;
a2)在序列表中序列2所示的蛋白质的N端或/和C端连接标签得到的融合蛋白质;
a3)将序列表中序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物穗型性状和/或生殖器官发育时间相关的蛋白质;所述穗型性状为d1)和/或d2)和/或d3):d1)穗粒数;d2)小穗数;d3)小花数。
其中,序列表中序列2可由238个氨基酸残基组成。
为了使a1)中的蛋白质便于纯化,可在序列表中序列2所示的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
表1标签的序列
上述a3)中的蛋白质,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。
上述a3)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
上述a3)中的蛋白质的编码基因可通过将序列表中序列1所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上标签的编码序列得到。
编码所述蛋白质TaVRS1-2B的核酸分子也属于本发明的保护范围。
编码所述蛋白质TaVRS1-2B的核酸分子可为如下b1)或b2)或b3)或b4)所示的DNA分子:
b1)编码区如序列表中序列1所示的DNA分子;
b2)核苷酸序列是序列表中序列1所示的DNA分子;
b3)与b1)或b2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质TaVRS1-2B的DNA分子;
b4)在严格条件下与b1)或b2)限定的核苷酸序列杂交,且编码所述蛋白质TaVRS1-2B的DNA分子。
其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。
其中,序列表中序列1由717个核苷酸组成,序列表中序列1的核苷酸编码序列表中序列2所示的氨基酸序列。
本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述蛋白质TaVRS1-2B的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的所述蛋白质TaVRS1-2B的核苷酸序列75%或者更高同一性的核苷酸,只要编码所述蛋白质TaVRS1-2B,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列表的序列2所示的氨基酸序列组成的蛋白质TaVRS1-2B的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
含有编码所述蛋白质TaVRS1-2B的核酸分子的表达盒、重组载体、重组微生物或转基因细胞系也属于本发明的保护范围。
所述重组载体可为向表达载体插入编码所述蛋白质TaVRS1-2B的核酸分子得到的重组质粒。
所述重组载体具体可为重组质粒pUbi::TaVRS1-2B-pAHC25。所述重组质粒pUbi::TaVRS1-2B-pAHC25具体可为将载体pUbi-pAHC25的限制性内切酶BamHⅠ和KpnⅠ识别序列间的小片段替换为序列表中序列1自5’末端起第1至714位所示的DNA分子。
所述重组微生物可通过将所述重组载体导入出发微生物得到。所述出发微生物可为酵母、细菌、藻类或真菌。
所述转基因植物细胞系均不包括繁殖材料。所述转基因植物理解为不仅包含将所述TaTFL1-2B基因(即蛋白质TaTFL1-2B的编码基因)转化受体植物得到的第一代转基因植物,也包括其子代。对于转基因植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述转基因植物包括种子、愈伤组织、完整植株和细胞。
下述g1)或g2)也属于本发明的保护范围:
g1)所述蛋白质TaVRS1-2B,或,编码所述蛋白质TaVRS1-2B的核酸分子,或,含有编码所述蛋白质TaVRS1-2B的核酸分子的表达盒、重组载体、重组微生物或转基因细胞系,在调控植物穗型性状和/或生殖器官发育时间中的应用;
g2)所述蛋白质TaVRS1-2B,或,编码所述蛋白质TaVRS1-2B的核酸分子,或,含有编码所述蛋白质TaVRS1-2B的核酸分子的表达盒、重组载体、重组微生物或转基因细胞系,在培育穗型性状改变和/或生殖器官发育时间改变的转基因植物中的应用;
所述穗型性状可为d1)和/或d2)和/或d3):d1)穗粒数;d2)小穗数;d3)小花数。
上述应用中,所述调控植物穗型性状可为植物穗型性状劣。所述穗型性状劣可体现为e1)和/或e2)和/或e3):e1)穗粒数减少;e2)小穗数减少;e3)小花数减少。所述调控植物生殖器官发育时间具体可为缩短植物生殖器官发育时间。
为解决上述技术问题,本发明还提供了一种培育转基因植物的方法。
本发明所提供的培育转基因植物的方法,可包括将编码所述蛋白质TaVRS1-2B的核酸分子导入受体植物中,得到转基因植物的步骤;与所述受体植物相比,所述转基因植物的穗型性状改变和/或生殖器官发育时间缩短。
上述方法中,编码所述蛋白质TaVRS1-2B的核酸分子可为如下b1)或b2)或b3)或b4)所示的DNA分子:
b1)编码区如序列表中序列1所示的DNA分子;
b2)核苷酸序列是序列表中序列1所示的DNA分子;
b3)与b1)或b2)限定的核苷酸序列具有75%或75%以上同一性,且编码所述蛋白质TaVRS1-2B的DNA分子;
b4)在严格条件下与b1)或b2)限定的核苷酸序列杂交,且编码所述蛋白质TaVRS1-2B的DNA分子。
其中,所述核酸分子可以是DNA,如cDNA、基因组DNA或重组DNA;所述核酸分子也可以是RNA,如mRNA或hnRNA等。
其中,序列表中序列1由717个核苷酸组成,序列表中序列1的核苷酸编码序列表中序列2所示的氨基酸序列。
上述方法中,所述“将编码所述蛋白质TaVRS1-2B的核酸分子导入受体植物中”可通过向受体植物中导入重组载体实现;所述重组载体可为向表达载体插入编码所述蛋白质TaVRS1-2B的核酸分子得到的重组质粒。
所述重组载体具体可为所述重组质粒pUbi::TaVRS1-2B-pAHC25。
为解决上述技术问题,本发明还提供了一种植物育种方法。
本发明所提供的植物育种方法,可包括如下步骤:增加植物中所述蛋白质TaVRS1-2B的含量和/或活性,从而穗型性状改变和/或生殖器官发育时间缩短。
上述任一所述方法中,所述穗型性状改变为所述穗型性状改变为穗粒数减少和/或小穗数减少和/或小花数减少。所述生殖器官发育时间缩短表现为幼穗发育时间缩短。所述幼穗发育时间具体可为幼穗在二棱期的发育时间和/或幼穗在小花分化期的发育时间和/或幼穗在雌雄蕊分化期的发育时间。
上述任一所述植物可为如下c1)至c5)中的任一种:c1)双子叶植物;c2)单子叶植物;c3)禾本科植物;c4)小麦;c5)小麦品种科农199。
实验证明,在科农199中过表达蛋白质TaVRS1-2B,可显著缩短幼穗的发育时间(如在二棱期的发育时间、在小花分化期的发育时间、在雌雄蕊分化期的发育时间),进而导致小穗数减少、小花数减少和穗粒数减少。因此,蛋白质TaVRS1-2B在调控小麦穗型性状和幼穗发育时间中具有重要的应用价值,在培育小麦品种中具有广阔前景。
附图说明
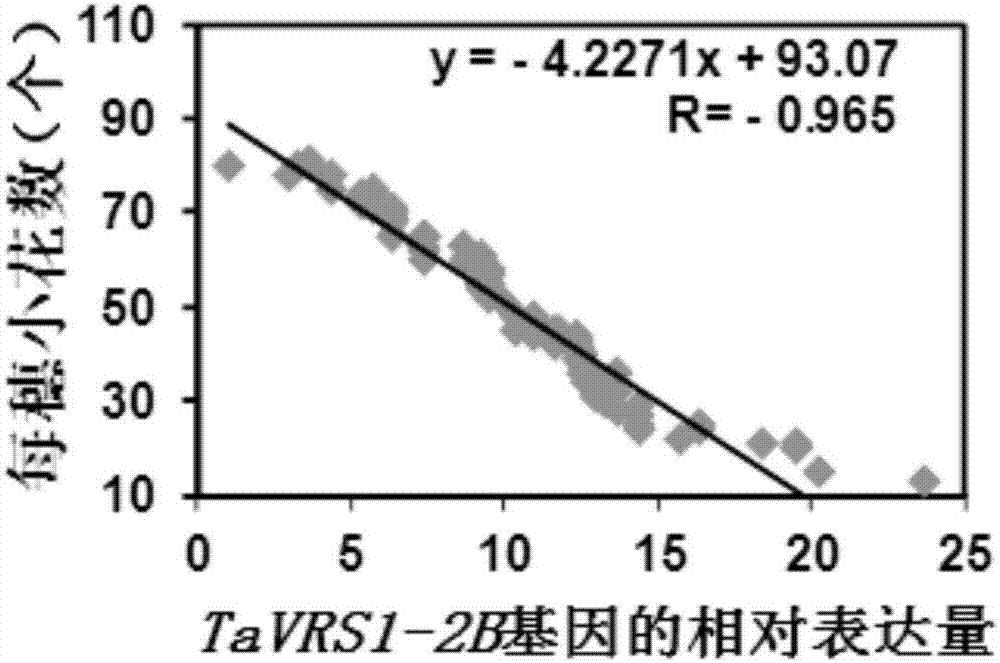
图1为TaTFL1-2B基因的相对表达量与每穗小穗数的相关性分析。
图2为TaTFL1-2B基因的相对表达量与每穗小花数的相关性分析。
图3为TaTFL1-2B基因的相对表达量与每穗穗粒数的相关性分析。
图4为电镜扫描的部分实验结果。
图5为各个发育时期发育天数的部分统计结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
RNA Miniprep Kit为Axygen公司的产品。TransScript First-Strand cDNA Synthesis SuperMix Kit为TransGen的产品。Premix Ex TaqTM为TaKaRa公司的产品。逆转录酶为TransGen的产品,产品目录号为AT301-02。KOD-plus-DNA聚合酶和10×PCR buffer for KOD-plus均为TOYOBO公司的产品,产品目录号为KOD-201。载体pGEM-Teasy为Promega公司的产品,产品目录号为A3600。扫描电子显微镜临界点干燥仪为HITACHI公司的产品,产品型号为HCP-2。冷冻扫描电子显微镜为HITACHI公司的产品,产品型号为S-3000N。
载体pUbi-pAHC25记载于如下文献中:Jing Wang,Jinghan Sun,et al.A phosphate starvation response regulator Ta-PHR1is involved in phosphate signalling and increases grain yield in wheat.Ann Bot.2013Jun;111(6):1139-53.
实施例1、TaVRS1-2B基因的克隆
1、提取小麦品种科农199(以下简称科农199)处于二棱期的幼穗组织的总RNA,然后将该总RNA用逆转录酶反转录出第一链cDNA,即得到科农199幼穗组织的cDNA。科农199幼穗组织的cDNA中DNA含量均为66ng/μL。
2、以步骤1得到的科农199幼穗组织的cDNA为模板,采用引物F:5’-CAGCAAGCATGGACAAGCAGC-3’和引物R:5’-TACCAGTCACCACCACCATC-3’进行PCR扩增,得到约1066bp的PCR扩增产物。
反应体系为50μL,由1μL KOD-plus-DNA聚合酶、1μL模板、5μL 10×PCR buffer for KOD-plus、5μL浓度为2mM的dNTPs水溶液(即dATP、dTTP、dCTP和dGTP的浓度均为2mM)、2μL浓度为25mM的MgSO4水溶液、1.5μL浓度为10μM的引物F水溶液、1.5μL浓度为10μM的引物R水溶液和33μL水组成。
反应条件:98℃预变性2min;98℃变性30s,54℃退火30s,68℃延伸40s,35个循环。
3、将步骤2得到的PCR扩增产物和载体pGEM-Teasy连接,得到重组质粒pGEM-Teasy-TaVRS1-2B。
对重组质粒pGEM-Teasy-TaVRS1-2B进行测序。测序结果表明,重组质粒pGEM-Teasy-TaVRS1-2B中含有序列表中序列1所示的DNA分子(以下命名为TaVRS1-2B基因)。
实施例2、转TaVRS1-2B基因小麦的获得及其鉴定
一、构建重组质粒pUbi::TaVRS1-2B-pAHC25
1、以实施例1构建的重组质粒pGEM-Teasy-TaVRS1-2B为模板,以5’-GGATCCATGGACAAGCAGCAGGTCTTTGG-3’(下划线为限制性内切酶BamHⅠ的酶切识别序列)和5’-GGTACCAATTAGCCCATACAGGCTAAA-3’(下划线为限制性内切酶KpnⅠ的酶切识别序列)为引物,进行PCR扩增,得到约730bp的PCR扩增产物。
2、用限制性内切酶BamHⅠ和KpnⅠ双酶切步骤1获得的PCR扩增产物,回收酶切产物。
3、用限制性内切酶BamHⅠ和KpnⅠ双酶切载体pUbi-pAHC25,回收约6.9kb的载体骨架。
4、将酶切产物和载体骨架连接,得到重组质粒pUbi::TaVRS1-2B-pAHC25。
根据测序结果,对重组质粒pUbi::TaVRS1-2B-pAHC25进行结构描述如下:将载体pUbi-pAHC25的限制性内切酶BamHⅠ和KpnⅠ识别序列间的小片段替换为序列表中序列1自5’末端起第1至714位所示的DNA分子。重组质粒pUbi::TaVRS1-2B-pAHC25表达序列表中序列2所示的蛋白质(以下命名为TaVRS1-2B蛋白或蛋白质TaVRS1-2B)。
二、T0代拟转TaVRS1-2B基因小麦的获得
采用基因枪介导的遗传转化方法,将重组质粒pUbi::TaVRS1-2B-pAHC25转化科农199,获得T0代拟转TaVRS1-2B基因小麦。
采用基因枪介导的遗传转化方法,将载体pUbi-pAHC25转化科农199,获得T0代转空载体小麦。
三、T0代拟转TaVRS1-2B基因小麦的实时定量PCR检测
随机选取96株T0代拟转TaVRS1-2B基因小麦进行实时定量PCR检测,具体步骤如下:
1、采用RNA Miniprep Kit分别提取96株T0代拟转TaVRS1-2B基因小麦处于二棱期的幼穗组织的总RNA,然后采用TransScript First-Strand cDNA Synthesis SuperMix Kit将该总RNA反转录出第一链cDNA,得到各个T0代拟转TaVRS1-2B基因小麦的cDNA。各个T0代拟转TaVRS1-2B基因小麦的cDNA中DNA含量约为74ng/μL。
2、使用RT-qPCR技术检测各个T0代拟转TaVRS1-2B基因小麦中TaVRS1-2B基因的相对表达量(以β-TaTubulin基因作为内参基因)。
检测TaVRS1-2B基因的引物为正向引物1:5’-CATCCTCCACAAATGCCACC-3’和反向引物1:5’-ACGCACATCATCAGGTCATC-3’。检测β-TaTubulin基因的引物为正向引物2:5’-ACCGCCAGCTCTTCCACCCT-3’和反向引物2:5’-TCACTGGGGCATAGGAGGAA-3’。
反应体系为20μL,由10μLPremix Ex TaqTM、0.5μL浓度为10μM的正向引物、0.5μL浓度为10μM的反向引物、1μL T0代拟转TaTFL1-2B基因小麦的cDNA和8.0μL无核酸酶水组成。
反应程序:94℃预变性2min;95℃变性3sec,60℃退火30sec,40个循环。
按照上述方法,将T0代拟转TaVRS1-2B基因小麦替换为科农199,其它步骤均不变,得到科农199中TaVRS1-2B基因的相对表达量。
按照上述方法,将T0代拟转TaVRS1-2B基因小麦替换为T0代转空载体小麦,其它步骤均不变,得到T0代转空载体小麦中TaVRS1-2B基因的相对表达量。
以科农199中的TaVRS1-2B基因的相对表达量作为1,统计其它各个小麦中TaVRS1-2B基因的相对表达量。结果表明,与科农199相比,65株T0代拟转TaVRS1-2B基因小麦(分别命名为OE-1-T0至OE-65-T0)中TaVRS1-2B基因的相对表达量均显著增加,而T0代转空载体小麦中TaVRS1-2B基因的相对表达量则无显著差异。
四、T2代转TaVRS1-2B基因小麦和T4代转TaVRS1-2B基因小麦的获得及实时定量PCR检测
将OE-1-T0至OE-65-T0经连续两代自交,获得T2代转TaVRS1-2B基因小麦,分别命名为OE-1-T2至OE-65-T2。
将OE-1-T0至OE-65-T0经连续四代自交,获得T4代转TaVRS1-2B基因小麦,分别命名为OE-1-T4至OE-65-T4。
将T0代转空载体小麦经连续两代自交,获得T2代纯合转空载体小麦。
将T0代转空载体小麦经连续四代自交,获得T4代纯合转空载体小麦。
按照步骤三的方法,对OE-1-T2至OE-65-T2、OE-1-T4至OE-65-T4、T2代纯合转空载体小麦、T4代纯合转空载体小麦和科农199分别进行实时定量PCR检测。结果表明,与科农199相比,OE-1-T2至OE-65-T2和OE-1-T4至OE-65-T4中TaVRS1-2B基因的相对表达量均显著增加,而T2代纯合转空载体小麦和T4代纯合转空载体小麦中TaVRS1-2B基因的相对表达量则无显著差异。
五、TaVRS1-2B基因的相对表达量与小麦穗型性状的相关性分析
待测小麦为OE-1-T2、OE-2-T2、OE-3-T2、OE-4-T2、OE-5-T2、OE-6-T2、OE-7-T2、OE-8-T2、OE-9-T2、OE-10-T2、OE-11-T2、OE-12-T2、OE-13-T2、OE-14-T2、OE-15-T2、OE-16-T2、OE-17-T2、OE-18-T2、OE-19-T2、OE-20-T2、OE-21-T2、OE-22-T2、OE-23-T2、OE-24-T2、OE-25-T2、OE-26-T2、OE-27-T2、OE-28-T2、OE-29-T2、OE-30-T2、OE-31-T2、OE-32-T2、OE-33-T2、OE-34-T2、OE-35-T2、OE-36-T2、OE-37-T2、OE-38-T2、OE-39-T2、OE-40-T2、OE-41-T2、OE-42-T2、OE-43-T2、OE-44-T2、OE-45-T2、OE-46-T2、OE-47-T2、OE-48-T2、OE-49-T2、OE-50-T2、OE-51-T2、OE-52-T2、OE-53-T2、OE-54-T2、OE-55-T2、OE-56-T2、OE-57-T2、OE-58-T2、OE-59-T2、OE-60-T2、OE-61-T2、OE-62-T2、OE-63-T2、OE-64-T2或OE-65-T2。
将待测小麦种植于温室,待开花后20d,调查每穗小穗数、每穗小花数和每穗穗粒数,然后与TaVRS1-2B基因的相对表达量进行相关性分析。培养条件具体如下:温度25℃,光照350μmol photons m-2s-1,湿度60-70%。
实验结果见图1、图2和图3。结果表明,TaVRS1-2B基因的相对表达量与每穗小穗数、每穗小花数和每穗穗粒数均负相关,即TaVRS1-2B基因的相对表达量越高,则每穗小穗数、小花数和穗粒数的数量越少。
六、TaVRS1-2B基因的相对表达量与小麦幼穗发育时间的研究
待测小麦为OE-1-T4、OE-2-T4、T4代纯合转空载体小麦或科农199。
取30株待测小麦幼穗进入单棱期后的第2d、第9d、第15d或第22d的幼穗,先置于甲醇中浸泡15min,再置于无水乙醇中浸泡30min,然后采用扫描电子显微镜临界点干燥仪冷冻干燥2h,最后采用冷冻扫描电子显微镜进行电镜扫描。根据电镜扫描结果,统计待测小麦幼穗在二棱期、小花分化期和雌雄蕊分化期的发育天数。
电镜扫描的部分实验结果见图4(A为科农199,B为OE-1-T4;LP为外稃原基,GP为护颖原基,数字6、7、8、9、10为小穗数,白色五角星为小穗)。各个时期发育天数的部分统计结果见图5(WT为科农199)。
结果表明,与科农199相比,OE-1-T4和OE-2-T4的幼穗在二棱期、小花分化期和雌雄蕊分化期的发育时间均显著缩短(在单棱期的发育时间无显著差异),而T4代纯合转空载体小麦的幼穗在单棱期、二棱期、小花分化期和雌雄蕊分化期的发育时间无显著差异。因此,在科农199中过表达TaVRS1-2B基因,可显著缩短幼穗的发育时间(如在二棱期的发育时间、在小花分化期的发育时间和在雌雄蕊分化期的发育时间),进而导致小穗数减少、小花数减少和穗粒数减少。
上述结果表明,蛋白质TaVRS1-2B在调控小麦穗型性状(如小穗数、小花数、穗粒数)和幼穗发育时间(如幼穗在二棱期的发育时间和/或幼穗在小花分化期的发育时间和/或幼穗在雌雄蕊分化期的发育时间)中具有重要的应用价值。
<110> 中国科学院遗传与发育生物学研究所
<120> 蛋白质TaVRS1-2B及其编码基因与应用
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 717
<212> DNA
<213> 小麦(Triticum aestivum L.)
<400> 1
atggacaagc agcaggtctt tggttcctcc tacgtggaca tgcctttctt cgcggccaat 60
ggtgcagcca cggcacaggg ggagagccgg ccgagggcgc ggcgcaggag gcggagggcc 120
gcgaggtgcg gcagagggga cggtgacggc ggggagatgg acgggggagg ggacctcaag 180
aagcggcggc tgaccgacga gcaggtgcac agtctggagc tgagcttccg ggaggagcgc 240
aagctggaga ccggccggaa ggttcatctc gctgccgagc tcgggctcga tcccaagcaa 300
gtcgcggtgt ggttccagaa ccgccgggcg cgacacaaga gcaagcttat ggaggaggag 360
ttcgccaagc tcaagcacgc ccacgacgcg gccatcctcc acaaatgcca cctcgagaac 420
gaggtgctga ggctgaagga gaggctggga gcgaccgagg aggaggtgcg acgcctcagg 480
tcggcagctg ggagccacgg agcatccggc gacggcggag acgccgctgg cgccgttggc 540
gcgtgtggcg ggagcccgag ctcgtccttc tcgacgggaa cctgccagca gcatccgggt 600
ttcagcggcg cagacgtgct ggggccggac gatgacctga tgatgtgcgt ccccgagtat 660
ggtggctacg ccgatagcag cgtggtcgag tggtttagcc tgtatgggct aatttga 717
<210> 2
<211> 238
<212> PRT
<213> 小麦(Triticum aestivum L.)
<400> 2
Met Asp Lys Gln Gln Val Phe Gly Ser Ser Tyr Val Asp Met Pro Phe
1 5 10 15
Phe Ala Ala Asn Gly Ala Ala Thr Ala Gln Gly Glu Ser Arg Pro Arg
20 25 30
Ala Arg Arg Arg Arg Arg Arg Ala Ala Arg Cys Gly Arg Gly Asp Gly
35 40 45
Asp Gly Gly Glu Met Asp Gly Gly Gly Asp Leu Lys Lys Arg Arg Leu
50 55 60
Thr Asp Glu Gln Val His Ser Leu Glu Leu Ser Phe Arg Glu Glu Arg
65 70 75 80
Lys Leu Glu Thr Gly Arg Lys Val His Leu Ala Ala Glu Leu Gly Leu
85 90 95
Asp Pro Lys Gln Val Ala Val Trp Phe Gln Asn Arg Arg Ala Arg His
100 105 110
Lys Ser Lys Leu Met Glu Glu Glu Phe Ala Lys Leu Lys His Ala His
115 120 125
Asp Ala Ala Ile Leu His Lys Cys His Leu Glu Asn Glu Val Leu Arg
130 135 140
Leu Lys Glu Arg Leu Gly Ala Thr Glu Glu Glu Val Arg Arg Leu Arg
145 150 155 160
Ser Ala Ala Gly Ser His Gly Ala Ser Gly Asp Gly Gly Asp Ala Ala
165 170 175
Gly Ala Val Gly Ala Cys Gly Gly Ser Pro Ser Ser Ser Phe Ser Thr
180 185 190
Gly Thr Cys Gln Gln His Pro Gly Phe Ser Gly Ala Asp Val Leu Gly
195 200 205
Pro Asp Asp Asp Leu Met Met Cys Val Pro Glu Tyr Gly Gly Tyr Ala
210 215 220
Asp Ser Ser Val Val Glu Trp Phe Ser Leu Tyr Gly Leu Ile
225 230 235
- 还没有人留言评论。精彩留言会获得点赞!
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺