猪结肠微生物组体外模拟培养的发酵参数的制作方法
本发明涉及生物技术和畜牧领域,尤其涉及一种猪结肠微生物组体外模拟培养的发酵参数,主要为培养基配方,还包括发酵液体体积、ph值、发酵时间、温度、搅拌速度、氧分压、补料和出料速度。
背景技术:
动物肠道中生活着大量的微生物,其数量和基因数都超过宿主(baekhed等,2005;qin等,2010),并与宿主有着紧密联系。结肠中微生物在丰度、种类和功能上占主导地位。肠道微生物具有重要的营养、免疫、抗肿瘤和抗衰老等作用(王珊珊等,2015),微生物不仅能发酵底物为宿主提供宿主所需能量的10%,合成维生素,促进营养物质的吸收;还能促进免疫器官的发育和免疫细胞的增殖分化,抑制病原菌在体内的增殖等。因此,肠道微生物被称为动物体的一个“新器官”(hattori等,2009)。
研究肠道微生物的功能和机制时,多采用动物或人体试验,通过收粪或屠宰采集肠道中微生物样品,但面临着成本高、操作复杂、粪便代表性低及潜在伦理等问题。此外,菌群移植技术不仅是治疗肠道疾病的有效手段,对艰难梭菌感染、炎性肠病、肠易综合征和克罗恩病等有较高治愈率,还能提高糖尿病患者胰岛敏感性(bakke等,2011;vermerire等,2012;vrieze等,2012;anderson等,2012);接受菌群移植后的家畜还能表现出与供体动物比较一致的健康水平、饲料转化效率和肥胖状况等表型。但菌群移植的研究面临着供体筛选程序复杂、来源少、标准不统一、成本高及潜在的伦理问题等因素的制约,因此,急需一种技术手段代替动物试验研究肠道微生物的功能和机制、代替粪便提供大量稳定、成本低的肠道菌群用于菌群移植。
体外连续发酵模拟培养是解决上述问题的有效手段。该系统能够模拟肠道的主要生理特征如ph值、流加速度、温度等,加上合适的培养基,理论上可以让微生物在发酵系统中与肠道内有相似的生长繁殖特性。因此,该系统可以代替动物试验在体外研究肠道微生物的功能和机制,并且能够生产出大量质量稳定的肠道菌群代替粪便中的菌群用于微生物移植,消除了上述存在的一系列制约因素。
已有大量研究表明,单相连续发酵系统具有较高水平的稳定性,不同培养批次之间的微生物菌群结构相似度基本都在90%以上(陈波,2012;),并且已经在部分食物原料和抗生素等药物对人体肠道微生物影响的研究方面取得了进展(郭卫革,2012;范彬,2016)。美国食品药品监督局也利用类似的体外系统作为新型的药物评价手段。甚至有研究人员将此系统用于筛选和生产益生菌,对动物生产性能有明显的促进作用(杨伟平,2015)。生产出的微生态制剂用于粪便移植,研究肠道微生物与宿主的相互作用(yin等,2010)。
培养基的配制是影响体外培养肠道微生物效果最重要的因素,也是决定体外培养系统可靠性的重要因素。营养供给直接决定了能够在体外生长增殖的细菌。此外,由于肠道微生物的种类多样性和代谢网路的复杂性,一种微生物的代谢产物可能影响着其他好多种微生物的生长增殖(alain等,2009)。因此,培养基的配制也是最具有挑战性的技术难点。已有大量关于连续发酵培养系统稳定性和重复性的研究,及利用该系统评价各种饲料原料和药物对肠道微生物影响的研究,但对系统培养的微生物与肠道微生物之间的相似性研究却很少,造成体外模拟培养的微生物菌群结构与肠道实际情况有较大差异,试验结果可信度大打折扣,严重制约了体外培养系统研究肠道微生物的发展与应用。
猪作为重要家畜,对人们生活水平和健康具有不可替代的作用。肠道微生物对猪的健康、营养利用及其肉品质有较大影响。同时,猪也是重要的模式动物,对人类医学研究也有重要的参考价值。结肠是猪肠道微生物聚集和发挥作用的主要部位,具有重要研究意义。
动物体内,肠道微生物能够接触并利用的营养物质主要来源于饲料。除部分人工合成的氨基酸外,实际生产中天然饲料原料占主要组成部分。葡萄糖和可溶性淀粉作为快速水解糖类,只有很小一部分能够到达后肠段供大肠微生物利用。此外,动物自身分泌的消化酶无法消化的低聚糖和细胞壁保护的细胞内的糖也能进入大肠。大肠微生物种类丰富,利用的糖种类也复杂多样、且组成结构较为复杂。因此,葡萄糖和可溶性淀粉作为主要糖来源用于体外培养大肠微生物似乎并不能满足需求。猪饲料中的蛋白质主要为植物源,培养基中的胰蛋白示和牛肉浸粉均为动物源蛋白质,这可能是体外模拟培养的限制因素之一。消化道分泌的消化酶和其它分泌蛋白都能被微生物进一步利用。
糖蜜(molasses,mol)是制糖工业的副产物,其主要组成为:干物质75%,全糖分46-52%,蔗糖28-32%,还原糖18-20%,非发酵糖类2-4%,非糖有机物9-12%,可溶性树胶及其他碳水化合物4%,还有少量的蛋白质、维生素和无机盐(tate等,1979)。玉米浆(cornsteepliquor,csl)是湿磨法生产玉米可溶性淀粉时的副产物,主要组成为:干物质40-50%,粗蛋白质16-30%,氨基酸8-12%,还原糖5-7%,维生素0.7-1mg/l总酸8-13%,乳酸7-12%,磷4-4.5%,钾2-2.5%(李海燕,2013)。糖蜜和玉米浆被广泛的应用抗生素、氨基酸、酶制剂等发酵工业中(左莹等,2013)。
目前没有比较完善的针对猪结肠微生物组的体外模拟培养参数,从针对人或动物的培养体系照搬过来使用,效果较差,微生物组相似性较低,导致体外模型研究猪肠道微生物可靠性较差。
技术实现要素:
解决猪结肠微生物组体外模拟培养效果较差的问题,使模拟培养的肠道微生物组与结肠微生物组相似度达到一个较高水平,使体外发酵模拟培养系统代替动物试验研究猪结肠道微生物更加可靠、可信。
本发明的一个目的是提供一套高效的、可靠的、用于体外模拟培养猪结肠微生物的发酵参数,特别是培养基。
本发明提供的培养基,包括溶质,所述溶质由牛肉浸粉、胰蛋白示、l-半胱氨酸-hcl、葡萄糖、酵母浸粉、氯化钠、可溶性淀粉和糖蜜组成。
牛肉浸粉,北京奥博星生物技术有限责任公司,01-008a;
酵母浸粉,北京奥博星生物技术有限责任公司,01-012;
可溶性淀粉(来源于玉米),北京索莱宝科技有限公司,g8300;
l-半胱氨酸-hcl(l-cysteine-hcl),北京索莱宝科技有限公司,c0011;
糖蜜,北京索莱宝科技有限公司,fa0070;
胰蛋白示,oxiod;
葡萄糖,国药,40165664;
氯化钠,国药,10019308;
上述培养基中,所述牛肉浸粉、所述胰蛋白示、所述l-半胱氨酸-hcl、所述葡萄糖、所述酵母浸粉、所述氯化钠、所述可溶性淀粉和所述糖蜜的质量比为2-5:20:0.5-1:2-3:5:5:1:5;
或所述牛肉浸粉、所述胰蛋白示、所述l-半胱氨酸-hcl、所述葡萄糖、所述酵母浸粉、所述氯化钠、所述可溶性淀粉和所述糖蜜的质量比为2.4:20:0.6:2.5:5:5:1:5。
本发明提供的发酵参数,包括发酵液体体积330ml,ph=6.4±0.1温度37±0.1℃,搅拌速度120rpm,补料和出料速度330ml/天,发酵天数12天,严格厌氧环境,发酵时间:①未开启进出料的闷罐发酵时间16h,②开启进出料的连续发酵时间8-14d。
上述可溶性淀粉为玉米可溶性淀粉(来源于玉米)。
上述培养基中,所述牛肉浸粉在所述培养基中的浓度为2.4g/l;
所述胰蛋白示在所述培养基中的浓度为20g/l;
所述l-半胱氨酸-hcl在所述培养基中的浓度为0.6g/l;
所述葡萄糖在所述培养基中的浓度为2.5g/l;
所述酵母浸粉在所述培养基中的浓度为5g/l;
所述氯化钠在所述培养基中的浓度为5g/l;
所述可溶性淀粉在所述培养基中的浓度为1g/l;
所述糖蜜在所述培养基中的浓度为5g/l。
上述培养基中,所述培养基还包括溶剂,所述培养基由溶质和溶剂组成。
上述培养基中,所述溶剂为水。
上述培养基中,所述猪肠道为猪结肠。
本发明另一个目的是提供一种用于体外模拟培养猪肠道微生物的培养基的制备方法。
本发明提供的方法,包括如下步骤:将上述的培养基的溶质中各组分按照所述浓度溶解于溶剂中,得到培养基。
上述的培养基在体外模拟培养猪肠道微生物中的应用也是本发明保护的范围。
上述的培养基在体外培养与猪结肠微生物组具有高水平相似度的发酵微生物组中的应用也是本发明保护的范围。
上述的培养基在制备体外模拟培养猪肠道微生物产品中的应用也是本发明保护的范围。
上述培养基在体外培养与猪结肠微生物组具有高水平相似度的发酵微生物组中的应用也是本发明保护的范围。
上述培养基在制备体外培养与猪结肠微生物组具有高水平相似度的发酵微生物组产品中的应用也是本发明保护的范围。
上述培养基在代替猪粪便用于菌群移植中的应用也是本发明保护的范围。
上述培养基在制备代替猪粪便用于菌群移植产品中的应用也是本发明保护的范围。
本发明第3个目的是提供一种体外模拟培养猪肠道微生物的方法。
本发明提供的方法,包括如下步骤:将离体猪结肠食糜在上述的培养基中发酵培养;所述发酵培养的发酵条件:ph6.4±0.1,温度37.0±0.1℃,进料和出料速度为0.042每小时的置换率(补料和出料速度13.75ml/h),发酵天数8-14天,厌氧发酵。
上述发酵培养的搅拌速度120rpm,上述发酵培养的总体系体积为330ml。
本发明的实验证明,本发明通过优化体外连续发酵培养模型的发酵参数,培养出与猪肠道较高相似度的微生物组,可使体外模拟培养的猪结肠微生物组与猪结肠微生物组的相似度达到68.5%,比原始的培养基vl的30.7%高出一倍多。大大提高了模型用于体外研究猪肠道微生物可靠性,为代替动物试验研究猪肠道微生物的功能和机制提供一个可靠有力的实用工具;其次,该模型发酵生产出的高相似度水平的微生物组可代替粪便用于菌群移植,解决了成本高、供体少和标准不一等问题,对猪的生产和人类健康研究起到积极地推动作用。
附图说明
图1为体外连续发酵模型示意图。
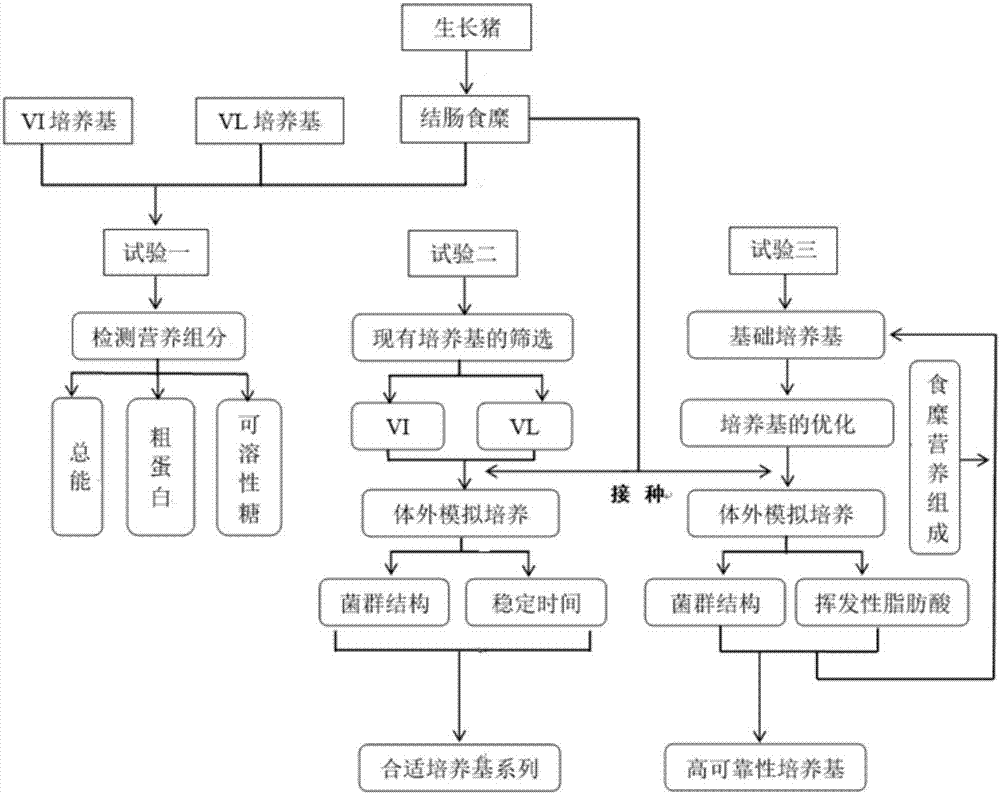
图2为本发明的技术路线。
图3为vi1培养基、vl1培养基、vi2培养基和vl2培养基培养后微生物属和食糜微生物属水平相对含量。
图4为培养基vl2、vlc、vlg、vlcmc培养后微生物属和食糜微生物属水平相对含量。
图5为培养基vlmol、vlcsl、vlm、zh培养后微生物属和食糜微生物属水平相对含量。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
糖蜜,北京索莱宝科技有限公司,fa0070
玉米浆干粉,北京索莱宝科技有限公司,fa0090
玉米可溶性淀粉,北京索莱宝科技有限公司,g8300
胰蛋白胨:北京奥博星生物技术有限责任公司,01-002
蛋白胨:北京奥博星生物技术有限责任公司,01-001
牛肉浸粉,北京奥博星生物技术有限责任公司,01-008a
酵母浸粉,北京奥博星生物技术有限责任公司,01-012
粘液素,sigma公司,m2378
纤维素,sigma公司,gf08832191-1ea
胰蛋白示,oxiod公司,lp0047b
葡萄糖,国药,40165664
氯化钠,国药,10019308
l-半胱氨酸-hcl(l-cysteine-hcl),北京索莱宝科技有限公司,c0011
羧甲基纤维素钠,国药,30036328
下述实施例中体外连续发酵模型示意图如图1所示,下面发酵在此模型中。
下述实施例的流程图如图2所示。
实施例1、猪结肠微生物组体外模拟培养的培养基的发现和优化
一、猪结肠食糜和vi1、vl1培养基的获得及检测
1、猪结肠食糜、vi1和vl1培养基的获得
使用45kg的杜长大三元杂交去势公猪6头、母猪6头。先空腹8h,再自由采食12h。颈部放血致死后,迅速打开腹腔,对空肠、回肠、盲肠和结肠进行结扎,再收集结肠食糜,-80℃保存。vi1和vl1培养基按照配方表称量、混匀。
2、猪结肠食糜、vi1和vl1培养基的营养组成检测
测定猪结肠食糜样、vi1和vl1的粗蛋白质、可溶性糖和总能指标,方法如下:
干物质:gb/t6435-2014
粗蛋白质:gb/t6432-1994
可溶性糖:ny/t2742-2015
总能:gb/t12456-2008
结果如表1所示。
表1结肠食糜和vi和vl培养基营养组成
二、培养基的优化
1、vi2培养基和vl2培养基的获得
1)vi2培养基和vl2培养基的配方
现有用于人肠道微生物的vi1培养基和鸡肠道微生物的vl1培养基溶质组分如下表2和表3所示,溶剂为水,培养基由溶质和溶剂组成。
根据猪结肠食糜的营养组成初步优化得到培养基vi2和vl2,配方如表2和表3所示。
表2vi1和vi2培养基配方(g/l)
表3为vl1和vl2培养基配方(g/l)
检测猪结肠食糜、vi1培养基、vl1培养基、vi2培养基和vl2培养基的营养组成,
检测方法:
干物质:gb/t6435-2014
粗蛋白质:gb/t6432-1994
可溶性糖:ny/t2742-2015
总能:gb/t12456-2008
结果如表4所示。
表4为四种培养基和食糜主要营养组成
2)vi2培养基和vl2培养基在体外模拟培养猪结肠微生物
(1)体外模拟培养猪结肠微生物
将vi1、vi2、vl1和vl2培养基配制好后,分别加入500ml的发酵罐和10l的补料瓶中,密封,121℃高压灭菌30min后,趁热连入发酵系统中,接入氮气保证厌氧环境。发酵罐中参数设定:液体体积300ml,ph6.4±0.1、温度37.0±0.1℃、搅拌120rpm。
厌氧条件下收集新鲜猪结肠食糜用pbs((nacl8.0g,kh2po40.2g,na2hpo42.9g,kcl0.2g,纯化水定容至1000ml,调ph至7.4)溶解并稀释10倍(m/v),无菌纱布过滤去掉残渣,形成接种液。再以体积比1:10的比例接种到发酵罐中,罐内液体体积达到330ml。闷罐培养16h后,再开启进出料,维持罐内体积的恒定,维护发酵设备在运行中各个指标保持在设定值,待稳定后停止发酵。
整个发酵过程中发酵参数为:发酵体积330ml,ph6.4±0.1,温度37.0±0.1℃,搅拌速度120rpm,进料和出料速度330ml/天,发酵天数12天,严格厌氧环境。
(2)体外培养后微生物检测
利用16srdna二代焦磷酸测序技术,hiseq2500对结肠道食糜和发酵产物中的微生物v3-v4区进行测序,此部分由北京市计算中心完成。
a、dna的提取
采用ctab或sds方法分别提取结肠道食糜和发酵产物的基因组dna。
采用琼脂糖凝胶电泳检测dna的纯度和浓度,取适量的样品于离心管中,使用无菌水稀释样品至终浓度为1ng/μl。
b、pcr扩增
稀释后的基因组dna为模板,使用带barcode的特异引物341f和806r,使用高效和高保真的酶进行pcr,得到约400bppcr产物,含有16srdna的v3-v4区。
pcr反应体系及反应条件
反应条件:95℃5min;95℃1min,50℃1min,72℃1min,25个循环;72℃7min,4℃∞。
c、pcr产物的混样和纯化
pcr产物使用2%浓度的琼脂糖凝胶进行电泳检测,使用thermoscientific公司的genejet胶回收试剂盒回收产物。
d、文库构建和上机测序
使用newenglandbiolabs公司的neb
vi1培养基、vl1培养基、vi2培养基和vl2培养基发酵产物和结肠道食糜含量前20的微生物组成和含量的检测结果如表5和图3所示。
表5为含量前20的微生物含量(%)
注:1此次发酵接种的食糜
用pearson距离函数计算之间的相似度,分析差异菌群,得到结肠食糜微生物组和各个培养基体外培养后微生物组菌群相似度,结果如表6。
表6为模拟微生物组与结肠微生物组相似度(%)
注:1此次发酵接种的食糜
根据上述结果可以看出,
在属水平上,培养基vi2和vi1对拟杆菌有很强的富集作用,含量分别为76.4%和57.9%,vl2和vl1能够较好的培养拟杆菌属和一种未知的微生物属,培养基vl1能够富集pyarmidobacter(36.5%),vl2中没有明显富集的细菌,分布比较均匀;与结肠食糜微生物结构相似度从高到低依次是vl238.7%,vl130.8%,vi226.5%,vi119.9%。四种培养几乎都不能培养出肠道中丰度较高的普氏菌属(prevotella)。优化前后vl系列比vi系列高,优化之后两种培养基的相似度都有提高,证明优化思路是比较可靠的。
vl2培养基相似度最高,因此被选作再次优化的基础。
2、vl2培养基再次优化
1)vlg、vlc和vlcmc培养基的配方
由于肠道食糜中除了可溶性糖,还有部分纤维被微生物发酵利用,因此粗纤维类的糖类对微生物应该比较重要。
优化vl2培养基中的葡萄糖、纤维素和羧甲基纤维素钠,得到优化后培养基vlg、vlc和vlcmc,培养基由溶质和溶剂组成,溶质组分如表7所示,溶剂为水。
表7为vl2培养基及其优化后配方比对(g/l)
2)优化后培养基vlg、vlc和vlcmc在体外模拟培养猪结肠微生物
(1)体外模拟培养猪结肠微生物
按照上述1的2)(1)中的方法体外模拟培养猪结肠微生物。
(2)体外培养后微生物检测
按照上述1的2)(2)中的方法检测,培养基配方如表7所示。
vl2培养基、vlg培养基、vlc培养基和vlcmc培养基发酵产物和结肠道食糜含量前20的微生物组成和含量的检测结果如表8和图4所示。
表8含量前20的微生物含量(%)
注:1此次发酵用于接种的结肠食糜
按照上述1的2)(2)中的方法计算结肠食糜微生物组和各个培养基体外培养后微生物组菌群相似度,结果如表9所示。
表9为模拟微生物组与结肠微生物组相似度(%)
从上述可以看出,在属水平上,四个培养基对拟杆菌富集效果最强,几乎都在50%以上,vl2最高,达到54.3%。结肠中,普氏菌属(prevotella)占结肠微生物的50%以上,是丰度最高的菌属。四个培养基均未能对普氏菌属(prevotella)有较好的富集作用。与结肠微生物的相似度上,四个培养基从高到低依次为vlg48.9%,vl223.5%,vlcmc16.7%,vlc11.9%。
试验中发现,溶于水的羧甲基纤维素钠和不溶的纤维素对体外模拟培养均有不利影响,降低了模拟培养菌群与肠道菌群的相似度;二者之间的菌群结构相似度达93.9%,与vl2的相似度分别为97.7%和96.1%,表明这两种纤维源几乎没有被微生物发酵利用,同时也证明了发酵系统的稳定和可靠性。从上述可以看出,vlg培养基添加葡萄糖以提高可溶性糖(也是总糖)含量,达到0.66%,高于结肠食糜0.43%的可溶性糖,仍然提高了相似度,表明肠道微生物在肠道内还利用了相当一部分的不可溶性糖,培养基中糖含量很可能仍不够微生物生长所需。
(3)体外培养后微生物代谢产物检测
检测猪结肠食糜、培养基vl2体外发酵产物、培养基vlg体外发酵产物、培养基vlc体外发酵产物、培养基vlcmc体外发酵产物中挥发性脂肪酸。
挥发酸测定:离子色谱法
检测方法:称取0.5g样品于10ml聚丙烯离心管中,加入8ml去离子水,超声30min后8000转离心10min,取上清液稀释10倍,用0.22μm滤膜过滤待上机。25μl样品溶液经ics-3000离子色谱仪分析(戴安,美国)电导检测。多种有机酸经as11分析柱(250mm×4mm)及ag11保护柱分离,流动相洗脱条件:氢氧化钾梯度,0-5min,0.8-1.5mm;5-10min,1.5-2.5mm;10-15min,2.5mm,流速为1ml/min。
结果如表10所示。
表10为食糜和培养基vl2、vlg、vlc、vlcmc发酵产生的挥发性脂肪酸(mg/g)
注:1用于此次发酵接种的结肠食糜
总体上,在四种发酵液和结肠食糜中,乙酸、丙酸、丁酸都是最主要的挥发性脂肪酸,其中乙酸(0.56~1.34mg/g)>丁酸(0.24~0.43mg/g)≥丙酸(0.15~0.55mg/g),这三种挥发性脂肪酸的比值差异不大。
根据微生物组间的相似度和发酵产物,将vlg选作下一次优化的基础培养基。
3、vlg培养基再次优化
1)vlmol、vlcsl、vlm、zh培养基的配方
实际生产中,猪饲料中所含的糖和蛋白质主要为植物来源,并且营养和组成较为丰富,因此体外发酵时微生物应该更倾向于利用与肠道内食糜来源和类型相似的营养底物。本试验参考前面部分试验结果,确定vlg为基础培养基,旨在研究糖蜜(molasses,vlmol)替代一半葡萄糖作为糖源、玉米浆干粉(cornsteerliquor,vlcsl)替代一半胰蛋白示作为蛋白来源和添加消化道分泌的黏蛋白(mucin,vlm)及这三种物质的组合(zh)对猪结肠微生物组体外模拟培养的影响。培养基由溶质和溶剂组成,溶质组分如表11所示,溶剂为水
表11为培养基vlmol、vlcsl、vlm、zh配方(g/l)
2)优化后培养基vlmol、vlcsl、vlm和zh在体外模拟培养猪结肠微生物
(1)体外模拟培养猪结肠微生物
按照上述1的2)(1)中的方法体外模拟培养猪结肠微生物。
(2)体外培养后微生物检测
按照上述1的2)(2)中的方法检测
vlmol、vlcsl、vlm和zh培养基发酵产物和结肠道食糜含量前20的微生物组成和含量的检测结果如表12和图5所示。
表12含量前20的微生物含量(%)
注:1用于此次发酵接种的结肠食糜
按照上述1的2)(2)中的方法计算结肠食糜微生物组和各个培养基体外培养后微生物组菌群相似度,结果如表13所示。
表13为模拟微生物组与结肠微生物组相似度(%)
注:1用于此次发酵接种的结肠食糜
试验结果表明,糖蜜和玉米浆干粉能够富集普氏菌属(prevotella),含量分别为25.3%和26.6%,大幅度提高体外模拟培养的效果,而黏蛋白和综合培养基zh对体外模拟培养有不利影响。模拟培养效果最好的培养基依次是vlmol、vlcsl、vlm和zh,与结肠微生物组的相似度分别为68.5%、52.3%、10.7%和5.0%。
(3)体外培养后微生物代谢产物检测
检测猪结肠食糜、培养基vlmol体外发酵产物、培养基vlcsl体外发酵产物、培养基vlm体外发酵产物、培养基zh体外发酵产物中挥发性脂肪酸(离子色谱,方法步骤同上)。
结果如表14所示。
表14为培养基vlmol、vlcsl、vlm、zh发酵产生的挥发性脂肪酸
注:1用于此次发酵接种的结肠食糜
挥发性脂肪酸总量上vlmol(1.64mg/g)与食糜相近,vlcsl、vlm和zh与食糜相比有较大幅度提升(3.18、2.80和2.99vs.1.70mg/g),vfa以乙酸、丙酸和丁酸为主,平均值分别为43.0%、18.0%、25.0%;体外发酵大大提高了丁酸的浓度(0.69、0.82、0.56和0.81vs.0.13mg/g)和比例(42.0%、26.0%、20.0%和27.0%vs.8.0%、),而乙酸浓度(0.49、1.22、1.26和1.25vs.1.02mg/g)比较接近。
上述表明,在培养基中添加复合成分的糖源物质糖蜜代替部分葡萄糖和植物来源的蛋白玉米浆干粉代替部分胰蛋白示,可大幅度提高体外模拟培养的微生物组与肠道微生物组的相似性,特别对猪结肠丰度最高的普氏菌属有重要的促生长作用。
因此,与猪肠道微生物组具有高度相似性的培养基为vlmol,可使体外模拟培养的猪肠道微生物组与猪肠道微生物组的相似度达到68.5%,比原始的培养基vl的30.7%高出一倍多,大大提高了模型用于体外研究猪肠道微生物可靠性。
- 还没有人留言评论。精彩留言会获得点赞!