EB病毒感染淋巴细胞亚群的鉴定方法及其应用与流程
本发明涉及医学检测技术领域,尤其是涉及一种eb病毒感染淋巴细胞亚群的鉴定方法及其应用。
背景技术:
eb病毒(epstein-barrvirus,ebv)属于人类疱疹病毒第四型,于1964年由epstein和barr在研究非洲儿童恶性淋巴瘤时发现。eb病毒是一种嗜淋巴细胞病毒,是人类普遍感染的病毒之一,感染全球超过90%的人群。eb病毒因兼具较高感染率和致癌率,已于1997年被国际癌症研究中心定为i类致癌物。
目前,已存在一些eb病毒的检测试剂盒,但其检测的多是全血的eb病毒感染情况,不具有针对性。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供一种eb病毒感染淋巴细胞亚群的鉴定方法,本发明的第二个目的在于提供eb病毒感染淋巴细胞亚群的鉴定方法的应用,以缓解现有技术中存在的eb病毒检测针对性差的技术问题。
本发明提供了一种eb病毒感染淋巴细胞亚群的鉴定方法,所述鉴定方法包括以下步骤:
步骤(a),提取人外周血单个核细胞;
步骤(b),对所述人外周血单个核细胞进行分选,分别得到不同亚群分型的淋巴细胞;
步骤(c),用流式细胞仪验证分选得到的所述不同亚群分型的淋巴细胞的纯度;
步骤(d),分别提取所述不同亚群分型的淋巴细胞的dna,并应用实时荧光定量pcr技术测定所述不同亚群分型的淋巴细胞中eb病毒dna的含量。
进一步的,所述不同亚群分型的淋巴细胞包括:cd3+t淋巴细胞、cd4+t淋巴细胞、cd8+t淋巴细胞、cd19+b淋巴细胞以及cd56+nk细胞。
进一步的,步骤(b)中,所述分选包括基于磁珠的分选。
进一步的,步骤(b)中,所述分选包括基于流式细胞仪的分选。
进一步的,所述基于磁珠的分选包括:将所述外周血单个核细胞按照1:1:1:2:2的比例分为五份,分别加入能够与cd3+t淋巴细胞、能够与cd4+t淋巴细胞、能够与cd8+t淋巴细胞、能够与cd19+b淋巴细胞以及能够与cd56+nk细胞特异性结合的磁珠,然后分别利用磁力架进行分选。
进一步的,所述基于流式细胞仪的分选包括:在所述外周血单个核细胞中加入抗cd3抗体、抗cd4抗体、抗cd8抗体、抗cd19抗体以及抗cd56抗体,孵育后过流式细胞仪进行分选。
进一步的,步骤(c)中,所述纯度合格的标准为90%以上。
另外,本发明还提供了鉴定方法在确定eb病毒感染疾病的治疗靶点中的应用。
另外,本发明还提供了鉴定方法在指导制备治疗eb病毒感染疾病的药物中的应用。
本发明提供的eb病毒感染淋巴细胞亚群的鉴定方法,通过分选ebv感染患者外周血的单核细胞,联合流式细胞技术及实时荧光定量pcr技术,可以准确定位ebv感染的细胞类型,有助于临床医生针对ebv感染的细胞类型制定治疗方案,对ebv感染造成的疾病进行高效、准确的治疗;另外,应用本发明提供的鉴定方法,可以确定ebv感染的靶细胞,能够指导相关治疗药物的制备,有针对性的制备靶向药物。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1中cd3+t淋巴细胞的纯度验证结果图;
图2为本发明实施例1中cd3+t淋巴细胞的纯度验证结果图;
图3为本发明实施例1中cd4+t淋巴细胞的纯度验证结果图;
图4为本发明实施例1中cd4+t淋巴细胞的纯度验证结果图;
图5为本发明实施例1中cd8+t淋巴细胞的纯度验证结果图;
图6为本发明实施例1中cd8+t淋巴细胞的纯度验证结果图;
图7为本发明实施例1中cd19+b淋巴细胞的纯度验证结果图;
图8为本发明实施例1中cd19+b淋巴细胞的纯度验证结果图;
图9为本发明实施例1中cd56+nk细胞的纯度验证结果图;
图10为本发明实施例1中cd56+nk细胞的纯度验证结果图;
图11为本发明实施例1中ebv-dna标准样品的qrt-pcr结果图;
图12为本发明实施例1中ebv-dna标准样品qrt-pcr的标准曲线;
图13为本发明实施例1中cd56+nk细胞样品的qrt-pcr结果图;
图14为本发明实施例1中内参gapdh的qrt-pcr结果图。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
现今检测ebv感染的方案,大多数只是提取全血的ebv-dna做qpcr,来检测患者是否感染ebv及监测ebv在全血中拷贝数的变化,临床医生依据这种方案所得的结果对患者进行治疗时,往往缺乏针对性,治疗效果较差。
发明人创造性的发现了这一问题,并针对这一问题,研究出了解决的方案。
针对上述技术问题,发明人首先对外周血细胞进行分选,再通过流式细胞仪验证分选的纯度,然后分别提取dna后再联合qpcr方法,不仅可以确定ebv感染的细胞类型,同时还可以定量检测感染细胞内的ebv-dna的拷贝数。有助于临床医生针对ebv感染的细胞类型制定有针对性的治疗方案。
例如,当应用本发明提供的方法鉴定出ebv感染的细胞为cd19+b淋巴细胞时,可以使用利妥昔单抗快速、有针对性的清除受感染的细胞(cd19+b淋巴细胞的表面同时会表达cd20,利妥昔单抗为抗cd20的抗体,因此,利妥昔单抗同样能够清除cd19+b淋巴细胞)。
另外,需要说明的是,根据本发明提供的eb病毒感染淋巴细胞亚群的鉴定方法,并不能直接判定待测患者是否患有疾病,其结果仅能说明该名患者携带有eb病毒,而携带eb病毒并不一定患有疾病。例如,有些患者可能终生携带eb病毒,但不会患病。
另外,本发明提供的方案中,步骤(c)中,纯度合格的标准为90%以上,表示:当分选后的细胞纯度为90%以上(包括90%)时,针对该细胞进行的qrt-pcr验证有无ebv感染的结果可信;当纯度低于90%(不包括90%)时,qrt-pcr的结果不完全可信。例如,分选后cd3+t淋巴细胞的纯度为93%,若进行qrt-pcr检测后发现其ebv-dna阳性,则表明cd3+t淋巴细胞受到了ebv感染;若分选后cd3+t淋巴细胞的纯度为65%,进行qrt-pcr检测后发现其ebv-dna阳性,则不一定表明是cd3+t淋巴细胞受到了ebv感染,也有可能是杂细胞受到了ebv感染,该qrt-pcr检测结果不可信。
如无特别说明,本发明中涉及的ebv为(epsteinbarrvirus,ebv),涉及的eb为(epsteinbarr,eb)。
为了有助于更清楚的理解本发明的技术方案,现通过具体的实施例,详细介绍如下。如未特别说明,以下实施例中涉及的试剂为常规市售试剂,涉及的仪器为常规仪器。另外,以下实施例中使用的试剂不应理解为对本发明的限制。
实施例1
本实施例提供了基于磁珠的eb病毒感染淋巴细胞亚群的鉴定方法,包括以下步骤:
1、提取人外周血单个核细胞(hpbmc):空腹静脉血6ml,置于edta抗凝的无菌试管中,用pbs稀释1倍后用淋巴细胞分离液分离pbmc(2000转20分钟),利用离心时间配好缓冲液(macsbsastocksolution(#130-091-376)和automacsrinsingsolution(#130-091-222)1:20的比例配比),放在4度冰箱降温;
2、吸取中间白膜层,加入10mlpbs,1400rpm,10min洗涤并沉淀pbmc;
3、弃上清,加入2ml红细胞裂解液(索莱宝红细胞裂解液货号:cat#r1010)裂解,混匀,室温下孵育5分钟;
4、充分混匀后,吸取20μl细胞用2%的冰醋酸按1:3稀释后,用细胞计数仪进行第一次读数,并记录读数;
5、加满pbs,1400rpm离心10min;
6、弃上清,加入磁珠分选缓冲液2ml,1400rpm离心10min;
7、根据第一次计数情况及患者淋巴细胞亚群比例,合理分配细胞比例,一般为cd3:cd4:cd8:cd19:cd56细胞比例为1:1:1:2:2;
其中,每种细胞对应的缓冲液最终体积为80μl,一般最大比例的细胞的最终体积为80μl,其余相应减少,吸出细胞后再用缓冲液补足80μl;例如上述cd3:cd4:cd8:cd19:cd56细胞比例为1:1:1:2:2,则相应的体积比为40μl:40μl:40μl:80μl:80μl;首先向步骤6中离心后的菌体中加入280μl缓冲液,充分混匀,然后分别吸取40μl细胞到用记号笔标记好cd3或者cd4或者cd8的ep管中,每管分别加入40μl缓冲液,补足80μl的体积;吸取80μl细胞到用记号笔标记好cd19或者cd56的ep管中;
8、若分为5份后每份细胞数均少于107个细胞,则分别加入20μl相应的磁珠(即能够特异性筛选cd3+t淋巴细胞、cd4+t淋巴细胞、cd8+t淋巴细胞、cd19+b淋巴细胞或者cd56+nk细胞的磁珠),混匀(若大于则每增加1×107个细胞,则磁珠加倍,不足1×107按1×107计算);
9、4度冰箱孵育15分钟,加入1ml缓冲液1400rpm离心10min洗涤一遍,弃上清;
10、加入500μl缓冲液,用0.45μm滤网过滤各待分选细胞;
11、润柱,将分离柱取出,加入500μl的缓冲液,让其自然流净后再加入过滤后的细胞,自然滴下液体,并用500μl缓冲液洗涤三次;
12、将分离柱拿离分离架,吸取1ml缓冲液,将1ml缓冲液注入分离柱中,用活塞快速冲洗分离柱中的细胞到1.5ml的ep管中;
13、依次按步骤11、12分离已加入cd3,cd4,cd8,cd19,cd56磁珠的细胞,每个分离柱只能用一次,即得到cd3+t淋巴细胞、cd4+t淋巴细胞、cd8+t淋巴细胞、cd19+b淋巴细胞以及cd56+nk细胞;
14、充分混匀,吸取20μl计数并记录;
15、吸取分离的细胞100μl,并分别标记cd3+,cd4+,cd8+,cd19+,cd56+的细胞,然后分别加入anti-humancd3-fitc10μl,anti-humancd56-apc5μl,anti-humancd8-percp5μl到上述cd3+,cd4+,cd8+,cd19+,cd56+的细胞中,室温避光孵育20分钟;
16、加入1mlpbs1400rpm离心5min洗涤细胞一遍;
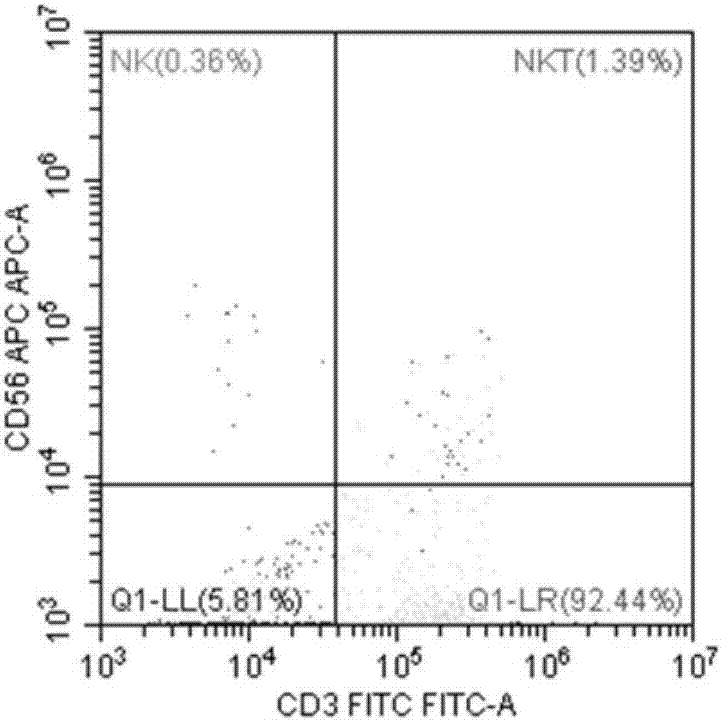
17、弃上清,加入100μlpbs混匀,上流式细胞仪验证分选的纯度,结果如图1至图10所示;
其中,图1和图2为cd3+t淋巴细胞的纯度验证结果图,结果显示,cd3+t淋巴细胞的分选纯度为94.01%,其中混有0.36%的nk细胞以及1.39%的nkt细胞;
图3和图4为cd4+t淋巴细胞的纯度验证结果图,结果显示,cd4+t淋巴细胞的分选纯度为98.45%,其中混有0.34%的cd8+t淋巴细胞,0.02%的nk细胞,以及0.22%的nkt细胞;
图5和图6为cd8+t淋巴细胞的纯度验证结果图,结果显示,cd8+t淋巴细胞的分选纯度为96.48%,其中混有0.15%的nk细胞;
图7和图8为cd19+b淋巴细胞的纯度验证结果图,结果显示,cd19+b淋巴细胞中混有1.01%的cd8+t淋巴细胞,2.47%的cd4+t淋巴细胞,0.51%的nk细胞,以及0.45%的nkt细胞;
图9和图10为cd56+nk细胞的纯度验证结果图,结果显示,cd56+nk细胞的分选纯度为83.26%,其中混有13.73%的nkt细胞;
18、将剩余的900μl细胞1400rpm离心10min,弃上清,然后用dna提取试剂分别提取各细胞的dna,最后溶于100μl的te中;
19、测dna浓度,三次,取其平均值;
20、根据测量的dna浓度用灭菌注射水稀释1μldna含量为10ng;
21、用达安ebv检测试剂盒及7500fast实时定量荧光pcr仪测量各分选后的细胞在10ngdna量处的ebv-dna拷贝数,找出ebv感染的细胞,并根据其拷贝数计算每106细胞的ebv的拷贝数;
首先,检测发现,分选后的cd3+t淋巴细胞、cd4+t淋巴细胞、cd8+t淋巴细胞以及cd19+b淋巴细胞的的ebv-dna检测结果为阴性,cd56+nk细胞的ebv-dna检测结果为阳性;
然后,对cd56+nk细胞中ebv病毒的拷贝数进行测定;ebv-dna标准样品的qrt-pcr结果如图11所示,对其进行处理得到图12所示的标准曲线;其中图12的横坐标表示ebv-dna的标准浓度,纵坐标表示ct值;
cd56+nk细胞样品的qrt-pcr结果图如图13所示(图14所示为内参gapdh的qrt-pcr结果图),结合图12的标准曲线计算得到,cd56+nk细胞中ebv的拷贝数为2.26×107拷贝/106个细胞;
因此,按照本实施例提供的方法,不仅可以确定是否感染了ebv,还可以准确的判断ebv感染的细胞,以及感染的ebv的拷贝数。
另外,需要注意的是,当分选后出现多个细胞阳性时,应联合考虑磁珠分选结果,排除是由分选纯度不够高,由ebv阳性的细胞掺杂进入ebv阴性的细胞里所造成,因此流式验证分选后细胞纯度不可缺少,对结果的分析极为重要。
例如假设cd56+nk细胞的分选结果纯度不够,有70.74%的cd3+t淋巴细胞,若qrt-pcr结果显示cd3+t淋巴细胞呈ebv阳性,则就造成分选后cd56+nk细胞ebv也为阳性的结果,在判读结果时,就不可以说是该患者cd3+t淋巴细胞和cd56+nk细胞都存在ebv感染,应对结果进行结合考虑。即,实时定量pcr的结果中多种淋巴为ebv阳性时,需要结合分选后分选的纯度综合考虑分析结果。
实施例2
本实施例提供了基于流式细胞仪的eb病毒感染淋巴细胞亚群的鉴定方法,包括以下步骤:
1、取外周血6ml,肝素抗凝,用pbs稀释成12ml,混匀;
2、将稀释后血液沿试管壁徐徐加入15ml淋巴细胞分离液的液面之上,勿用力过大,以免造成血液与分离液混合,保持清晰的分层状态;
3、18-20℃温度下2000rpm离心20min,离心后可见试管内的血液清楚的分为4层,上层为血浆层,中层为分离液层(单个核细胞所处于血浆层和分离液层中间),底层为红细胞层,红细胞层上为粒细胞层;
4、用吸管将上层与中层之间的淋巴细胞层吸出收集到另一试管中,用pbs洗涤1遍,1400prm离心10min;
5、弃上清,加入2ml红细胞裂解液裂解,混匀,室温下孵育5分钟;
6、加满pbs,1400rpm离心10min洗涤一遍;
7、弃上清,加入流式分选缓冲液(含2%fbs的pbs溶液)2ml,1400rpm离心10min;
8、加入抗cd3抗体,抗cd4抗体,抗cd8抗体,抗cd19抗体,抗cd56抗体,孵育20分钟;
9、加入2mlpbs,1400rpm离心5min洗涤细胞一遍,用分选buffer稀释细胞浓度为5×106个/ml,上流式细胞仪进行分选,即得到cd3+t淋巴细胞、cd4+t淋巴细胞、cd8+t淋巴细胞、cd19+b淋巴细胞以及cd56+nk细胞,收集分选出的目的细胞,bdfacsaria分选出的目的细胞密度为5×105个/ml;
10、吸取分离的细胞100μl,并分别标记cd3+,cd4+,cd8+,cd19+,cd56+的细胞,然后分别加入anti-humancd3-fitc10μl,anti-humancd56-apc5μl,anti-humancd8-percp5μl到上述cd3+,cd4+,cd8+,cd19+,cd56+的细胞中,室温避光孵育20分钟;
11、加入1mlpbs1400rpm离心5min洗涤细胞一遍;
12、弃上清,加入100μlpbs混匀,上流式细胞仪验证分选的纯度;
13、将剩余的细胞1400rpm离心10min,弃上清,然后用dna提取试剂分别提取各细胞的dna,最后溶于100μl的te中;
14、测dna浓度,三次,取其平均值;
15、根据测量的dna浓度用灭菌注射水稀释1μldna含量为10ng;
16、用达安ebv检测试剂盒及7500fast实时定量荧光pcr仪测量各分选后的细胞在10ngdna量处的ebv-dna拷贝数,找出ebv感染的细胞,并根据其拷贝数计算每106细胞的ebv的拷贝数;
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!