猪流行性腹泻病毒荧光定量PCR的引物和探针的制作方法
本发明属于分子生物学领域,具体涉及一种可以鉴别检测猪流行性腹泻经典株和变异株的荧光定量pcr引物和探针。
背景技术:
猪流行性腹泻(porcineepidemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)引起的一种急性的,高度传染性的,以严重水样呕吐和腹泻及脱水为特征的肠道病毒性疾病,主要危害新生仔猪,死亡率高达100%。pedv属于冠状病毒科,冠状病毒属1群,为单股正链不分节段rna病毒,基因组全长28-kb包含7个开放阅读框,其中编码的四个结构蛋白基因分别为:s基因、e基因、m基因和n基因。ped最早发现于英国,随后在许多国家陆续报道,如比利时、日本、韩国、意大利、泰国和美国等。自20世纪80年代开始,我国陆续有ped的报道,至2010年,我国爆发了更加严重的ped,给养猪业带来了巨大的经济损失。
随着对pedv分子流行病学的不断研究,基于pedvs基因的变异情况,pedv分为了两个基因型,即g1型和g2型,分别代表了pedv经典毒株和变异毒株。pedvg1型和g2型在抗原性和基因遗传水平均表现出一定差异。目前,针对pedv的实验室检测方法有elisa(enzyme-linkedimmunosorbentassay)、ic(immunochromatography)、rt-lamp(reversetranscriptionloop-mediatedisothermalamplification)、nanoparticle-assistedpcr、reversetranscription-pcr(rt-pcr)等。尽管这些方法对于检测pedv有较好的特异性、灵敏性和可重复性,但却不能够区分不同的pedv毒株类型。荧光定量pcr有特异性强、灵敏度高、重复性好和准确定量及快速的优点,广泛用于实验室疫病检测。
s基因为区分pedv不同毒株的特征基因,目前,已报道有基于s基因的taqman探针荧光定量pcr方法来鉴别检测pedv不同毒株(中国专利号cn103509882a),但由于近年来pedv变异株s基因的不断变异,发现该方法所述的变异株探针序列中有碱基的突变,由于taqman探针的高度特异性,新的突变株有不被检出的可能。所以,同样基于s基因,我们设计了分别针对不同毒株更加保守的特异性探针序列,建立taqman荧光定量pcr方法,并评估其特异性、灵敏性和可重复性,用于临床pedv毒株的鉴别检测。
技术实现要素:
本发明的目的在于针对现有技术存在的问题,通过对pedvs1基因的序列分析,设计引物和taqman探针,并建立了荧光定量pcr方法,该方法可以实现对pedv经典毒株和变异毒株进行快速鉴别检测。
为实现发明目的,本发明采用的技术方案如下:
本发明提供了一种猪流行性腹泻病毒荧光定量pcr的引物和探针,其中,所述引物的核苷酸序列为:
上游引物:5’-gctagtggcgttcatgg-3’(seqidno.1),
下游引物:5’-tgtaaataaagctggtaaccac-3’(seqidno.2);
所述探针的核苷酸序列为:
探针1(pedv经典毒株):5’-tacatcgattctggtcagggctttgag-3’(seqidno.3),
探针2(pedv变异毒株):5’-ccatattagaggtggtcatggctttgag-3’(seqidno.4);
探针1核苷酸序列的5’端结合有荧光报告基团,3’端结合有荧光淬灭基团;探针2核苷酸序列的5’端结合有荧光报告基团,3’端结合有荧光淬灭基团。
根据上述猪流行性腹泻病毒荧光定量pcr的引物和探针,优选地,所述探针1的荧光报告基团为cy5,荧光淬灭基团为bhq2。
根据上述猪流行性腹泻病毒荧光定量pcr的引物和探针,优选地,所述探针2的荧光报告基团为fam,荧光淬灭基团为bhq1。
本发明所述的引物和探针是通过dnaman8软件对genbank中公布的猪流行性腹泻病毒的经典毒株和变异毒株的基因进行序列比对,在序列差异区设计两条特异探针,并在探针位置的外围设计共用引物,然后用mfeprimer-2.0评估探针和引物的可行性。所有的引物和探针均由生工生物工程(上海)股份有限公司。
本发明还提供了一种上述猪流行性腹泻病毒荧光定量pcr的引物和探针在制备检测猪流行性腹泻病毒经典毒株和变异毒株的试剂中的应用。
本发明还提供了一种检测猪流行性腹泻病毒的试剂盒,所述试剂盒包括猪流行性腹泻病毒荧光定量pcr的引物和探针,其中,
所述引物的核苷酸序列为:
上游引物:5’-gctagtggcgttcatgg-3’(seqidno.1),
下游引物:5’-tgtaaataaagctggtaaccac-3’(seqidno.2);
所述探针的核苷酸序列为:
探针1:5’-tacatcgattctggtcagggctttgag-3’(seqidno.3),探针2:5’-ccatattagaggtggtcatggctttgag-3’(seqidno.4);
优选地,探针1核苷酸序列的5’端结合有荧光报告基团,3’端结合有荧光淬灭基团;探针2核苷酸序列的5’端结合有荧光报告基团,3’端结合有荧光淬灭基团;更优选地,所述探针1的荧光报告基团为cy5,荧光淬灭基团为bhq2,所述探针2的荧光报告基团为fam,荧光淬灭基团为bhq1。
本发明还提供了上述试剂盒在检测猪流行性腹泻病毒中的应用。
本发明还提供了一种猪流行性腹泻病毒经典毒株和变异毒株荧光定量pcr鉴别检测方法,包括以下步骤:
(1)分别以猪流行性腹泻病毒经典毒株cv777和变异毒株ch/hnly的rna为模板,反转录合成cdna,然后以cdna为模板采用权利要求1所述的上、下游引物进行pcr反应,扩增目的片段,将获得的目的片段分别连接克隆载体,转化宿主菌进而构建重组质粒;
(2)提取鉴定为阳性的重组质粒,测定其浓度,根据重组质粒的浓度计算拷贝数,并将重组质粒做10倍系列梯度稀释,然后分别以每一稀释浓度的重组质粒作为质粒标准品;
(3)收集临床样品,提取样品的rna,反转录合成cdna,以样品的cdna为模板,同时以质粒标准品作为标准模板,进行荧光定量pcr,根据质粒标准品的ct值和与之相对应的标准模板的质粒拷贝数,分别生成猪流行性腹泻病毒经典毒株和变异毒株的质粒拷贝数-ct值的标准工作曲线;将待测样品的ct值带入标准工作曲线中,即可判断临床样品中猪流行性腹泻病毒经典毒株和变异毒株的病毒含量;
其中,步骤(3)中所述荧光定量pcr反应的反应体系为:模板1μl,premixextaqtm(probeqpcr,2*conc.)10μl,10pmol/l的上、下游引物各0.4μl,10pmol/l的探针1和探针2各0.1μl,roxreferencedyeii(50*conc.)0.4μl,去离子水补至20μl;
所述上游引物的核苷酸序列为:5’-gctagtggcgttcatgg-3’,所述下游引物的核苷酸序列为:5’-tgtaaataaagctggtaaccac-3’;所述探针1的核苷酸序列为:5’-tacatcgattctggtcagggctttgag-3’,所述探针2的核苷酸序列为:5’-ccatattagaggtggtcatggctttgag-3’;优选地,探针1核苷酸序列的5’端结合有荧光报告基团,3’端结合有荧光淬灭基团;探针2核苷酸序列的5’端结合有荧光报告基团,3’端结合有荧光淬灭基团;更优选地,所述探针1的荧光报告基团为cy5,荧光淬灭基团为bhq2,所述探针2的荧光报告基团为fam,荧光淬灭基团为bhq1。
所述荧光定量pcr反应的反应程序是95℃预变性20s,然后进行以下40个循环:95℃变性3s,60℃延伸30s。
本发明每次检测样品时须设立阴性对照和阳性对照,在检测中两种对照为有效扩增时,样本结果判断标准如下:
扩增曲线ct值<35时样品结果为阳性;
扩增曲线ct值≥40时样品结果为阴性;
扩增曲线ct值在35~40之间时,样品需要重复,重复试验如ct值依然ct值仍在这个范围的判断为阳性。
本发明的积极有益效果:
(1)本发明基于pedvs基因,设计了分别对pedv经典毒株和变异毒株特异的探针序列,在探针的外围设计了共用的引物序列,该引物和探针序列特异性和灵敏性都较高,其检测样本的最低拷贝数达到了4.8×102,能够鉴别检测pedv经典毒株和变异毒株,因此,可以实现对临床样本的精确鉴别检测。
(2)本发明提供的猪流行性腹泻病毒经典毒株和变异毒株荧光定量pcr鉴别检测方法操作简单,准确性高,检测速度快,可以实现对样品中pedv的定量检测。
附图说明
图1为本发明pedv经典毒株的标准曲线;
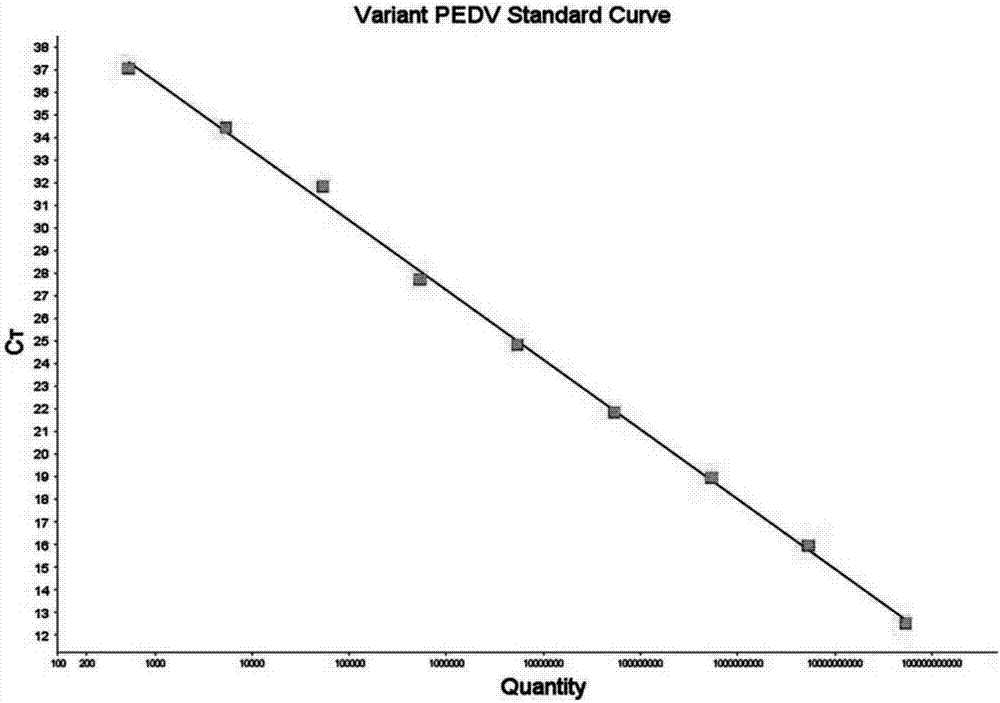
图2为本发明pedv变异毒株的标准曲线;
图3为本发明的特异性试验,1:pedv经典毒株的重组质粒;2:pedv变异毒株的重组质粒;3:pedv经典毒株重组质粒和pedv变异毒株重组质粒的混合物;4:rv;5:tgev;6:prv;7:prrs;8:pcv2;9:ppv;10:csfv;11:阴性对照;
图4为荧光定量pcr方法检测临床样品中pedv的核酸拷贝数。
具体实施方式
以下结合具体实施例进一步说明本发明的内容,但不应该理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范畴。
除非特别说明,本发明采用的除引物、探针之外的试剂、方法和设备均为本领域常规试剂、方法和设备。除非特别说明,本发明使用的样品、试剂和试剂盒均为市购。
实施例1:探针和引物的设计与合成
引物和探针是通过dnaman8软件对genbank中近年来公布的猪流行性腹泻病毒的经典毒株(经典毒株代表毒株的登录号为:af353511.1,jn547228.1,kt323979.1,ef185992.1,jn601050.1,jx560761.1)和变异毒株(变异毒株代表毒株的登录号为:kc210145.1,jx112709.1,ku133250.1,kj646584.1,kp698764.2,kt428879.1,kx073609.1,ku133236.1,ku133259.1,ku237226.1,ku710232.1,kr233257.1,kj646580.1,ku237230.1,ku237229.1,ku977512.1,ku710235.1,ku133269.1,ku710245.1,ku710234.1,ku710229.1,ku710242.1,kr296683.1,kt989356.1,ku237217.1)的s1基因进行序列比对,在序列差异区设计两条特异探针,并在探针位置的外围设计共用引物,然后用mfeprimer-2.0评估探针和引物的可行性。所有的引物和探针均由生工生物工程(上海)股份有限公司合成。
实施例2:rna提取及cdna合成
取300μl感染猪流行性腹泻病毒经典毒株cv777(该毒株已鉴定为猪流行性腹泻经典毒株,也可以使用其它经典毒株替代)的细胞培养液、300μl感染猪流行性腹泻病毒变异毒株ch/hnly(该毒株已鉴定为猪流行性腹泻变异毒株,也可以使用其它变异毒株替代)的临床样本处理上清液(取感染猪流行性腹泻病毒变异毒株ch/hnly的猪肠道组织,用剪刀剪碎,加入适量生理盐水,冻融3次,3000rpm/min离心5min取上清),分别加入800μltrizol,充分混匀,室温静置10min;再加入200μl氯仿,充分混匀,室温静置10min,12000rpm离心10min,取上清分别加入等倍体积的异丙醇,混匀后-20℃过夜;取出后4℃条件下12000rpm离心10min,弃上清,沉淀用75%depc水配制乙醇洗涤两遍,rna用适量rnaase-free水溶解,即为rna模板,-80℃保存备用。
取1μgrna(用rnaase-free水补足体积为13μl)进行反转录,首先向1μgrna(用rnaase-free水补足体积为13μl)中加入1μl10pmololigo(dt),70℃孵育10min然后冰上放置1min,向混合液中加入4μl5×rtbuffer,1μldntp(2.5mm),0.5μlofrna酶抑制剂(40u/μl)和0.5μl反转录酶(200u/μl),42℃孵育1h,得到cdna模板,-20℃保存备用。
实施例3:基因克隆
以反转录得到的cdna为模板,用本发明上、下游引物(seqidno.1-seqidno.2)分别扩增目的片段,其中,pcr扩增反应体系为:模板1μl,2×extaq10μl,上、下游引物(10pmol)各1μl,补去离子水至20μl;pcr反应程序为:95℃预变性5min,然后进行以下30个循环:95℃变性30s,55℃退火30s,72℃延伸30s,循环结束后进行72℃延伸5min。pcr扩增产物用1%琼脂糖电泳鉴定,并用胶回收试剂盒(takara)回收目的片段,将目的片段克隆至peasy-blunt载体并转化到dh5α感受态细胞,蓝白斑筛选挑取阳性克隆,测序鉴定阳性重组质粒。
实施例4:标准曲线的建立
采用质粒提取试剂盒提取测序鉴定为阳性的重组质粒,用分光光度计测定重组质粒的浓度,根据重组质粒的浓度计算每μl重组质粒的拷贝数,并将重组质粒做10倍系列梯度稀释(稀释后重组质粒的浓度范围为4.8×1010-4.8×100拷贝数/μl),然后分别以每一稀释梯度的重组质粒为模板进行荧光定量pcr反应。其中,荧光定量pcr反应体系为:模板1μl,premixextaqtm(probeqpcr,2*conc.)(10μl,10pmol/l的上、下游引物各0.4μl,10pmol/l的探针1和探针2各0.1μl,roxreferencedyeii(50*conc.)0.4μl,去离子水补至20μl。荧光定量pcr反应程序为:95℃预变性20s,再进行以下40个循环:95℃变性3s,60℃延伸30s。荧光定量pcr反应结束后根据质粒拷贝数和与之对应的ct值建立标准曲线,其中,以猪流行性腹泻病毒经典毒株重组质粒10倍系列稀释为模板生成的标准曲线为pedv经典毒株标准曲线,斜率:-3.213,r2=0.999,直线方程为:y=-3.213lgx+45.14(图1);以猪流行性腹泻病毒变异毒株重组质粒10倍系列稀释为模板生成的标准曲线为pedv变异毒株标准曲线,斜率:-3.119,r2=0.999,直线方程为:y=-3.119lgx+45.75(图2)。
实施例5:特异性检验
利用本发明建立的荧光定量pcr方法,以实验室收集保存的7种猪源病毒(分别为:轮状病毒(rv)、猪传染性肠胃炎病毒(tgev)、伪狂犬病毒(prv)、蓝耳病病毒(prrs)、圆环病毒(pcv2)、细小病毒(ppv)和猪瘟病毒(csfv))的dna或cdna为模板,利用本发明的荧光定量pcr引物和探针进行荧光定量pcr扩增反应,同时设立阴性对照(去离子水为模板)和3个阳性对照(pedv经典毒株重组质粒、pedv变异毒株重组质粒、pedv经典毒株重组质粒和变异毒株重组质粒的混合物);其中,荧光定量pcr的反应体系、反应程序同实施例4。结果显示只有阳性对照出现报告荧光信号,其他均未出现,表明本发明的荧光定量pcr引物和探针具有较好的特异性(图3)。
实施例6:敏感性试验和重复性检验
分别以浓度为4.8×1010拷贝数/μl、4.8×109拷贝数/μl、4.8×108拷贝数/μl、4.8×107拷贝数/μl、4.8×106拷贝数/μl、4.8×105拷贝数/μl、4.8×104拷贝数/μl、4.8×103拷贝数/μl、4.8×102拷贝数/μl、4.8×101拷贝数/μl、4.8×100拷贝数/μl的重组质粒为模板做批间重复,每个浓度做三个重复,以出现阳性曲线所用模板的最高稀释度为其敏感度,结果见表1。由表1可知,本发明的荧光定量pcr方法最低检出浓度为4.8×102拷贝数/μl,批间重复的变异系数均小于5%,由此可以说明本发明所建立的荧光定量pcr反应体系具有较好的敏感性和可重复性。
表1为本发明荧光定量pcr检测方法的敏感性和重复性试验结果
实施例7:临床样品检测
(1)临床样品和采集和处理
收集79份来自临床的粪便和肠道组织样品,向肠道组织(用剪刀适当剪碎)或粪便样本中加入适量生理盐水,冻融3次,取上清提取rna并反转录成cdna(rna提取及cdna合成的方法同实施例2),-20℃保存备用。
(2)pcr体系和程序
以反转录合成的样品的cdna为模板,以本发明的荧光定量pcr引物和探针进行荧光定量pcr扩增反应,其中,荧光定量pcr的反应体系、反应程序同实施例4。
(3)结果判定
荧光报告基团cy5有扩增曲线出现说明检测样品感染了pedv经典毒株,荧光报告基团fam有扩增曲线出现说明检测样品感染了pedv变异毒株;若是均无扩增曲线产生,则说明样品没有感染pedv;若荧光报告基团cy5和fam均有扩增曲线产生,说明检测样品为经典株和变异株pedv共感染样品。其中扩增曲线ct值小于35的判断为阳性,ct值大于35而小于40的判断为可疑,需重复试验,重复试验ct值仍在这个范围的判断为阳性。由图4可以看出,79份临床样本中,有63份样品感染pedv变异毒株,3份样品为经典株和变异株pedv共感染样品,1份样品感染pedv经典毒株。
sequencelisting
<110>河南省农业科学院
河南中泽生物工程有限公司
<120>猪流行性腹泻病毒荧光定量pcr的引物和探针
<130>1
<160>4
<170>patentinversion3.5
<210>1
<211>17
<212>dna
<213>artificialsequence
<220>
<223>上游引物
<400>1
gctagtggcgttcatgg17
<210>2
<211>22
<212>dna
<213>artificialsequence
<220>
<223>下游引物
<400>2
tgtaaataaagctggtaaccac22
<210>3
<211>27
<212>dna
<213>artificialsequence
<220>
<223>探针1
<400>3
tacatcgattctggtcagggctttgag27
<210>4
<211>28
<212>dna
<213>artificialsequence
<220>
<223>探针2
<400>4
ccatattagaggtggtcatggctttgag28
- 还没有人留言评论。精彩留言会获得点赞!
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用