基因芯片杂交组件、包含该杂交组件的试剂盒、其应用及杂交检测方法与流程
本发明涉及基因芯片杂交组件,更详细地说,本发明涉及一种针对于不同gc%含量dna序列进行检测的基因芯片杂交组件。
背景技术:
基因芯片为一种生物芯片,已广泛用于基因测序、基因诊断等。其中,基因诊断已作为一种重要的医学方法来预测疾病、指导用药。
基因诊断的原理是在载体上固定上寡核苷酸探针,并将靶dna片段与之杂交显色,来判断特定的dna片段中其碱基是否存在突变。在高通量基因芯片检测过程中,现有技术常通过调节探针长度及探针gc含量来统一杂交温度,确保基因芯片杂交信号的稳定。但随着基因芯片通量的上升,该方法的难度呈指数增长,并且该方法无法解决所有高通量基因芯片杂交温度问题。
由于不同gc%含量的dna片段其在基因芯片上的杂交温度不一样,现有技术中在同一张芯片上通常只能检测一种dna序列或者几种gc%含量相近的dna序列,而无法在同一张芯片上检测gc%含量有一定差异的不同dna序列。
技术实现要素:
为解决上述的不同gc%含量的dna片段难以在同一张芯片上杂交的技术问题,本发明提供一种基因芯片杂交组件。
本发明基因芯片杂交组件,包括至少两种具有不同gc%含量的探针和杂交溶液;其中,所述探针序列的gc%含量范围在10%-80%;所述杂交溶液包含甜菜碱和zn2+。基于基因芯片杂交的目的,本发明通过杂交溶液提供目的片段,用于与固定在基因芯片上的探针杂交结合。利用本发明基因芯片杂交组件,可对包含有与探针进行互补配对的dna序列进行检测,对样品进行基因型判断。
本发明基因芯片杂交组件中探针序列的gc%含量范围在10%-80%,亦如本发明下文实验结果所揭示的,探针序列之间gc%含量的差异范围可为0%~70%。优选地,探针序列之间gc%含量的差异范围在20%~65%。可选地例如,探针序列之间gc%含量的差异为20%、30%、35%、45%和65%。
其中,所述杂交溶液主要包括预杂交液、显色液、抗体抗稀、杂交缓冲液和洗液;其中,所述杂交缓冲液包括缓冲盐溶液、靶序列、甜菜碱和zn2+,ph值范围在7.0-7.5。其中,靶序列是指由样品片段提供的dna片段的序列,对于样品片段仅需满足能够与探针进行互补配对的原则即可。
其中,所述甜菜碱浓度范围1.5m~2.5m,所述zn2+浓度范围10-4m~10-2m。优选地,所述甜菜碱浓度为2.5m,所述zn2+浓度为10-3m。
其中,所述探针序列片段长度在20bp左右,样品片段长度在100bp左右。
其中,杂交温度为31℃。
其中,所述探针序列任意选自包含以下的组:
seqidno.5:5’-atggcccaggcccagccgcg-3’
seqidno.7:5’-acatgcagagacccagcaat-3’
seqidno.9:5’-aattttgagtctttttaaaa-3’
seqidno.4:5’-atggcccaggtccagccgcg-3’
seqidno.6:5’-acatgcagaggcccagcaat-3’
seqidno.8:5’-aattttgagtatttttaaaa-3’
其中,所述样品片段的序列任意选自包含以下的组:
seqidno.10:
5’-caggcacaacaccttgccgccaggcacaacaccttgccgctg
ggcctgggccatgaccacgctgaccccggcatggctgatggc-3’
seqidno.11:
5’-gggcaactagaaaggctggtggagttgacttagctgagattgctggg
tctctgcatgtcatcccttctgactttctggtgacttcttaggtcattaata-3’
seqidno.12:
5’-acatgttaaaatactatgaagaatgacatcagggattcttttaaaaagac
tcaaaattggctnggtgcggtggctcacacctgtaatcccaacactttg-3’。
本发明还提出包含所述的杂交组件的试剂盒。
本发明还提出所述的杂交组件或包含该杂交组件的试剂盒在杂交测定中的应用。其中,所述杂交反应中探针序列gc%含量范围在10%-80%,与探针结合的目的dna片段需要包含有与探针进行互补配对的序列即可。上述杂交反应包括不同gc%含量dna序列之间进行的杂交,可用于基因芯片的测序和突变检测、高通量研究。
本发明还提出利用所述杂交组件进行杂交检测方法,包括以下步骤:
提供与目的片段杂交的至少两种基因芯片探针,
提供包含目的dna片段的杂交溶液,
使所述探针与所述目的dna片段经杂交、洗涤后,进行信号分析。
本发明还提出具有不同gc%含量的探针同时杂交的方法,包括将基因芯片上至少两种gc%含量范围在10%-80%的探针与杂交溶液中的目的dna片段进行杂交和测定;所述杂交溶液包含甜菜碱和zn2+。本发明通过利用上述杂交组件,实现了将不同gc%含量dna片段在同一张基因芯片同一条件(包括温度条件)下进行正确杂交,按照本发明利用具有不同gc%含量的探针同时杂交能够排除非特异杂交引起的信号。所述探针是任选自seqidno.4至seqidno.9中的两种或多种,所述目的dna片段是任选自seqidno.10至seqidno.12中的两种或多种。
本发明中,
“杂交”是指结合了杂交过程的变性和复性(重新退火)步骤。
“杂交组件”是指用于进行杂交过程(例如使探针与核酸序列结合)的本发明含水溶液,其中含有杂交溶液及分子探针。
“杂交溶液”是指用于本发明杂交组件的含水溶液。
本发明所述杂交组件实现了将不同gc%含量的dna片段在同一基因芯片上进行杂交,并且具有提高杂交的特异性。为实现芯片的高通量研究提供了一种解决方法。
附图说明
图1是基因芯片杂交组件构建过程中基因芯片的点样模式。其中,各号位点对应的片段分别为:0-阳性对照,1-a,2-b,3-c,4-d,5-e,6-f。
图2是基因芯片杂交组件构建过程中杂交实验结果。其中,(a)图所示为空白对照及甜菜碱1.5m组,(b)图为甜菜碱2m组,(c)图为甜菜碱2.5m组。
图3是应用本发明杂交组件进行基因芯片杂交中的基因芯片的点样模式。
图4是实施例2中杂交实验的结果。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明。本发明的实现并不限于下述实施方式,在本领域技术人员所具备的知识范围内所采用的本发明技术构思下的各种变形、变换、组合和改进均属于本发明的保护范围。
除以下专门提及的内容之外,实施本发明的过程、条件、实验方法等,均为本领域的普遍知识和公知常识,用于实施本发明的试剂、材料、设备等均市售可得,本发明没有特别限制内容。
杂交仪(上海百傲科技股份有限公司,型号:br-526-24);点样仪(上海百傲科技股份有限公司,型号:zsb-yf-490);扫描仪(博奥生物基因有限公司,型号:luxscan-10k/a);荧光定量pcr(杭州博日科技有限公司,型号:fqd-48a);xp基因扩增仪(杭州博日科技有限公司,型号:tc-xp-d);超微量分光光度计(南京五义科技有限公司,型号:od-1000+);恒温金属浴(杭州博日科技有限公司,型号:hb-100)。
sybrgreenⅰ(生工生物工程(上海)股份有限公司,规格:“10000×”)、dmso(生工生物工程(上海)股份有限公司,规格:500ml/瓶)、tris盐酸盐(生工生物工程(上海)股份有限公司,规格:>99.0%)、tris碱(生工生物工程(上海)股份有限公司,规格:>99.9%)均为生工生物工程(上海)股份有限公司产品。k2hpo4·3h2o(分析纯)、kh2po4(分析纯)均为国产分析纯。甜菜碱(国药集团化学试剂有限公司,规格:>98.0%);zncl2(永华化学科学(江苏)有限公司,规格:>98.0%);杂交缓冲液(上海百傲科技股份有限公司,产品编号:20160105)。
实施例1:基因芯片杂交组件的构建
1、不同gc%含量dna片段
150~300bp的不同gc%含量dna片段的制备,是选择人基因组中不同gc%含量的基因(tpmt、cy、apoedna片段的gc%摩尔含量分别为35%、55%、75%),采用体外扩增并纯化。
本发明中,用于150~300bp的不同gc%含量dna片段的制备的序列如下
tpmt(seqidno.1):
gtcttgagaaggttgatgcttttgaagaacgacakaaaagttggggaattgactgtctttttgaaaagttatrtctacttacagaaaagtaaatgagacatagataaaataaaatcacactgacatgtttttgaggaattgaaaattatgctaaagcctgaaaatgtaatggatga
cy(seqidno.2):
tggagagtggcataggagatacccacgtatgtaccacccagcttaacgaatgctctactgtcatttctaaccataatctctttaaagagctcttttgtctttcartatctcttccctgtttggaccacattacccttcatcatatgaagccttgggtggctcctgtgtgagactcttgctgtgtgtcacaccctaatgaactagaacctaaggttgctgtgtgtcg
apoe(seqidno.3):
cggtggcggaggagacgcgggcacggctgtccaaggagctgcaggcggcgcaggcccggctgggcgcggacatggaggacgtgtgcggccgcctggtgcagtaccgcggcgaggtgcaggccatgctcggccagagcaccgaggagctgcgggtgcgcctcgcctcccacctgcgcaagctgcgtaagcggctcctccgcgatgccgatgacctgcagaagcgcctggcagtgtaccaggccggggcccgcgagggcgccgagc
20bp、100bp左右不同gc%含量dna片段为人工合成。先设计不同gc%含量的dna序列(见表1),委托生工生物工程(上海)股份有限公司合成并纯化。
表1不同gc%含量的dna序列
注:探针a、c、e分别为探针b、d、f片段序列中一个碱基突变得到.探针a、c、e分别与靶序列g、h、i不完全配对互补,杂交得到的为非特异信号;探针b、d、f分别与靶序列g、h、i完全配对互补,杂交得到的为特异性信号.
2、基因芯片
基因芯片的制备的过程如下:
1.把a~f号探针分别用tris溶液溶解,定量至100μm。
2.按探针3μl(探针终浓度为5μm)、tris溶液27μl、点样液30μl的比例配置点样溶液。
3.把点样溶液加入点样板中,放入点样仪,再加入经过常规处理的载玻片,在载玻片上进行探针的点样固定,得到需要的芯片。
其中,探针的点样固定方式为,将上述合成的序列a、b、c、d、e、f作为检测目标序列g、h、i的探针于基因芯片上进行点样。点样方式如图1所示。
3、基因芯片杂交组件的构建
【溶液的配制】
荧光染色剂稀释液:规格为“10000×”的sybrgreenⅰ溶液用dmso稀释10000倍,备用。
磷酸盐缓冲液:分别称取k2hpo4·3h2o和kh2po4,分别配制成50mm的溶液,两种磷酸盐溶液调节ph至7.4左右,备用。
tris盐缓冲液:分别称取tris盐酸盐和tris碱,分别配制成400mm的溶液,两种tris溶液调节ph至7.4左右,备用。
【制备te值待测样品】
对照组:荧光染色剂稀释液1μl、磷酸盐溶液(终浓度5mm)、tris盐溶液(终浓度5mm),加入适量dna溶液(使定量后dna终浓度为4ng/μl),用超纯水定量至40μl。
甜菜碱实验组:荧光染色剂稀释液1μl、磷酸盐溶液(终浓度5mm)、tris盐溶液(终浓度5mm),加入适量dna溶液(使定量后dna终浓度为4ng/μl),甜菜碱溶液(使定量后终浓度分别为1m、2m、3m、4m、5m),用超纯水定量至40μl。
zn2+实验组:荧光染色剂稀释液1μl、磷酸盐溶液(终浓度5mm)、tris盐溶液(终浓度5mm),加入适量dna溶液(使定量后dna终浓度为4ng/μl),zn2+溶液(使定量后终浓度分别为10-1m、10-2m、10-3m、10-4m),用超纯水定量至40μl。
【荧光定量pcr测定dna片段熔解曲线实验】
dna片段受不同因素的影响时,荧光熔解曲线图会出现难以明确判定tm值的情况,故取荧光熔解曲线中荧光信号降为零的温度(te值,即荧光信号为零的最小温度)进行考察。将te值待测样品溶液放入荧光定量pcr仪中,设置荧光定量pcr程序为:30℃30s,65个循环,每个循环加1℃。结果如下。
甜菜碱实验组中150~300bpdna片段的te值,及与对照组的比较,见表2。
表2甜菜碱溶液中不同gc%含量150~300bpdna片段的te值
从表2可见,加入甜菜碱后,不同gc%含量的150~300bp左右dna片段随着甜菜碱浓度的提高te值呈现降低的趋势。其中,gc%含量越高的dna片段,te值下降幅度越大。
尽管甜菜碱能够使不同gc%含量dna片段的te值趋于一致,但是甜菜碱浓度过高(如浓度达到5m左右时)将导致溶液粘度过大,使得在芯片上杂交显色需要的仪器条件过高甚至难以实现。具体来说,将缓冲溶液粘度设定为“1”,则加入3m甜菜碱的缓冲溶液粘度提高为“3”,由于加入甜菜碱的溶液粘度较正常缓冲溶液高,严重缩短了仪器的使用寿命,不利于杂交检测的进行。
已知二价金属元素可以影响dna的双链稳定性。如,zn2+、co2+、ni2+等二价金属元素与dna片段结合,可以破坏碱基对之间的氢键作用。而dna片段的稳定性主要依赖于氢键,故过渡金属离子更容易影响dna双链的稳定性。本发明通过考察zn2+、ca2+、cu2+对不同gc%含量dna片段解链温度的影响,发现只有zn2+对不同gc%含量的dna片段te值的影响存在规律性,在此基础上利用zn2+与甜菜碱的影响进行协同作用。实验结果表明,ca2+、cu2+对不同gc%含量的dna片段的te值的影响不规律,协调性不强,无法使不同gc%含量的片段达到一致的te值(如下方表格所示)。本发明在此基础上提出将zn2+加入甜菜碱缓冲溶液的发明构思,以实现解决不同gc%含量dna片段在基因芯片杂交统一条件的特定技术问题。
ca2+实验组中150~300bpdna片段的te值,及与对照组的比较,见表3。
表3ca2+离子溶液中不同gc%含量150~300bpdna片段的te值
cu2+实验组中150~300bpdna片段的te值,及与对照组的比较,见表4。
表4cu2+离子溶液中不同gc%含量150~300bpdna片段的te值
表4*注:“/”表示加入cu2+后,荧光信号值测定时一直为零。
zn2+实验组中150~300bpdna片段的te值,及与对照组的比较,见表5。
表5zn2+离子溶液中不同gc%含量150~300bpdna片段的te值
从表5可见,不同浓度zn2+对dna片段存在不同影响。随着zn2+浓度的提高,不同gc%含量的dna片段te值呈现趋于一致的趋势,直至zn2+浓度为10-3m时,各片段dna双链完全解链为单链的温度基本一致。
而当zn2+浓度由10-3m提高为10-2m时,不同gc%含量的dna片段的te值差异重新变大。至zn2+浓度达到10-1m时,dna溶液有白色沉淀生成,可能原因为zn2+浓度过高与dna形成聚合物沉淀。根据zn2+浓度对dna片段影响的实验结果可见,zn2+浓度不宜过高,可在10-3m至10-2m之间。较优地,zn2+浓度为10-3m。
【杂交实验】
在研究不同gc%含量dna片段的熔解曲线实验中,高于5m浓度的甜菜碱实现了不同dna片段te值逐渐趋于一致的目的。但基因芯片杂交时,超过3m的甜菜碱溶液的粘度很大,不利于杂交的进行。本发明通过进一步引入zn2+离子进行调节,实现在甜菜碱低浓度时,调整不同gc%含量的dna片段在基因芯片上的杂交条件,使其在统一实验条件下就可以进行杂交,简化实验操作。
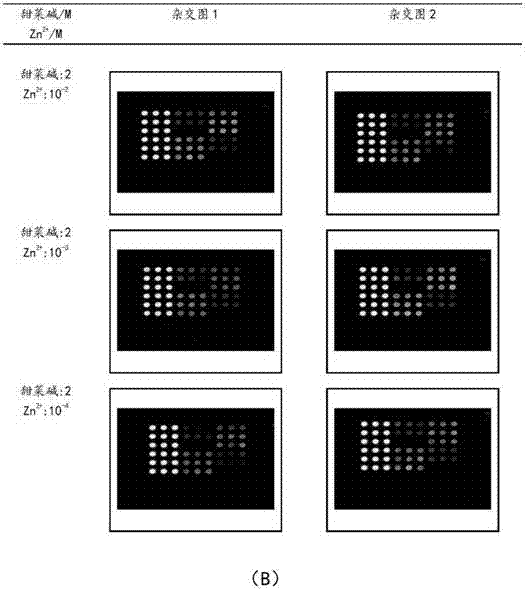
实验过程:取磷酸盐溶液(终浓度5mm)、tris盐溶液(终浓度5mm),杂交缓冲液90μl,加入g、h、i三种靶序列dna片段(使定容后三个dna片段终浓度都为5*10-4μm)、甜菜碱溶液和zn2+离子溶液,用超纯水定量至200μl。设置定量后zn2+离子溶液浓度为10-2m、10-3m、10-4m,甜菜碱定量后浓度分别为1.5m、2m、2.5m,制备得到杂交实验用的杂交溶液,进行梯度实验。杂交溶液放入杂交仪中进行杂交,杂交温度设定为31摄氏度。结果如图2(a)-图2(c)所示。
在本项杂交实验中,通过调节杂交缓冲液中甜菜碱和锌离子浓度,从而设置芯片杂交的不同条件,以检测各因素对杂交结果的影响。实验结果表明,甜菜碱浓度为2.5m、zn2+离子浓度为10-3m时芯片杂交达到最优效果,即芯片上1、3、5号位点没有非特异信号,2、4、6号位点特异性信号明显,表明特异性杂交的成功进行。
如图2表明,在杂交缓冲液中加入甜菜碱和zn2+离子,本发明如图2表明,在甜菜碱浓度2.5m、zn2+离子浓度10-3m的条件下,实现了将不同gc%含量dna片段在同一条件下进行杂交。尤其地,在甜菜碱浓度2.5m、zn2+离子浓度10-3m的条件下,还实现了消除不同gc%含量dna片段中由于突变引起dna片段的杂交信号。具体参见图2(a)的甜菜碱:0、zn2+离子:0组中,在1、3和5号位点具有明显信号(非特异性杂交信号),表示现有杂交条件不适于对具有较大差异gc%含量dna片段同时在同一芯片上进行杂交。而在甜菜碱浓度2.5m、zn2+离子浓度10-3m的条件下,1、3、5号位点的非特异信号明显变弱消失。
基于上述实验结果,本发明构建得到一种基因芯片杂交组件,其包括至少两种或更多种具有不同gc%含量的探针和杂交溶液。其中,多种探针序列之间具有较高gc%含量差异,gc%含量差异程度可达到0%~70%,多种探针序列的gc%含量范围可为10%-80%。本发明的基因芯片杂交组件中含有杂交溶液,其提供了待检测的目的片段,杂交溶液的成分包括预杂交液、显色液、抗体抗稀、杂交缓冲液和洗液。与一般杂交溶液尤其区别的是,本发明中杂交溶液中含有包含甜菜碱和zn2+。本发明杂交溶液ph值范围在7.0-7.5。
本发明的基因芯片杂交组件,杂交溶液中,甜菜碱浓度1.5m~2.5m、zn2+离子浓度在10-4m至10-2m之间。较优地,zn2+浓度为10-3m。
本发明基因芯片杂交组件中,举例来说,探针序列可以任选自以下的:
seqidno.5:5’-atggcccaggcccagccgcg-3’(片段b,gc%含量80%)
seqidno.7:5’-acatgcagagacccagcaat-3’(片段d,gc%含量50%)
seqidno.9:5’-aattttgagtctttttaaaa-3’(片段f,gc%含量15%)
seqidno.4:5’-atggcccaggtccagccgcg-3’(片段a,gc%含量75%)
seqidno.6:5’-acatgcagaggcccagcaat-3’(片段c,gc%含量55%)
seqidno.8:5’-aattttgagtatttttaaaa-3’(片段e,gc%含量10%)
seqidno.10:5’-
caggcacaacaccttgccgccaggcacaacaccttgccgctg
ggcctgggccatgaccacgctgaccccggcatggctgatggc
-3’(片段g,gc%含量69.7%)
seqidno.11:5’-
gggcaactagaaaggctggtggagttgacttagctgagattgctggg
tctctgcatgtcatcccttctgactttctggtgacttcttaggtcattaata
-3’(片段h,gc%含量47%)
seqidno.12:5’-
acatgttaaaatactatgaagaatgacatcagggattcttttaaaaagac
tcaaaattggctnggtgcggtggctcacacctgtaatcccaacactttg
-3’(片段i,gc%含量38.4%)
本发明基因芯片杂交组中至少包括两种探针,其序列的gc%含量差异较大,gc%含量范围在10%-80%。本发明基因芯片杂交组探针的序列可任意选自seqidno.4至seqidno.9的两种或更多,样品片段的序列可任意选自seqidno.10至seqidno.12的两种或更多。探针和/或样品片段的个数多至能实现用于基因芯片上杂交的情形。
举例来说,本发明基因芯片杂交组所包括的探针是seqidno.5(gc%含量80%)、seqidno.7(gc%含量50%)、seqidno.9(gc%含量15%)中的任意两种序列,或者是该三种序列。在该实现方式中,探针序列之间gc%含量的差异范围在30%~65%,具体探针序列之间gc%含量的差异为30%、35%和65%。或者,本发明基因芯片杂交组所包括的探针是seqidno.4(gc%含量75%)、seqidno.6(gc%含量55%)、seqidno.8(gc%含量10%)中的任意两种序列,或者是该三种序列。在该实现方式中,探针序列之间gc%含量的差异范围在20%~65%,具体探针序列之间gc%含量的差异为20%、45%和65%。本发明基因芯片杂交组所包括的靶序列是seqidno.10、seqidno.11、seqidno.12中的任意两种序列,或者是该三种序列。
实施例2:应用本发明杂交组件进行基因芯片杂交
【基因芯片】
参考实施例1所述方法,制备基因芯片。其中,点样到基因芯片上的探针序列如下:
(片段b)seqidno.5:5’-atggcccaggcccagccgcg-3’(gc%含量80%)
(片段d)seqidno.7:5’-acatgcagagacccagcaat-3’(gc%含量50%)
(片段f)seqidno.9:5’-aattttgagtctttttaaaa-3’(gc%含量15%)
(片段a)seqidno.4:5’-atggcccaggtccagccgcg-3’(gc%含量75%)
(片段c)seqidno.6:5’-acatgcagaggcccagcaat-3’(gc%含量55%)
(片段e)seqidno.8:5’-aattttgagtatttttaaaa-3’(gc%含量10%)
点样模式如图3所示。图3中各号位点对应的片段分别为,0-阳性探针,1-6为设计的探针序列,1-a,2-b,3-c,4-d,5-e,6-f。
【杂交溶液】
本发明基因芯片杂交组件包括至少两种或更多种探针和杂交溶液。杂交溶液的成分包括预杂交液、显色液、抗体抗稀、杂交缓冲液和洗液。
预杂交液:主要为盐溶液,洗涤载玻片,为后续杂交反应进行准备。
显色液:主要成分为生物素。生物素可标记寡核苷酸和pcr产物,被生物素标记的序列与固定在载玻片上的核苷酸序列进行杂交,形成专一的核酸杂交体。
抗体抗稀:主要成分为碱性磷酸酶-链亲和素抗体复合物和蛋白质。此复合物与形成的核酸杂交体进行抗原抗体反应,形成三元复合物。该三元复合物催化nbt、bcip显色反应,产生蓝紫色沉淀,从而使杂交体染色。抗体抗稀中的蛋白质可以封阻固相载体非杂交位点。
杂交缓冲液:主要成分为缓冲盐溶液、锌离子、甜菜碱、提供靶序列的目的dna片段,调整ph为7.0-7.5。为杂交显色反应提供反应环境,确保实验的进行;锌离子和甜菜碱,主要作用为调节芯片上不同gc%含量寡核酸片段与杂交溶液中的靶序列的杂交条件,使之实现在统一的条件下进行杂交。甜菜碱选择较优浓度2.5m、zn2+离子选择较优浓度10-3m。
洗液:主要成分为盐溶液,作用为洗去杂交残留物,获得清晰、可视的靶点信号。
【杂交过程】
使用本发明杂交组件的杂交方法可包括将所述杂交组件用于包含靶核酸序列(很可能呈双链形式)的样品。通常,为了保证芯片上的探针与靶序列杂交,将样品加热,以使靶核酸变性。杂交期间,杂交缓冲液作用于靶序列与芯片上探针的杂交。与现有技术相比,本发明杂交缓冲液实现了将gc%含量具有较大差异的片段以固定在基因芯片上的探针形式在同一条件下与目的片段进行正确杂交,本发明显著降低了由于多个探针序列gc%含量的差异所引起的杂交条件的苛刻性。
分别取不低于200ul的显色液、杂交缓冲液、抗体抗稀加入到已预装洗液的8联条管的相应位置中,将条管放入全自动杂交仪内。g、h、i三种单链dna片段用作与探针序列杂交的靶序列。
(片段g)seqidno.10:
5’-caggcacaacaccttgccgccaggcacaacaccttgccgctg
ggcctgggccatgaccacgctgaccccggcatggctgatggc-3’
(片段h)seqidno.11:
5’-gggcaactagaaaggctggtggagttgacttagctgagattgctggg
tctctgcatgtcatcccttctgactttctggtgacttcttaggtcattaata-3’
(片段i)seqidno.12:
5’-acatgttaaaatactatgaagaatgacatcagggattcttttaaaaagac
tcaaaattggctnggtgcggtggctcacacctgtaatcccaacactttg-3’
取出芯片,做好标记,将基因芯片放入全自动杂交仪中,运行如下杂交程序:预杂交液,31℃,5min;杂交缓冲液,31℃,30min;洗液1,31℃,6min;洗液1,31℃,6min;洗液2,28℃,5min;洗液2,28℃,5min;抗体液,28℃,20min;洗液2,28℃,5min;洗液2,28℃,5min;洗液3,28℃,3min;显色液,31℃,30min;预杂交液,28℃,2min;预杂交液,28℃,2min。
反应结束后,取出芯片。将芯片放入芯片识读仪中,进行图像扫描与数据分析。
【杂交结果】
识读仪根据芯片上位点杂交产生的蓝紫色斑点来生成光点信号,来判断每个位点上杂交情况。如图4所示,杂交结果如下:
1、2位点为同一种碱基序列,其中1位点探针有一个碱基突变,不能与靶序列seqidno.10进行完全杂交,2位点探针可以与靶序列seqidno.10进行完全杂交。
3、4位点为同一种碱基序列,其中3位点探针有一个碱基突变,不能与靶序列seqidno.11进行完全杂交,4位点探针可以与靶序列seqidno.11进行完全杂交。
5、6位点为同一种碱基序列,其中5位点探针有一个碱基突变,不能与靶序列seqidno.12进行完全杂交,6位点探针可以与靶序列seqidno.12进行完全杂交。
由此可见,本发明通过调节杂交缓冲液中的锌和甜菜碱的量,使不同gc%含量的dna片段在同一个条件下进行杂交,表现为2(片段b)、4(片段d)、6(片段f)位点都有光点信号,信号均匀;1(片段a)、3(片段c)、5(片段e)位点没有光点信号,即本杂交实验结果确保了能够将非特异性杂交区别开来。
实验结果表明,采用本发明基因芯片杂交组件,能够使序列具有不同gc%含量、且含量范围在10-80%的多个dna片段在同一张基因芯片上和相同条件下实现同时杂交。并且,采用本发明基因芯片杂交组件消除了不同gc%含量dna片段中由于突变引起dna片段的非特异性杂交信号。
序列表
<110>上海百傲科技股份有限公司
<120>基因芯片杂交组件、包含该杂交组件的试剂盒、其应用及杂交检测方法
<160>12
<210>1
<211>176
<212>dna
<213>tpmt(homosapiens)
<400>1
gtcttgagaaggttgatgcttttgaagaacgacakaaaagttggggaattgactgtctttttgaaaagttatrtctacttacagaaaagtaaatgagacatagataaaataaaatcacactgacatgtttttgaggaattgaaaattatgctaaagcctgaaaatgtaatggatga
<210>2
<211>226
<212>dna
<213>cy(homosapiens)
<400>2
tggagagtggcataggagatacccacgtatgtaccacccagcttaacgaatgctctactgtcatttctaaccataatctctttaaagagctcttttgtctttcartatctcttccctgtttggaccacattacccttcatcatatgaagccttgggtggctcctgtgtgagactcttgctgtgtgtcacaccctaatgaactagaacctaaggttgctgtgtgtcg
<210>3
<211>264
<212>dna
<213>apoe(homosapiens)
<400>3
cggtggcggaggagacgcgggcacggctgtccaaggagctgcaggcggcgcaggcccggctgggcgcggacatggaggacgtgtgcggccgcctggtgcagtaccgcggcgaggtgcaggccatgctcggccagagcaccgaggagctgcgggtgcgcctcgcctcccacctgcgcaagctgcgtaagcggctcctccgcgatgccgatgacctgcagaagcgcctggcagtgtaccaggccggggcccgcgagggcgccgagc
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
atggcccaggtccagccgcg
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
atggcccaggcccagccgcg
<210>6
<211>20
<212>dna
<213>人工序列
<400>6
acatgcagaggcccagcaat
<210>7
<211>20
<212>dna
<213>人工序列
<400>7
acatgcagagacccagcaat
<210>8
<211>20
<212>dna
<213>人工序列
<400>8
aattttgagtatttttaaaa
<210>9
<211>20
<212>dna
<213>人工序列
<400>9
aattttgagtctttttaaaa
<210>10
<211>84
<212>dna
<213>人工序列
<400>10
caggcacaacaccttgccgccaggcacaacaccttgccgctg
ggcctgggccatgaccacgctgaccccggcatggctgatggc
<210>11
<211>99
<212>dna
<213>人工序列
<400>11
gggcaactagaaaggctggtggagttgacttagctgagattgctggg
tctctgcatgtcatcccttctgactttctggtgacttcttaggtcattaata
<210>12
<211>99
<212>dna
<213>人工序列
<400>12
acatgttaaaatactatgaagaatgacatcagggattcttttaaaaagac
tcaaaattggctnggtgcggtggctcacacctgtaatcccaacactttg
- 还没有人留言评论。精彩留言会获得点赞!