Taqman‑MGB探针检测绵羊BMPR‑IB基因A746G突变的试剂盒和方法与流程
本发明属于生物技术领域,具体涉及taqman-mgb探针检测绵羊bmpr-ib基因a746g突变试剂盒和方法。
背景技术:
高繁殖力是世界绵羊生产共同追求的重要目标之一。但由于绵羊绝大多数产单羔,少数产双羔,故极大地影响了绵羊的繁殖性能,随着集约化养羊业的不断发展,如何提高绵羊繁殖力是养羊业获得较好经济效益的关键。多胎性状是绵羊重要的繁殖性状之一,也是绵羊多产、高产的基础,繁殖力的高低直接影响生产成本,进而影响经济效益,因此,绵羊的多胎性能引起人们的普遍关注,国内外纷纷引进或培育多胎绵羊品种。研究表明,大部分绵羊品种产羔数低,多羔的遗传力较低,仅为0.12,在一定程度上限制了我国绵羊生产性能的提高,同时,繁殖性状与生长速度呈负相关关系,因而影响了常规育种方法的效果和可操作性,选育周期长。分子标记辅助选择可以弥补常规表型选择方法的不足,提高选择的准确性并缩短世代间隔,提高育种效率。
自从1980年以来,研究人员开始筛选、鉴定控制绵羊排卵率和产羔率的主效基因,研究证实绵羊fecb基因实际为骨形态发生蛋白ib型受体(bmpr-ib)基因,bmpr-ib基因的突变能够显著增加绵羊排卵率,是中国美利奴羊、小尾寒羊、湖羊等绵羊排卵率和产羔数的主效基因。我们前期研究表明,中国美利奴羊(军垦型)bmpr-ib基因存在a746g碱基突变,该基因编码区746处的a→g突变的发生与fecb表型一致,在绵羊群体中存在3种基因型,其遗传效应表现为:bb纯合型与地方品种羊相比,平均排卵数增加3枚,每只母羊平均每胎能多产1.5只羔羊;b+杂合型与地方品种羊相比,平均排卵数增加1.5枚,每只母羊平均每胎能多产1.0只羔羊;++野生型产羔数与地方品种接近。bmpr-ib基因b等位基因在绵羊群体中存在,使得羊群的繁殖率比较高,该基因a746g碱基突变对绵羊排卵率呈加性效应,对窝产羔数呈部分显性效应。因此,bmpr-ib基因可用于多胎绵羊的分子育种。
通过对母羊bmpr-ib基因a746g碱基突变的检测,开展bmpr-ib基因标记辅助选择,组建bb基因型绵羊群体,是快速提高绵羊繁殖力的一个有效方法,能够使群体平均产羔数达到230%以上,极大的增加羔羊数量,提高养羊的经济效益。而建立bmpr-ib基因a746g碱基突变的检测方法是实现分子标记辅助选择的前提条件。目前,针对bmpr-ib基因a746g突变的检测方法主要有:测序法、聚合酶链式反应-限制性片段长度多态性技术(pcr-rflp)、聚合酶链式反应-单链构象多态性(pcr-sscp)、基因芯片法、荧光定量pcr方法(qpcr)。
测序法准确性高,但操作繁琐,成本较高。基因芯片是在核酸杂交基础上建立起来的新方法,在大规模样本检测或基因多态性位点检测方面具有很大优势,但是配套检测仪器设备要求高、仪器价格高、检测成本高。pcr-sscp方法存在假阴性和假阳性,一般对长度不超过300bp段的检出率为70-80%。pcr-rflp方法是一种常用的snps检测技术,2008年基于pcr-sscp和pcr-rflp技术已建立农业行业标准“绵羊多胎主效基因fecb分子检测规程(ny/t1672-2008)”,pcr-rflp方法成本低,结果比较直观,但是操作繁琐,检测时间长,不能适应在绵羊群体中开展大规模、并行的检测要求。qpcr方法包括突变阻滞扩增系统pcr(又名等位基因特异pcr)(arms-pcr)方法、高分辨率熔解曲线(hrm)方法、taqman探针法,qpcr方法的优点是操作简单,检测速度快,pcr产物无需进行后续实验分析即可判断结果,全过程在封闭的pcr管内进行,能最大程度的减少交叉污染。arms-pcr方法检测snp位点,操作麻烦,优化反应条件较难。hrm染料法对荧光染料、pcr仪器要求较高,仪器需要增加专门的hrm分析功能,不同基因型溶解曲线峰图差异不明显,实验要求比较高。taqman-mgb探针法是在普通taqman探针基础之上发展起来的,mgb探针是指带有一个小沟结合物基团的dna探针,它可与单链的靶dna形成极为稳定的异源双链,mgb探针相对于通常的探针序列更短一些,使荧光基团和淬灭基团的距离更近;其3'端标记了自身不发光的淬灭分子,以取代常规可发光的tamra等荧光标记,3'端增加的一个mgb分子可以稳定探针与模板的杂交,提高探针的退火温度和特异性,使荧光本底降低,荧光光谱分辨率得以大大改善,探针淬灭效果更好,分辨率更高,检测结果更加精确。利用taqman-mgb探针法可实现高通量、快速、准确的检测绵羊bmpr-ib的a746g突变,可以为多胎绵羊育种提供一种合适的基因检测方法。
技术实现要素:
本发明的目的之一在于提供taqman-mgb探针检测绵羊bmpr-ib基因a746g突变的准确、效果好、分辨率高的引物、探针;
另一个目的在于提供一种灵敏度高、准确率高,可规模检测、有效提高工作效率、简便实用的检测绵羊bmpr-ib基因a746g突变的试剂盒及检测方法,适用于常用的荧光定量pcr仪,能够快速、准确对绵羊bmpr-ib基因a746g突变进行检测,并实现基因分型。
本发明所采取的技术方案是:
taqman-mgb探针检测绵羊bmpr-ib基因a746g突变的引物、探针,其特征在于核苷酸序列如下:
其上游引物bmf的核苷酸序列如序列表中seqidno:1所示;
其下游引物bmr的核苷酸序列如序列表中seqidno:2所示;
其野生探针bpa的核苷酸序列如序列表中seqidno:3所示;
其突变探针bpg的核苷酸序列如序列表中seqidno:4所示;
所述野生探针bpa的5’一端标记有荧光基团1,3'一端标记有mgb淬灭基团;所述突变探针bpg的5’一端标记有荧光基团2,3'一端标记有mgb淬灭基团;
其中所述的荧光基团1或荧光基团2为fam、tet、vic、hex或rox中的一种,且荧光基团1与荧光基团2不相同。
利用所述引物、探针所构成的taqman-mgb探针检测绵羊bmpr-ib基因a746g突变的试剂盒,包含阳性对照样品、dna提取液ⅰ、dna提取液ⅱ、2×lightcycler480probesmaster、一对引物bmf和bmr,以及其对应的探针bpa和bpg、ddh2o;
其中dna提取液ⅰ、dna提取液ⅱ,其组成成分如下:
dna提取液ⅰ:0.01mol/ltris,0.01mol/lnacl,0.005~0.01mol/lmgcl2﹒6h2o;
dna提取液ⅱ:10mmol/ltris,0.1mmol/ledta-na2﹒2h2o,0.1~1%tritonx-100。
作为优选,所述试剂盒中所包含的阳性对照样品为三个,分别对应绵羊bmpr-ib基因的++、b+和bb三种基因型。
一种利用所述试剂盒的检测方法,包括以下步骤:
(1)从绵羊血液中提取基因组dna:
(a)取无菌的1.5ml离心管,向其中加入混匀的edta抗凝血200µl和dna提取液ⅰ溶液600µl,充分混匀,室温静置10min;将离心管置于离心机中,6000rpm离心1min;
(b)取出离心管,倾去上清液,保留沉淀;向离心管中加入dna提取液ⅱ溶液60µl,充分振荡混匀;沸水浴中10min;
(c)取出离心管,置离心机中,12,000rpm离心10min,离心后上清液可用于后续实验;
(2)将骤(1)得到的dna分别加入到pcr反应液中,取一对引物和探针,进行实时荧光定量pcr扩增,获得绵羊的bmpr-ib基因包含a746g突变位点的基因片段;
(3)根据检测到的荧光信号对绵羊bmpr-ib基因a746g位点的三种基因型进行判定,即++、b+和bb基因型。
作为优选,所述的检测方法,步骤(2)中实时荧光定量pcr反应所使用的扩增体系为20µl,扩增体系中包含以下溶液或试剂:2×lightcycler480probesmaster10μl,10μmol/l上游引物bmf0.8μl,10μmol/l下游引物bmr0.8μl,10μmol/l野生探针bpa0.4μl,10μmol/l突变探针bpg0.4μl,基因组dna3μl,去离子水补齐至20µl。
作为优选,所述的检测方法,步骤(2)中实时荧光定量pcr反应所使用的扩增程序为95℃预变性10min;95℃变性10sec,55℃退火30sec,72℃延伸1sec,45个循环。
根据bmpr-ib基因a746g基因型将绵羊群体分为三种类型,选择bb基因型个体组建多胎绵羊群体,从而实现多胎绵羊的分子标记辅助育种,即完成基于taqman-mgb探针检测绵羊bmpr-ib基因a746g突变试剂盒和方法的应用。
所述绵羊血液中基因组dna提取原理:
批量检测中,应用相同起始edta-na2抗凝血,可以保证提取的基因组dna浓度的一致性,确保后续实时荧光定量pcr扩增条件的一致性,以及检测结果的准确性。抗凝血经dna提取液ⅰ处理,将血液中红细胞破裂,经离心除去红细胞碎片,保留白细胞;dna提取液ⅱ使分离的白细胞裂解,释放出基因组dna,经离心处理,上清中的dna可以用于实时荧光定量pcr,在短时间内实现基因组dna的提取。
经典方法中,通过酚/氯仿抽提基因组dna,先从血液样品中去除蛋白质,酚抽提一次,酚/氯仿抽提一次,氯仿抽提一次,有时还要重复几次,这样就大大增加了工作量。而且酚具有高度腐蚀性,易引起严重的烧伤;氯仿对中枢神经系统具有麻醉作用,对操作者的心、肝、肾有损害,吸入或经皮肤吸收引起急性中毒。因此,经典方法对操作人员的身体伤害较大。
虽然有相关的商品化血液基因组dna提取试剂盒,其提取基因组中多数都需要加入proteinasek,成本较高。
本发明中提供的快速从血液中提取基因组dna的方法,克服了经典方法中有害溶剂对人体危害的影响,具有提取的基因组dna步骤少、速度快、省时省力、成本低等特点。24个样品批次提取时间约为45min,比一般的动物血液基因组dna提取试剂盒减少约1h,比经典方法减少约2h。虽然应用琼脂糖凝胶电泳检测的基因组dna条带较弱、纯度较低,但是完全可以满足所述的taqman-mgb探针检测绵羊bmpr-ib基因a746g突变位点。
所述的taqman-mgb探针检测绵羊bmpr-ib基因a746g突变的方法是以快速提取的绵羊基因组dna为模版,在实时荧光定量pcr体系中同时加入上述引物和探针,引物用于绵羊bmpr-ib基因包含a746g的基因片段扩增,上述探针中在5’端分别加入2种不同荧光基团,即fam和vic,野生探针(bpa)和突变探针(bpg)分别与bmpr-ib基因的+和b等位基因完全配对。探针的3’端加入淬灭基团为mgb。taqman-mgb探针是利用taqdna聚合酶5’→3’外切酶活性切断探针,产生荧光信号。探针和模版特异性的结合在两条引物之间,由于探针5’端标记有报告基团(fam、vic),3′端标记有淬灭基团mgb。当探针完整时,5’端报告基团和3′端淬灭基团紧邻在一起,报告基团所发射的荧光能量被淬灭基团吸收,仪器检测不到信号。随着pcr的进行,taqdna聚合酶在链延伸中遇到与模版结合的探针,与模板完全配对的探针逐步被taqdna聚合酶5’→3’外切核酸酶活性切断,致使探针5’端上的报告基团与3’端的淬灭基团分离,淬灭效应解除,报告基团所发射的荧光能量不能被吸收,产生荧光信号。而与模板不完全配对的探针不能被切断,故检测不到荧光信号。因此,仪器根据荧光信号及其对应的颜色就可以实现基因突变的检测,根据检测结果即可判定绵羊个体为bmpr-ib基因的++、b+或bb基因型。
本发明中的mgb探针具有3’端淬灭基团,不产生荧光,可以大大降低本底信号的强度,也将探针的tm值提高10℃左右,提高探针的退火温度和特异性,因此为了获得同样的tm值,mgb探针可以比普通的taqman探针设计的更短,既可以降低合成成本,也使得探针设计的成功率大为提高,探针淬灭效果更好,分辨率更高,对单个碱基突变检测更敏感、准确,比传统的taqman探针检测和hrm检测等方法结果判读更容易。与pcr-rflp方法检测bmpr-ib基因多态性相比,根据pcr仪器的通用性,一次可以检测92个样品,且不需要进行pcr产物的酶切和电泳后续分析,在节省检测成本的同时,大大缩短了检测周期,提高了检测的效率。由于全过程在封闭的pcr管内进行,也有效降低了pcr产物污染引起假阳性的风险,结果更易于准确判读。所提供的基于taqman-mgb探针的绵羊bmpr-ib基因a746g突变检测试剂盒和方法,可实现高通量、快速、准确的检测绵羊bmpr-ib的基因型,可以为多胎绵羊分子辅助育种提供一种合适的基因检测方法。该试剂盒及检测方法操作简单、检测速度快、准确性高,而且不需要进行pcr产物后续分析即可判型,反应全过程在封闭的管内进行,减少了交叉污染。
附图说明
附图1,为本发明实施例1中基于taqman-mgb探针的绵羊bmpr-ib基因的a746g突变三种基因型的检测结果,图中标注的bb、b+和++分别对应bmpr-ib基因的bb、b+和++三种基因型。
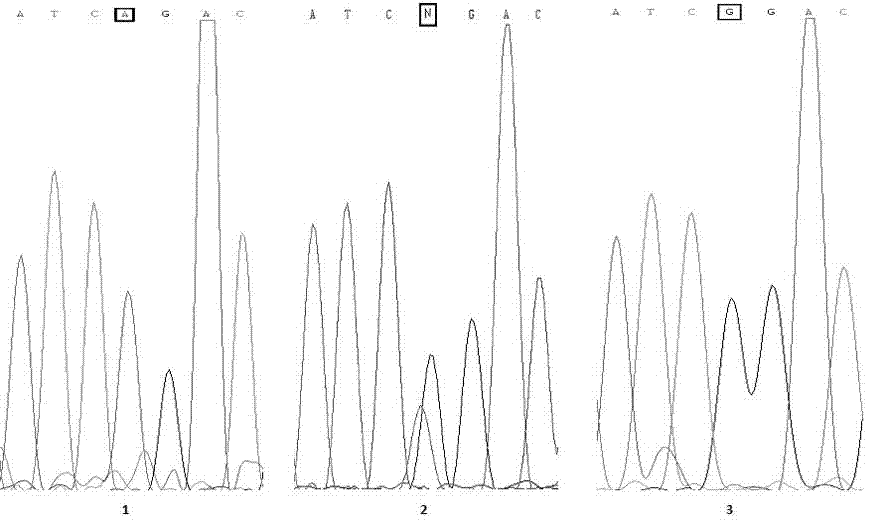
附图2,为选取的1号、2号和3号绵羊样本,经基于taqman-mgb探针的bmpr-ib基因实时荧光定量pcr扩增产物的测序图谱,如图2所示,1号样本经pcr扩增及测序,证明在bmpr-ib基因746处碱基为a,对应bmpr-ib基因型为++基因型;2号样本经pcr扩增及测序,证明在bmpr-ib基因746处碱基为a/g杂合型,对应bmpr-ib基因型为b+基因型;3号样本经pcr扩增及测序,证明在bmpr-ib基因746处碱基为g,对应bmpr-ib基因型为bb基因型;经对比,基于taqman-mgb探针的绵羊bmpr-ib基因a746g突变检测结果与测序结果完全符合。
附图3,为参照农业行业标准“绵羊多胎主效基因fecb分子检测规程(ny/t1672-2008)”,应用pcr-rflp方法,进行绵羊bmpr-ib基因a746g突变检测结果,图中m为dna分子量puc19dna/mspⅰ(hapⅱ)marker;1~12分别为不同样本pcr-rflp电泳分型结果,8为bb基因型,1、3、4、5、10、12为b+基因型,2、6、7、9、11为++基因型。
具体实施方式
实施例1:
参考附图1-图3,下面结合附图对实施例详细描述本发明的技术方案,本实施例实施步骤如下:
1、实验材料与样品采集:
选取498只中国美利奴(军垦型)肉用多胎品系、464只中国美利奴(军垦型)毛用多胎品系、663只多胎萨福克羊、150只萨福克羊、320只哈萨克羊和150湖羊为实验对象,共计2245只。
采用一次性注射器从绵羊颈静脉抽取约1ml的血液,注入经高压灭菌并装有约150µl2%无菌edta(ethylenediaminetetraaceticacid,edta)抗凝剂的1.5ml离心管中,轻轻摇匀,记录羊号,-20℃保存备用。
2、主要药品和试剂:
三(羟甲基)氨基甲烷(tris),nacl,mgcl2﹒6h2o,edta-na2﹒2h2o,tritonx-100,生工生物工程(上海)股份有限公司;lightcycler480probesmaster,罗氏诊断产品(上海)有限公司。
3、主要仪器:
lightcycler®480高通量实时荧光定量pcr系统,roche公司;hico21高速离心机,生工生物工程(上海)股份有限公司。
4、引物和探针的设计与合成:
根据绵羊bmpr-ib基因a746gsnp位点设计引物和探针,上游引物bmf和下游引物bmr由生工生物工程(上海)股份有限公司合成,野生探针bpa和突变探针bpg由上海辉睿生物科技有限公司合成。
上游引物(bmf):5'-gtgttcttcactacagaggaggc-3'
下游引物(bmr):5'-cctgaacatcgctaatacagactt-3'
野生探针(bpa):5’-fam-caacaccgtctgatat-mgb-3'
突变探针(bpg):5’-vic-caacaccgtccgatat-mgb-3'
5、绵羊基因组dna的快速提取:
(1)试剂配制:
配制绵羊基因组dna快速提取的试剂,如下:
dna提取液ⅰ(ph8.0):0.01mol/ltris,0.01mol/lnacl,0.005~0.01mol/lmgcl2﹒6h2o;
dna提取液ⅱ(ph8.0):10mmol/ltris,0.1mmol/ledta-na2﹒2h2o,0.1~1%tritonx-100。
(2)取无菌的1.5ml离心管(自备),向其中加入混匀的edta抗凝血200µl和dna提取液ⅰ溶液600µl,充分混匀,室温静置10min;将离心管置于离心机中,6000rpm离心1min。
(3)取出离心管,倾去上清液,保留沉淀;向离心管中加入dna提取液ⅱ溶液60µl,充分振荡混匀;沸水浴中10min。
(4)取出离心管,置离心机中,12,000rpm离心10min,离心后上清液可用于后续实验。
6、基于taqman-mgb探针的实时荧光定量pcr:
(1)以绵羊基因组dna为模版,利用前述的引物和探针,进行实时荧光定量pcr扩增,获得绵羊的bmpr-ib基因包含a746g突变的117bp基因片段。
20μl反应体系中包含以下溶液或试剂:
2×lightcycler480probesmaster10μl;
上游引物bmf(10μm)0.8μl;
下游引物bmr(10μm)0.8μl;
探针bpa(10μm)0.4μl;
探针bpg(10μm)0.4μl;
去离子水4.6μl;
基因组dna3.0μl。
其中2×lightcycler480probesmaster,包含faststarttaqdna聚合酶、pcr反应buffer、6.4mmmgcl2和dntp混合物。
根据实时荧光定量pcr仪器规格,通常为96孔,为提高加样一致性和速度,可制备除了基因组dna以外的混合pcr反应体系,考虑移液器和吸头误差,一般每个96孔板按100个反应体系计算,应用移液器将反应体系分至96孔板,每孔分别加入待检测的基因组dna样品,完成以后用封口膜封口,瞬时离心。
每个96孔板上设置一个空白对照ntc和三个已知基因型(bb、b+和++基因型)的绵羊基因组对照。
(2)将上述溶液混合均匀,按以下条件进行pcr反应。
95℃预变性10min;95℃变性10sec,55℃退火30sec,72℃延伸1sec,45个循环。
7、基因分型:
反应结束后,应用lightcycler®480高通量实时荧光定量pcr系统配套软件lightcycler480softwarerelease1.5.1.62软件进行数据分析,根据对照扩增结果,分型产生三种基因型(bb、b+和++基因型)(见图1)。
++基因型:接近x轴区域,呈蓝色点。
bb基因型:接近y轴区域,呈绿色点。
b+基因型:位于x轴和y轴的中间区域,呈红色点。
8、数据统计分析:
根据检测结果,统计中国美利奴(军垦型)肉用多胎品系、中国美利奴(军垦型)毛用多胎品系、多胎萨福克羊、萨福克羊、哈萨克羊和湖羊不同基因型。
表1不同品种绵羊bmpr-iba746g位点基因型频率分布
注:cmmm代表中国美利奴(军垦型)肉用多胎品系;cmmw代表中国美利奴(军垦型)毛用多胎品系。括号中为绵羊只数。
可见,中国美利奴(军垦型)肉用多胎品系、中国美利奴(军垦型)毛用多胎品系和多胎萨福克羊群体中存在bmpr-ib基因三种基因型,中国美利奴(军垦型)肉用多胎品系和中国美利奴(军垦型)毛用多胎品系以++基因型为主;多胎萨福克以b+基因型为主;萨福克羊和哈萨克羊全部为++基因型;湖羊全部为bb基因型。
对检测结果的分析如下:
(1)条件优化:
taqman-mgb探针的实时荧光定量pcr检测过程中,基因组dna模版的使用量、pcr引物的扩增效率和特异性、探针的特异性和使用量、最适退火温度都成为成功检测的关键因素。因此在设计时,考虑了批量检测时间要短,pcr产物的长度要合适,检测过程中设置了一个空白对照ntc和三个已知基因型(bb、b+和++基因型)的绵羊基因组对照,pcr过程中对两步法和三步法及退火温度进行了条件摸索,并对pcr产物进行了抽样测序,确保了每一个样本检测结果的正确性。
经多次反复实验,确定了绵羊基因组dna快速提取试剂和提取方法,实时荧光定量pcr采用三步法,退火温度使用55℃,可以确保pcr的扩增效率和正确性。
(2)准确性和特异性检测:
每批次检测结束以后,随机选取++基因型、b+基因型和bb基因型的bmpr-ib基因pcr产物送生工生物工程(上海)股份有限公司测序,基因序列用blast在线软件进行比对分析。序列比对结果证实pcr扩增序列为绵羊bmpr-ib基因包含a746g突变位点的基因片段,3个样本为++基因型、b+基因型和bb基因型(见图2),检测结果与测序结果完全一致,说明设计的引物和探针正确,特异性高。
(3)重复性检测:
从2245只绵羊样本中随机选出95只羊,每一个样本从基因组dna提取、应用taqman-mgb探针的实时荧光定量pcr检测,至少重复完成3次,结果表明所有样本经多次检测,分析结果都相同,重复检测正确率达到100%,说明探针设计合理,检测结果可靠。
(4)为了进一步证明检测结果的可靠性,实验中随机选择600只中国美利奴羊(军垦型)为实验材料,应用taqman-mgb探针的实时荧光定量pcr检测试剂盒对bmpr-ib基因进行基因分型,并参照农业行业标准“绵羊多胎主效基因fecb分子检测规程(ny/t1672-2008)”,应用标准中的pcr-rflp方法对bmpr-ib基因进行检测(图3),对比分析,结果表明,两种方法检测bmpr-ib的基因型结果一致,taqman-mgb探针的实时荧光定量pcr检测试剂盒和方法的检测准确率达到100%,其中++基因型个体数为282只,b+基因型个体数为271只,bb个体数为47只,说明建立的taqman-mgb探针检测bmpr-ib基因a746g突变的试剂盒和方法能够实现绵羊多胎主效基因bmpr-ib基因型的检测。
以上检测试剂盒中所包含的阳性对照样品、dna提取液ⅰ、dna提取液ⅱ、2×lightcycler480probesmaster、两对引物及其对应的探针,以及检测方法能够准确检测绵羊多胎性状主效基因bmpr-ib基因的不同基因型,选择bb基因型绵羊个体进行组群,从而能够实现准确、快速、并行的绵羊多胎性状主效基因标记辅助育种。
上述实施例是提供给熟悉本领域内的人员来实现或使用本发明的,熟悉本领域的人员可在不脱离本发明的发明思想的情况下,对上述实施例做出种种修改或变化,因而本发明的保护范围并不被上述实施例所限,而应该是符合权利要求书提到的创新性特征的最大范围。
<110>新疆农垦科学院
<120>基于taqman-mgb探针检测绵羊bmpr-ib基因a746g突变的试剂盒和方法
<141>2017-05-26
<160>4
<170>patentinversion3.3
<210>1
<211>23
<212>dna
<213>人工序列
<400>1
gtgttcttcactacagaggaggc23
<210>2
<211>24
<212>dna
<213>人工序列
<400>2
cctgaacatcgctaatacagactt24
<210>3
<211>16
<212>dna
<213>人工序列
<400>3
caacaccgtctgatat16
<210>4
<211>16
<212>dna
<213>人工序列
<400>4
caacaccgtccgatat16
- 还没有人留言评论。精彩留言会获得点赞!