一种具有CXCR4蛋白激动活性的多肽及其应用和药物组合物的制作方法
本发明涉及生物医药技术领域,特别涉及一种具有cxcr4蛋白激动活性的多肽及其应用和药物组合物。
背景技术:
趋化因子受体cxcr4属于g蛋白偶联受体(g-protein-coupledreceptor,gpcr)超家族。与其他g蛋白偶联受体相似,cxcr4由胞外n端、七个跨膜螺旋、以及连接跨膜螺旋的三个胞外loop区和三个胞内loop区、一个胞内c端组成。与其他趋化因子受体不同,cxcr4目前仅有两个内源性天然配体被发现,分别是趋化因子基质细胞衍生因子(sdf-1α,cxcl12)以及泛素。sdf-1α通过与受体cxcr4结合后,可激活下游的多条信号通路,介导细胞增殖、迁移,造血和淋巴干细胞的归巢、记忆和转运等多种生物效应。cxcr4/sdf-1轴与肿瘤、艾滋病、造血功能和恶性血液疾病、炎症性疾病、神经系统疾病等有关。
cxcr4蛋白调节剂分为拮抗剂和激动剂,二者都具有很好的市场潜力。研究显示cxcr4蛋白激动剂可以动员神经干细胞到病变部位,人神经干细胞的应用为神经系统性疾病包括神经退行性疾病以及神经损伤治疗带来新希望。多发性硬化症、阿尔茨海默病、帕金森病、桑德霍夫病、tay-sachs病以及中风等神经系统性疾病目前仍然缺乏有效的治疗方法。人神经元干细胞是一类具有自我更新和分裂潜能的细胞,这类细胞可以产生神经元和各类神经胶质细胞。通过神经干细胞进行的组织修复需要cxcr4/sdf-1轴的参与,可以促进干细胞到病变部位的迁移。
因此,调节cxcr4蛋白活性的化合物开发具有广阔的应用前景。为了更好的满足市场需求,急需提供一种新型的具有cxcr4蛋白激动活性的多肽。
技术实现要素:
有鉴于此,本发明提供了一种具有cxcr4蛋白激动活性的多肽及其应用和药物组合物。该多肽具有cxcr4蛋白激动活性,可作为cxcr4蛋白激动剂使用。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种如式i所示的多肽,或其互变异构体、内消旋体、外消旋体、对映异构体、非对映异构体及其混合物,或其药学上可接受的盐以及它的前药,或其氨基酸序列中取代、缺失或添加一个或多个氨基酸残基所得到的多肽,或其氨基酸序列中一个或多个氨基酸的侧链、氨基酸序列的氮末端或碳末端被一个或多个羟基化、烷基化、羰基化、酯化、磷酸化、糖基化、泛素化、聚乙二醇化修饰所得到的多肽,或其氨基酸序列中连接荧光标记或放射性同位素标记所得到的多肽;
其中,a片段或b片段各自独立的选自来源于vmip-∥的由3个氨基酸至全长序列任意排列组成的多肽或其反向序列,或者来源于sdf-1α(cxcl12)的由3个氨基酸至全长序列任意排列组成的多肽或其反向序列,或者没有其中一个片段;
a片段和b片段同时存在时,a片段和b片段通过l连接,所述l选自linker或者化学键;
所述linker选自-l、-l'、-ll'、z、-lz、-l'z、-lzl',或其重复单元;
其中,l和l'分别独立选自—co—(ch2)n—nh—、—co—(ch2)m(—och2—ch2)nnh—、—co(ch2—ch2—o—)nnh—;其中n代表1~20中的任意整数,m代表0~2中的任意整数;
z为连接肽片段;所述连接肽片段选自1~15个氨基酸组成的肽片段;
所述化学键为—s—、—o—、—s—s—、—s(o)—、—s(o)2—或—co—nh—。
作为优选,a片段或b片段选自vmip-ⅱ中氮末端10~21个氨基酸组成的多肽或其反向序列,或者sdf-1α(cxcl12)中氮末端5~18个氨基酸组成的多肽或其反向序列;
所述linker选自-l、-l'、-ll'、-lzl'。
在本发明提供的实施例中,所述linker为c6(-co-(ch2)5-nh2)或c12(-co-(ch2)11-nh2)。
作为优选,连接肽片段选自1~2个氨基酸组成的肽片段。
在本发明提供的实施例中,a片段或b片段选自vmip-ⅱ中氮末端11~14个氨基酸组成的多肽或其反向序列。
在本发明提供的具体实施例中,a片段或b片段的氨基酸序列为:
以上斜体字表示的氨基酸均为d型氨基酸。
在本发明提供的实施例中,a片段或b片段选自sdf-1α(cxcl12)中氮末端8个氨基酸组成的多肽或其反向序列。
在本发明提供的具体实施例中,a片段或b片段的氨基酸序列为:kpvslsyr(lys-pro-val-ser-leu-ser-tyr-arg)。
在本发明提供的实施例中,linker为peg3-k-peg3、k-peg3或peg5-k-peg5。
作为优选,连接肽片段选自1~2个氨基酸组成的肽片段。
在本发明提供的实施例中,连接肽片段为gg(gly-gly)。
在本发明提供的实施例中,多肽为seqidno:1~seqidno:6所示多肽中的一种或几种。具体序列如下:
在本发明中,斜体字的氨基酸表示为d型氨基酸。
在本发明中,seqidno:1~seqidno:6所示多肽的氨基酸序列中取代、缺失或添加一个或多个氨基酸残基所得到的多肽,或其一个或多个氨基酸的侧链,氨基酸序列的氮末端或碳末端被一个或多个羟基化、烷基化、羰基化、酯化、磷酸化、糖基化、泛素化、聚乙二醇化修饰所得到的多肽,或其氨基酸序列中连接荧光标记或放射性同位素标记所得到的多肽。
本发明所述多肽是指氨基酸之间通过肽键(—conh—)共价结合形成的化合物,式ι从左到右表示为从多肽氮末端到碳末端。所述多肽也可以通过还原肽键(—ch2nh—)连接。
所述氨基酸包括天然和非天然氨基酸。天然氨基酸是指常见的主要的用于组成多肽和蛋白质的氨基酸。非天然氨基酸是指其他通过合成途径获得或者来源于天然资源的氨基酸(如d型氨基酸,d型氨基酸与l型氨基酸的混合物,β氨基酸,γ氨基酸,α,α二取代衍生物、n取代氨基酸等)。
所述反向序列(reversesequence)多肽由原来的多肽序列倒序组成而得。
所述的氨基酸取代、缺失或添加,可以在氨基酸序列的任意位点进行,只要具有改造后的氨基酸序列的多肽具有激动cxcr4蛋白的活性即可。类似的,所取代、缺失或添加的氨基酸的数目也是任意的,只要具有改造后的氨基酸序列的多肽具有激动cxcr4蛋白活性即可。
多肽没有连接化学基团,则氮末端为氨基基团,碳末端为羧基或酰胺基团。所述多肽可以在其氮末端或碳末端连接化学基团进行末端修饰。所述修饰可以是羟基化、烷基化、羰基化、酯化、磷酸化、糖基化、泛素化、聚乙二醇化等等。
所述的荧光标记可以连接于多肽的氮末端或多肽侧链中的任意的游离氨基上,如式ii-v所示,只要具有荧光标记后的氨基酸序列的多肽具有调节cxcr4活性的作用即可。
优选的,所述荧光标记为fitc、fam、罗丹明衍生物、pitc或eitc。
本发明所述多肽可以是天然多肽、重组多肽或合成多肽。所述多肽的制备方法本发明没有限定,只要能获得本发明所述的多肽即可。在一些实施方案中,可以通过化学方法合成,如通过固相合成法、液相合成法或固相液相相结合的方法合成。
在本发明中,氨基酸取代、缺失或添加,可以在氨基酸序列的任意位点进行,只要具有改造后的氨基酸序列的多肽具有激动cxcr4蛋白的活性即可。类似的,所取代、缺失或添加的氨基酸的数目也是任意的,只要具有改造后的氨基酸序列的多肽具有激动cxcr4蛋白活性即可。
在本发明中,多肽可以在其氮末端或碳末端连接化学基团进行末端修饰。所述修饰可以是羟基化、烷基化、羰基化、酯化、磷酸化、糖基化、泛素化、聚乙二醇化等等。
在本发明中,荧光标记可以连接于多肽的氮末端或多肽侧链中的任意的游离氨基上,如式ii-v所示,只要具有荧光标记后的氨基酸序列的多肽具有激动cxcr4活性的作用即可。
优选的,荧光标记为fitc、fam、罗丹明衍生物、pitc或eitc。
作为优选,本发明的多肽可以是天然多肽、重组多肽或合成多肽。
在本发明中,多肽的制备方法本发明没有限定,只要能获得本发明的多肽即可。在一些实施方案中,可以通过化学方法合成,如通过固相合成法、液相合成法或固相液相相结合的方法合成。
本发明还提供了该多肽在制备cxcr4蛋白激动剂中的应用。
在本发明中,本发明多肽可有效诱导supt1细胞的迁移,与cxcr4结合之后可引发细胞内的钙流增加,表明该多肽具有cxcr4蛋白激动活性,可作为cxcr4蛋白激动剂使用。
作为优选,cxcr4蛋白激动剂的相关病症选自神经变性疾病、神经损伤相关疾病、癌症或免疫性疾病。
作为优选,神经变性疾病为阿尔兹海默病、帕金森病、桑德霍夫病、tay-sachs病、聚谷氨酰胺病、亨廷顿病、癫痫发作、纹状体黑质变性、进行性核上性麻痹、痉挛性斜颈和运动障碍、扭转张力不全、家族性震颠、抽动秽语综合征、弥漫性lewy体疾病、皮克病、脊髓性肌肉萎缩症、肌萎缩侧索硬化症、颅内出血、原发性侧索硬化症、肥大性间质性多神经病、视网膜色素变性、遗传性视神经萎缩、遗传性痉挛性截瘫、shy-drager症候群或进行性共济失调症;
优选地,神经变性疾病为阿尔兹海默病、帕金森病、桑德霍夫病或tay-sachs病;
作为优选,神经损伤相关疾病为肌萎缩侧索硬化症、中风或急性脑血管疾病的后遗症;
作为优选,癌症为非霍奇金淋巴瘤、多发性骨髓瘤、急性髓细胞白血病、慢性髓细胞白血病、急性淋巴细胞白血病或黑色素瘤;
作为优选,免疫性疾病为艾滋病。
本发明还提供了该多肽在制备造血干细胞/祖细胞动员剂中的应用。
本发明还提供了该多肽在过表达cxcr4的肿瘤组织中作为检测肿瘤标志物的应用。
本发明还提供了一种药物组合物,该药物组合物包括本发明提供的多肽。
作为优选,该药物组合物还包括药学上可接受的辅料。
作为优选,药学上可接受的辅料选自载体、稀释剂或赋形剂中的一种或几种。如崩解剂、润滑剂、乳化剂、粘合剂等。但药学上可接受的辅料并非仅限于此,本领域技术人员认为可行的辅料均在本发明的保护范围之内。
本发明提供了一种如式i所示的多肽,或其互变异构体、内消旋体、外消旋体、对映异构体、非对映异构体及其混合物,或其药学上可接受的盐以及它的前药,或其氨基酸序列中取代、缺失或添加一个或多个氨基酸残基所得到的多肽,或其氨基酸序列中一个或多个氨基酸的侧链、氨基酸序列的氮末端或碳末端被一个或多个羟基化、烷基化、羰基化、酯化、磷酸化、糖基化、泛素化、聚乙二醇化修饰所得到的多肽,或其氨基酸序列中连接荧光标记或放射性同位素标记所得到的多肽。本发明具有的有益效果为:
研究表明,本发明多肽可有效诱导supt1细胞的迁移,与cxcr4结合之后可引发细胞内的钙流增加,表明该多肽具有cxcr4蛋白激动活性,可作为cxcr4蛋白激动剂使用。
附图说明
图1示本发明提供的h0001多肽的趋化活性;
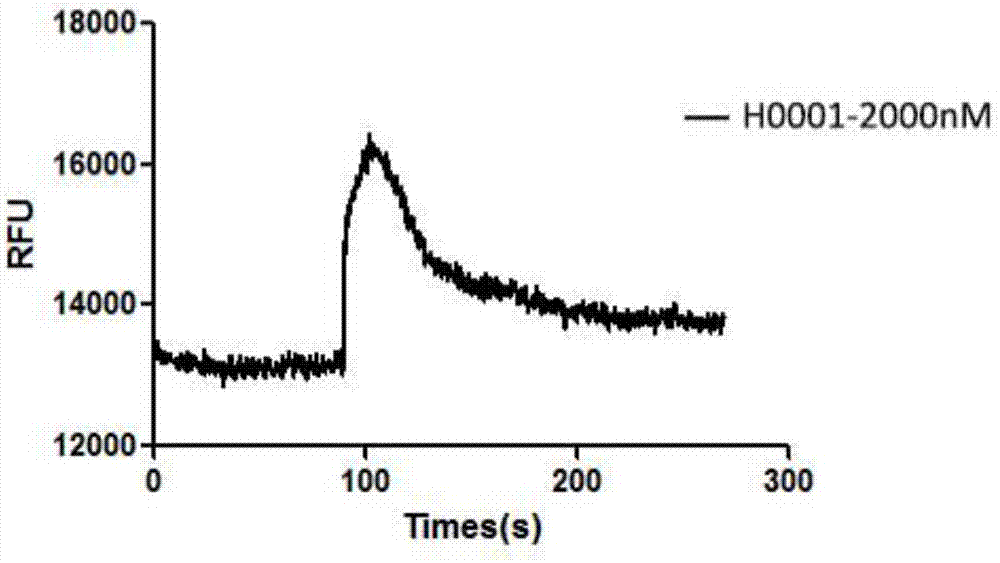
图2示本发明提供的h0001在浓度为2μm时细胞内钙流的活性;
图3示本发明提供的h0005在浓度为0.2μm、1μm时细胞内钙流的活性。
具体实施方式
本发明公开了一种具有cxcr4蛋白激动活性的多肽及其应用和药物组合物,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
术语解释:
vmip-ⅱ为病毒巨噬细胞炎性蛋白ⅱ。
sdf-1α(cxcl12)为基质细胞衍生因子-1。
本发明提供的具有cxcr4蛋白激动活性的多肽及其应用和药物组合物中所用原料药或辅料均可由市场购得。
其中部分试剂名称与缩写的对应如下:
dmf:n,n-二甲基甲酰胺;
dcm:二氯甲烷;
dic:n,n-二异丙基碳二亚胺;
hobt:1-羟基苯并三氮唑;
pip:哌啶;
boc:叔丁氧羰基;
trt:三苯甲基;
tbu:叔丁基;
pbf:五甲基二氢苯并呋喃-5-磺酰基;
dde:4,4-二甲基-2,6-二氧代环己亚基;
fmoc:芴甲氧羰基。
下面结合实施例,进一步阐述本发明:
实施例1:h0001的合成
采用fmoc固相合成法合成,具体制备方法如下:
称取357mg替代度为0.28mmol/g的rinkamide-mbha树脂于固相反应器中,加入dcm溶胀30min,随后加入20%pip/dmf溶液脱保护2次,第一次5min,第二次20min。分别用dcm与dmf洗涤多次,抽干。用kaiser测试检测,树脂或溶液显蓝色说明已脱保护。
向固相反应器中加入fmoc-d-pro-oh(169mg,0.5mmol),dic(103mg,0.5mmol),hobt(68mg,0.5mmol),dmf(4ml),室温反应2h。偶联完成后分别用dcm与dmf洗涤多次,抽干。再使用kaiser测试检测,检测通过后进行下一步反应。将树脂洗涤抽干,即得fmoc-pro-rinkamide-mbha树脂。加入20%pip/dmf溶液脱保护2次,第一次5min,第二次20min,脱除fmoc保护基。分别用dcm与dmf洗涤3次,得nh2-pro-rinkamide-mbha树脂。
向固相反应器中加入fmoc-d-leu-oh(177mg,0.5mmol),dic(103mg,0.5mmol),hobt(68mg,0.5mmol),dmf(4ml),室温反应2h。将树脂洗涤抽干,即得fmoc-leu-pro-rinkamide-mbha树脂。以此方法依次偶联剩余的氨基酸,得到侧链全保护kpvslsyr-gg-lgaswhrpdkcclgyqkrplp:lys(boc)-pro-val-ser(tbu)-leu-ser(tbu)-tyr(tbu)-arg(pbf)-gly-gly-leu-gly-ala-ser(tbu)-trp(boc)-his(trt)-arg(pbf)-pro-asp(otbu)-lys(boc)–cys(trt)–cys(trt)–leu-gly-tyr(tbu)-gln(trt)-lys(boc)-arg(pbf)-pro-leu-pro-rinkamide-mbha树脂。
多肽裂解前先脱最后连接氨基酸的fmoc保护基,再向固相反应器中加入冷冻的6ml裂解液(体积比为三氟乙酸:二苯硫醚:水=95:2.5:2.5),室温反应2h。裂解反应结束,过滤树脂,二氯甲烷洗涤树脂,合并滤液和洗液,旋蒸浓缩。加入10ml冷冻的乙醚溶液,析出白色沉淀,离心后收集白色固体,真空干燥得粗肽286mg。粗肽使用制备型hplc纯化,将制备得到的液体冷冻干燥得到目标化合物。
实施例2h0006的合成
称取357mg替代度为0.28mmol/g的rinkamide-mbha树脂于固相反应器中,加入dcm溶胀30min,随后加入20%pip/dmf溶液脱保护2次,第一次5min,第二次20min。分别用dcm与dmf洗涤多次,抽干。用kaiser测试检测,树脂或溶液显蓝色说明已脱保护。
向固相反应器中加入fmoc-lys(dde)-oh(266mg,0.5mmol),dic(103mg,0.5mmol),hobt(68mg,0.5mmol),dmf(4ml),室温反应2h。偶联完成后将树脂洗涤抽干,即得fmoc-lys(dde)-rinkamide-mbha树脂。使用kaiser测试检测,检测通过后进行下一步反应。加入20%pip/dmf溶液脱保护2次,第一次5min,第二次20min,脱除fmoc保护基。分别用dcm与dmf洗涤3次,得nh2-lys(dde)-rinkamide-mbha树脂。
向固相反应器中加入fmoc-peg5-ch2ch2cooh(160mg,0.3mmol),hatu(114mg,0.3mmol),hobt(41mg,0.3mmol),diea(78mg,0.6mmol),dmf(4ml),室温反应1h。偶联完成后使用kaiser测试检测,检测通过后进行下一步反应。将树脂洗涤抽干,即得fmoc-peg5-lys(dde)-rinkamide-mbha树脂。
向固相反应器中加入fmoc-cys(trt)-oh(293mg,0.5mmol),dic(103mg,0.5mmol),hobt(68mg,0.5mmol),dmf(4ml),室温反应2h。偶联完成后使用kaiser测试检测,检测通过后进行下一步反应。将树脂洗涤抽干,即得fmoc-cys(trt)-peg5-lys(dde)-rinkamide-mbha树脂。以此方法依次偶联剩余的氨基酸,最后一个偶联的氨基酸为boc-leu-oh,得到侧链全保护boc-leu-gly-ala-ser(tbu)-trp(boc)-his(trt)-arg(pbf)-pro-asp(otbu)-lys(boc)-cys(trt)-peg5-lys(dde)-rink-amide-mbha树脂。
向固相反应器中加入2%nh2nh2.h2o/dmf溶液脱除dde保护基团(3*3min),分别用dcm与dmf洗涤多次,抽干。用kaiser试剂检测。向固相反应器中加入fmoc-peg5-ch2ch2cooh(160mg,0.3mmol),dic(103mg,0.5mmol),hobt(68mg,0.5mmol),dmf(4ml),室温反应2h。偶联完成后分别用dcm与dmf洗涤多次,再使用kaiser测试检测,检测通过后进行下一步反应。以此方法依次偶联剩余的氨基酸。
多肽裂解前先脱保护,再向固相反应器中加入冷冻的6ml裂解液(体积比为三氟乙酸:二苯硫醚:水=95:2.5:2.5),室温反应2h。裂解反应结束,过滤树脂,二氯甲烷洗涤树脂,合并滤液和洗液,旋蒸浓缩。加入10ml冷冻的乙醚溶液,析出白色沉淀,离心后收集白色固体,真空干燥得粗肽195mg。粗肽使用制备型hplc纯化,将制备得到的液体冷冻干燥得到目标化合物。
实施例3:本发明所述多肽化合物
cxcr4活性调节多肽的氨基酸序列如表1所示,按照实施例1或实施例2所述方法合成。
表1cxcr4活性调节多肽及其氨基酸序列
a斜体字表示为d型氨基酸
实施例4生物学活性
1.cxcr4亲和活性检测
cxcr4的亲和活性检测所用的细胞系为体外构建的稳定转染cxcr4的cho细胞系。cho细胞系经dmem培养基(含10%胎牛血清,100iu青霉素,0.1mg/ml的链霉素和0.2mg/ml的g418)培养,胰蛋白酶消化后,清洗计数后用facs缓冲液(含0.5%bsa,0.05%nan3的pbs)悬浮细胞,加入96孔板中。每孔的反应体系共100μl,包含5×105个细胞,250ng/ml的12g5单抗以及不同浓度的检测的抑制剂。冰上孵育40min后,用facs缓冲液洗涤后,加入抗鼠的fitc标记的igg二抗(1:200)后冰上孵育30min,用facs缓冲液洗涤两次,酶标仪(perkinelmer)检测485nmex/535nmem的吸收。每组实验结果均经过至少三次的独立实验得到。实验的ic50值是经graphpad拟合计算得到的。结果见表2。
表2本发明化合物的cxcr4亲和力活性
2.cxcr4细胞迁移活性检测
cxcr4诱导的细胞迁移实验是用天然表达cxcr4的supt1细胞系检测的。首先收集rpmi1640(含10%胎牛血清,100iu青霉素和0.1mg/ml的链霉素)培养的悬浮的supt1细胞,用含0.5%bsa的rpmi1640洗涤后计数,悬浮细胞至每毫升2.67×107个细胞,细胞和不同浓度的抑制剂混匀后,取75μl加入至tranwell小室中,37℃孵育30min后,在下层培养板的孔内加入200μl含2nmsdf-1α的0.5%bsa的rpmi1640(背景值的一组不含sdf-1α),37℃孵育3小时后,去除上层的tranwell小室,在下层培养孔中每孔加入40μl的celltiter96(promega),孵育1-4小时后检测490nm处的吸收值。每组实验结果均经过至少三次的独立实验得到。实验的ic50值由graphpad拟合计算得到的。结果见图1。
由图1可知,化合物h0001在浓度为0.5μμ可以有效的诱导supt1细胞的迁移。
3.cxcr4钙信号检测
本实验所用的细胞系为supt1。实验前收集细胞,并用实验缓冲液(含20mmhepes的hbss缓冲液)洗涤,与含有4μmfluo-4和1mm丙磺舒钠的缓冲液37℃孵育30min后洗去残留的染料,将细胞悬浮至每毫升2×106个细胞,取200μl加入黑色96孔板中,记录494nmex/516nmem细胞的吸收值,之后加入不同浓度的抑制剂混匀,记录基线,再加入50nm的sdf-1α混匀,记录钙离子的信号。观察加入抑制剂与不同浓度的抑制剂组之间的信号强度的差别。结果见图2、3。
化合物h0001和h0005在和cxcr4结合之后,可引发细胞内的钙流增加,释放出的钙离子可以和细胞内的荧光探针结合,造成细胞瞬时荧光信号的增强。浓度越高,则细胞荧光信号越强。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
sequencelisting
<110>黄子为
<120>一种具有cxcr4蛋白激动活性的多肽及其应用和药物组合物
<130>mp1708082
<160>6
<170>patentinversion3.3
<210>1
<211>31
<212>prt
<213>人工序列
<220>
<221>mod_res
<222>(11)..(31)
<223>第11位到第31位氨基酸为d型氨基酸
<400>1
lysprovalserleusertyrargglyglyleuglyalasertrphis
151015
argproasplyscyscysleuglytyrglnlysargproleupro
202530
<210>2
<211>29
<212>prt
<213>人工序列
<220>
<221>mod_res
<222>(8)..(9)
<223>第8位氨基酸与第9位氨基酸由c6连接,第9到29位氨基酸为d型氨基酸
<400>2
lysprovalserleusertyrargleuglyalasertrphisargpro
151015
asplyscyscysleuglytyrglnlysargproleupro
2025
<210>3
<211>29
<212>prt
<213>人工序列
<220>
<221>mod_res
<222>(8)..(29)
<223>第8位氨基酸与第9位氨基酸由c12连接,第9位到第29位氨基酸为d型氨基酸
<400>3
lysprovalserleusertyrargleuglyalasertrphisargpro
151015
asplyscyscysleuglytyrglnlysargproleupro
2025
<210>4
<211>23
<212>prt
<213>人工序列
<220>
<221>mod_res
<222>(1)..(23)
<223>第1位到第14位氨基酸为d型氨基酸,第15位氨基酸与第16位氨基酸之间由p
eg3连接
<400>4
leuglyalasertrphisargproasplyscysalaleuglylysarg
151015
tyrserleuservalprolys
20
<210>5
<211>19
<212>prt
<213>人工序列
<220>
<221>mod_res
<222>(1)..(19)
<223>第1位到第11位氨基酸为d型氨基酸,第11位氨基酸与第12位氨基酸之间由p
eg3-k-peg3连接
<400>5
leuglyalasertrphisargproasplyscysargtyrserleuser
151015
valprolys
<210>6
<211>19
<212>prt
<213>人工序列
<220>
<221>mod_res
<222>(1)..(19)
<223>第1位到第11位氨基酸为d型氨基酸,第11位氨基酸与第12位氨基酸之间由p
eg5-k-peg5连接
<400>6
leuglyalasertrphisargproasplyscysargtyrserleuser
151015
valprolys
- 还没有人留言评论。精彩留言会获得点赞!