一种棘阿米巴特异性抗原肽、多克隆抗体及其用途的制作方法
本发明涉及生物技术领域,具体涉及一种棘阿米巴特异性抗原肽、多克隆抗体及其用途。
背景技术:
棘阿米巴(acanthaoebaspp.)是广泛分布于自然环境中的致病性自由生活阿米巴,在人体主要引起棘阿米巴角膜炎(acanthamoebakeratitis,ak)。棘阿米巴角膜炎呈亚急性发病,慢性进行性加重,临床表现为眼红、畏光、流泪、结膜充血和出现明显的眼痛,其程度往往超出体征,形成“症状与体征分离”的现象。随着病情的进展发展为环形角膜浸润,严重者可出现角膜混浊和盘状角膜溃疡,可并发虹膜睫状体炎、前房积脓和积血或巩膜炎,病情慢性进行性恶化,导致全角膜溃疡或穿孔,并发白内障,继发青光眼而失明。
1973年英国nagington等报道了首例ak患者,直到80年代中期本病仍为一种罕见的寄生虫感染。近年来,随着角膜接触镜的广泛使用和aids患者的急速增加,有关棘阿米巴引起的疾病越来越受到研究者的重视。美国cdc的stehr-green曾对208例ak患者进行流行病学调查,结果表明角膜创伤、配戴角膜接触镜(contactlens,cl)和接触污水是ak发生的3个主要危险因素,其中配戴cl是ak最主要的危险因素,85%的ak患者为cl的使用者。角膜接触镜保存液及保存盒中棘阿米巴的检出率为可达2%-15%不等。我们研究小组曾分别对93份我校学生的cl保存盒擦试液、保存液和104份饮用水样品进行棘阿米巴检查,结果其中1份cl保存盒擦试液、保存液和41份饮用水中检出棘阿米巴。2006年美国某品牌隐形眼镜护理液因导致棘阿米巴结膜炎而全球召回(http://health.sohu.com/s2006/06quanneng/)。近年来因佩戴cl导致的棘阿米巴角膜感染和失明案例在全球范围内频频发生(http://www.zynews.com/jbbk/cs/2014-07-25/8062.html;http://health.zjol.com.cn/05zjhealth/system/2012/08/30/018775463.shtml)。在免疫功能低下的感染人群,若诊断和治疗不及时,多发展为阿米巴性肉芽肿性脑炎或脑膜脑炎(granulomatousamoebicencephalitis,gae)、弥漫性感染和肺部感染等,病情多呈急进性发展,死亡病例居多。此外,棘阿米巴原虫还可携带细菌、衣原体等病原体,为此类疾病传播的重要病原体贮存宿主和传播媒介。为棘阿米巴角膜感染的预防、诊断和治疗提出了新的课题。
棘阿米巴角膜炎的临床诊断比较困难,主要的实验室诊断方法包括10%氢氧化钾(koh)湿封片镜检、棘阿米巴培养、倒置显微镜观察、病理切片h.e.染色法和spa染色检查等等。临床诊断率低,样本的采集困难,常常不被患者所接受。棘阿米巴原虫生活史过程有活动期的滋养体和静止期的包囊两个阶段,当周围环境不利于其生长时,如人体免疫抵抗、营养物质缺乏、化学药物治疗等因素均可导致阿米巴滋养体向包囊转化。包囊的双层囊壁结构对环境和药物的抵抗能力很强,对绝大多数抗生素有不同程度的抵抗作用,使感染慢性化。在感染部位包囊的持续存活是临床上棘阿米巴感染慢性化、不易根治和复发根本原因,故临床治愈棘阿米巴感染非常困难。对于已确诊的棘阿米巴角膜炎患者的治疗以手术为主,尚无理想的药物。
综上,对棘阿米巴感染的预防是防治ak发生至关重要的手段。除了避免角膜损伤和接触疫水以外,疫苗的研发是未来发展的趋势。直至目前为止,尚无有关的报道和相应产品问世。而研制疫苗首先要寻找到高反应原性的抗原基因,并对筛选出的抗原基因进行原核表达,再分离纯化重组抗原作为疫苗。因此,高反应原性抗原的筛选就显得尤为重要。
研究表明,棘阿米巴感染过程中,甘露糖诱导的细胞蛋白(mannose-inducedcytopathicprotein,mip-133)、磷脂酶a2(phospholipasea2,pla2)、纤维蛋白酶原激活剂(plasminogenactivator,apa)和蛋白酶激活受体(protein-activatedreceptor,par)等均发挥重要的作用。mip-133主要是通过诱导角膜上皮细胞和基质细胞的凋亡,及刺激蛋白水解酶的产生,启动细胞损伤。有研究者通过亲和层析的方法在虫体的培养物中分离纯化得到mip-133,与霍乱毒素分子偶联后,通过口服的方式可有效减轻角膜感染的程度,在这一过程中,pla2是重要的中介分子。apa通过par途径诱导角膜上皮细胞il-8的分泌释放。除此之外,对棘阿米巴原虫抗原分子的研究报道甚少。
技术实现要素:
有鉴于此,本发明的目的在于提出一种棘阿米巴特异性抗原肽、多克隆抗体及其用途,本发明筛选了5个特异性抗原肽,该特异性抗原多肽均具有高反应原性;由该抗原肽免疫动物制备得到的多克隆抗体具有特异性强、纯度高的特点。
基于上述目的,本发明提供的一种棘阿米巴特异性抗原肽,所述特异性抗原肽的氨基酸序列如seqidno:1、seqidno:3、seqidno:5、seqidno:7或seqidno:9所示。
本发明采用smart技术成功构建了棘阿米巴原虫滋养体全长cdna文库,然后通过棘阿米巴感染兔血清对棘阿米巴原虫滋养体全长cdna文库进行免疫学筛选,筛选得到5个抗原肽,将该5个抗原肽免疫动物,检测发现全部动物均产生了特异性抗体,抗体效价在1:25600以上,说明本发明筛选的5个抗原肽均具有高反应原性。
在本发明中,5个特异性抗原肽分别为含有lim结构域的蛋白(limdomaincontainingprotein)、hsp20/α结晶超家族蛋白(hsp20/alphacrystallinesuperfamilyprotein)、推定的核糖体蛋白s15(ribosomalproteins15,putative)、含有泛素结构域的蛋白质/核糖体l40e家族(ubiquitindomaincontainingprotein/ribosomall40efamily)和actin1蛋白,所述含有lim结构域的蛋白的氨基酸序列如seqidno:1所示,所述hsp20/α结晶超家族蛋白的氨基酸序列如seqidno:3所示,所述推定的核糖体蛋白s15的氨基酸序列如seqidno:5所示,所述含有泛素结构域的蛋白质/核糖体l40e家族的氨基酸序列如seqidno:7所示,所述actin1蛋白的氨基酸序列如seqidno:9所示。
编码所述的棘阿米巴特异性抗原肽的核苷酸序列、含有所述核苷酸序列的表达载体以及含有所述表达载体的宿主细胞也在本发明的保护范围之内。
在本发明中,优选的,所述核苷酸序列如seqidno:2、seqidno:4、seqidno:6、seqidno:8或seqidno:10所示。
具体的,编码含有lim结构域的蛋白的核苷酸序列如seqidno:2所示,编码hsp20/α结晶超家族蛋白的核苷酸序列如seqidno:4所示,编码推定的核糖体蛋白s15的核苷酸序列如seqidno:6所示,编码含有泛素结构域的蛋白质/核糖体l40e家族的核苷酸序列如seqidno:8所示,编码actin1蛋白的核苷酸序列如seqidno:10所示。
进一步的,本发明还提供了一种多克隆抗体,以所述的棘阿米巴特异性抗原肽为免疫原,免疫动物制备而成。
在本发明中,优选的,所述多克隆抗体采用以下方法制备得到:将含有lim结构域的蛋白、hsp20/α结晶超家族蛋白、推定的核糖体蛋白s15、含有泛素结构域的蛋白质/核糖体l40e家族、actin1蛋白分别与完全弗氏佐剂混合免疫小鼠,隔周再用含有lim结构域的蛋白、hsp20/α结晶超家族蛋白、推定的核糖体蛋白s15、含有泛素结构域的蛋白质/核糖体l40e家族、actin1蛋白分别与弗氏不完全佐剂混合加强免疫小鼠,加强免疫两次,于末次免疫后10天采集小鼠血液,离心取血清,进行亲和纯化后,获得多克隆抗体。
本发明对多克隆抗体进行鉴定,鉴定结果表明该多克隆抗体可特异性识别棘阿米巴抗原肽,具有特异性强、纯度高的特点,可用于棘阿米巴角膜炎的临床诊断。
因此,本发明还提供了所述的多克隆抗体在诊断棘阿米巴角膜炎试剂中的用途。
角膜是棘阿米巴感染的第一道屏障,角膜的完整性和局部环境的免疫能力,是对抗阿米巴原虫粘附的重要因素。通过对血清和眼泪中特异性抗体的对比分析,在棘阿米巴角膜炎患者与健康人眼泪中,siga的滴度存明显的差异,健康人明显高于患者。相对应的二者血清iga、igg和igm之间无明显差异。表明眼睛局部的免疫水平对于抵御虫体的感染至关重要。因此特异性提高眼泪中的抗棘阿米巴抗体的水平,是免疫预防成功的关键。本发明筛选的5个抗原肽免疫动物能够显著局部特异性siga、igg和iga的水平,对动物具有有效的保护作用。
因此,本发明还提供了所述的棘阿米巴特异性抗原肽在制备预防或治疗棘阿米巴角膜炎药物中的用途。
与现有技术相比,本发明具有以下有益效果:
本发明通过棘阿米巴感染兔血清对棘阿米巴原虫滋养体全长cdna文库进行免疫学筛选,获得了高反应原性的抗原基因,进一步对筛选出的抗原基因进行原核表达和免疫原性鉴定,筛选的抗原肽免疫动物能够显著局部特异性siga、igg和iga的水平,对实验动物具有有效的抗感染保护性,该抗原肽对动物和人的棘阿米巴角膜炎的预防具有重要意义。同时由该抗原肽免疫动物制备得到的多克隆抗体具有特异性强、纯度高的特点,可用于棘阿米巴角膜炎的临床诊断。鉴于棘阿米巴感染对人类健康和生活质量的威胁,本发明将具有广阔的应用前景。
附图说明
附图是结合具体的工艺实施方式,详细的说明了工艺走向。
图1为本发明兔实验眼角膜图;
图2为本发明兔棘阿米巴角膜炎模型血清抗体滴度的变化图;
图3为本发明棘阿米巴cdna文库阳性克隆pcr鉴定图,其中,m:dna标志物,1~20:分别为1~20号阳性克隆产物;
图4为本发明cdna表达文库的免疫学筛选图;其中,左图为初筛,右图为复筛;
图5为本发明重组蛋白诱导表达后的sds-page结果图,其中,m:蛋白标志物,单位为kda;1,3:iptg诱导重组菌全菌蛋白;2,4:未诱导后重组菌全菌蛋白;
图6为本发明特异性多克隆抗体(anti-actin-1)的效价图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
本发明将采用基因克隆、载体构建、蛋白的原核表达、蛋白质的分离纯化、噬菌体展示技术、抗体与免疫因子检测、动物的免疫接种等研究方法,分为以下实施例进行具体阐述。
实施例1棘阿米巴角膜炎动物模型建立
1材料与方法
1.1棘阿米巴原虫培养
棘阿米巴原虫标准虫株(acanthamoebahealyi)由延边大学病原教研室惠赠。将棘阿米巴原虫培养于蛋白胨-酵母-葡萄糖培养基中,取对数生长期的滋养体离心,生理盐水洗3次,调整原虫浓度为1×104个/ml。
1.2棘阿米巴角膜炎动物模型的建立方法
健康新西兰家兔6只(吉林大学白求恩医学院动物实验中心提供),左眼为实验组,右眼为对照组。实验前3d每只家兔每眼先行结膜下注射地塞米松2mg,每天1次,同时用0.5%氢化考的松眼水点眼,每天3次~4次。实验开始,停用激素,家兔固定后双眼经0.5%的可卡因点眼局麻,开睑器开睑,用5号针头在家兔角膜基质内注入棘阿米巴原虫悬液0.2ml(104个/ml),对照眼右眼眼角膜基质内注入生理盐水0.2ml。于注射原虫后6h、12h、24h以及以后每天观察兔眼角膜病变情况,直到30d。
1.3镜检和原虫培养
在实验第10、20、30天分别作角膜刮片,刮取兔角膜较深层病变组织涂于载玻片上,普通显微镜下检查,同时进行原虫培养,从病原学角度确认模型构建是否成功。
1.4血清滴度检测
1.4.1棘阿米巴虫体抗原制备
2000r/min离心15min手机对数期生长的棘阿米巴原虫,pbs洗涤3次,超声破碎虫体。4℃下10000r/min离心10min去除成功替碎片,取上清。采用bca蛋白定量试剂盒测定蛋白浓度。并将提取物除菌过滤,-20℃保存备用。
1.4.2试验血清
分别于感染后第1d、7d、14d、21d、28d、30d分别耳缘静脉或动脉取血,制备血清。将实验组感染兔体内所获得的血清作为阳性血清,将健康对照组兔体内获取的血清作为阴性血清。
1.4.3血清滴度检测
采用间接酶联免疫吸附法(elisa)对兔血清中抗棘阿米巴原虫抗原的抗体滴度进行检测。将棘阿米巴原虫粗抗原稀释至10μg/ml,按每孔100μl包被96孔酶标板,4℃过夜。次日用0.05mol/lph7.4的pbs-tween-20(pbst)洗液洗涤3次,每次5min;3%脱脂奶粉每孔100μl封闭1h,pbst洗涤后,加入1:5000稀释后的二抗,37℃孵育0.5h,pbst洗涤后,以tmb为底物显色10min,4mol/l硫酸终止反应,于酶联免疫检测仪上测(a450值),每份血清做4孔测定平均值。
2试验结果
2.1家兔临床表现
观察6只新西兰家兔临床表现:形成角膜炎的家兔左眼在注射棘阿米巴原虫悬液后,局部应出现反应,如结膜囊内、外眼出现分泌物,局部形成炎性斑块,球、睑结膜充血,症状逐渐加重,炎性斑块逐渐增大,整个角膜呈弥漫性点状混浊;对照右眼未出现炎症反应。
如图1所示,实验组1d时家兔左眼弥漫性角膜点状水肿、混浊;10d时角膜基质环形浸润伴角膜溃疡;14d时角膜基质环形浸润伴角膜缘新生血管;28d时角膜新生血管变细,并向角膜中央区侵入,溃疡灶局限缩小。
2.2镜检结果和原虫培养结果
刮取兔角膜较深层病变组织涂于载玻片上,普通显微镜下检查,实验眼全部看到棘阿米巴原虫的双层壁包囊,对照眼呈阴性。
家兔眼角膜经棘阿米巴原虫培养,实验眼全部培养出棘阿米巴原虫,对照右眼棘阿米巴原虫培养呈阴性。说明本实施例成功地建立了棘阿米巴角膜炎的动物模型。
2.3血清滴度检测结果
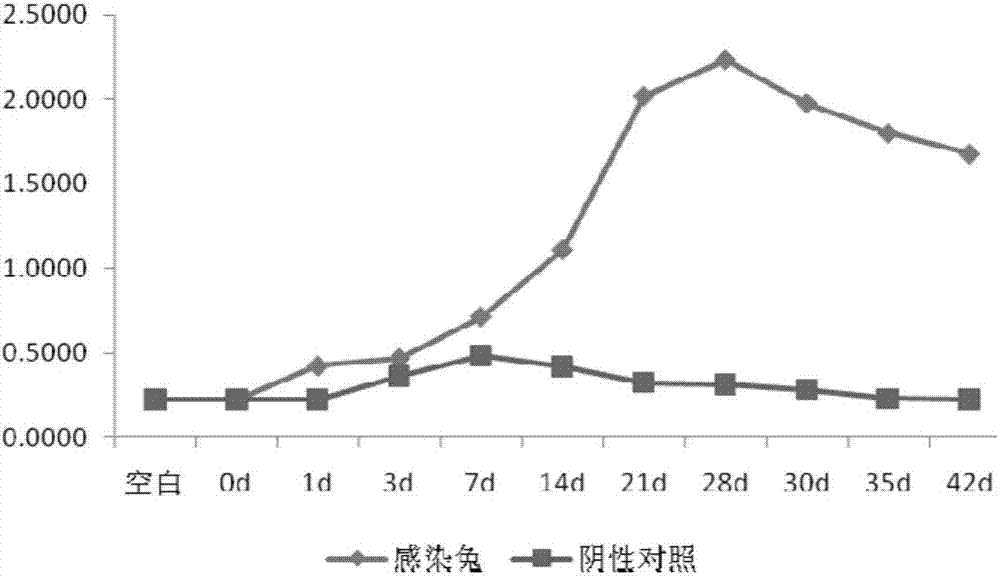
随着感染的进行,实验组兔血清抗体水平逐渐升高,于感染后的第28天达到峰值,而后抗体滴度开始缓慢下降,但于感染后第42d抗体水平仍明显高于正常;阴性对照组兔血清抗体水平没有明显变化(图2)。
实施例2棘阿米巴滋养体cdna文库的构建
1.试验方法
1.1棘阿米巴原虫培养
棘阿米巴原虫株用蛋白胨酵母葡萄糖浸膏培养液(peptone-yeastextract-glucose,pyg)做无菌培养,以2000r/min(离心半径13.5cm)离心收集对数生长期虫体5.0×106个,pbs洗涤2次,溶于rnalater溶液中,储存于-80℃。
1.2棘阿米巴滋养体总rna的提取
用trizol试剂(invitrogen公司)提取滋养体总rna;根据试剂盒说明书进行酚-氯仿纯化。使用紫外分光光度计对提纯的rna测定,260nm处吸光度值来估计总rna的浓度。用4ul的rna进行rna电泳以确认rna的质量。
1.3cdna合成
1.3.1cdna第一条链的合成
采用cdna文库构建试剂盒(smarttmcdna文库构建试剂盒,clontech公司,usa)对提取的rna进行合成。参照试剂盒说明书,取3ul提取的总rna(约400ng)加入到含有2.4umcdsiii和2.4umsmartoligoivoligonucleotide的反应体系中,加入去离子水,使总体积至5ul。然后将混合物在72℃下温育2分钟,冰浴2分钟,以除去rna二级结构。然后,在反应管中加入1mm的dntp,2mm的dtt和100个单位smartscribemmlv逆转录酶,终体积10ul。然后将反应管于42℃孵育1小时。接着,将反应体系冰浴以终止反应,第一条链合成。
1.3.2cdna第二条链的合成
将合成的cdna第一条链2ul装入一个干净的,预冷的pcr管。将反应管置于冰上,于反应体系中加入如下试剂:80ul的去离子水,10ul10×2pcr缓冲液,dntp的终浓度为0.4um,5'pcr引物和cdsiii/3'pcr引物(smarttmcdna文库构建试剂盒,clontech公司,usa)的终浓度均为0.48um,4u2-聚合酶混合物(
1.4cdna分离
合成的双链cdna经蛋白酶k消化,限制性内切酶sfil酶切和chromaspon-400(smarttmcdna文库构建试剂盒,clontech公司,usa)凝胶柱层析分级。收集各管过柱流出液,分别取3ul,在150v电泳10分钟。收集前四个含cdna的级分,并用2.5倍体积的乙醇,26ug糖原和1/10体积的乙酸钠沉淀cdna。获得的cdna沉淀重新悬浮于7ul去离子水中。
1.5cdna文库的构建
参照cdna文库构建试剂盒说明书进行操作。5ul的ligationsystem系统是在200ulpcr管中构建,组分包括:1.5ulcdna,1ulλtriplex2(500ng/ul),0.5ul10×ligation缓冲液,atp终浓度为1mm,和200ut4dna连接酶。将反应管在16℃过夜温育。
1.6cdna文库的鉴定
用nucleotrappcr纯化试剂盒(clontech公司)对pcr扩增产物进行纯化。用topotacloning(invitrogen公司)进行pcr产物的克隆转化。用x-gal和iptg进行蓝白斑筛选,挑取白色菌落利用引物进行pcr扩增,观察是否有插入片段以及插入片段的大小和分布范围。
1.7cdna文库滴度测定
利用平板法对未扩增文库的滴度进行测定。取1μl原始文库,用1×λdilutionbuffer分别进行1×10-3、1×10-4和1×10-5倍稀释。从每个浓度分别吸取1μl加入至100μle.colixl1-blue感受态细胞,37℃孵育15min。将上述混合液与6mllb/mgso4/麦芽糖软顶琼脂混合后倾注平板,室温冷却,于37℃培养16h~18h。计数溶菌斑数量,以确定该文库的滴度。同时对20个pcr产物进行序列测定。
2.试验结果
2.1总rna提取
经紫外分光光度计测定,提取的总rnaa260/a280和a260/a230值分别是2.06和1.51。总rna浓度为1.2μg/μl。经甲醛变性电泳分析,rna大小在400bp和4kb之间。
2.2cdna的合成与分离
chromaspon-400凝胶柱分离得到的12个分离产物各取3μl,进行1%琼脂糖凝胶电泳,结果见图1,ld-pcr合成的双链cdna分子大小介于0.1~4kb之间。收集第4~8管并浓集于7μl去离子水中。
2.3cdna文库质量评价
对培养板上的噬菌斑计数,得到所构建的cdna文库滴度为3.85×107pfu/ml。随机选取20个噬菌斑进行重组鉴定,插入片段大小在0.4~2.5kb之间(图3)。
实施例3棘阿米巴滋养体cdna文库的筛选
1.试验方法
1.1cdna文库的免疫学筛选
1×10-3稀释的棘阿米巴cdna文库0.5μl,加入至100μle.colixl1-blue感受态细胞,37℃孵育15min。将上述混合液与6mllb/mgso4/麦芽糖软顶琼脂混合后倾注平板,室温冷却,于37℃培养16h~18h,至噬菌斑清晰可见,未融合。将预先准备好的140mm直径的pvdf膜覆盖于噬菌斑表面,标记固定,37℃正置孵育4h,4℃倒置过夜。取下pvdf膜,pbst溶液洗涤三次后,5%脱脂奶粉室温封闭1h,洗涤后一抗和二抗各自孵育1h,dab显色。一抗:分别取1μl感染后第7、14、21和28天兔血清,混合后,与e.colixl1-blue裂解液室温混合过夜;次日2000×g,室温离心10min,收集上清,用抗体稀释液进行1:5000稀释。二抗:辣根过氧化酶标记羊抗兔igg,使用浓度1:500。从培养板上挑取阳性克隆置于1.5ml离心管中,加入50μl1×λ稀释缓冲液,4℃过夜;次日离心取上清进行复筛和测序。
2试验结果
取已建立的棘阿米巴角膜炎动物模型的血清为探针,筛选重组子,经过初筛和复筛后,获得持续阳性表达克隆(如图4)。将复筛获得的阳性克隆进行测序,测序结果如表1所示。
表1
实施例4疫苗候选分子的原核表达与纯化
1.试验方法
1.1actin1蛋白的小量表达与可溶性鉴定
1.1.1目的片段的扩增
根据文库筛选测序结果,设计特异性引物ac-actin1-f2:gccatatgatgactcagatcatgtt(酶切位点为ndei),ac-actin1-r2:gcaagcttgaagcacttcctgtggacaat(酶切位点为hindiii,用8his-tag表达),以棘阿米巴总dna为模板,进行pcr扩增actin1蛋白的基因片段,大小为783bp。其中,pcr反应体系(20μl)为:
2×taqpcrmix(天根生化科技有限公司):12.5μl;
10μmol/l的ac-actin1-f2:0.25μl;
10μmol/l的ac-actin1-r2:0.25μl;
棘阿米巴总dna:0.5μl;
加水6.5μl。
扩增条件为:95℃预变性10min;95℃变性1min,55℃退火1min,延伸1min,共30个循环,72℃延伸10min;4℃保存。
将pcr产物于1%琼脂糖凝胶100v电泳30min,凝胶成像仪拍照、存盘,并用dna胶回收试剂盒回收目的片段。
1.1.2原核表达载体的构建与鉴定
将目的片段与原核表达载体pet22b(+)进行酶切连接,转化大肠杆菌感受态bl21(de3),经蓝白斑筛选出阳性菌落,进行pcr鉴定。经鉴定与分子量大小与预期一致的阳性菌落,将阳性克隆菌液进行测序鉴定。
1.1.3小量表达与可溶性鉴定
将目的片段与原核表达载体pet22b(+)进行酶切连接,得到重组质粒,重组质粒转化大肠杆菌感受态bl21(de3),进行小量培养和诱导表达,并进行可溶性表达鉴定。具体步骤为:将鉴定正确的阳性克隆划线培养,挑取单克隆菌落接种至4mllb培养基中(含氨苄青霉素),37℃,200rpm振荡培养过夜;将培养过夜的菌液按照1%的比例接种到另一lb(含氨苄青霉素)液体培养基中,37℃,200rpm,振荡培养2~3h,使细菌生长至对数生长期,od600=0.6~1.0时,取出500μl后,加入iptg,使其终浓度为1mm;于37℃,200rpm振荡培养,在加入iptg后5~8h,取出500μl细菌培养物;将取出的细菌培养物于室温,12000rpm离心2min,弃去上清液,沉淀中加入80μlddh2o,悬浮细胞,每管加入20μl5×sds-pageloadingbuffer,充分混匀;样品在100℃水浴中煮5min,室温,12000rpm离心5min,取出上清液,直接进行sds-page电泳。
1.2actin1蛋白的大量表达与纯化
筛选高表达菌株,加入50ml含氨苄青霉素的lb培养液中。37℃,200rpm,振摇培养过夜;次日,分别取25ml过夜培养的菌液接种两个装有1llb液体培养基(含氨苄青霉素30μg/ml)的4l锥形瓶中。37℃,250rpm,快速振摇培养至od600≈0.6。加入iptg至终浓度为1mm,在30℃,250rpm,诱导表达5h;离心收集菌体沉淀,超声裂解,收集上清(可溶性表达),采用his-tag亲和层析柱进行目的蛋白纯化。
1.3特异性多克隆抗体制备与检测
20只6~8周龄balb/c雌性小鼠,分别用20μg/0.1ml的抗原(actin1、lim、hsp20/α、s15、l40e)加等量的完全弗氏佐剂(cfa)背部多点皮下注射。隔周用不完全弗氏佐剂(ifa)与步骤1.2中的重组蛋白混合,以同样剂量加强,共加强两次。于末次免疫后10天,摘眼球取血,采集的血液置室温中凝固2~3h后,3000rpm,4℃离心10分钟;再取上清,3000rpm,4℃离心10分钟。收集血清并分装,进行抗体滴度检测得出效价,–80℃保存。
用间接酶联免疫吸附实验(elisa)检测多克隆抗体效价,具体步骤为:用20μg/ml浓度的actin1抗原在4℃条件下包被间接elisa板12h。然后,在室温条件下,用封闭液封闭,再用磷酸盐缓冲液洗涤以去除未包被的抗原。将制备的多克隆抗体(anti-actin-1)按比例为1:200、1:400、1:800、1:1600、1:3200、1:6400、1:12800、1:25600、1:51200、1:102400进行稀释。按照每孔100μl的剂量加入检测板,同时设立阴性对照和空白对照,然后每孔再加入200μl的磷酸盐缓冲液洗涤2次,再加入1:1000稀释的辣根过氧化物酶标记的山羊抗兔二抗100μl,37℃孵育45min,每孔加入200μl的磷酸盐缓冲液洗涤2次,每孔中加入100μl的tbe显色液,37℃孵育15min后,测定450nm的吸光值,与阴性血清的比值大于2.1判定为阳性,计算抗体效价。
2.试验结果
2.1actin1蛋白的表达和纯化
重组质粒在大肠杆菌感受态bl21(de3)中,经1mmiptg诱导表达,sds-page结果表明,重组质粒表达的融合蛋白约为30kda左右(图5)。结果表明actin1基因在原核系统中成功表达。
2.2特异性多克隆抗体的制备与检测
间接酶联免疫吸附实验(elisa)检测多克隆抗体效价的结果见表2和图6,从表2中可以看出,效价为1/2最大od值(0.693)所对应的稀释倍数为1:25600,说明本发明所制得的多克隆抗体(anti-actin-1)效价在1:25600以上。
表2多克隆抗体(anti-actin-1)效价检测结果
综上所述,本发明通过棘阿米巴感染兔血清对棘阿米巴原虫滋养体全长cdna文库进行免疫学筛选,获得了高反应原性的抗原基因,进一步对筛选出的抗原基因进行原核表达和免疫原性鉴定,筛选的抗原肽免疫动物能够显著局部特异性siga、igg和iga的水平,对实验动物具有有效的抗感染保护性,该抗原肽对动物和人的棘阿米巴角膜炎的预防具有重要意义。同时由该抗原肽免疫动物制备得到的多克隆抗体具有特异性强、纯度高的特点,可用于棘阿米巴角膜炎的临床诊断。鉴于棘阿米巴感染对人类健康和生活质量的威胁,本发明将具有广阔的应用前景。
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本发明的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,并存在如上所述的本发明的不同方面的许多其它变化,为了简明它们没有在细节中提供。因此,凡在本发明的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>吉林医学院
<120>一种棘阿米巴特异性抗原肽、多克隆抗体及其用途
<130>fi170209
<160>10
<170>patentinversion3.5
<210>1
<211>142
<212>prt
<213>limdomaincontainingprotein
<400>1
metasnprolyscysglyvalcysasnlysthrvaltyrproval
151015
glulysileserproglyasnglylysasntyrhislysleucys
202530
phelyscysservalcyslysilethrleuasnleulysasnphe
354045
lysserhisgluglythrleutyrcysprovalhistyralapro
505560
alaglnvalgluvalargserpheglusergluarglysalaasp
657075
glnglyglutyralaserasnproserserthrglnalaalaala
808590
glyglyalatrpglyglnserthrproaspserglyglutyrgly
95100105
glyglyasnseralaalaalaglyglytyraspglnglyglytyr
110115120
aspglnglyglytyrgluglnglnglyglytyraspglnglygly
125130135
tyrglnglnglutyrtyrglu
142
<210>2
<211>426
<212>dna
<213>limdomaincontainingprotein
<400>2
atgaaccccaagtgtggcgtttgcaacaagaccgtgtaccccgtggagaagatcagcccg60
ggtaacggcaagaactaccacaagctgtgcttcaagtgctcggtgtgcaagatcacgctc120
aacctgaagaacttcaagtcgcacgagggtaccctctactgcccggtccactacgcgccc180
gcgcaggtcgaggtgaggtcgttcgaatccgagaggaaggccgaccagggcgagtacgcc240
agcaacccctcctccacccaggccgcggccggtggtgcctggggccaatcgactcccgat300
tctggcgagtacggcggcggcaacagcgctgctgctggcggctacgatcagggtggatat360
gaccagggcggctacgagcagcagggcggctacgatcagggtggctaccagcaggagtac420
tacgag426
<210>3
<211>187
<212>prt
<213>hsp20/alphacrystallinesuperfamilyprotein
<400>3
metserleuleuglyphethraspprotrpseraspmetargasp
151015
metglnargglnmetaspargleumetasnargpheaspargasp
202530
leuthrseraspvalproleuleuthrglyglyaspvalglyglu
354045
argalaleuglnproileglyalaglyglnleualaargtrpasn
505560
prohismetaspvalarggluthrasplysserleuileleuhis
657075
alagluleuproglycysasnlysgluaspilelysleuserile
808590
aspasnasnargleuvalleuglnglyglulyslysthrhislys
105110115
lysglugluglygluasntrpvalarglysgluargpheglugly
110115120
thrphelysargthrleuglnleuproargglyvalaspalaasn
125130135
glnileglnalaasntyrasnasnglyvalleugluilevalval
140145150
prolysprogluaspmetprolysargglnleuileaspilelys
155160165
thrglygluglyleulysglulysglulysgluglnvalproile
170175180
serglygluargglyglnlys
187
<210>4
<211>561
<212>dna
<213>hsp20/alphacrystallinesuperfamilyprotein
<400>4
atgtctctccttggcttcaccgatccctggtctgacatgcgcgacatgcagaggcagatg60
gacaggctcatgaatcgcttcgacagagacctcacctcggacgttcctcttctcactggt120
ggcgacgttggcgagcgtgccttgggccccataggtgctggtcagctagcgagatggaac180
ccccacatggacgtgcgtgagaccgacaagtcgctcattctgcacgctgagctgccaggc240
tgcaacaaggaagacatcaagctgagcatcgacaacaacaggctcgtgcttcagggcgaa300
aagaagacccacaagaaggaggaaggcgagaactgggtgaggaaggagcgcttcgagggc360
accttcaagcgcacgcttcagcttcctcgcggcgtggacgcgaaccagatccaggccaac420
tacaacaacggcgtgctcgagattgtagtacccaagcccgaggacatgcctaagaggcag480
ctgatcgacatcaagacaggagagggcttgaaggagaaggagaaggaacaagttcctatc540
tctggcgagaggggccagaag561
<210>5
<211>151
<212>prt
<213>ribosomalproteins15,putative
<400>5
metglyargmethisglyproglylysglyileserglyserala
151015
glnprophelysargthralaprosertrpleulysthrthrthr
202530
progluvalthraspleuilecyslysleualalyslysglyleu
354045
thrproserglnileglyvalileleuargaspserhisglyile
505560
glylysvallysphevalthrglyserlysvalleuargileleu
657075
lysalaasnglyleualaprogluleuprogluaspleutyrhis
808590
leuvallyslysalavalalavalarglyshisleuglulysphe
95100105
arglysasplysaspalalyspheargleuileleuilegluser
110115120
argilehisargleuserargtyrtyrargargthrlysglnleu
125130135
proproasntrplystyrgluserserthralaseralaleuvalala
140145151
<210>6
<211>453
<212>rna
<213>ribosomalproteins15,putative
<400>6
atgggtcgtatgcatggacctggtaagggtatctcgggctccgcccagcccttcaagcgc60
actgccccctcgtggctgaagaccaccacccccgaggtgaccgatctgatctgcaagctc120
gccaagaagggtctcaccccctcgcagatcggcgtcatcctccgtgactcgcacggtatc180
ggtaaggtcaagttcgtcaccggcagcaaggtgctccgcatcctgaaggccaacggtctt240
gcccccgagctccccgaggatctttaccacctcgtcaagaaggccgtggccgtgaggaag300
cacctcgagaagttcaggaaggacaaggatgccaagttcaggctcattctcatcgagtcg360
cgtatccaccgtctctcccgctactaccgccgcacgaagcagctgccccccaactggaag420
tacgagtcttccacggcctcggccctcgtcgcc453
<210>7
<211>76
<212>prt
<213>ubiquitindomaincontainingprotein/ribosomall40efamily
<400>7
metglnilephevallysthrleuthrglylysthrilethrleu
151015
gluvalgluserseraspthrilegluasnvallysglnlysile
202530
glnasplysgluglyileproproaspglnglnargleuilephe
354045
alaglylysglnleugluaspglyargthrleualaasptyrasn
505560
ileglnlysgluserthrleuhisleuvalleuargleuargglygly
657076
<210>8
<211>228
<212>dna
<213>ubiquitindomaincontainingprotein/ribosomall40efamily
<400>8
atgcagatcttcgtgaagacccttaccggcaagactatcacccttgaggtggagtccagc60
gatactatcgagaacgtgaagcagaagattcaggacaaggagggtattcctcccgaccag120
cagcgcctcatcttcgcgggcaagcagctcgaggacggccgtactctggccgactacaac180
atccaaaaggagtccactctccacctcgtgctccgtctgcgtggtggt228
<210>9
<211>257
<212>prt
<213>actin1
<400>9
metthrglnilemetphegluthrpheasnthrproalamettyr
151015
valalaserglnalavalleuserleutyralaserglyargthr
202530
thrglyilevalleuaspserglyaspglyvalthrhisthrval
354045
proiletyrgluglytyralaleuprohisalaileleuargleu
505560
aspleualaglyargaspleuthrasptyrleumetlysileleu
657075
thrgluargglytyrserphethrthrthralagluarggluile
808590
valargaspilelysglulysleucystyrvalalaleuaspphe
95100105
gluglnglumethisthralaalaserserseralaleuglulys
110115120
sertyrgluleuproaspglyglnvalilethrileglyasnglu
125130135
argpheargalaproglualaleupheglnproserpheleugly
140145150
metgluseralaglyvalhisgluthrthrtyrasnserilemet
155160165
lyscysaspvalaspilearglysaspleutyrglyasnvalval
170175180
leuserglyglythrthrmetpheproglyilealaaspargmet
185190195
glnlysgluleuthralaleualaproserthrmetlysilelys
200205210
ileilealaproprogluarglystyrservaltrpileglygly
215220225
serileleualaserleuserthrpheglnglnmettrpileser
230235240
lysgluglutyraspgluserglyproserilevalhisarglyscysphe
245250257
<210>10
<211>771
<212>dna
<213>actin1
<400>10
atgactcagatcatgttcgagaccttcaacacgccggccatgtacgtcgccagccaggcc60
gtgctttcgctgtacgcctctggccgtaccaccggtatcgtgctcgactcgggtgacggt120
gtgacccacactgtgcccatctacgagggttatgccctgccccacgccatcctccgtctc180
gaccttgccggccgtgacctcactgactacctcatgaagatcctcaccgagcgtggttac240
tcgttcaccaccaccgccgagcgtgagatcgtgcgtgacatcaaggagaagctgtgctac300
gtcgccctcgacttcgagcaggagatgcacaccgctgcctcgtcgtccgccctcgagaag360
tcctatgagcttcccgacggtcaggtcatcaccatcggtaacgagcgtttccgtgccccc420
gaggccctcttccagccctcgttcctcggcatggagtctgctggtgtgcacgagaccacc480
tacaactccatcatgaagtgcgacgttgatatccgtaaggacctttacggcaacgttgtg540
ctctccggtggcaccaccatgttccccggcattgctgaccgcatgcagaaggagctcact600
gccctcgctccctcgaccatgaagatcaagatcatcgctccccccgagcgtaagtactcc660
gtctggatcggtggctccatccttgcctcgctctccaccttccagcagatgtggatctcc720
aaggaggagtacgacgagtctggtccctccattgtccacaggaagtgcttc771
- 还没有人留言评论。精彩留言会获得点赞!