一种基于GALNT2基因的非小细胞肺癌辅助诊断、预后评价试剂盒及其使用方法与流程
本发明属于检测试剂盒技术领域,具体涉及一种基于galnt2基因的非小细胞肺癌辅助诊断、预后评价试剂盒及其使用方法。
背景技术:
肺癌是目前世界上最常见、对人类健康和生命威胁最大的肿瘤。非小细胞肺癌作为发病率最高的肺癌组织类型,由于早期缺乏典型临床症状,几乎70%的非小细胞肺癌患者在诊断之初就己经进入晚期或者发生了转移。一项全球性的肿瘤数据调查显示,在新发的肿瘤病例中,肺癌占据了17%,并且在肿瘤相关性死亡中,肺癌占据了23%,居肿瘤相关性死亡之首。因此,如何寻找新的非小细胞肺癌诊断及预后因子,并发掘其潜在治疗价值仍然是目前研究的热点问题,临床医师和科研人员迫切地需要寻找到经济、便捷、精准的诊断及预后指标。
糖基化是蛋白质最常见的翻译后修饰,异常糖基化是大多数人类癌症的标志,并影响许多细胞性质,包括细胞增殖,凋亡,分化,转化,迁移,入侵和免疫反应。存在哺乳动物细胞中蛋白质糖基化的两种主要类型:n连接和o连接。多肽-n-乙酰氨基半乳糖转移酶2(polypeptiden-acetylgalactosaminyltransferase2,galnt2)是多肽-n-乙酰氨基半乳糖转移酶家族的一员,它可能参与了免疫球蛋白形成中的o-糖基化。同时,galnt2可能影响甘油三酯的水平,参与了2型糖尿病及部分肿瘤的发生发展。galnt2已经报道参与口腔鳞癌,肝癌和卵巢癌等的发生发展,但其在非小细胞肺癌中的表达情况及临床意义尚未有相关报道。
技术实现要素:
本发明主要提供了一种基于galnt2基因的非小细胞肺癌辅助诊断、预后评价试剂盒及其使用方法,发现galnt2基因在非小细胞肺癌患者肿瘤部位与癌旁正常部位转录表达水平存在显著差异。与正常组织相比,galnt2基因在非小细胞肺癌肿瘤组织中表达显著上调,通过检测galnt2基因转录水平的表达情况,可以诊断非小细胞肺癌。同时,依据galnt2的表达情况,可以评估患者预后情况。其技术方案如下:
一种基于galnt2基因的非小细胞肺癌辅助诊断、预后评价试剂盒,包括扩增galnt2基因的pcr引物对,所述引物对为:
正向引物序列为5’-accaggtggagagtgataagc-3’,如seqidno:1所示;
反向引物序列为5’-tcctcaggatcattgctgtagtc-3’,如seqidno:2所示。
优选的,所述试剂盒还包括扩增管家基因gapdh的pcr引物对,所述引物对为:
正向引物序列为5’-gcaccgtcaaggctgagaac-3’,如seqidno:3所示;
反向引物序列为5’-tggtgaagacgccagtgga-3’,如seqidno:4所示。
优选的,所述试剂盒还包括sybrgreen聚合酶链式反应体系,所述sybrgreen聚合酶链式反应体系包括pcr缓冲液、dntps、sybrgreen荧光染料、无酶水和荧光定量加样板。
优选的,所述试剂盒还包括rna提取试剂,所述rna提取试剂包含trizol、氯仿、异丙醇、75%乙醇和无酶水。
优选的,所述试剂盒还包括将mrna反转录为cdna的体系,该反转录体系包含gdnaeraser、gdnaeraserbuffer、t重复寡核苷酸oligo(dt)、反转录反应液、反转录酶和dntps。
一种基于galnt2基因的非小细胞肺癌辅助诊断、预后评价试剂盒及其使用方法,包括以下步骤:
(1)将获取的新鲜组织经过液氮处理研磨后进行rna抽提;
(2)将抽提出的rna反转录成对应的cdna;
(3)将反转录后的cdna进行对galnt2和gapdh基因的荧光定量pcr扩增;
(4)以gapdh作为内参,记录每个反应的ct值,检测结果以δct表示,其中δct=ctgene-ctgapdh。
galnt2基因在制备非小细胞肺癌辅助诊断、预后评价试剂盒中的应用。
采用上述方案,本发明具有以下优点:
(1)本发明首次公开了galnt2基因与非小细胞肺癌的发生发展密切相关,galnt2基因有望成为诊断非小细胞肺癌的分子标志物,并为研究非小细胞肺癌疾病进展的分子机理提供新的思路;
(2)galnt2基因在在非小细胞肺癌患者肿瘤部位与癌旁正常部位转录表达水平存在显著差异,与癌旁正常组织相比,galnt2基因在非小细胞肺癌患者肿瘤部位表达显著上调,通过检测galnt2基因转录水平的表达情况,可以诊断非小细胞肺癌,从而可以制备含有galnt2基因的非小细胞肺癌辅助诊断试剂盒,利用检测基因转录水平表达的方式诊断非小细胞肺癌的方法更加灵敏更加特异,有利于疾病早期的诊断;
(3)本发明首次证实了galnt2基因在非小细胞肺癌中表达的高低与患者预后直接相关,高表达galnt2的非小细胞肺癌患者与低表达galnt2的患者相比,生存时间显著减少。通过检测galnt2转录水平的表达情况,可以预估非小细胞肺癌患者的预后情况,从而制备含有galnt2基因的非小细胞肺癌预后评价试剂盒,可以更加精准、更加客观的评判患者预后;
(4)本发明还提示可以通过干预galnt2的表达阻断非小细胞肺癌疾病进展,其有可能作为非小细胞肺癌未来靶向治疗的特定靶点,为非小细胞肺癌疾病的治疗提供新思路。
附图说明
图1为tcga数据库中galnt2基因mrna在110例非小细胞肺癌癌旁正常组织和1016例癌组织中的表达情况;
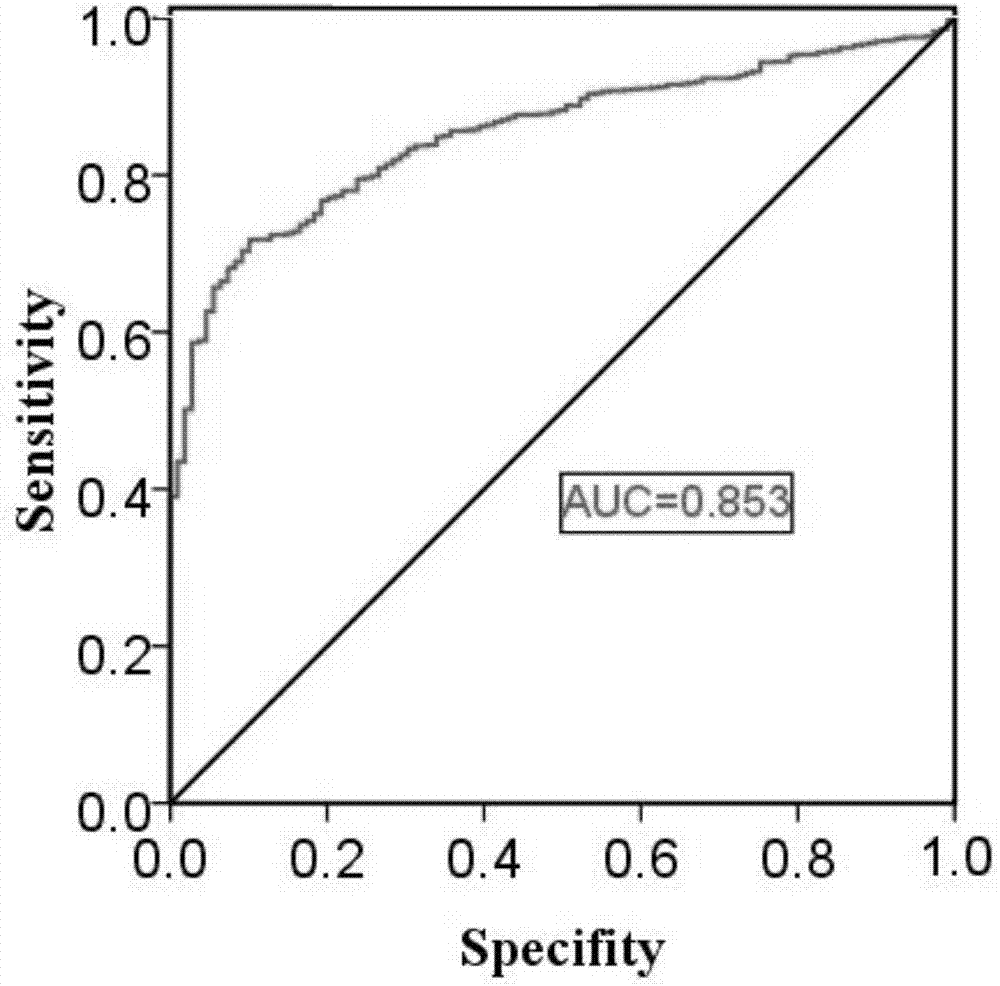
图2为基于tcga数据库中galnt2基因mrna表达情况,绘制的galnt2对于诊断非小细胞肺癌的roc曲线;
图3为临床标本来源的galnt2基因mrna在60对非小细胞肺癌患者组织中的表达情况;
图4为基于临床标本来源galnt2基因mrna表达情况,绘制的galnt2对于诊断非小细胞肺癌的roc曲线;
图5为tcga的非小细胞肺癌数据库中,基于galnt2基因mrna高低绘制的生存曲线;
图6为基于60对临床标本来源的非小细胞肺癌的galnt2基因mrna高低绘制的生存曲线;
图7为cck-8实验证实降低galnt2表达水平可以抑制肿瘤细胞增殖能力结果图;
图8为transwell实验证实降低galnt2表达水平可以抑制肿瘤细胞侵袭能力结果图。
具体实施方式
具体实施例
以下实施例中的实验方法如无特殊规定,均为常规方法,所涉及的实验试剂及材料如无特殊规定均为常规生化试剂和材料。
一、tcga数据库对比非小细胞肺癌患者癌与癌旁正常组织中galnt2差异表达
肿瘤基因图谱计划(thecancergenomeatlas,tcga)项目组最初由美国国家肿瘤研究所(thenationalcancerinstitute,nci)和美国国家人类基因组研究所(thenationalhumangenomeresearchinstitute,nhgri)组成,并发展成一个非常大的数据研究平台。tcga中非小细胞肺癌样本主要包括肺鳞癌和肺腺癌样本,数据来源于(https://genome-cancer.ucsc.edu),其中癌旁正常组织收录了110例,癌组织收录了1016例样本。galnt2基因转录水平结果来自illuminahiseq测序平台的rna-seq结果。图1为tcga数据库中galnt2基因mrna在癌旁正常组织(normal)和癌组织(cancer)中的表达情况。如图1所示,与癌旁正常组织相比,galnt2基因在癌组织中表达水平显著上升(p<0.0001)。
二、基于galnt2在tcga中差异表达绘制非小细胞肺癌诊断roc曲线
基于上述tcga样本非小细胞肺癌样本癌组织与癌旁组织的galnt2表达水平,绘制用于诊断非小细胞肺癌的roc曲线。在roc曲线评价方法中,roc曲线下的面积值auc在大于0.5的情况下,越接近于1,说明诊断效果越好。auc在0.5~0.7时有较低准确性,auc在0.7~0.9时有一定准确性,auc在0.9以上时有较高准确性。结果如图2所示,galnt2诊断非小细胞肺癌的roc曲线下面积(auc)为0.853,即诊断具有一定准确性。
三、临床组织样本检测非小细胞肺癌癌组织与癌旁组织中galnt2差异表达
收集郑州大学第一附属医院经病理诊断为非小细胞肺癌组织及配对的癌旁正常组织样本60对。对这些样本进行rna提取和反转录,对反转录得到的cdna进行galnt2和gapdh基因的荧光定量pcr扩增。结果如图3所示。由图3可知,galnt2基因在非小细胞肺癌癌组织中相对表达水平较癌旁正常组织中表达水平显著上升
(p<0.0001)。
四、基于galnt2在临床组织中差异表达绘制非小细胞肺癌诊断roc曲线
基于上述收集的60对非小细胞肺癌组织样本galnt2表达水平,绘制用于诊断非小细胞肺癌的roc曲线。结果如图4所示,galnt2诊断非小细胞肺癌的roc曲线下面积(auc)为0.907,即诊断具有较高准确性。
五、tcga的非小细胞肺癌数据库中galnt2表达高低绘制生存曲线
在tcga数据库中,非小细胞肺癌数据中包含1016例肿瘤样本,带有预后信息的为958例。将这958例样本根据galnt2的mrna表达水平排序,高表达组为前479例,低表达组为后479例,绘制生存曲线,图5为基于galnt2基因mrna高低绘制的生存曲线。通过longranktest分析得p<0.0001,即预后有统计学意义。说明在非小细胞肺癌中,高表达galnt2的患者预后显著差于低表达galnt2患者。
六、临床标本来源的非小细胞肺癌肿瘤组织中galnt2表达高低绘制生存曲线
临床收集的非小细胞肺癌60例患者均带有随访信息。根据60例样本galnt2的mrna表达水平排序,高表达组为前30例,低表达组为后30例,绘制生存曲线,图6为基于galnt2基因mrna高低绘制的生存曲线。通过longranktest分析得p=0.0061,即预后有统计学意义。进一步在非小细胞肺癌临床样本中证实了高表达galnt2的患者预后显著差于低表达galnt2患者。
七、cck-8实验证实降低galnt2表达水平可以抑制肿瘤细胞增殖能力
选取体外培养的非小细胞肺癌细胞系a549进行干预实验,经复苏后与37℃,5%co2孵箱中培养,a549细胞转染前24h以2×105个细胞每孔接种于6孔培养板中,当细胞达60%-80%融合时,参照lipofectamine2000产品说明书分别将sirna-nc和sirna-galnt2转染至六孔板中,转染6h后更换新鲜培养基,继续培养至24小时后将两组细胞消化收集,计数,以每孔3000个/100μl接种于96孔板中,待细胞贴壁后分别在0、1、2、3、4天(d)加入10μlcck-8,37℃孵育1.5h后在波长450nm处检测其吸光度值。通过cck-8法检测细胞贴壁后0、1、2、3、4d的光密度值,绘制生长曲线,结果如图7所示,与sirna-nc组相比,中细胞生长速率明显下降(p<0.05),说明降低galnt2可以对a549细胞增殖具有抑制作用。
八、transwell实验证实降低galnt2表达水平可以抑制肿瘤细胞侵袭能力
将转染24小时后的a549细胞系及对照组用无血清rpmi1640培养基重悬细胞,调至2.5×105/ml细胞,取100μl加入transwell板的上室孔中,下室加入600μl含有小牛血清rpmi1640培养基。37℃,5%co2孵箱中培养12小时后吸尽培养基,pbs清洗后,甲醛室温固定15min,用棉签轻擦掉上表面的细胞,苏木精染色,室温干燥过夜。图8结果表明,下调galnt2的基因表达后,a549细胞侵袭能力显著被抑制(p<0.05),说明抑制galnt2可以抑制肺癌细胞的侵袭能力。
九、基于958例tcga来源的非小细胞肺癌组织的cox多因素回归分析
性别、年龄、肿瘤大小及galnt2的表达水平被纳入cox多因素回归分析模型,分析这些因素与非小细胞肺癌患者预后的关系。分析结果如表1。
表1基于tcga来源的非小细胞肺癌的cox多因素回归分析结果
该结果说明了galnt2表达水平对非小细胞肺癌具有独立判断预后的价值(p<0.0001)。
十、基于galnt2基因的非小细胞肺癌辅助诊断试剂盒的制备及使用
1.非小细胞肺癌辅助诊断试剂盒包括扩增galnt2基因的pcr引物对、扩增管家基因gapdh的pcr引物对、sybrgreen聚合酶链式反应体系、rna提取试剂、mrna反转录为cdna的体系。
其中扩增galnt2基因的pcr引物对为:
正向引物序列为5’-accaggtggagagtgataagc-3’,如seqidno:1所示;
反向引物序列为5’-tcctcaggatcattgctgtagtc-3’,如seqidno:2所示。
扩增管家基因gapdh的pcr引物对为:
正向引物序列为5’-gcaccgtcaaggctgagaac-3’,如seqidno:3所示;
反向引物序列为5’-tggtgaagacgccagtgga-3’,如seqidno:4所示。
所述sybrgreen聚合酶链式反应体系包括pcr缓冲液、dntps、sybrgreen荧光染料、无酶水和荧光定量加样板。
所述rna提取试剂包含trizol、氯仿、异丙醇、75%乙醇和无酶水。
所述反转录为cdna的体系包含gdnaeraser、gdnaeraserbuffer、t重复寡核苷酸oligo(dt)、反转录反应液、反转录酶和dntps。
2.诊断试剂盒的检测过程如下:
1)将待测的新鲜组织在液氮作用下研碎,在碎裂后的组织中加入1mltrizol,使用1ml的移液枪反复吹打,室温孵育5min,充分分离核蛋白复合物;
2)每管加入500μl氯仿,上下颠倒混匀10次。待溶液充分乳化后,室温静置5min。4℃离心,12000rpm,15min;
3)从离心机中小心取出离心管,此时匀浆液分为三层,即:无色的水相、中间的白色蛋白层及带有颜色的下层有机相。吸取水相转移至新的离心管中;
4)向水相中加入等体积的异丙醇,上下颠倒离心管充分混匀后,室温静置10min;4℃,12000rpm离心10min,离心后,ep管底部会出现沉淀;
5)小心弃去上清,缓慢地沿离心管壁加入lml预冷75%乙醇(切勿触及沉淀),12000rpm,4℃离心5min,弃去上清;
6)室温干燥沉淀2-5min,加入适量的rnase-free水溶解沉淀,必要时可用移液枪轻轻吹打沉淀;
7)利用nanodrop检测rna的浓度及纯度。od260/od280比值在1.80-2.0之间,说明rna纯度符合实验要求;
8)反转录:首先配置5×gdnaeraserbuffer(2μl)、gdnaeraser(1μl)、rna(1μ)和rnase-free水混合体系,共10μl,42℃,2min;将5×primescriptbuffer2(4μl)、primescriptrtenzymemix(1μl)、rtprimermix(1μl)、rnase-free水(4μl)及上述混合液(10μl)进行混合,短暂离心后放入pcr仪,反应条件:37℃反应15min,85℃反应5秒,获得cdna;
9)加样:将荧光定量板置于冰上,每个样本设2个复孔,将cdna(稀释4~5倍,稀释后加2μl)、sybergreen和rcr缓冲液混合一起每孔12μl,引物每孔8μl,配置好总体系后进行分装,减少误差;
10)加样结束后,使用pe手套小心将荧光定量板膜盖上密封板,离心,避免气泡产生;
11)设置程序:95℃10min;95℃10s,60℃10s,72℃10s,40个循环+溶解曲线;
12)实验数据分析:以gapdh作为内参,记录每个反应的ct值,ct值为每个反应管内的荧光信号到达设定的阈值时所经历的循环数。δct=ctgene-ctgapdh,δct越小表示其起始拷贝数越多,表达越高。
对本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及形变,而所有的这些改变以及形变都应该属于本发明权利要求的保护范围之内。
序列表
<110>郑州大学第一附属医院
<120>一种基于galnt2基因的非小细胞肺癌辅助诊断、预后评价试剂盒及其使用方法
<130>1
<160>4
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>1
accaggtggagagtgataagc21
<210>2
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>2
tcctcaggatcattgctgtagtc23
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
gcaccgtcaaggctgagaac20
<210>4
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>4
tggtgaagacgccagtgga19
- 还没有人留言评论。精彩留言会获得点赞!