一种烟酰胺的生产工艺的制作方法
本发明属于生物化工领域,尤其涉及一种烟酰胺的生产工艺。
背景技术:
烟酰胺又名尼克酰胺,英文名称:nicotinamide,烟酰胺又称为维生素b3,属于b族维生素(vb),是生物体内烟酰胺腺嘌呤二核苷酸(辅酶i)和烟酰胺腺嘌呤二核苷酸磷酸(辅酶ii)的组成部分,参与碳水化合物、脂肪和蛋白质的代谢过程。烟酰胺作为维生素具有抗粗皮肤病的作用,对某些皮肤病和神经障碍有独特疗效。烟酰胺的最大应用领域是作为饲料添加剂,同时也可以添加到食品中用以补充人体所需的维生素。研究发现,在饲料中添加烟酰胺或烟酸可以提高畜禽的抗病能力和生长速率。烟酰胺也是合成某些医药、农药的重要中间体。
目前,全球烟酰胺和烟酸的总生产能力近6万t/年,随着饲料工业的发展,烟酰胺的市场需求正以每年4%~5%的速度快速增长。同时,随着生活水平的不断进步,人们对饮食水平提出更高的要求,作为维生素的烟酰胺将得到更广泛的应用。
主流生产烟酰胺的方法是利用腈水合酶催化3-氰基吡啶生产烟酰胺。瑞士龙沙(lonza)集团在中国广州南沙市建立的一条年产9000吨的烟酰胺生产线,采用产腈水合酶的野生菌种r.rhodochrousj1的细胞作为催化剂,应用细胞固定化技术进行生产。但野生菌生产烟酰胺往往会会有副产物烟酸的产生,导致烟酰胺产品质量不高;
此外,目前生物法生产烟酰胺的反应液杂质多、产品浓度不高,导致后续精制工艺复杂、能耗高。
技术实现要素:
本发明提供了一种烟酰胺的生产工艺,该生产工艺制备获得的烟酰胺产品浓度高、杂质少,得率高。
具体技术方案如下:
一种烟酰胺的生产工艺,包括:重组腈水合酶基因工程菌的构建,所述工程菌的发酵培养以及利用所述工程菌催化3-氰基吡啶得到烟酰胺;其特征在于:
所述重组腈水合酶基因工程菌包括宿主细胞和转入宿主细胞的目的基因,所述宿主细胞为大肠杆菌,所述目的基因为碱基序列如seqidno.1或seqidno.2所示的腈水合酶基因;
所述催化的过程包括:(1)以水为溶剂,重悬所述工程菌,制得细胞悬液;(2)向所述细胞悬液中分批加入底物3-氰基吡啶,控制反应体系中3-氰基吡啶的浓度≤90g/l,进行水合反应,得到产物烟酰胺。
具体的,本发明以两种菌株为例,即:表达博得特氏菌dsm12804(bordetellapetriidsm12804)来源腈水合酶的基因工程菌e.colibl21(de3)/pet-30a(+)-nhasep;以及表达锰氧化橙单胞菌si859a(aurantimonasmanganoxydanssi859a)来源腈水合酶的基因工程菌e.colibl21(de3)/pet-30a(+)-penhase-1229。
上述重组腈水合酶基因工程菌中的重组腈水合酶分别来源于博得特氏菌(bordetellapetrii)dsm12804和锰氧化橙单胞菌(aurantimonasmanganoxydans)si859a;重组腈水合酶基因的碱基序列分别如seqidno.1和seqidno.2所示,工程菌采用大肠杆菌e.colibl21(de3)作为宿主菌,以pet-30a(+)作为载体。
本发明工艺所涉及的腈水合酶是在大肠杆菌中表达的胞内酶,为了高效、大规模地获取表达腈水合酶的大肠杆菌细胞,同时利用基因工程菌具有精确的基因开关的特点,我们将发酵过程分为两个阶段、分别加以控制:即细胞快繁阶段和产酶阶段。
作为优选,所述发酵培养的过程包括:菌种活化、种子培养和补料分批发酵;
所述补料分批发酵的过程包括:
(1)细胞快繁阶段:将种子培养后的重组腈水合酶基因工程菌菌种接种至基础发酵培养基中进行培养;其中,培养的温度为30~37℃,发酵液的溶氧量为5~75%,发酵液的ph值为6.8~7.2;在培养过程中,通过向发酵液补加补料培养基来控制基因工程菌的比生长速率在0.2~0.5之间;
(2)产酶阶段:待发酵液中基因工程菌的细胞浓度达到od600=70~90时,向发酵液中加入乳糖诱导基因工程菌产酶,直至发酵结束;其中,培养的温度为15~25℃,发酵液的溶氧量为5~75%,发酵液的ph值为6.8~7.2;在培养过程中,通过向发酵液补加补料培养基来控制基因工程菌的比生长速率在0.01~0.1之间;
所述基础发酵培养基为:20g/l甘油,8g/l蛋白胨,12g/l酵母抽提物,17.1g/lna2hpo4·12h2o,3.0g/lkh2po4,0.5g/lnacl,1.0g/lnh4cl和0.6g/lmgso4,卡那霉素浓度为50μg/ml;
所述补料培养基为:300~600g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
其中,在细胞快繁阶段,采用指数流加方式连续补加补料培养基,使基因工程菌以一恒定的比生长速率快速生长;而在产酶阶段,采用恒速流加的方式继续连续补加补料培养基,使基因工程菌的主要生理代谢活动适合腈水合酶的高效表达,这一阶段菌体快速生长和繁殖虽然较为缓慢、但并未停止,从而进一步提高发酵密度。
大肠杆菌发酵最适温度是37℃,最适ph6.8~7.2,当条件最适菌体生长时,大肠杆菌很快就会进入指数生长期。当基础培养基营养物质被耗尽后,生长进入衰亡期,但如果在基础培养基营养物质被耗尽前流加营养物质(补料培养基),大肠杆菌的指数生长期会大大延长,从而获得高细胞密度。然而,随温度上升细菌代谢加快,其产生代谢副产物也会增加,这些副产物会对菌体的生长产生一定的抑制作用。菌体生长过快也会影响质粒的稳定性。降低培养温度,菌体对营养物质的摄取和生长速率都会下降,但同时也减少了有毒代谢副产物的产生和代谢热的产生。因此,降低温度、降低比生长速率,更有利于目的蛋白的正确折叠及表达。在重组大肠杆菌的发酵中不同发酵阶段其最适温度也不同,为了能获得大量的目的蛋白,首先要保证菌体的量,因此在前期可优先考虑菌体的生长,到诱导阶段应将目的产物的表达放在首位。
作为优选,步骤(1)中,所述温度为32~35℃,溶氧量为20~30%;步骤(2)中,所述温度为18~20℃,溶氧量为30~50%。
作为优选,步骤(1)中,控制所述基因工程菌的比生长速率为0.2~0.3;步骤(2)中,控制所述基因工程菌的比生长速率0.01~0.04。
作为优选,步骤(1)中,以基础发酵培养基的体积计,所述基因工程菌菌种的接种量为5~15%。
作为优选,步骤(2)中,以发酵液的体积计,所述乳糖的投加量为5~15g/l。
作为优选,步骤(1)中,发酵培养的时间为8~16h;步骤(2)中,发酵培养的时间为48~96h。
作为优选,所述菌种活化的过程,包括:将基因工程菌菌株接种至固体培养基上进行活化培养;
所述活化培养的温度为35~37℃,时间为8~16h;所述固体培养基为:lb-kan固体培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,ph7.0,20g/l琼脂粉,卡那霉素浓度为50μg/ml。
作为优选,所述种子培养的过程,包括:将活化后的菌种接种至一级种子培养基中,进行一级培养;再接种至二级种子培养基中进行二级培养;所述一级培养的温度为35~37℃,时间为8~24h;所述二级培养的温度为35~37℃,时间为3~12h。
作为优选,所述一级种子培养基为lb培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,ph7.0,卡那霉素浓度为50μg/ml;
所述二级种子培养基为12g/l蛋白胨,24g/l酵母抽提物,16.43g/lk2hpo4·3h2o,2.31g/lkh2po4,5.04g/l甘油,卡那霉素浓度为50μg/ml。
现有的烟酰胺生产工艺中,一般均以磷酸盐作为缓冲液或者直接在细胞发酵液中进行水合反应,使得制备获得的烟酰胺成品中存在大量杂质,进而影响产品质量;本发明发酵获得的工程菌酶活高,能够在以纯水为介质的细胞悬液中保持高酶活,制备获得的烟酰胺成品中无杂质带入,进而获得高质量的烟酰胺产品。
作为优选,以腈水合酶酶活计,所述细胞悬液中重组腈水合酶基因工程菌的添加量为5~10万u/l。
作为优选,所述酰胺化反应的温度为15~25℃;反应体系的ph值为6.5~8.5。
进一步地,步骤(2)中,3-氰基吡啶分批加入的次数为4~8次。
与现有技术相比,本发明的有益效果为:
(1)本发明工艺采用含高酶活的重组腈水合酶基因的基因工程菌进行发酵培养并制备以纯水为反应介质的细胞悬液,采用分批投加底物的方式向细胞悬液中添加3-氰基吡啶,实现高效地酰胺化反应,得到烟酰胺产品;该工艺中酰胺化反应的转化率>99.9%,获得的产品品质高,且无杂质和副产物产生。
(2)本发明工艺在生产烟酰胺时采用分批投加底物的方式,避免高底物浓度对重组腈水合酶活力的抑制,使得烟酰胺的浓度超过400g/l,时空产率为>80g烟酰胺/l/h;显著提高了产品浓度和生产强度,充分利用了腈水合酶的催化活性,降低酶的使用成本;同时高产品浓度也大大降低了浓缩能耗。
(3)本发明工艺提供的烟酰胺生产方法,采用游离细胞纯水转化技术,避免将缓冲盐或发酵液杂质带入到烟酰胺成品中,在制备获得高质量烟酰胺的同时降低生产成本。
(4)本发明工艺提供的工程菌发酵培养过程中通过将补料分批发酵人为分成两个阶段并控制各阶段的培养条件,尤其是工程菌比生长速率的控制以及发酵过程中培养基的组成,使得重组腈水合酶基因工程菌实现高密度发酵,不仅提高了产腈水合酶的工程菌的菌浓度(以干重计达到60-80g/l),还提高了腈水合酶的酶活,获得了腈水合酶酶活最高超过6500u/ml的发酵液。
附图说明
图1为实施例3发酵过程中腈水合酶诱导表达后的sds-page电泳图;
m:低分子量标准蛋白质;w:全细胞蛋白;s:可溶蛋白;i:不溶蛋白。
图2为实施例3催化反应过程中底物和产物浓度的变化情况。
图3为实施例4的发酵过程控制参数变化曲线。
图4为实施例4的发酵细胞生长和产酶过程曲线。
图5为实施例4中催化反应液的hplc图谱。
图6为实施例4中产品烟酰胺的核磁图谱。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并非仅限于此。下列实施例中所述的产品烟酰胺浓度是指水合反应后转化液中的烟酰胺浓度。
实施例1菌种与酶活的测定
(1)菌种构建
本实施例所采用的菌株为:表达博得特氏菌dsm12804(bordetellapetriidsm12804)来源腈水合酶的基因工程菌e.colibl21(de3)/pet-30a(+)-nhasep。基因工程菌构建具体方法见:申请公布号为cn104498466a,名为“腈水合酶及其应用”的发明专利申请文献。该基因工程菌中腈水合酶基因的碱基序列如seqidno.1所示。
表达锰氧化橙单胞菌si859a(aurantimonasmanganoxydanssi859a)来源腈水合酶的基因工程菌e.colibl21(de3)/pet-30a(+)-penhase-1229,基因工程菌中腈水合酶基因的碱基序列如seqidno.2所示。基因工程菌的构建方法如下:
采用细菌基因组提取试剂盒提取锰氧化橙单胞菌atccbaa-1229的基因组。再根据锰氧化橙单胞菌atccbaa-1229基因组中假定腈水合酶的核苷酸序列设计引物ama_alphaf和ama_actr,以锰氧化橙单胞菌atccbaa-1229基因组为模板,pcr扩增全长腈水合酶基因。在上、下游引物中分别加入限制性酶切位点bamhi、hindiii(下划线所示)。
ama_alphaf序列:5′-cgggatccatgacgggatcgcacggcag-3′;
ama_actr序列:5′-cccaagctttcagtcgtgtgggttcggcagg-3;
pcr反应体系和反应条件如下:
pcr扩增体系:
pcr扩增条件:
1)预变性:95℃2min;
2)变性:95℃10s;退火:58℃15s;延伸:72℃15s;共循环30次;
3)延伸:72℃10min;
4)4℃保存2.0h。
用0.7%琼脂糖凝胶电泳检测pcr扩增产物,产物为单一条带,大小为1700bp左右(如图1所示)。用dna回收纯化试剂盒对pcr扩增产物进行纯化回收,具体步骤参照该试剂盒说明书。选择pet28a(+)作为表达载体,将载体pet28a(+)和腈水合酶基因经bamhi和hindiii双酶切,采用dna凝胶回收试剂盒进行酶切产物的回收。
双酶切体系和反应条件:
采用核酸电泳初步确定两者的浓度,以基因/质粒(mol/mol,2:1)进行混合,加入t4dna连接酶16℃连接过夜,得到重组质粒penhase-1229。然后,将重组质粒转化入感受态e.colibl21(de3)细胞中。再将转化后的菌液涂布于含有终浓度100μg/ml卡那霉素(kanamycin,kan)的lb平板上,经37℃静止培养,挑取单菌落,由上海生工进行基因序列的测定,从而验证重组质粒penhase-1229及重组菌株的正确性,最终获得耐热腈水合酶基因工程菌e.colibl21(de3)/penhase-1229。
(2)酶活测定
发酵过程中监测酶活,可将发酵液12000×g离心1min,去上清,再用50mm磷酸盐缓冲液(ph8.0)重悬细胞,测定其中的腈水合酶酶活。
在通常情况下,腈水合酶酶活采用标准反应体系进行测定,反应体系为0.5ml,50mm磷酸盐缓冲液(ph8.0)含100mm3-氰基吡啶,添加适量细胞悬液起始反应。25℃振荡反应2min,立即添加0.5ml纯乙腈终止反应,12000×g离心1min,上清液采用高效液相色谱法(hplc)测定体系中所生成的烟酰胺量。
腈水合酶活力定义:1单位(u)为在25℃条件下1min催化形成1μmol烟酰胺所需要的酶量。
hplc法采用安捷伦高效液相色谱仪(agilent1100,usa),色谱柱:varianpursuitc18反向色谱柱(4.6mm×250mm),流动相:10mm磷酸钾盐缓冲液(ph2.8):乙腈=92:8(v/v),流速设定为0.5ml/min,uv检测器,波长230nm。
实施例2采用基因工程菌e.colibl21(de3)/pet-30a(+)-nhasep生产烟酰胺
(1)菌种活化:采用接种环取菌种管内的-80℃甘油管保藏的表达博得特氏菌dsm12804(bordetellapetriidsm12804)来源腈水合酶的基因工程菌e.colibl21(de3)/pet-30a(+)-nhasep菌种在lb-kan-琼脂固体培养基表面(平皿或茄子瓶)上划线,平皿倒置于37℃恒温培养箱,培养12小时;
(2)种子培养:将活化后的菌种再接种到40ml的一级种子培养基中,37℃下振荡培养12小时,得到一级种子液;然后,将一级种子液移入400ml二级种子培养基中,35℃下振荡培养4小时,得到二级种子液;
其中,一级种子培养基为lb培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,5m氢氧化钠溶液调节ph值至7.0,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。二级种子培养基为:12g/l蛋白胨,24g/l酵母抽提物,16.43g/lk2hpo4·3h2o,2.31g/lkh2po4,5.04g/l甘油,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。
(3)补料分批发酵:
(a)细胞快繁阶段:先配制5l基础培养基置于发酵罐中,初始ph=6.54,121℃灭菌20min,降温到35℃,ph变为6.23,用氨水将ph调到6.8,将440ml二级种子液接入发酵罐,进行发酵,控制发酵温度35℃,通过通气与搅拌控制溶氧维持在20~30%之间。另配3l补料培养基,121℃灭菌20min,冷却到室温后,待用。待基础培养基营养物质耗尽(表现为溶氧急剧上升),开始补料,补料速率按照如下公式计算:
其中,f(t)为所述补料培养基的流加速率,单位为l/h;x0为每升发酵液中的大肠杆菌基因工程菌的细胞干重,单位g/l;v0为发酵体系的初始体积,单位l;sf为补料培养基中甘油的浓度,单位为g/l;s0为调整流加速率时发酵液中甘油的浓度,单位g/l;μset为设定的比生长速率,单位h-1,yx/s为甘油对大肠杆菌基因工程菌细胞干重的得率系数,单位为g/g;t为流加补料培养基的时间,单位为h。
经测算,yx/s=0.4g/g,调节补料速率时,发酵液甘油残留量为0,即s0=0.0g/l;为简化操作,每一小时改变流加速率,改变后的流加速率根据公式计算得出。
上述基础发酵培养基为:20g/l甘油,8g/l蛋白胨,12g/l酵母抽提物,17.1g/lna2hpo4·12h2o,3.0g/lkh2po4,0.5g/lnacl,1.0g/lnh4cl和0.6g/lmgso4,卡那霉素浓度为50μg/ml;
上述补料培养基为:400g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
(b)产酶阶段:发酵12h后,测得发酵液的od600=78.1,将发酵液温度降至18℃,加入诱导剂乳糖8g/l,继续发酵到68h,期间溶氧维持在20~30%;补料速率为0.05l/h。
上述补料培养基为:400g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
发酵结束后,得到od600=186,细胞干重为58.1g/l,腈水合酶酶活为1920u/ml的发酵液。
(4)将发酵液进行4000rpm离心30min,弃上清,得到基因工程菌菌泥。测定菌泥单位酶活为9000u/g。在10l转化罐中注入6.5l纯水,加入菌泥80g,调ph=8.0,补水定容到7l,用冷却循环水控制罐温为20℃,开启搅拌。将3.2kg烟腈固体粉末分5批投入反应。投料操作及检测结果如下表所示:
转化结束后,量取转化液体积为9.0l,产品烟酰胺浓度为405.0g/l。
实施例3基因工程菌e.colibl21(de3)/pet-30a(+)-penhase-1229生产烟酰胺
(1)菌种活化:采用接种环取菌种管内的-80℃甘油管保藏的表达锰氧化橙单胞菌si859a(aurantimonasmanganoxydanssi859a)来源腈水合酶的基因工程菌e.colibl21(de3)/pet-30a(+)-penhase-1229菌种在lb-kan-琼脂固体培养基表面(平皿或茄子瓶)上划线,平皿倒置于37℃恒温培养箱,培养12小时;
(2)种子培养:将活化后的菌种再接种到50ml的一级种子培养基中,37℃下振荡培养12小时,得到一级种子液;然后,将一级种子液移入500ml二级种子培养基中,35℃下振荡培养4小时,得到二级种子液;
其中,一级种子培养基为lb培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,5m氢氧化钠溶液调节ph值至7.0,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。二级种子培养基为:12g/l蛋白胨,24g/l酵母抽提物,16.43g/lk2hpo4·3h2o,2.31g/lkh2po4,5.04g/l甘油,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。
(3)补料分批发酵:
(a)细胞快繁阶段:先配制7l基础培养基置于发酵罐中,初始ph=6.56,121℃灭菌20min,降温到35℃,ph变为6.21,用氨水将ph调到7.0,将550ml二级种子液接入发酵罐,进行发酵,控制发酵温度37℃,通过通气与搅拌控制溶氧维持在20~30%之间。另配4l补料培养基,121℃灭菌20min,冷却到室温后,待用。待基础培养基营养物质耗尽(表现为溶氧急剧上升),开始补料,补料速率按照实施例2的方法计算和控制。
上述基础发酵培养基为:20g/l甘油,8g/l蛋白胨,12g/l酵母抽提物,17.1g/lna2hpo4·12h2o,3.0g/lkh2po4,0.5g/lnacl,1.0g/lnh4cl和0.6g/lmgso4,卡那霉素浓度为50μg/ml;
上述补料培养基为:500g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
(b)产酶阶段:发酵12h后,测得发酵液的od600=76.7,将发酵液温度降至20℃,加入诱导剂乳糖5g/l,继续发酵到58h,期间溶氧维持在20~30%;补料速率为0.07l/h。所述补料培养基为:500g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
发酵结束后,得到od600=190,细胞干重为62.5g/l,腈水合酶酶活为5345u/ml发酵液。
发酵过程的腈水合酶大部分以可溶蛋白形式过表达,占细胞总蛋白25%以上,蛋白表达sds-page见图1所示。
(4)将发酵液进行4000rpm离心30min,弃上清,得到基因工程菌菌泥;测定菌泥单位酶活为15450u/g。
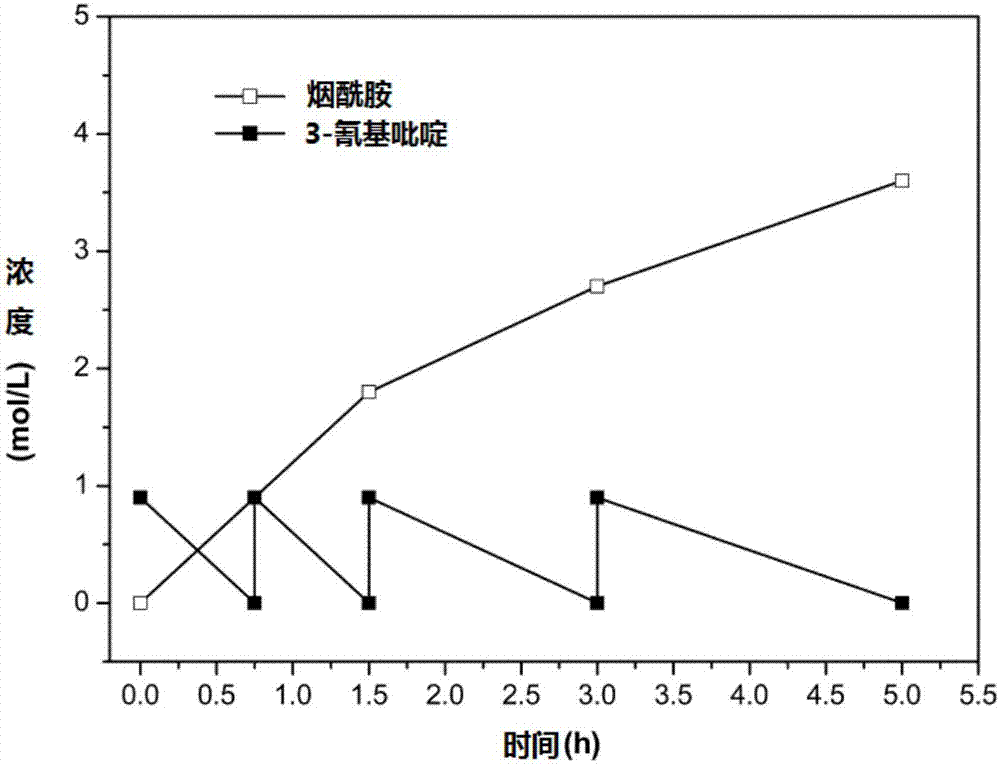
在5l的圆底烧瓶中,加入含1.0l纯水,加入4.6g菌泥,用氨水调ph=8.0,加入0.9mol的3-氰基吡啶。20℃水浴,100rpm磁力搅拌,开始反应,定期取样,分析过程中底物和产物的情况。当反应液中的底物完全转化后,再重复分批添加0.9mol的3-氰基吡啶晶体。反应过程结果如图2所示。四批0.9m3-氰基吡啶分批次加入到反应体系中,大约5h完成催化反应,转化率>99.9%,产品烟酰胺浓度为3.6mol/l,即439.2g/l。
实施例4基因工程菌e.colibl21(de3)/pet-30a(+)-penhase-1229大规模生产烟酰胺
(1)菌种活化:采用接种环取菌种管内的-80℃甘油管保藏的表达锰氧化橙单胞菌si859a(aurantimonasmanganoxydanssi859a)来源腈水合酶的基因工程菌e.colibl21(de3)/pet-30a(+)-penhase-1229菌种在lb-kan-琼脂固体培养基表面(茄子瓶)上划线,茄子瓶倒置于37℃恒温培养箱,培养16小时;
(2)种子培养:20l发酵罐配15l一级培养基,121℃灭菌20min,降温到37℃后接入茄子瓶种子,并加入7.5ml100mg/l的卡那霉素溶液,37℃培养18小时。200l发酵罐配150l二级培养基,121℃灭菌20min,降温到37℃后移入一级种子液,并加入75ml100mg/l的卡那霉素溶液,37℃培养3.5小时,期间溶氧维持在30%以上,此为二级种子液;
其中,一级种子培养基为lb培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,5m氢氧化钠溶液调节ph值至7.0,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。二级种子培养基为:12g/l蛋白胨,24g/l酵母抽提物,16.43g/lk2hpo4·3h2o,2.31g/lkh2po4,5.04g/l甘油,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。
(3)补料分批发酵:
(a)细胞快繁阶段:先配制1000l基础培养基置于2000l发酵罐中,初始ph=6.50,121℃灭菌30min,降温到35℃,ph变为6.37,用氨水将ph调到7.0,移入二级种子液,开始发酵,控制发酵温度35℃,期间溶氧维持在30%以上。另配700l补料培养基,121℃灭菌30min,冷却到室温后,待用。待基础培养基营养物质耗尽(表现为溶氧急剧上升),开始补料,补料速率按照实施例2的方法计算和控制。
上述基础发酵培养基为:20g/l甘油,8g/l蛋白胨,12g/l酵母抽提物,17.1g/lna2hpo4·12h2o,3.0g/lkh2po4,0.5g/lnacl,1.0g/lnh4cl和0.6g/lmgso4,卡那霉素浓度为50μg/ml;
上述补料培养基为:400g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
(b)产酶阶段:发酵10h后测得od600=78.6,进行降温诱导,降温到18℃,加入诱导剂乳糖10g/l,继续发酵到91h,期间溶氧维持在40~60%;补料速率为8.5l/h。
上述补料培养基为:400g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
发酵结束后,得到od600=233,细胞干重75.9g/l,腈水合酶酶活6520u/ml发酵液。发酵过程的主要控制参数如图2所示,细胞生长和产酶过程见图4。
(4)将发酵液经过陶瓷膜微滤,清夜进入排污系统处理,含细胞的浊液再用纯水洗涤2~3次,得到基因工程菌细胞悬液,测定酶活为9640u/g。
在10吨水合釜中注入5500l去离子水,加入基因工程菌细胞悬液100kg,调ph=8.0,补水定容到6000l。将3.5吨3-氰基吡啶配成70%水溶液,70℃水浴熔化后60℃保温。用冷却循环水控制水合釜温度为20℃,开启搅拌。用泵将熔融状态的原料泵入罐内反应。检测结果如下表所示:
转化结束后,获得转化液体积为9.8吨,产品烟酰胺浓度为452.6g/l。转化液经过分离纯化后,得到烟酰胺晶体,再经过hplc(图5)和核磁共振(图6)分析后,证明重组腈水合酶催化3-氰基吡啶得到的产品为烟酰胺,而且几乎没有副产物烟酸产生。
对比例1
kimby等人(kimby,kimjc,leehh,etal.(randdcenter,tongsuhpetrochemicalcorp.ltd.,p.o.box50,nam-ulsan,southkorea;departmentofbioscienceandbiotechnology,hankukuniversityofforeignstudies,kyunggi-do449-791,southkorea).fed-batchfermentationforproductionofnitrilehydratasebyrhodococcusrhodochrousm33.biotechnologyandbioprocessengineering,2001,6(1):11-17.)通过分批补料发酵,对红球菌(rhodococcusrhodochrousm33)进行高密度发酵,发酵时长120~140h,od600=120左右,细胞干重24~32g/l,腈水合酶酶活1600~2880u/ml,而且该酶活测定是以丙烯腈为底物测定的,一般的腈水合酶以烟腈为底物的酶活要低于以丙烯腈为底物的酶活。
由此可见,本发明方法获得的腈水合酶单位发酵体积的酶活力要远高于对比例1,说明本发明的方法更适用于工业大规模生产腈水合酶。
对比例2
将基因工程菌e.colibl21(de3)/pet-30a(+)-penhase-1229甘油保藏菌种接于5ml含50μg/mlkan的lb液体培养基中,37℃,200rpm振荡培养10~14h。取2ml培养液转接至100ml含50μg/mlkan的新鲜lb液体培养基中,37℃,200rpm振荡培养至菌体密度(od600)达到0.8时,加入iptg至终浓度为0.1mm,18~37℃下诱导12~18h。
培养结束后,测得od600=5.7,细胞干重1.0g/l,腈水合酶酶活130u/ml发酵液。
对比例3
prasads.(indianjournalofmicrobiology,47:34-41,2007)等从土壤筛选到一株紫红红球菌pa-34(rhodococcusrhodochrouspa-34)来催化3-氰基吡啶的水合反应。发现在1l的反应体系中,含9.0g野生菌细胞(干重),12h内完全转化7m3-氰基吡啶水合生成855g烟酰胺,其生产率为71.2g烟酰胺/l/h。本实施例2~4的催化工艺,其生产率大于80g烟酰胺/l/h。
对比例4
瑞士龙沙(lonza)集团采用产腈水合酶的野生红球菌r.rhodochrousj1的细胞作为催化剂,应用细胞固定化技术进行生产烟酰胺(中国专利cn1154364a),采用一次性配置3-氰基吡啶水溶液进行腈水合酶的催化反应,产品烟酰胺的浓度为10~20%,远低于本实施例2~4的产品烟酰胺浓度为40%(即400g/l)。
对比例5
(1)菌种活化:采用接种环取菌种管内的-80℃甘油管保藏的表达锰氧化橙单胞菌si859a(aurantimonasmanganoxydanssi859a)来源腈水合酶的基因工程菌e.colibl21(de3)/pet-30a(+)-penhase-1229菌种在lb-kan-琼脂固体培养基表面(平皿或茄子瓶)上划线,平皿倒置于37℃恒温培养箱,培养12小时;
(2)种子培养:将活化后的菌种再接种到50ml的一级种子培养基中,37℃下振荡培养12小时,得到一级种子液;然后,将一级种子液移入500ml二级种子培养基中,35℃下振荡培养4小时,得到二级种子液;
其中,一级种子培养基为lb培养基,10g/l蛋白胨,5g/l酵母抽提物,10g/l氯化钠,5m氢氧化钠溶液调节ph值至7.0,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。二级种子培养基为:12g/l蛋白胨,24g/l酵母抽提物,16.43g/lk2hpo4·3h2o,2.31g/lkh2po4,5.04g/l甘油,121℃灭菌20min,接种前加入卡那霉素浓度为50μg/ml。
(3)补料分批发酵:
(a)细胞快繁阶段:先配制7l基础培养基置于发酵罐中,初始ph=6.56,121℃灭菌20min,降温到35℃,ph变为6.21,用氨水将ph调到7.0,将550ml二级种子液接入发酵罐,进行发酵,控制发酵温度37℃,通过通气与搅拌控制溶氧维持在20~30%之间。另配4l补料培养基,121℃灭菌20min,冷却到室温后,待用。待基础培养基营养物质耗尽(表现为溶氧急剧上升),开始补料,补料速率按照实施例2的方法计算和控制。
上述基础发酵培养基为:20g/l甘油,8g/l蛋白胨,12g/l酵母抽提物,17.1g/lna2hpo4·12h2o,3.0g/lkh2po4,0.5g/lnacl,1.0g/lnh4cl和0.6g/lmgso4,卡那霉素浓度为50μg/ml;
上述补料培养基为:500g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
(b)产酶阶段:发酵12h后,测得发酵液的od600=76.7,将发酵液温度降至20℃,加入诱导剂乳糖5g/l,继续发酵到58h,期间溶氧维持在20~30%;补料速率为0.07l/h。所述补料培养基为:500g/l甘油,20g/l蛋白胨,10g/l酵母抽提物。
发酵结束后,得到od600=190,细胞干重为62.5g/l,腈水合酶酶活为5345u/ml发酵液。
(4)将发酵液进行4000rpm离心30min,弃上清,得到基因工程菌菌泥。测定菌泥单位酶活为15450u/g。
在5l的圆底烧瓶中,加入含1.0l纯水,加入6.0g菌泥,用氨水调ph=8.0,一次性加入200g/l(20%)的3-氰基吡啶。20℃水浴,100rpm磁力搅拌,开始反应,定期取样,分析过程中底物和产物的情况。检测结果如下表所示:
反应1h后基本停滞,原料3-氰基吡啶不能反应完全。
序列表
<110>浙江大学
<120>一种烟酰胺的生产工艺
<160>4
<170>siposequencelisting1.0
<210>1
<211>1429
<212>dna
<213>博得特氏菌(bordetellapetriidsm12804)
<400>1
atgctcgaagttctttgcatggggttgcgccgggagcgcaatctgcaaggtggcattggc60
cttcagtgtcgatgccgagttgaagtcgctgtaccccttttttcaaccacacaggagaac120
cgcaccatggggcaatcacacacacacgaccaccatcacgacgggtaccaggcaccgcct180
gaagacattgcgctgcgggtgaaggccttggagtctctgctcgtcgagaaaggtttggtc240
gacccggcggccatggacgctgtggtccaaacctatgaacacaaggtgggccctcggaac300
ggcgccaaggttgttgccaaggcctgggtggacccggcatacaaggcgcgcttgctggcg360
aatggcagcgctggcattgccgaactgggcttctctggagtgcagggagaagacacagtc420
attctggaaaacacccccgccgtgcacaacgtcttcgtctgcaccctgtgctcttgctac480
ccatggccgtcactgggcttgccgccggcctggtacaaggccgcaccctaccggtcgcgc540
atggtgagcgacccgcgtggggtcctggcggagttcggtttggtgatccccaccaacaag600
gaaatccgcgtctgggacaccacagccgaattgcgctacatggtgctgccggaaaggccc660
gcaggaaccgaaggctacagcgaagaacaactggccgaactcgtcacccgcgattcgatg720
atcggcactggcctgcccacccaacccaaaccttcccactaaggagatcatcatgaacgg780
cattcacgacactggcggagcacatggttatggcccggtttacagggagccgaatgagcc840
catccttcatggcgagtgggagggtcgggtcctggcattgtttccggcgcttttcgcaaa900
cggcaacttcaacatcgatgagtttcgacacggcatcgagcgcatgaaccccatcgacta960
cctgaagggaacctactacgaacactggatccattccatcgaaaccttgctggtcgaaaa1020
gggtgtgctcacggcaacggaactcgcgaccggcaaggcatctggcaagacagcgacacc1080
ggtgctgacgccggtcatggtggacggactgctcagtaacggagcttctgccgcccgcaa1140
ggagggggtgcaggcgcggttcgctgtgggcgacaaggttcgcgtcctcaacaagcaccc1200
ggtgggccatacccgcatgccgcgctacacgcggggcaaagtggggacagtggtcatcga1260
ccatggtgtgttcgtgacgccggacaccgcggcacacggaaagggcgagcacccccagca1320
cgtttacaccgtgagtttcacgtcggtcgaactgtgggggcaagacgcttcctcgccgaa1380
ggacacgattcgcgtcgacttgtgggatgactacctggagccagcgtga1429
<210>2
<211>1701
<212>dna
<213>锰氧化橙单胞菌(aurantimonasmanganoxydanssi859a)
<400>2
atgacgggatcgcacggcagggacggtgatcaccacggccatcaccacgaccgtgatcac60
gacaaccatctcgacccgatgaccgcgcgggtcatggcgctggagacgatcctcaccgaa120
aagggcatggtcgacccggacgccctcgacgccatcatcgacacctacgagaccaaggtc180
gggccgcgcaacggcgccagcgtcgtcgccaaggcctggagcgacccggactacgccgac240
tggctggcgcgcgacgcaaccgccgccattgcctcgcttggcttcaccggccgccagggc300
gagcacatgcaggcggtgttcaacaccccggagcgccacaacctcgtcgtctgcaccctg360
tgctcctgctatccgtggtcagtgctcggcctgccgccggtctggtacaagtcgccgccc420
tatcgctcgcgcgccgtctccgatccgcgcggcgtcctgcgcgaattcggcgtcgcgctg480
ccggacggcgtctcggtgcgagtctgggactccaccgccgagctgcgctacctcgtcgtg540
cccgagcgcccggcgggtaccgagggactgtccgaggcggcgctggcggcgctcgtcacc600
cgcaagtccatgatcggtaccgagcgtgacctgagcccgcatgccgcgccggagacggcg660
gcatgaacggcccccacgatctcggcggtcggcacggcttcgggccgatcgcgccgaagg720
cagacgagccgctgttccatgcgccctgggagcgccgcgccctcgccctgacgctcgcgc780
cggtgcgatgggccattggtcgatcgacgaaagccgcgccgcccgtgaggatcgccaccc840
ggccgactattacggttcgtcctattacgagatctggacccaagggccttgagacgctgc900
tcgtgcgccacggcctcatcagccatcgcgaattgcgcgccgggcggcccctcgacctga960
ccgtgccgccgaaccgcatcgtgaaggccgatgccgtcgcgccggcccttgccaagggca1020
gtccggccaaccgcgatcccgaaggcagcacgcccgttttcgcgccgggcgacagggtcc1080
gcacgctgaacctgcagccgcgccatcacatccgcctgcccgcctatgcccgcgagaagg1140
ccggcaccatcgaaaccgttcagggtttccatgtcttcgcggatgccagcgccaagggcg1200
acgaccatgtcgcgcactggctctacacggtggtcttcgacgcattcacgctgtggggcg1260
gcgacgcttcgcccaacgacaccgtctccatcgatgcctgggagccctatcttgcgcacg1320
cctgagaccggcatcgccgcatcgcccggcctgccacgcgatgcggcgggtgaacccgtc1380
ttcttcgcgccctggcaggccaaggccttcgccatgaccgtcgcgctgaacgagcgcggc1440
atccttgcctggaccgactgggctgccgcgctcggccgcgcctgcgccagcctgcccgcc1500
gccggcccctcgcccgaagcaacagcggatgcctatttcaccgcatggctcgtcgcgctc1560
gaagaaatcctcacggcacgggcgctggtaagcgccaatgccgtcgacgcggcgcaggcc1620
gtctggcaccgcgccgccgaggccacgccccacggcacgccgatccgcttcgaggccggc1680
ctgccgaacccacacgactga1701
<210>3
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>3
cgggatccatgacgggatcgcacggcag28
<210>4
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>4
cccaagctttcagtcgtgtgggttcggcagg31
- 还没有人留言评论。精彩留言会获得点赞!