一种基于花菁的有机化合物及其应用的制作方法
本发明涉及单胺氧化酶的检测,具体地说是一种基于花菁的有机化合物及其应用。
背景技术:
单胺氧化酶(monoamineoxidase,mao,ec1.4.3.4)是一种位于线粒体外膜上的黄素酶,在fad辅酶的协同作用下催化氧化生物体内产生的胺,包括神经传递素多巴胺、去肾上腺素(ne)、血清素(5-ht)、酪胺、苯乙胺(pea)以及神经毒素1-甲基-4-苯基-1,2,3,6-四氢嘧啶(mptp)等。由于被不同的基因编辑,mao分为两种亚型:mao-a和mao-b,其对底物或抑制剂选择性、细胞分布、免疫特异性等不同。mao-a和mao-b维持生物胺的稳态,包括一级胺、二级胺三级胺以及一些长链的二胺类。mao-a主要氧化的胺类有:5-羟色胺、去甲肾上腺素、肾上腺素。mao-a基因的缺陷会导致brunner症状,即智商低于平均水平,有问题的冲动行为、睡眠障碍以及情绪波动。除此之外,这些酶含量的紊乱也会引起神经性疾病和神经变性疾病的神经元功能障碍。因此,通过测定生物体内mao-a的含量,可实现进一步的对某些疾病的早期诊断和治疗。实现实时地、特异性地检测不同亚型的单胺氧化酶具有十分重要的意义。
目前,用于检测mao-a的方法包括:分光光度法、放射性法、酶联免疫法、荧光分析法等。在上述方法中,荧光法相比较而言更加具有吸引力,不仅简单易行,价格实惠,便于操作,具有高灵敏度、高选择性的特点,而且可以实现活细胞内mao-a“原位可视化”检测,从而对其在生命体内进行“实时在线”观测。huiminma等公开了一类用于检测mao-a的比率型荧光探针(huiminma.analyticalchemistry,2015,88(2):1440-1446.),与mao-a作用后荧光发生变化从而检测mao-a的存在。但该探针反应前只能在紫外光区检测mao-a,不能有效避免生物自体荧光的干扰,同时紫外光对生物体光漂白作用很大,易于损伤生物样品。因此,开发具有良好选择性,可在近红外区进行联动检测生物体系中mao-a的荧光探针具有重要意义。
技术实现要素:
本发明目的在于提供一种基于花菁的有机化合物及其应用。
为实现上述目的,本发明采用技术方案:
一种基于花菁的有机化合物,基于花菁的有机化合物,结构式如式ⅰ所示,
一种基于花菁的有机化合物的应用,:所述式ⅰ所示的基于花菁的有机化合物在定性的检测细胞或生物体内、外的mao-a中的应用。
所述式ⅰ所示的基于花菁的有机化合物在比率检测线粒体外膜上单胺氧化酶a(mao-a)的应用。
一种荧光探针,探针为结构式如式ⅰ所示基于花菁的有机化合物。
一种荧光探针的应用,所述探针在定性的检测细胞或生物体内、外的mao-a中的应用。
所述探针在比率检测线粒体外膜上单胺氧化酶a(mao-a)的应用。
本发明的有益效果:
本发明基于花菁的有机化合物用于作为比率检测细胞或生物体内的mao-a的荧光探针化合物,其在mao-a存在下发生氧化脱氨基作用,使探针有明显的荧光变化,紫外吸收亦发生明显的变化,进而可以用于生物体内mao-a的检测。本发明化合物用作荧光探针,可用于细胞内mao-a进行检测,还可对细胞内的线粒体进行定位,这对深入研究mao-a在生物体内催化单胺类物质、催化方式以及催化产物的产生、聚积等过程的动力学机理,尤其是在研究mao-a在生物体中的生理作用以及酶含量地失常对各种疾病的作用有重要的生物医学意义。
本发明比率检测mao-a荧光探针的化合物,在mao-a存在时,紫外吸收亦发生明显变化,可同时用紫外分光光度计及肉眼进行检测。这类化合物作为荧光探针可用于细胞内外mao-a水平的检测,这对深入研究mao-a在生物体内催化单胺类物质的方式以及催化产物的产生、聚积等过程的动力学机理,尤其是在研究mao-a在生物体中的生理作用以及催化产物对生物体的影响有重要的生物学意义。
附图说明
图1为本发明实施例提供的采用的荧光探针对mao-a检测前后紫外吸收变化图。
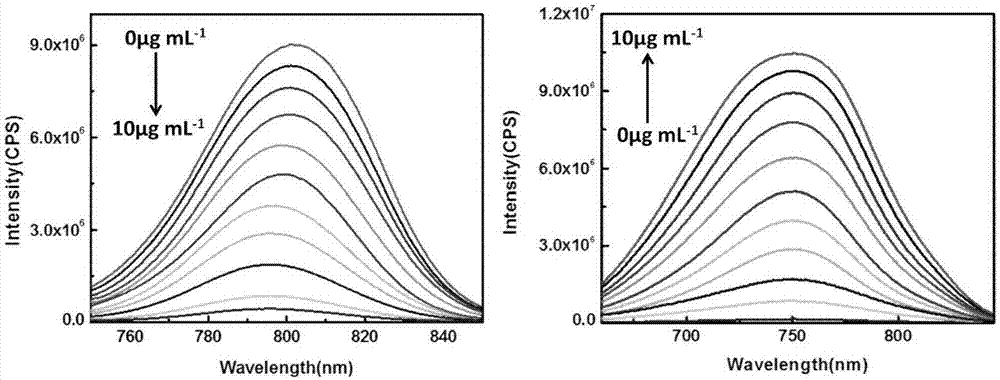
图2为本发明实施例提供的采用的荧光探针对mao-a检测前后荧光变化图。
图3为本发明实施例提供的所采用的荧光探针对mao-a的选择性示意图;其中,横坐标从左至右依次为:空白对照、氯化镁、氯化铁、硫酸锌、葡萄糖、精氨酸、丝氨酸、谷胱甘肽、尿素、基质金属蛋白酶-2、基质金属蛋白酶-9、基质金属蛋白酶-14、磷酸水解酶、单胺氧化酶b、mao-a。
图4为本发明实施例提供的采用荧光探针用于检测细胞线粒体内mao-a的共聚焦显微镜成像图,其中a代表荧光探针在λem=770–810nm(λex=730nm)的成像;b代表荧光探针在λem=700–740nm(λex=650nm)的成像;c代表商业化线粒体染料在细胞中的成像图;d代表商业化细胞核染料在细胞中的成像图;e代表b,c,d的叠加图。
具体实施方式
下面实施例用于进一步说明本发明,但本发明不限于实施例。
本发明比率检测mao-a的荧光探针的化合物,在mao-a的存在下,响应基团作为mao-a的底物,在fad辅酶的作用下,通过mao-a催化的甲氨基氧化成醛(通过亚胺中间体)丙醛部分通过β消除和一个co2的自发释放,荧光团被释放。本发明用于比率检测mao-a,在mao-a存在下对应的荧光波长发生明显位移,可用于mao-a的检测,并可大大降低外部检测条件的干扰,提高检测精度。
具体为:
基于花菁的有机化合物结构式为:
式ⅰ化合物与待测定生物体内外中的mao-a结合,通过mao-a催化式ⅰ化合物的甲氨基使其氧化成醛(通过亚胺中间体)丙醛部分通过β消除和一个co2的自发释放,荧光团被释放,得到结构式ii的化合物。从而导致式ⅰ化合物的荧光,紫外吸收均发生改变,进而可以用来进行mao-a的定性检测。
实施例1
基于花青的式ⅰ有机化合物的制备:
(1)化合物一的制备
在氩气保护下,(4-溴丁基)三苯基溴化磷(14.35g,30mmol)和叠氮钠(3.9g,60mmol)溶于50mldmf中。90℃条件下,搅拌,过夜。溶液的颜色由无色到浅黄色到红色。将反应瓶冷却到室温,加入50ml二氯甲烷,直到产生大量的沉淀。过滤,收集滤液。收集的滤液经乙酸乙酯与水1:1(v/v)萃取,收集有机相,旋蒸。旋蒸后的产物置入圆底烧瓶中,安装回流装置,搅拌,加入约7.5毫升的二氯甲烷使其完全溶解,加热至溶液温度约40℃,回流。溶液微沸时,加入乙酸乙酯,使溶液有白色晶体析出又消失,直至浑浊出现时,再加入二氯甲烷,如此重复3次,冷却,析出晶体,得到化合物一。
1hnmr(400mhz,cdcl3)δ(ppm):7.89-7.85(q,6h),7.82-7.79(t,3h),7.73-7.71(m,6h),3.98-3.92(m,2h),3.46-3.44(t,2h),2.06-2.01(m,2h),1.76-1.74(m,2h).13cnmr(100mhz,cdcl3,ppm)δ134.98,133.72,133.64,130.52,130.42,118.54,117.86,50.59,29.19,29.06,22.34,21.93,19.84,19.80.gc-ms(api-es):m/zc22h23n3p+[m]+calcd:360.1624,found:360.4022.
(2)化合物二的制备
在氩气保护下,将抗坏血酸钠(0.01m,1ml)和cuso4·5h2o(0.01m,1ml)的水溶液混合,得到含有铜(i)催化物质溶液。将商业花菁染料(63.6mg,0.1mmol),化合物一(39.6mg,0.11mmol)和dipea(1.5mg,0.01mmol)加入到6.0ml四氢呋喃中,通过恒压滴液漏斗滴加到上述溶液。将混合物在氮气保护下,在25℃下进一步搅拌24小时。真空除去溶剂,所得蓝色固体残余物用梯度洗脱剂ch2cl2和ch3oh(100:0-85:15,v/v)的硅胶色谱纯化(200-300目),收集洗脱组分即为化合物二。
1hnmr(400mhz,cd3od)δ(ppm):8.07(s,2h),7.90-7.88(m,6h),7.38-7.37(d,3h),7.32-7.29(m,6h),7.10-7.08(t,3h),7.04-7.00(t,5h),5.75-5.72(d,2h),5.25(s,5h),5.12(s,3h),4.55-4.52(t,3h),4.14-4.08(m,1h),3.43-3.37(m,1h),3.10-3.08(m,2h),2.97-2.93(m,3h),2.69-2.64(m,3h).2.20-2.18(m,3h),2.03(s,1h),1.85-1.81(m,1h),1.76-1.75(d,2h),1.50-1.46(m,1h),1.29-1.21(m,12h),1.05-1.00(m,2h),0.94-0.92(m,2h).13cnmr(100mhz,cd3od)δ(ppm):169.97,166.81,159.96,157.15,143.82,140.03,137.84,134.94,133.49,133.41,130.26,130.16,128.00,127.91,124.09,122.39,121.69,118.63,117.94,114.55,108.27,93.21,93.08,62.27,61.06,52.30,49.95,38.33,36.31,33.07,30.30,30.17,29.24,29.11,27.70,27.56,21.08,20.93,20.66,20.52,19.49,19.46,19.09,10.27,7.87,6.34.gc-ms(api-es):m/zc66h73n6op+[m]+calcd:996.557,found:498.6522.
(3)化合物三的制备
在氩气保护下,将3-甲氨基-1丙醇(0.15g,1.7mmol)溶于二氯甲烷(1.6ml)中,逐滴加入三乙胺,直至检测所得溶液为碱性,所得溶液搅拌15min,待用;
二碳酸二叔丁酯(0.34g,1.6mmol)溶于二氯甲烷(5.0ml)通过恒压滴液漏斗逐滴加入上述碱性混合物中,滴加的时间为1h,室温反应,过夜。用饱和nahco3水溶液洗涤3次,有机相用无水naso4干燥过夜。目标化合物三为无色粘稠液体,浓缩后直接进行下一步合成。
1hnmr(400mhz,cd3cl3)δ(ppm):1.46(s,9h),1.75(q,2h),2.96(t,2h),3.31(s,3h),3.55(t,2h),4.39(s,1h).13cnmr(100mhz,cd3od,ppm)δ29.4,38.7,49.3,59.4,79.8,154.3.
(4)化合物四的制备
在氩气保护下,冷阱控制反应温度在0℃以下,将化合物二(0.10g,0.1mmol)和三光气(12.0mg,0.04mmol)溶于干燥的二氯甲烷(5.0ml)所得溶液搅拌3min,待用;
三乙胺(12.1mg,0.12mmol)溶于二氯甲烷(2.0ml)通过恒压滴液漏斗逐滴滴入混合溶液中,溶液全部由蓝色变为绿色,用饱和nahco3水溶液淬灭反应,减压浓缩,所得产物和化合物三(56.7mg,0.3mmol)溶于干燥的二氯甲烷(5.0ml)所得溶液搅拌3min,三乙胺(30.3mg,0.3mmol)溶于二氯甲烷(2.0ml)通过恒压滴液漏斗逐滴滴入混合溶液中,开始反应温度为0℃以下,滴加完毕,升至室温,反应过夜。真空除去溶剂,所得绿色固体残余物用梯度洗脱剂ch2cl2和ch3oh(100:0-85:15,v/v)的硅胶色谱纯化(200-300目),收集洗脱组分即为化合物四。
1hnmr(400mhz,cd3od)δ(ppm):8.17(d,2h),7.39-7.35(m,24h),7.05-7.02(d,1h),6.98-6.89(d,1h),6.82(m,4h),6.32(s,1h),5.75(s,1h),5.23(d,2h),4.48(t,2h),4.13-4.07(m,6h),3.81(s,3h),3.28(t,2h),2.85(m,2h),2.36(m,4h),1.84-1.79(m,8h),1.41-1.37(m,25h).13cnmr(100mhz,cd3od)δ(ppm):173.1,172.8,156.3,152.8,149.1,146.6,144.6,142.3,141.2,137.0,134.0,132.8,130.7,120.0,118,114,111,79.5,72.3,60.1,55.0,51.1,45.0,38,36.8,35.1,34,31.5,24.7,16.4,13.8,7.84,6.35.gc-ms(api-es):m/zc75h88n7o5p2+[m]+calcd:1197.66,found:599.34.
(5)化合物五的制备
在氩气条件下,保持反应体系温度为0℃,将化合物四(0.3g,0.25mmol)溶解在二氯甲烷(1.5ml)中,tfa(100ul)溶于二氯甲烷(0.5ml)通过恒压滴液漏斗逐滴加入,室温下搅拌30min。所得的绿色溶液洗涤,真空除去溶剂,所得固体残余物用梯度洗脱剂ea和ch3oh(100:0-85:15,v/v)的硅胶色谱纯化(200-300目),收集洗脱组分即为式ⅰ所示有机化合物五。
1hnmr(400mhz,cd3od)δ(ppm):7.81(s,1h),7.42-7.38(m,18h),7.16-7.01(m,4h),6.80-6.72(m,9h),6.41(s,3h),6.36-6.31(m,2h),5.78(s,1h),5.54(s,1h),5.14(s,1h),4.76(t,2h),4.43(q,2h),3.88(s,3h),3.71(t,2h),2.94(m,4h),2.33(m,4h),1.95(m,2h),1.81(m,6h),1.65(m,2h),1.45(m,6h),1.35(m,8h).13cnmr(100mhz,cd3od)δ(ppm):178.3,157.4,150.1,149.5,148.1,147.7,145.3,140.2,135.5,134.3132.5,130.1,129.8,128.5,127.6,123.2,121.6,110.6,106.5,98.5,78.6,65.1,57.6,53.2,45.5,35.4,19.8,14.2.gc-ms(api-es):m/zc70h81n7o3p+[m]+calcd:1097.61,found:548.78.
实施例2
将制备所得式ⅰ化合物作为探针应用于细胞、组织和器官进行对mao-a的检测,模拟生理条件,以下各项实验均在ph=7.4条件下进行(hepes缓冲溶液,浓度为40mm),探针的浓度采用10μm。
上述制备所得化合物式ⅰ对mao-a的紫外响应:
ph采用hepes缓冲溶液控制。于10ml比色管中加入式ⅰ化合物,保证其最终的浓度为10μm,再加入40mmhepes,然后加入mao-a,加入超纯水10ml定容后,使mao-a的浓度分别为0μgml-1,1μgml-1,2μgml-1,3μgml-1,4μgml-1,5μgml-1,6μgml-1,7μgml-1,8μgml-1,9μgml-1,10μgml-1。摇匀溶液,平衡60min后,将上述工作液加入比色皿中测定紫外吸收光谱。紫外吸收光谱在检测mao-a前后的变化如图1所示。式ⅰ化合物可用于实现生物体内的mao-a的检测。
同时,本发明实施例所提供的探针与mao-a反应后的产物式二结构如下:
实施例3
式ⅰ化合物对mao-a的荧光响应:
ph采用hepes缓冲溶液控制。于10ml比色管中加入式ⅰ化合物,保证其最终的浓度为10μm,再加入40mmhepes,然后加入mao-a,加入超纯水10ml定容后,使mao-a的浓度分别为0μgml-1,1μgml-1,2μgml-1,3μgml-1,4μgml-1,5μgml-1,6μgml-1,7μgml-1,8μgml-1,9μgml-1,10μgml-1。摇匀溶液,平衡60min后,将上述工作液加入荧光皿中测定荧光光谱光谱。荧光光谱在检测mao-a前后的变化如图2所示。式ⅰ化合物可用于实现生物体内的mao-a的检测。
由图2表示随mao-a浓度的变化体系荧光强度的变化,表明随mao-a浓度的增加,体系760-850nm波段的荧光强度明显减弱,690-810nm波段的荧光强度明显增强。
实施例4
式ⅰ化合物对mao-a的特异性的选择:
ph采用hepes缓冲溶液控制。取多个10ml比色管,并在每个10ml比色管中加入10μm式ⅰ化合物,再加入40mmph为7.4的hepes缓冲液,然后分别加入如图4所示,待测物依次为:空白对照、氯化钾、氯化镁、氯化铁、硫酸锌、葡萄糖、vc、精氨酸、丝氨酸、谷胱甘肽、尿素、mmp-2、mmp-9、mmp-12、磷酸水解酶、mao-b、mao-a。最后用超纯水定容到10ml。摇匀溶液,25℃下平衡60min后,将各个比色管中工作液分别倒入到荧光皿中测定荧光光谱。式ⅰ化合物对mao-a的特异性的选择如图3所示。并由图3可知式ⅰ化合物对mao-a具有很好的选择性。
实施例5
式ⅰ化合物用于细胞线粒体内mao-a的检测
人肝癌细胞smmc7721细胞按照americantypetissueculturecollection规定进行培养。10.0um式ⅰ化合物孵育smmc7721细胞50分钟,用培养基洗涤3次,置于共聚焦荧光显微镜下拍照,结果如图4a,4b所示,其中4a使用的激发波波长为730nm,收集波长范围为770-810nm,4b使用的激发波波长为650nm,收集波长范围为700-740nm;然后加入1umrhodamine123(商品化线粒体染色染料)孵育smmc7721细胞10分钟,用培养基洗涤3次,置于共聚焦荧光显微镜下拍照,结果如图4c所示;然后加入1umhoechest(商品化细胞核染色染料)孵育smmc7721细胞10分钟,用培养基洗涤3次,置于共聚焦荧光显微镜下拍照,结果如图4d所示;图4e是叠加图,表明探针主要对线粒体染色。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。作为荧光染料是本发明新化合物的一种用途,不能认定本发明的化合物仅用于荧光染料,对于本发明所属技术领域的普通技术人员来说,在基于本发明化合物用作荧光染料的相同作用机理的考虑下,还可以做出若干简单推理,得出本发明的化合物的其他应用用途,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!