一种在大肠杆菌中生产衣康酸的方法与流程
本发明涉及基因工程领域,更具体地涉及一种在大肠杆菌中生产衣康酸的方法。
背景技术:
衣康酸(甲叉丁二酸、亚甲基琥珀酸)是一种不饱和二元羧酸,是化工领域的重要工业原料和添加剂,作为构造模块被广泛应用于生产塑料、化纤、超吸附剂、乳胶、防垢剂等方面。衣康酸作为一种可再生材料,已得到了越来越多的关注。2004年,衣康酸被美国能源部评选为最具发展潜力的12种生物基平台化合物之一。目前,全世界衣康酸的产能为5万吨/年,还面临至少3万吨的缺口,且衣康酸可以替代丙烯酸和甲基丙烯酸用于可降解塑料的生产,其未来需求量将会继续快速增长,是一种具有广阔应用前景的重要生物质来源有机酸。
目前,国内外工业化生产衣康酸的主导方法是土曲霉发酵法。生物合成衣康酸的主流学说认为是通过糖酵解和tca循环的路线,即以柠檬酸和乌头酸为代谢中间产物,后者通过乌头酸脱羧酶cada脱羧形成衣康酸。然而,与其他有机酸发酵生产相比,目前国际上利用土曲霉发酵生产衣康酸的发酵单位仍然较低,其原因在于:1)土曲霉发酵时间长,时空产率不高;2)在真菌细胞中acna定位于线粒体中,而cada则是定位于胞质中,两个酶定位的不同使两个酶的底物与中间产物的扩散和反应变得更为困难。因此,有研究者选择大肠杆菌作为生产衣康酸的宿主菌,其优点在于:1)生长周期短,时空产率高;2)遗传背景清楚,基因改造较为容易,且不存在不同酶定位在不同细胞器的问题;3)大肠杆菌具有很好的有机酸耐受性,具备生产较高浓度衣康酸的潜力。但目前这些研究还只是关注采用传统的生物技术手段,如提高关键酶的表达和代谢途径改造等方面。虽然可以在大肠杆菌中达到克级的发酵水平,但距离生产要求还有一定的差距。
多酶组装技术是近些年发展起来的一种可以显著提高多酶级联催化效率的方法。多酶级联反应体系可以解决底物在多个酶之间的传递问题,减小传质距离,增加局部范围内底物的浓度,缩短底物的转运和反应时间,提高各单一酶的催化效率,已越来越多地应用于需多步单酶催化完成的生化反应中。其中使用到的相互作用多肽或蛋白广泛存在于自然界,而且其类型丰富多样,分子量从几kd到几百kd不等,相互作用的方式也各有特点,适合作为相互作用的装配元件,例如本发明中使用的源自后生动物细胞的pdz相互作用蛋白对和源自小鼠信号蛋白的shm相互作用蛋白对。人工构建高效的异源多酶级联反应系统也是合成生物学的主要研究内容和研究热点之一。
将衣康酸合成途径中的关键三个酶进行组装,构建具有一定区室化效应的高效多酶体方面目前还没有研究报道。如果能在大肠杆菌中将衣康酸合成路径中的关键三个酶都组装在一起,形成一个结构紧密、排列有序并具有一定区室化微环境的人工多酶体,使衣康酸合成途径与tca循环的部分路径紧密连接,则可大幅减少中间体—柠檬酸和顺式乌头酸的传质距离和运输时间,增加多酶体微环境内的底物浓度,使产生的中间物能即时地被下一个酶所催化,提高级联催化反应效率,增强衣康酸合成路径代谢流,使平衡朝衣康酸合成方向进行,将有望使衣康酸的时空产率得到大幅提高,具有广泛的应用前景和工业价值。
技术实现要素:
本发明的目的是提供一种在大肠杆菌中生产衣康酸的方法,从而解决现有技术中生产衣康酸的方法还无法满足高产量工业化生产的问题。
为了解决上述技术问题,本发明采用以下技术方案:
提供一种在大肠杆菌中生产衣康酸的方法,所述方法是一种同时利用多酶组装技术与代谢途径改造技术实现在大肠杆菌中高效生产衣康酸的方法,具体地,所述方法包括以下步骤:1)将合成衣康酸的三个关键酶在细胞内进行自组装形成多酶复合体,所述三个关键酶包括:柠檬酸合酶glta、顺式乌头酸酶acna和乌头酸脱羧酶cada;2)利用crispr/cas9技术对大肠杆菌进行代谢途径改造;以及3)将所述多酶复合体转入经过代谢途径改造的大肠杆菌构建一种大肠杆菌工程菌,通过发酵进行衣康酸的生产。
所述步骤1)包括利用两对相互作用蛋白sh3/sh3lig和pdz/pdzlig融合柠檬酸合酶glta、顺式乌头酸酶acna和乌头酸脱羧酶cada,分别形成glta-pdz-sh3,acna-pdzlig,cada-sh3lig。
所述步骤2)是利用crispr/cas9技术对大肠杆菌敲除部分糖酵解过程,三羧酸循环以及副产物支路上的基因。
利用crispr/cas9技术对大肠杆菌的代谢途径改造包括抑制乳酸副产物通路、甲酸副产物通路、乙酸副产物通路,以及增强pepc途径和pep途径。
在所述代谢途径改造中敲除的基因包括:乳酸脱氢酶基因ldha,丙酮酸甲酸裂解酶pflb,丙酮酸氧化酶基因poxb,异柠檬酸裂解酶基因icl和异柠檬酸脱氢酶基因icd中的至少一种。
在所述代谢途径改造中敲除的基因同时包括:乳酸脱氢酶基因ldha,丙酮酸甲酸裂解酶pflb,丙酮酸氧化酶基因poxb,异柠檬酸裂解酶基因icl和异柠檬酸脱氢酶基因icd。
所述大肠杆菌工程菌的发酵条件为:采用基本培养基,ph7.0,30℃下发酵培养40~100h。
所述基本培养基的成分包括:6.8g/lna2hpo4,3g/lkh2po4,0.5g/lnacl,1g/lnh4cl,0.49g/lmgcl,0.1mmol/lcacl2,1mg/l硫胺素,30g/l的葡萄糖,4g/lα-酮戊二酸,1000×微量元素(2.86gh3bo3,1.81gmncl2·4h2o,0.222gznso4·7h2o,0.39gna2moo4·2h2o,0.79gcuso4·5h2o,0.049gco(no3)2·6h2o)。
所述大肠杆菌工程菌的发酵包括以下步骤:1)首先在37℃,300~500rpm条件下培养15~20h使菌体生物量增长;2)15~20h后,将温度改为30℃,550rpm发酵,流加4mnaoh实时控制发酵液ph=6.7,不断通入无菌空气使溶氧控制在30%以上;3)每隔6h取样,测量葡萄糖浓度,当葡萄糖浓度低于10g/l时,手动补加300g/l葡萄糖,52.5g/l(nh4)2so4,4g/lα-酮戊二酸,使得葡萄糖浓度不低于20g/l;以及4)发酵100小时后,测得葡萄糖消耗完毕,发酵结束。
本实验室之前的研究表明,在大肠杆菌中将衣康酸合成途径中的三个关键酶中的两个酶-acna与cada进行组装,其催化柠檬酸生成衣康酸的效率和产量都有显著提高。但是,仍然没有达到工业生产的水平,因此本发明提供了一种新的思路,即同时使用多酶组装与代谢途径改造两种策略,将衣康酸通路构建在大肠杆菌中,组装关键酶并调节代谢通量的流向,从而达到高效生产的目的。本发明的主要思路具体如下:
(1)在计算机模拟建立glta、acna和cada的3d结构模型的基础上,根据同源建模分别在三个酶的结构表面寻找与pdz或shm的结构域或配体融合的合适位点(或区域),以及选择恰当的链接元件,使得它们在与pdz或shm蛋白对融合(末端融合或是插入融合)之后,结构和活力不发生大的改变,并保持相互作用元件的结构完整并充分暴露在融合蛋白表面,易于实现相互识别和组装,且在组装后三个酶的活性中心之间呈现出一定的距离和朝向。依据级联反应路线及寡聚酶自聚特性,科学设计组装方案,经过融合蛋白的建模和分析,并筛选出最佳的融合方式。
(2)根据获得的理性设计方案,分别构建质粒,实现glta、acna和cada分别与pdz或shm的结构域或配体的融合以及相互作用元件的串联组合融合,分别表达、纯化并考察融合对各酶的活力、稳定性等的影响,进一步筛选较为理想的融合方式和组合方式,并获得高活性的融合蛋白,并在体外进行组装验证与表征。利用非变性电泳、分子排阻色谱、激光粒径测定、原子力显微镜(afm)、扫描电镜(sem)和动态光散射等技术,结合催化活性检测,考察各酶的排列顺序、比例、融合方式等对区室化的构建、组装过程以及级联催化活性的影响,确定最佳组装工艺。
(3)研究不同类型(柔性,刚性)、不同长度(1nm~30nm)的连接短肽以及不同的连接位点(或区域)对区室化的形成、空间结构(几何构型)和多酶体的活性的影响。同时考察组装前后,底物及中间产物在三个酶之间传递效率的变化,以及三酶之间的距离、比例以及酶活中心朝向对底物和中间产物传递效率的影响,建立反应动力学模型,考察并验证多酶体的区室化效应,揭示其高效级联催化反应机理。
(4)根据胞外组装研究所确立的最佳组装方式,通过融合蛋白在大肠杆菌中的共表达,实现三个酶在胞内的无支架区室化自组装,并考察不同的表达载体以及组装基元表达量、比例、串联组合方式等对形成的多酶体的结构及催化活性的影响,确定最优化的胞内组装模式与条件。利用分子荧光互补技术和激光共聚焦测定,考察酶的表达、相互作用元件的组合方式对多酶自组装的影响,监测自组装过程以及在此过程中形成区室化多酶体的动态变化、组装过程中和组装完成后多酶体在细胞内的分布情况等,揭示胞内多酶体的形成过程和机制。
(5)利用crispr/cas9技术对宿主菌-大肠杆菌进行基因编辑,改造有可能影响衣康酸生成的代谢通路。涉及糖酵解过程及tca循环中的相关基因,包括抑制乳酸副产物通路、甲酸副产物通路、乙酸副产物通路等,使代谢途径按照最优的方向进行,减少c原子的损耗,从而增强中间产物柠檬酸以及顺式乌头酸的浓度,达到高产衣康酸的目的。
(6)通过测定细胞内底物(葡萄糖)、中间产物(柠檬酸,顺式乌头酸)、产物(衣康酸)以及副产物(甲酸、乙酸、乳酸、琥珀酸、异柠檬酸等)含量的变化,研究组装及代谢途径改造对衣康酸合成路径和代谢流的影响,考察影响衣康酸合成的条件和因素,进一步阐明大肠杆菌中衣康酸合成的路径与分子机制,并通过调控各酶的表达量及形成多酶体的量来调控中间产物的代谢途径,实现tca循环与衣康酸合成的最佳平衡,达到衣康酸合成路径的最优化。
(7)对经多酶自组装及代谢途径改造优化所获得的大肠杆菌工程菌,进行摇瓶及上罐发酵,确定最优发酵条件,为衣康酸工业化生产提供依据。
总之,根据本发明,公开了一种通过产衣康酸相关酶的自组装与代谢途径改造技术相结合,在大肠杆菌中高效生产衣康酸的方法。将合成衣康酸的关键三个酶:柠檬酸合酶glta、顺式乌头酸酶acna和乌头酸脱羧酶cada作为主要装配对象,通过理性设计选择并利用多肽结构元件将三个酶分别与两对相互作用蛋白sh3/sh3lig和pdz/pdzlig进行串联组合融合,利用蛋白对的相互作用,将三个酶在细胞内自组装成结构紧密、排列有序、具有一定区室化微环境的多酶复合体,并利用crispr/cas9技术改造代谢途径,调控柠檬酸的代谢途径,实现tca循环与衣康酸合成的最佳平衡,达到衣康酸合成路径的最优化,并最终实现在大肠杆菌中高效生产衣康酸,因此本发明为衣康酸的工业化生产提供了新途径。
附图说明
图1是根据本发明提供的glta-pdz-sh3,acna-pdzlig,cada-sh3lig三酶胞内自组装模拟图;
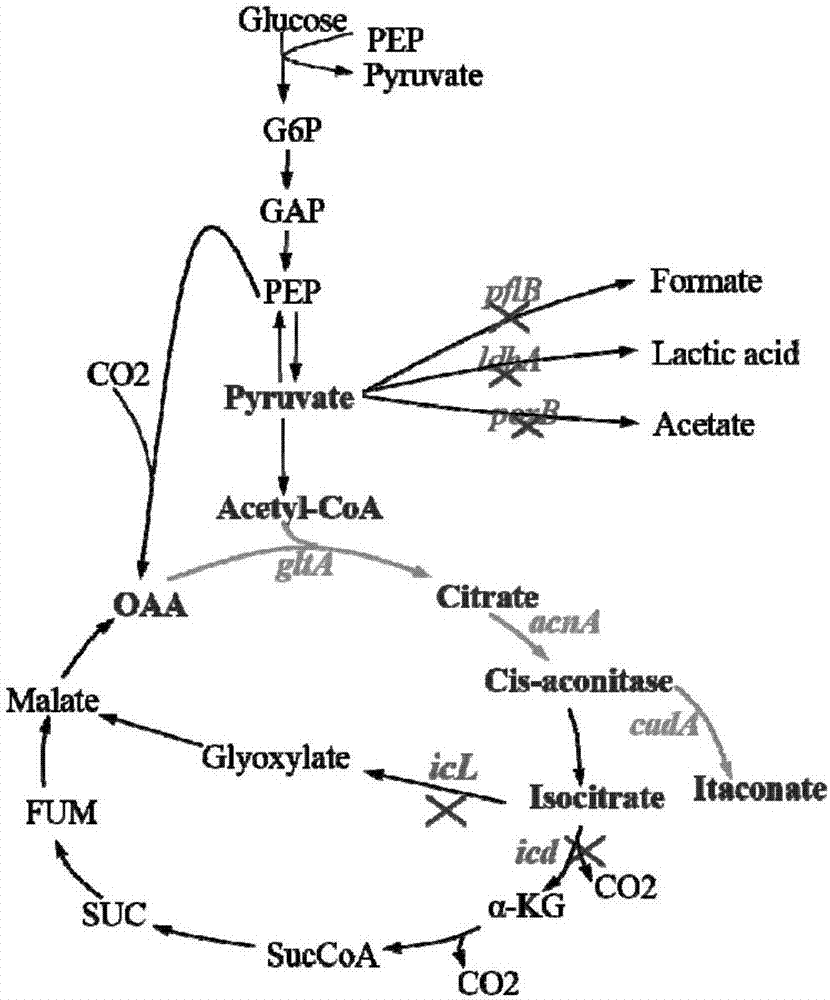
图2是大肠杆菌k12mg1655代谢途径改造示意图。
图3是不同实验菌株的衣康酸发酵结果对比图。
具体实施方式
以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。
实施例1三酶自组装质粒的构建与表达
glta(预测为二聚体酶)基因来自谷氨酸棒状杆菌(genbankid:1018824),acna(预测为单体酶)来源于谷氨酸棒状杆菌(genbankid:1019512),cada(预测为二聚体酶)来源于土曲霉(genbankid:bag49047.1)。基因glta,acna,cada通过生物公司全基因合成获得,经过密码子优化。另外,基因pdz,sh3已构建于本实验室中,保藏于-20℃。
质粒构建采用一步克隆的方法,本实验中所有质粒骨架均插入强启动子bba_j23100进行改造,将目的基因与载体进行基因融合。将glta和cada基因构建在质粒pqe-30中,获得质粒pqe30-cada-glta,利用一步克隆的方法分别插入shm蛋白对的配基sh3lig和两对相互作用蛋白对配体pdz-sh3形成pqe30-cada-sh3lig-taa-glta-pdz-sh3;现有的acna基因构建于pacycduet-1质粒上,利用一步克隆的方法插入pdz相互作用蛋白对的配基pdzlig形成pacycduet-acna-pdzlig。三酶组装形式如图1所示。
在上述已经构建完成的pqe30-cada-sh3lig-taa-glta-pdz-sh3基础上,利用一步克隆方法另外构建两个质粒pqe30-cada-sh3lig和pqe30-glta-pdz-sh3,将构建成功的这两个质粒和pacycduet-acna-pdzlig分别转化至大肠杆菌bl21(de3)中,从诱导温度、初始葡萄糖浓度、培养基ph及发酵时间等多方面研究glta、acna和cada融合不同相互作用蛋白元件的表达情况,进行条件优化,并分离纯化获取各融合蛋白,用于胞外多酶自组装研究,实验发现最佳诱导条件为:诱导温度为30℃,mm培养基ph为7.0,诱导时间为20h。分离纯化获取各融合蛋白acna-pdzlig,cada-sh3lig,glta-pdz-sh3,用于胞外多酶自组装研究。
实施例2glta,acna和cada酶学性质表征
构建单独表达glta、acna和cada蛋白的质粒,分离纯化后作为对照。分别测定三个融合酶及其原酶的催化活性,研究其酶学性质。酶活检测方法如下:
1)乌头酸脱羧酶cada酶活通过衣康酸浓度进行检测,利用顺式乌头酸与酶反应,采用hplc法检测衣康酸的生成量。检测条件为:inertsilods—3column,0.1m磷酸二氢铵(ph2.6)作为流动相,柱温为40℃。一单位酶活定义为37℃条件下每分钟催化生成1微摩尔衣康酸的酶量。
2)乌头酸酶acna检测方法是在ph7.0缓冲液下酶与柠檬酸钠反应,利用异柠檬酸试剂盒进行检测。一单位酶活定义为37℃条件下每分钟催化生成1微摩尔异柠檬酸的酶量。
3)柠檬酸合酶glta的酶活检测可利用商品化的柠檬酸合酶测试盒进行测定。
检测结果发现加入相互作用蛋白对后,对各单酶的酶活影响较小,保持原始酶活75%以上。
实施例3多酶体外组装实验
在胞外进行多酶组装并验证与表征,即采用非变性电泳、分子排阻色谱、激光粒度分析、动态光散射等技术以及活性检测,考察各酶组装的浓度、比例以及组装时间对组装过程和级联催化活性的影响,并通过原子力显微镜(afm)、扫描电子显微镜(sem)等手段测定组装后多酶体的形态与表面形貌,表征多酶体的结构与区室化几何特征。细胞内组装活性通过最终发酵合成的产物衣康酸的量(hplc检测)来进行验证。
实施例4胞内自组装的验证与优化
首先,利用ni-nta镍柱纯化的方法对蛋白进行分离组装验证。根据前面构建得到质粒进行共转化宿主菌得到一组组装菌株为cada-sh3lig-glta-(linker-pdz-linker-sh3)+acna-pdzlig和相应的对照菌株glta-cada+acna,其中,linker为常见的5nm刚性链接臂er/k,可选地,蛋白序列为kaklkeeeerkqreeeerikrleelakrkeeerk。虽然我们有设计过多种组装模式,但是上述这种组装模式是目前所选效果最优的。在大肠杆菌中进行三种蛋白的共表达,破碎细胞后借助组氨酸标签纯化的方法纯化上清中可溶共表达的蛋白,在洗脱目的蛋白的过程中,组装蛋白在某一浓度咪唑洗脱液下洗脱,而对照蛋白glta-cada+acna由于并未组装,不存在结构上的连接,因此三个蛋白会在不同浓度咪唑洗脱液下被洗脱,则可验证蛋白在细胞内完成了自组装,形成相对紧密的多酶反应器。
将三个融合蛋白在大肠杆菌k12mg1655中进行共表达,考察胞内三酶自组装情况,并利用三分子荧光互补技术检测组装过程。将荧光蛋白mirisfp分为min150,min(151-165)和mic166三部分,分别与组装蛋白进行融合,构建质粒:pqe-cada-sh3lig-min(151-165)-taa-glta-pdz-sh3-mic166-taa,pacycduet-acna-min150-pdzlig-taa。将构建好的双荧光质粒转化至宿主菌中进行共表达,当蛋白表达后,在各自相互作用元件的作用以及glta、cada的二聚作用下自组装,利用激光共聚焦测定胞内荧光变化情况,观察三酶区室化自组装的动态变化过程及其组装位置,菌体在561nm激发光下为红色,488nm激发光下为绿色,利用激光共聚焦荧光显微镜实时监测胞内区室化组装过程以及在此过程中形成多酶体的动态变化、组装过程中和组装完成后多酶体在细胞内的分布情况,揭示多酶复合体的形成过程和机制。
实施例5基于crispr/cas9技术大肠杆菌代谢途径改造
crispr/cas9技术是一种新型的基因编辑手段,操作简便,编辑效率高,成本较低,脱靶率低,并且可以同时对多个基因进行打靶,因此本发明采用该技术作为基因编辑的方法,涉及到的基因如图2所示。
敲除质粒pcas与ptargetf均购自addgene,保藏于本实验室-40℃冰柜中。具体方法如下:
1)构建ptargetf-n20质粒:根据待敲除基因序列,利用crispr.mit.edu设计其n20序列,选取得分高且脱靶率低的一条n20构建到ptargetf质粒上,得到质粒ptargetf-n20;
2)一步克隆法构建ptargett-δgene质粒:以大肠杆菌mg1655基因组为模板,pcr扩增待敲除基因的上下游序列片段up、down,多片段一步克隆法连接经ecori/hindiii双酶切得到的ptargetf-n20线性片段、ptargetf-n20+up和ptargetf-n20+down片段,转化e.colidh5α感受态,涂布于含spec的lb固体培养基,37℃倒置培养,挑取单克隆,菌液pcr验证并测序,测序成功后提质粒得到ptargett-δgene质粒。
3)基因编辑:将质粒ptargett-δgene电转入大肠杆菌mg1655-pcas电转感受态细胞,涂布于含卡那霉素和壮观霉素的lb固体培养基,30℃倒置培养,挑取单克隆,菌液pcr验证;
4)质粒消除:①消除ptargett:挑取含pcas和ptargett的单克隆,接种于含kan和iptg的lb液体培养基,30℃振荡培养,适量稀释后,涂布于含kan的lb固体培养基,30℃倒置培养,挑取单克隆,通过检测其对spec的敏感性验证ptargett消除效果;②消除pcas:将上述菌液接种于无抗性lb液体培养基中,振荡培养过夜以消除温敏型质粒pcas。
5)敲除菌验证:挑选单克隆进行pcr验证,选用两组引物进行,一组为敲除基因特异性引物,另一组为敲除基因上游以及设计的引物,若成功敲除则第一组pcr验证无条带,第二组pcr条带大小为up+down;若敲除不成功则第一组pcr条带大小为基因原始大小,第二组pcr条带大小为基因原始大小加上up+down。挑选验证正确的单克隆敲除菌进行下一步实验。
6)基因敲除菌感受态细胞制备:tss法制备敲除菌株感受态,转化时取一管感受态细菌,加入dna,轻轻混匀后冰浴。加入lb培养液,37度温和振荡培养,涂布,室温放置后放于37℃恒温培养箱过夜培养,挑选经pcr验证双质粒均已转化成功的转化菌进行后续实验。
实施例6大肠杆菌发酵条件优化及活性验证
将构建好的各组装质粒在经代谢途径改造后的大肠杆菌中进行共表达,以未组装工程菌为对照组,进行发酵实验。利用葡萄糖作为碳源,30℃下发酵若干时间,监控ph变化,在各个时间点取发酵液进行分析。有机酸检测方法如前面所述。
对发酵培养基进行优化,包括:培养基的组成、c/n比、ph、温度、培养时间、底物浓度、底物添加方式等等,定时取样,hplc检测产物衣康酸的生成,不断优化培养条件以确定最佳发酵条件与生产工艺。发酵培养基为改良mm培养基,成分包括:6.8g/lna2hpo4,3g/lkh2po4,0.5g/lnacl,1g/lnh4cl,0.49g/lmgcl,0.1mmol/lcacl2,1mg/l硫胺素,30g/l的葡萄糖,4g/lα-酮戊二酸,1000×微量元素(2.86gh3bo3,1.81gmncl2·4h2o,0.222gznso4·7h2o,0.39gna2moo4·2h2o,0.79gcuso4·5h2o,0.049gco(no3)2·6h2o)和对应抗生素。发酵过程中,首先在37℃,400rpm条件下培养20h使菌体生物量增长。20h后,将温度改为30℃,550rpm发酵,流加4mnaoh实时控制发酵液ph=6.7,不断通入无菌空气使溶氧控制在30%以上。每隔6h取样,测量葡萄糖浓度,当葡萄糖浓度低于10g/l时,手动补加300g/l葡萄糖,52.5g/l(nh4)2so4,4g/lα-酮戊二酸,使得葡萄糖浓度不低于20g/l。发酵100小时后,测得葡萄糖消耗完毕,发酵结束。
利用hplc法测定自组装菌与实验对照菌株在发酵过程中α-酮戊二酸、柠檬酸、异柠檬酸、顺式乌头酸和衣康酸含量的变化,研究组装对三酶的级联催化通路及衣康酸合成代谢流的影响,前期工作中利用pdz相互作用蛋白对进行多酶组装的策略,在原始菌株中进行了比较,如图3所示,组装菌与未组装菌相比,产量提高了63%;进一步在原始野生宿主菌中敲除icl,icd,poxb,pflb和ldha基因,并在敲除菌中进行多酶组装,进行了摇瓶发酵,如图3所示,在大肠杆菌敲除菌中,利用蛋白对进行组装后,其合成衣康酸的能力得到了大幅提高,最终敲除5个基因后,是原始组装菌的4.3倍,100h摇瓶发酵最后达到了3g/l,这个结果也证明,代谢途径的改造对衣康酸生产同样具有重大的影响,最佳的代谢途径改造是同时敲除icd,icl,poxb,pflb和ldha,从而获得基因敲除菌株。
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
- 还没有人留言评论。精彩留言会获得点赞!