单核苷酸检测方法及相关探针与流程
遗传物质的下一代测序已经在整体上对生物科学和医学产生了重大影响,特别是因为测序的单位成本随着越来越快测序机器的上市而降低。
在我们先前的申请wo2014/053853、wo2014/053854、wo2014/167323、wo2014/167324和wo2014/111723中,我们已经描述了一种新的测序方法,其涉及逐步(progressive)消化多核苷酸分析物以生成有序的单核苷酸流,优选单核苷三磷酸的流,其中的每一个可以逐个地捕获到微滴流中的相应液滴中。此后,可以对每个液滴进行化学和/或酶促操作以揭示其最初包含的特定单核苷酸。在一个实施方案中,这些化学和/或酶促操作包括涉及使用一种或多种双组分寡核苷酸探针类型的方法,每种探针类型适于能够选择性地捕获构成分析物的单核苷酸类型之一。通常,在每种这样的探针类型中,两种寡核苷酸组分之一包含典型的荧光团,并且在探针未使用状态下,这些荧光团发荧光的能力由于存在靠近的猝灭剂或通过自猝灭而保持熄灭。在使用中,当探针已经捕获其相应的单核苷酸时,使其易受随后的核酸外切影响,从而从猝灭剂和/或彼此中释放荧光团使其能够自由发荧光。通过这种手段,可以通过光谱手段间接地推断每个液滴中存在的原始单核苷酸。
此方法的变体已在我们的其他未决申请中描述,包括wo201405385和wo2016012789;后者涉及使用三组分探针系统。尤其是,wo2016012789描述了一种改进的方法,其特征在于以下步骤:(1)通过核酸的逐步消化生成单核苷三磷酸的流;(2)通过在聚合酶和连接酶存在下使至少一种所述单核苷三磷酸与相应的探针系统反应产生至少一种基本上双链的寡核苷酸占用探针,所述探针系统包含(a)标记有例如处于不可检测状态的典型的荧光团的第一单链寡核苷酸和(b)能够与第一寡核苷酸上的互补区域杂交的第二和第三单链寡核苷酸;(3)用具有双链核酸外切活性的酶消化占用探针以产生处于可检测状态的荧光团和至少部分与所述第一寡核苷酸互补的序列;(4)使第四寡核苷酸与另一个第一寡核苷酸反应以产生对应于占用探针的基本上双链的寡核苷酸产物;(5)在一个循环中重复步骤(3)和(4),以及(6)检测在步骤(3)的每次重复中释放的荧光团。此方法具有如下优点:通过在一个循环中重复步骤(3)和(4),可以使荧光信号强烈生长,从而提高整体灵敏度,从而提高核苷酸检测的可靠性。在一个实施方案中,第二和第三寡核苷酸被连接,使得在核苷酸捕获后,它们形成闭环单链寡核苷酸组分,其有利地抵抗核酸外切。
关于其他现有技术,fan等人在naturereviewsgenetics7(8)632-644(2006)中提供了对能够进行基因分型、拷贝数测量、测序和检测杂合性缺失、等位基因特异性表达和甲基化的高度平行基因组测定的方法和平台的发展的综述。此综述的图2a示意性地显示了3′和5′末端可环化探针的使用,其在分析物上的单核苷酸多态性(snp)位点的上游和下游退火,从而留下缺口,该缺口随后用为snp补体的核苷酸填充,以形成完整的环型探针,然后该环型探针可以在释放后进行扩增。然而,与我们的方法不同,在填充过程中捕获的核苷酸不是直接从分析物本身获得的。
wo03080861公开了一种方法,其中核酸分析物在核苷酸特异性反应性标记存在下经历逐步焦磷酸解,所述标记物在释放时直接附着于核苷酸。这不仅与我们采用的方法完全不同,而且在实践中,当标记的核苷酸随后被查询(interrogate)时测量的荧光信号可能太弱而不能在相关的背景噪声之上进行可靠的鉴定。
最后,wo9418218教导了一种dna测序方法,其中分析物经历逐步核酸外切以产生单核苷酸二磷酸或单核苷酸单磷酸流,然后在检测之前将其掺入荧光增强基质中。这不仅是对于我们描述的方法的完全不同的方法,而且我们再次观察到所生成的任何信号都可能太弱而无法可靠地检测和识别。
上述基于核外体溶解的方法的一个缺点是荧光信号的生成速率受到消化阶段的速度的限制。虽然这对于该方法的实用性绝不是致命的,但是从技术角度来看仍然非常需要减少与荧光增长相关的温育期以实现更快的测序;特别是在考虑长序列读取的情况下。现在这已经被我们实现了,通过用带有猝灭的荧光团的链的相对更快的选择性核酸内切(endonucleolytic)切口(nicking)取代所占用探针的核酸外切消化。因此,根据本发明,提供了一种核酸测序方法,其特征在于以下步骤:(1)通过核酸的逐步酶促消化生成单核苷三磷酸的流;(2)通过在聚合酶和连接酶存在下使至少一个所述单核苷三磷酸与相应的生物探针反应产生至少一个基本上双链的寡核苷酸占用探针,所述生物探针包含(a)第一单链寡核苷酸,其包括限制性核酸内切酶切口位点、用于捕获所述单核苷三磷酸的单核苷酸捕获位点和并置于切口位点任一侧的分别带有至少一个荧光团和至少一个猝灭剂以使荧光团猝灭的寡核苷酸区域,以及(b)能够与捕获位点任一侧的第一寡核苷酸上的互补区域杂交的第二和第三单链寡核苷酸;(3)用切口限制性核酸内切酶在切口位点切割占用探针的第一寡核苷酸链,以产生分别带有荧光团和猝灭剂的分离的第一寡核苷酸组分;(4)将步骤(3)中生成的第一寡核苷酸组分与占用探针的互补链分离,以及(5)检测在带有荧光团的分离的寡核苷酸组分上的荧光团。
在一个优选的实施方案中,如下所述重复步骤(3)和(4)以显著增加在步骤(5)中释放用于检测的荧光团的数量。
本发明方法的步骤(1)包括通过逐步酶促消化从核酸分析物生成单核苷三磷酸的流。在一个实施方案中,这可以通过分析物的逐步核酸外切后接激酶对获得的单核苷一磷酸的作用来实现。然而,优选通过逐步焦磷酸解作用直接从分析物产生核苷三磷酸。在该步骤中使用的分析物合适地是双链多核苷酸,其长度原则上可以是没有限制的,例如包括在人基因或染色体片段中发现的高达数百万个核苷酸碱基。然而,通常,多核苷酸长度至少为50个核苷酸对,优选至少为150个核苷酸对;适当地,它将大于500,大于1000并且在许多情况下长数千个核苷酸对。尽管该方法也可用于对合成产生的rna或dna或全部或部分由在自然界中不常遇到的核碱基(即腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)、胸腺嘧啶(t)和尿嘧啶(u)外的核碱基)构成的其他核酸进行测序,但分析物本身优选是天然来源(例如来源于植物、动物、细菌或病毒)的rna或dna。这种核碱基的实例包括4-乙酰基胞苷、5-(羧基羟甲基)尿苷、2-o-甲基胞苷、5-羧甲基氨基甲基-2-硫尿苷、5-羧甲基氨基-甲基尿苷、二氢尿苷、2-o-甲基假尿苷、2-o-甲基鸟苷、肌苷、n6-异戊基腺苷、1-甲基腺苷、1-甲基假尿苷、1-甲基鸟苷、1-甲基肌苷、2,2-二甲基鸟苷、2-甲基腺苷、2-甲基鸟苷、3-甲基胞苷、5-甲基胞苷、n6-甲基腺苷、7-甲基鸟苷、5-甲基氨基甲基尿苷、5-甲氧基氨基甲基-2-硫尿苷、5-甲氧基尿苷、5-甲氧基羰基甲基-2-硫尿苷、5-甲氧基羰基甲基尿苷、2-甲硫基-n6-异戊烯基腺苷、尿苷-5-氧基乙酸-甲酯、尿苷-5-氧基乙酸、wybutoxosine、wybutosine、假尿苷、辫苷、2-硫胞苷、5-甲基-2-硫尿苷、2-硫尿苷、4-硫尿苷、5-甲基尿苷、2-o-甲基-5-甲基尿苷和2-o-甲基尿苷。在dna的情况下,生成的单核苷三磷酸是脱氧核糖核苷三磷酸,而在rna的情况下,其是核糖核苷三磷酸。
在该方法的一个实施方案中,步骤(1)还包括将分析物附着到基质上的第一子步骤。通常,此基底包括微流体表面、微珠或可渗透膜;例如,由玻璃或不可降解的聚合物制成的基底。优选地,基底还包括具体适于接收分析物的表面。有许多方法可以将分析物附着到这样的表面上,其中任何一个原则上都可以用在这个子步骤中。例如,一种方法涉及用官能化硅烷诸如环氧硅烷、氨基烃基硅烷或巯基硅烷涂布(priming)玻璃表面。然后可以用分析物的衍生物处理如此生成的反应位点,所述分析物的衍生物已被修饰以包括末端胺、琥珀酰基或硫醇基。
在步骤(1)的另一个实施方案中,焦磷酸解分析物以生成生单核苷三磷酸的流,其顺序对应于分析物序列的顺序。这种焦磷酸解可以在例如包含合适的聚合酶的反应介质的存在下,在20至90℃的温度下进行。优选地,它在连续流动的条件下进行,使得单核苷三磷酸释放时连续地从反应区中除去。最优选地,通过使含有酶和其它典型添加剂的含水缓冲介质连续流经分析物所结合的表面来进行焦磷酸解。
在另一个实施方案中,使用的酶是可以引起分析物的逐步的3′-5′焦磷酸解降解以高保真度和合理反应速率产生核苷酸流的酶。优选地,该降解速率尽可能快,并且在一个实施方案中,其为每秒1至50个核苷酸。
关于应用于多核苷酸消化的焦磷酸解反应的进一步信息可以在例如j.biol.chem.244(1969)pp.3019-3028中找到。合适地,焦磷酸解消化在介质存在下进行,该介质进一步包含焦磷酸根阴离子和镁阳离子;优选以毫摩尔浓度。
在本发明方法的步骤(2)中,所述流中的至少一个单核苷三磷酸、优选每个单核苷三磷酸,在聚合酶和连接酶存在下与探针系统反应以生成基本上双链的占用探针。优选地,在进行此步骤之前,用焦磷酸酶处理步骤(1)的产物,以将任何残留的焦磷酸盐水解成磷酸根阴离子。
在该步骤中使用的聚合酶适当地选自由以下各项组成的组:在反应条件下基本上既不显示核酸外切酶活性也不显示核酸内切酶活性的那些聚合酶。可以有利地使用的聚合酶的实例包括但不限于从细菌如大肠杆菌(escherichiacoli)(例如klenow片段聚合酶)、水生栖热菌(thermusaquaticus)(例如taqpol)、嗜热脂肪芽孢杆菌(bacillusstearothermophilus)、bacilluscaldovelox和热坚芽孢杆菌(bacilluscaldotenax)获得的原核pol1酶或酶衍生物。原则上可以在该步骤中使用任何合适的连接酶。
步骤(2)中采用的生物探针由三个组分组成;(a)用处于不可检测状态的特征可检测元件标记的第一单链寡核苷酸和(b)能够与所述第一寡核苷酸上互补区域杂交的第二和第三未标记的单链寡核苷酸。在一个实施方案中,第二和第三寡核苷酸是离散的实体,而在另一个实施方案中,它们通过接头区的手段彼此连接。在后一种情况下,在一个实施方案中,接头区连接第二和第三寡核苷酸的末端。所述接头区原则上可以是任何二价基团,但方便地是另一个寡核苷酸区域。在一个实施方案中,该寡核苷酸接头区基本上不能与第一寡核苷酸杂交。
选择第一、第二和第三寡核苷酸,使得在步骤(2)中,第二和第三寡核苷酸可以分别与第一寡核苷酸上的3′侧和5′侧侧翼区域杂交,所述3′侧和5′侧侧翼区域本身并置于捕获位点的任一侧,所述捕获位点包含其核碱基与待检测的核苷三磷酸带有的核碱基互补的单核苷酸。这使得三组分探针系统对特定的核苷三磷酸具有高选择性。因此,例如,如果分析物衍生自dna并且第一、第二和第三寡核苷酸由脱氧核糖核苷酸组成,则捕获位点对脱氧腺苷三磷酸具有高选择性,如果其包含的核苷酸带有胸腺嘧啶核碱基的话。因此,在本发明的一个有用的实施方案中,步骤(2)可以在由多个探针类型组成的探针系统的存在下进行;例如,一个、两个、三个或四个探针类型,每个探针类型包含第一寡核苷酸,其具有所寻求的各种不同核碱基的不同捕获位点特征和不同的附着于其的可检测元件。
通常,第一寡核苷酸长达150个核苷酸,优选10到100个核苷酸。在一个实施方案中,第二寡核苷酸比第一寡核苷酸的互补3′侧侧翼区域短至少1个核苷酸。在另一个实施方案中,在第一寡核苷酸的3′末端与在第二寡核苷酸上与其相对的核苷酸之间存在单核苷酸错配以防止核苷三磷酸在此点处被聚合酶捕获。类似地,在一个实施方案中,第三寡核苷酸比第一寡核苷酸的互补5′侧侧翼区域长至少一个核苷酸,而在另一个实施方案中,在第三寡核苷酸的3′末端与在第一寡核苷酸上与其相对的核苷酸之间存在单核苷酸错配以防止核苷三磷酸在此点处被聚合酶捕获。
第一寡核苷酸的一个特征是它是用具有用其自身独特类型的荧光团标记的区域提供的,并且这些荧光团被布置以便当探针系统处于未使用状态时基本上不可检测。优选地,它们被布置成在荧光团被设计成在要被检测的那些波长处基本上不发荧光。因此,尽管荧光团可以在大部分电磁光谱中显示出广泛的低水平背景荧光,但通常会有一个或少量特定波长或波长包络,在此处荧光强度最大。在典型地检测荧光团的这些最大值中的一个或更多个处基本上不应发生荧光。在该专利的上下文中,术语“基本上不发荧光”或等同措辞是指附着至第一寡核苷酸的荧光团的总数在相关典型波长或波长包络处的荧光强度小于25%;优选小于10%;更优选小于1%且最优选小于0.1%的相应数量的游离荧光团的相应荧光强度。
原则上,可以使用任何方法来确保在第一寡核苷酸的未使用状态下荧光团基本上不发荧光。在一个实施方案中,这通过分别在荧光团和猝灭区域中的切口位点的任一侧配置荧光团和猝灭剂来实现。在另一个实施方案中,其通过在切口位点的任一侧的两个区域中配置荧光团并依赖以下观察结果而实现:当多个荧光团彼此紧密接近时,它们倾向于彼此足够好地猝灭,使得可以在不需要猝灭剂的情况下实现前一段中描述的标准。在该专利的上下文中,荧光团之间或荧光团与猝灭剂之间的“紧密接近”构成取决于所使用的特定荧光团和猝灭剂以及可能地第一寡核苷酸的结构特征。因此,该术语旨在应当参考所要求的结果而不是在所述两个区域中的各种元件的任何特定结构布置来解释。然而,并且仅出于提供示例的目的,指出当相邻的荧光团或相邻的荧光团和猝灭剂分离对应于典型的
关于荧光团本身,它们原则上可以选自本领域常规使用的任何一种,包括但不限于氧杂蒽部分,例如荧光素,罗丹明及其诸如异硫氰酸荧光素、罗丹明b等的衍生物;香豆素部分(例如羟基-、甲基-和氨基香豆素)和诸如cy2、cy3、cy5和cy7的花菁部分。具体实例包括衍生自以下常用染料的荧光团:alexa染料、花青染料、attotec染料和罗丹明染料。实例还包括:atto633(atto-tecgmbh)、texasredtm、atto740(atto-tecgmbh)、rosebengal、alexafluortm750c5-马来酰亚胺(invitrogen)、alexafluortm532c2-马来酰亚胺(invitrogen)和罗丹明红c2-马来酰亚胺和若丹明绿以及诸如quasar570的亚磷酰胺染料。备选地,可以使用量子点或近红外染料,诸如由li-corbiosciences提供的那些。荧光团通常使用本领域已知的化学方法经由核苷酸碱基附着至第一寡核苷酸。
合适的猝灭剂包括通过
第一寡核苷酸的特征为:通过凭借并行于单链限制性核酸内切酶切口位点的任一侧的荧光团和猝灭剂区域,所述单链限制性核酸内切酶切口位点是在探针已被使用并处于双链状态时用于经历选择性的切口核酸内切降解,导致所述荧光团在所述探针未使用的状态下是不可检测的。在一个优选的实施方案中,该切口位点包含第一寡核苷酸上的寡核苷酸区域,所述第一寡核苷酸本身包括捕获位点。在另一个实施方案中,当使用不止一种探针系统时,然而优选每种不同标记的第一寡核苷酸包含共同的切口位点,因此仅需要使用一种切口限制性核酸内切酶。为了实现这一点,因此优选切口位点包含含有rna或dna的每种典型核苷酸中的至少一种的序列,视情况而定。
在另一个优选的实施方案中,如本文所定义的切口限制性核酸内切酶是常规的限制性核酸内切酶,另外能够切割所占用探针的两条链并且在切口位点的区域中使互补链对核酸内切降解具有抗性;例如,通过包括一个或更多个核酸内切酶阻断位点。在一个实施方案中,这些阻断基团可以选自硫代磷酸酯键和本领域常用的其他骨架修饰、c3间隔基、磷酸基等。
步骤(2)适当地通过使流中的每种单核苷三磷酸与酶以及一种或更多种如上所述的探针在20至80℃的温度下接触来进行。
如上所述,本发明方法的步骤(2)的产物是基本上双链的占用探针,其组成链分别是第一寡核苷酸和由第二寡核苷酸(由单核苷三磷酸衍生的核酸)和最终的第三寡核苷酸组成的互补寡核苷酸。如果第二和第三寡核苷酸先前已通过接头区连接在一起,则很明显该互补寡核苷酸将包含闭环链。
在步骤(3)中,用切口限制性核酸内切酶在30至100℃的温度范围内处理占用探针。在该步骤中,将衍生自第一寡核苷酸占用探针的链切割成两个分离的组分,然后其可以在步骤(4)中从探针的互补链中去杂交,从而将荧光团和猝灭剂区域彼此分离并允许荧光团发荧光。因此,当发生核酸内切降解和去杂交时,观察者看到荧光信号的快速增长。然后,该荧光的特征间接反映了相关探针系统最初捕获的单核苷三磷酸的性质。步骤(4)可以通过将带切口的占用探针加热到30至100℃的温度来最有效地实现。
此后,在步骤(5)中,检测步骤(4)中释放的荧光团或通过步骤(3)和(4)的各种重复,并通过推断确定附着于单核苷三磷酸的核碱基的性质。通过系统地对步骤(1)中产生的流中的所有单核苷三磷酸实施本发明的方法,可以产生并分析原始核酸分析物的序列的数据特征。进行这个的方法在本领域中是众所周知的;例如,反应介质可以用来自激光和使用用光电探测器或等效装置检测的调谐到各种荧光团的典型荧光波长或波长包络的生成的任意荧光的光来查询。这又使光电探测器产生特征电信号,该特征电信号可以使用已知算法在计算机中处理和分析。
如上所述,在一个优选的实施方案中,在步骤(4)的最后,使现在以单链形式存在的衍生自占用探针的互补寡核苷酸与另一个相应的第一寡核苷酸分子杂交,从而产生新的基本上双链的寡核苷酸产物,其对应于,即具有与占用探针相同的化学和物理结构。然后在步骤(3)的重复中切割该产物,从而释放以可检测的状态另外的荧光团,并在重复步骤(4)后再次再生互补的寡核苷酸。此后,允许步骤(3)和(4)重复,从而在荧光信号方面引起进一步的增强;原则上直到基本上全部第一寡核苷酸被消耗。结果,观察者看到荧光信号的增强比原本可能获得的更大。
在一个特别优选的实施方案中,本发明的方法全部或部分地在微滴流中进行,其中至少一些微滴包含单核苷三磷酸;适当地是有序流。例如,这种方法可以以将步骤(1)中产生的核苷三磷酸一个接一个地插入相应的保持在不混溶的载体溶剂(例如烃或硅油)中的含水微滴的流中以帮助维持有序化而开始。备选地,这可以通过在消化(焦磷酸解)区下游直接产生微滴来实现;例如,通过使反应介质从适当尺寸的微滴头出现进入溶剂的流动流中。备选地,可以将来自步骤(1)的小等份反应介质定期并依次注入悬浮在溶剂中的预先存在的含水微滴流中。如果采用后一种方法,则每个微滴可能已经含有探针系统的各种组分以及实现步骤(2)-(4)所需的酶和任何其他试剂(例如缓冲液)。在又一种方法中,可以使在前一实施方案中产生的微滴随后与这种预先存在的微滴流合并以实现类似的结果。在这些微滴方法中,步骤(5)则优选涉及将微滴递送到储存区并查询每个微滴以识别释放的荧光团。此后,将从每个微滴获得的结果组装成原始核酸分析物序列的数据特征的流。
为了避免给定微滴含有多于一个核苷三磷酸的风险,优选以一定速率释放步骤(1)中的每个核苷三磷酸,使得每个填充的微滴平均分开1至20个,优选2个至10个空微滴。此后,使溶剂中的填充和未填充的微滴的流沿着流动路径,合适地是微流体流动路径,以一定的速率和方式流动,使得它们保持在离散状态并且没有机会彼此聚结。合适地,所用微滴的有限直径小于100微米,优选小于50微米,更优选小于20微米,甚至更优选小于15微米。最优选地,它们的所有直径都在2至20微米的范围内。在一个实施方案中,通过整个系统的微滴流动速率为每秒50至3000个微滴,优选100至2000个微滴。
在本发明的第二方面,还提供了一种多组分生物探针,其特征在于包含(a)第一单链寡核苷酸,其包括限制性核酸内切酶切口位点、用于捕获所述单核苷三磷酸的单核苷酸捕获位点和并置于切口位点任一侧的分别带有至少一个荧光团和至少一个猝灭剂以使所述荧光团猝灭的寡核苷酸区域,以及(b)能够与所述捕获位点任一侧的所述第一寡核苷酸上的互补区域杂交的第二和第三单链寡核苷酸。
在一个实施方案中,寡核苷酸区域包含其中带有至少一个荧光团的荧光团区域和其中带有至少一个猝灭剂的猝灭剂区域。在另一个实施方案中,两个区域都带有荧光团或荧光团和猝灭剂的混合物。在这种情况下,所有荧光团都被布置成彼此自猝灭。合适的荧光团和猝灭剂包括但不限于上述那些。在另一个实施方案中,第二和第三寡核苷酸通过如上文说明的接头区连接;接头区本身优选是另一个寡核苷酸区域。优选地,在第一寡核苷酸上的切口核酸内切酶识别位点包括捕获位点。
如上所述,为了dna或rna测序的目的,本文所述的生物探针可以组装成由1-4种不同的第一寡核苷酸类型组成的相应的生物探针系统,所述1-4种不同的第一寡核苷酸类型仅在捕获位点的核碱基特征(a、g、c和t或u)和要使用的荧光团方面不同。在另一个实施方案中,所述生物探针系统作为一个试剂盒出现,其进一步包含一旦在探针系统内已经产生双链占用探针,能够切割切口位点的连接酶、聚合酶和切口限制性核酸内切酶中的至少一种。
可以与本发明的方法、探针和探针系统一起使用的合适的切口限制性核酸内切酶的细节可以在http://rebase.neb.com在与其相关的数据库中找到。
据信,上述测序方法中使用的检测方法通常也适用于生物样品中的单核苷三磷酸或由其衍生的分析物的分析、表征或定量。因此,在本发明的第三方面,提供了分析单核苷三磷酸的方法,其特征在于以下步骤:(1)通过在聚合酶和连接酶存在下使所述单核苷三磷酸与相应的生物探针反应产生至少一种基本上双链的寡核苷酸占用探针,所述生物探针包含(a)第一单链寡核苷酸,其包括限制性核酸内切酶切口位点、用于捕获所述单核苷三磷酸的单核苷酸捕获位点和并置于切口位点任何一侧的分别带有至少一个荧光团和至少一个猝灭剂以使所述荧光团猝灭的寡核苷酸区域,以及(b)能够与捕获位点任一侧的所述第一寡核苷酸上的互补区域杂交的第二和第三单链寡核苷酸;(2)用切口限制性核酸内切酶在切口位点切割所述占用探针的所述第一寡核苷酸链,以产生分别带有所述荧光团和所述猝灭剂的分离的第一寡核苷酸组分;(3)将步骤(2)中生成的所述第一寡核苷酸组分与所述占用探针的所述互补链分离,以及(4)检测在带有荧光团的分离的寡核苷酸组分上的荧光团。
在这种方法中,各种步骤的性质和所采用的生物探针将适当地如上所述。在一个实施方案中,单核苷三磷酸将通过焦磷酸解衍生自前体双链dna分析物。在另一个实施方案中,它将使用例如激酶从前体单核苷一磷酸或单核苷二磷酸中生成(参见例如bao和ryu的biotechnologyandbioengineering(doi10.1002/bit.21498))。
现在参考以下实施例说明本发明。
实施例1-探针系统的制备和使用
制备单链的第一寡核苷酸1,其具有以下核苷酸序列:
5′-atgttctgatatcxcgtattcattgcqtgatgcccttagc-3’
其中a、c、g和t代表带有dna相关特征核苷酸碱基的核苷酸;x代表使用常规胺连接化学法用atto655染料标记的脱氧胸苷核苷酸(t),且q代表用bhq-2猝灭剂标记的脱氧胸苷核苷酸。它进一步包含从其5′端开始的第21个碱基上的捕获区域(c核苷酸)和切口核酸内切酶的识别序列nb.bsrdi,‘nncattgc’,所述捕获区域对捕获脱氧核苷三磷酸(dntp)混合物中的脱氧鸟苷三磷酸核苷酸(dgtp)有选择性。
还制备另一种单链寡核苷酸2和单链寡核苷酸3,所述单链寡核苷酸2包含具有与具有四个碱基错配的第一寡核苷酸的3′末端互补的序列的寡核苷酸区域,所述单链寡核苷酸3,包含具有与具有四个碱基错配的第一寡核苷酸的5′末端互补的序列的寡核苷酸区域和5′磷酸基团。他们有以下核苷酸序列:
寡核苷酸2:5′-ttccgcatcaagcaat-3′
寡核苷酸3:5′-paatacgagatatgtct-3′
其中p代表5′磷酸基团。
然后制备包含探针系统的反应混合物。其具有对应于衍生自以下配方的组合物:
20ul5x缓冲液ph7.9
10ul寡核苷酸1,1000nm
10ul寡核苷酸2,10hm
10ul寡核苷酸3,10hm
10ul精胺溶液,10mm
10unb.bsrdi切口核酸内切酶(例如newenglandbiolabsinc.)
20ue.coli连接酶
5.8ubst大片段聚合酶
10uldntp的混合物,1nm
加水至100ul
其中5x缓冲液包含以下混合物:
25ultrizmaacetate,1m,ph7.9
50ul醋酸镁水溶液,1m
25ul乙酸钾水溶液,1m
50ultritonx-100表面活性剂(10%)
500μg牛血清白蛋白
加水至1ml
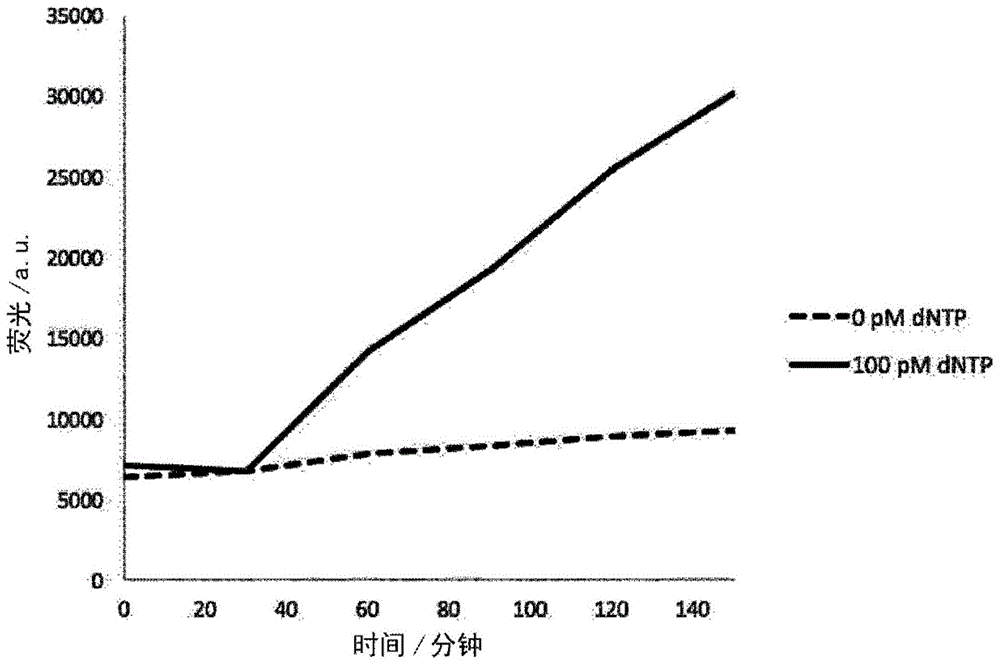
然后通过将混合物在37℃温育30分钟,然后将温度升至60℃再保持120分钟,进行dgtp的捕获和寡核苷酸3与寡核苷酸3的连接以形成占用探针。使用氦-氖激光的633nm线照射反应混合物,并且使用照相机检测所得的atto655染料的特征荧光,发生核酸内切降解的循环和占用探针的再生。
监测在反应的dntp组分存在和不存在时荧光强度随时间的增长,并且结果在图1中图示。由此可以看出,探针系统有效地捕获dgtp,并且本发明方法的循环性质导致荧光信号的快速增长。相反,在反应混合物中不存在dntp的对比实验中,寡核苷酸1上的atto655染料未显示出任何显著程度的荧光。
实施例2-使用探针系统的液滴微流体方法
图2示意性地说明了微流体测序装置,其中使每个含有单核苷酸碱基的微滴与如上所述类型的探针系统反应。
将包含通过衍生自人dna的100个核苷酸碱基多核苷酸分析物的逐步焦磷酸解获得的单核苷酸三磷酸盐流的含水介质1流过由pdms聚合物制成的10微米直径的微流体管。焦磷酸解反应本身是通过使含有taqpol和具有每升2毫摩尔的浓度的每个溶液焦磷酸钠和氯化镁的溶液的含水缓冲(ph7.5)反应介质,在72℃下,流经玻璃微珠进行的,分析物先前已经通过琥珀酰桥的方式连接在该玻璃微珠上。在微珠下游的1中的单核苷酸的顺序对应于分析物的序列。1从液滴头2出现到第一腔室3中,在第一腔室3中它与一种或更多种不混溶的轻质硅油4的流接触,选择这些流的速度以避免湍流混合并产生悬浮在油中的含水球形液滴5,其具有约为8微米的直径。通常,调节速率使得在相邻的填充的液滴之间平均存在10个空液滴。然后沿着相同直径的第二微流体管向前传送5的流到第二室6,5微米含水球形液滴7的第二流也通过第二液滴头8的方式供给到第二室6中。使液滴5和7以顺序方式合并,以形成直径约9微米的增大的含水微滴9。每个7含有无机焦磷酸酶,以破坏每个5中存在的任何残留的焦磷酸根阴离子。
然后通过微流体管以相同的速率将9的流送入第三室10,在第三室10中这些液滴与5微米含水球形液滴11的第三流接触,其中所述液滴11也通过相应的液滴头12供给到第三室11中。每个9在腔室6和10之间移动所花费的时间是c.2分钟。
然后使液滴9和11在10中合并以产生液滴13(直径约10微米)。每个11都含有嗜温连接酶、嗜热聚合酶、切口限制性核酸内切酶nb.bsrdi(例如,newenglandbiolabsinc.)和包含四组单链寡核苷酸的探针系统,所述单链寡核苷酸类似于实施例1中描述的那些,各自具有用不同荧光团标记的不同的第一寡核苷酸。
然后如此形成的合并的微滴13的流在37℃下温育30分钟,接着在60℃下温育120分钟。在此时间结束时,将13传送到检测系统14。
检测系统(未示出)通常包含检测窗口,其中每个液滴用来自激光器的入射光进行查询。然后,该光的作用使得每个液滴中释放的荧光团以单核苷酸碱基特征性的方式发荧光,所述单核苷酸碱基是最初掺入到捕获的分子中的(或者如果液滴最初是空的,则基本上完全没有)。然后在与上述四种寡核苷酸组相关的四种荧光团的四个典型波长处检测该荧光的存在或不存在。因此,当依次查询液滴时,原始多核苷酸分析物中的核苷酸碱基序列实际上可以被读出。
- 还没有人留言评论。精彩留言会获得点赞!