一种非手性铝化合物及其合成方法和聚乳酸合成方法与流程
本发明属于材料领域,特别涉及一种非手性铝化合物及其合成方法和聚乳酸合成方法方面的应用。
背景技术:
聚乳酸,也被称为聚丙交酯,是一种通过化学或生物方法合成的可生物降解的环保高分子材料,因其具有良好的生物相容性和可降解性,在使用后作为废弃物的二氧化碳排放量比传统塑料的二氧化碳排放量至少减少 60%,所以,这种环保高分子材料在产品外包装、化学与生物制药、医疗及工农业生产和我们日常生活等方面得到广泛的应用。本发明中的原料可以来自于代替石油来源的可再生资源如玉米或甜菜,合成的聚乳酸下游产品可以是可降解塑料(代替传统聚乙烯等不可降解塑料,有利于保护环境),临床骨钉,缓释药物,组织工程支架及手术缝合线等产品。一般我们合成聚乳酸用两种聚合反应方式来完成,即乳酸直接聚合反应与丙交酯开环聚合反应。其中,高分子量的聚乳酸仅能通过利用丙交酯开环聚合反应的方式来得到,目前有一些文献及专利报道了丙交酯开环聚合合成聚乳酸,例如,国外有文献(Jan Feijen,Angew.Chem.Int.Ed.2002,41,4510)报道从外消旋环己二胺中经手性分离得到的左旋-反式-1,2-环己二胺为前驱,合成为希夫碱化合物,再与铝化合物反应得到基于左旋-反式-1,2-环己二胺衍生物的手性铝化合物,他们采用此化合物催化丙交酯开环聚合合成得到聚乳酸。再如专利公开号为5235031 和5357034的两份美国专利也使用了铝化合物催化合成聚乳酸。
丙交酯存在三种立体异构体:左旋丙交酯(L-LA),右旋丙交酯(D-LA) 和内消旋丙交酯(meso-LA),等物质的量左旋丙交酯和右旋丙交酯均匀混合形成外消旋丙交酯。如下所示:
聚丙交酯的立体空间构型会决定该类高分子材料的热力学性能、机械性能和生物降解性能。以前丙交酯开环聚合反应所用的催化剂一般为异丙醇铝。在它的催化下,光学纯的左旋丙交酯(L-LA),右旋丙交酯(D-LA)分别开环聚合分别得到等规立构的聚左旋丙交酯以及聚右旋丙交酯,两种聚丙交酯均为熔点较低的结晶性聚合物。但是,外消旋丙交酯在异丙醇铝催化下开环聚合得到的是非结晶性无规聚丙交酯。与非晶性聚丙交酯相对比,结晶性聚丙交酯的应用温度范围更宽,意义更大。因此需要开发一类对外消旋丙交酯聚合有立体选择性的开环聚合催化剂,催化外消旋丙交酯聚合而获得高熔点聚乳酸。
到目前为止,关于外消旋丙交酯立体选择性开环聚合的催化剂有一些报道,如Spassky等报道的含氮铝催化剂(Salbinap)AlOMe是由2,2'-二氨基-1,1'- 联二萘与水杨醛缩合得到配体,然后再与异丙醇铝反应制得;Tolman等报道的基于卡宾配体锌催化剂,是NCN卡宾配体与二乙基锌反应,再与苄醇反应制得。但是以上所报道的催化剂催化丙交酯开环聚合反应的活性(单体转化率31~82%)和立体选择性(59~70%)均较低。通过查询,在现有技术中还没有利用N1-(2-aminoethyl)-N1-methylethane-1,2-diamine衍生物与烷基铝及醇反应合成希夫碱铝化合物及将其用于催化丙交酯开环聚合合成聚乳酸的报道。
技术实现要素:
本发明要解决的技术问题在于提供一种非手性铝化合物及其合成方法和聚乳酸合成方法方面的应用,该铝化合物催化丙交酯开环聚合生成聚乳酸具有高反应活性和较高选择性。
本发明提供了一种非手性铝化合物,如式(I)所示:
式(I)中,R为-CH3、-CH2CH3、-OCH3、-OCH2CH3、-OCH2CH2CH3、 -OCH(CH3)2或-OCH2Ph,其中Ph为芳香烃基;
R1独立地选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、-(CH2)3CH3、 -Cl、-Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
本发明提供了一种非手性铝化合物及其合成方法,包括以下步骤:
将式(II)结构的配体与Al(R′)3在溶剂中反应,得到式(III)结构的铝化合物:
R′为-CH3或-CH2CH3;
R1独立地选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、-(CH2)3CH3、 -Cl、-Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
优选的是,还包括:将所述式(III)结构的铝化合物与R〞H在溶剂中反应,得到式(IV)结构的铝化合物;
R〞为-OCH3、-OCH2CH3、-OCH2CH2CH3、-OCH(CH3)2或-OCH2Ph,其中Ph为芳香烃基;
R1独立地选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、-(CH2)3CH3、 -Cl、-Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
优选的是,所述式(II)结构的配体与Al(R′)3的摩尔比为1:1。
优选的是,所述式(II)结构的配体与Al(R′)3反应的反应温度为20~110 摄氏度,反应时间为3.5~60小时。
优选的是,所述式(III)结构的铝化合物与R〞H的摩尔比为1:1。
优选的是,所述式(II)结构的配体按照以下步骤合成:
将式(V)中取代的2H-isoindole-1-carbaldehyde与式(VI)中 N1-(2-aminoethyl)-N1-methylethane-1,2-diamine反应生成得到式(II)结构的配体;
式(V)中,R1选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、 -(CH2)3CH3、-Cl、-Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
本发明提供了一种聚乳酸的合成方法,包括以下步骤:
将丙交酯与式(I)结构的铝化合物在溶剂中反应,得到聚乳酸;
式(I)中,R为-CH3、-CH2CH3、-OCH3、-OCH2CH3、-OCH2CH2CH3、 -OCH(CH3)2或-OCH2Ph,其中Ph为芳香烃基;
R1选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、-(CH2)3CH3、-Cl、 -Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
优选的是,所述式(I)结构的铝化合物与丙交酯的摩尔比为 1:30~1:500。
优选的是,所述聚合反应的反应进行温度为0~110摄氏度,反应时间为8~240小时。
本发明的有益成果
本发明提供了一种非手性铝化合物,该铝化合物的结构如式(I)所示。本发明结构式(I)中的化合物一方面具有大的体积获得了大的空间位阻,使其对丙交酯开环聚合的选择性增强,提高了聚合产物空间结构的立体规整度;另一方面金属铝为中心原子也增强了催化剂的聚合反应的催化性能。
本发明还提供一种非手性铝化合物合成方法,该铝化合物是首次利用式(V)中取代的2H-isoindole-1-carbaldehyde与式(VI)中 N1-(2-aminoethyl)-N1-methylethane-1,2-diamine反应制得的,该方法原料易得,便宜,合成方法简单。
本发明还提供了一种聚乳酸的合成方法,它是通过丙交酯与式(I) 结构的铝化合物在溶剂中反应而成,实验结果表明本发明中的铝化合物催化外消旋丙交酯开环聚合反应生成的聚乳酸主要成分为全同立构的聚乳酸,选择性比传统的异丙醇铝化合物催化丙交酯开环聚合获得的聚合物要提高很多,而且聚乳酸全同立构成分可达88.2%(见实施例9),熔点达183.5℃,使所得聚乳酸应用范围更广。
附图说明
图1是异丙醇铝催化外消旋丙交酯开环聚合获得的聚乳酸的同核去耦核磁氢谱图(氘代试剂为CDCl3)。
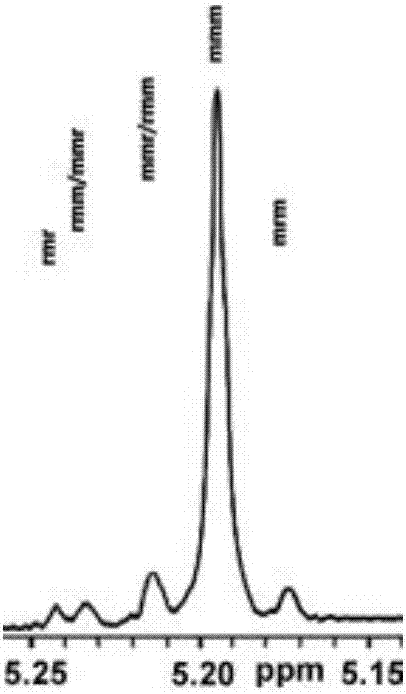
图2是本发明的实施例9中获得的聚乳酸的同核去耦核磁氢谱(氘代试剂为CDCl3)。
图3为本发明实施例9和实施例12制备得到的聚乳酸的DSC曲线图。
图4是本发明的实施例12中获得的聚乳酸的核磁氢谱图(氘代试剂为CDCl3)。
具体实施方式
本发明提供了一种非手性铝化合物,其结构如式(I)所示:
式(I)中,R为-CH3、-CH2CH3、-OCH3、-OCH2CH3、-OCH2CH2CH3、 -OCH(CH3)2或-OCH2Ph,其中Ph为芳香烃基;
R1独立地选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、-(CH2)3CH3、-Cl、-Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
在本发明,结构式(I)中的铝化合物一方面金属铝为中心原子催化剂有较高催化反应活性,获得较为满意的聚合反应活性;另一方面具有适合的体积获得了理想的空间阻碍,使增强对丙交酯开环聚合的选择性,直接获得较高的聚合产物立体结构的规整度。
有选择的,当R为-CH3或-CH2CH3时,本发明提供了一种非手性铝化合物的合成方法,包括以下步骤:将式(II)结构的配体与Al(R′)3在溶剂中反应,得到式(III)结构的铝化合物。其中,所述溶剂为本领域技术人员熟知的有机溶剂,优选为干燥的甲苯或四氢呋喃。
R1的选择影响着反应对溶剂的选择,当R1选自-Cl、-Br或-NO2时,反应溶剂优选为四氢呋喃;R1选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、 -(CH2)3CH3、-Cl、-Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基时,反应溶剂优选为甲苯。
R′为-CH3或-CH2CH3;
R1独立地选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、-(CH2)3CH3、 -Cl、-Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
本发明中所述Al(R′)3优选为Al(CH3)3或Al(CH2CH3)3。式(III) 中的R′来自Al(R′)3。所述Al(R′)3与式(II)结构化合物的摩尔比优选为 1:1,本发明化合物为金属化合物,该比例可保证一个金属活性中心同时与两个C=N官能基团形成配位键。
所述配体与Al(R′)3反应的温度条件优选为20~110摄氏度,温度的选择取决于反应溶剂的选择,更优选为25~70摄氏度,反应时间为3~100小时,优选为10小时。其中,所述式(II)结构的配体优选按照以下步骤合成:将式(V)中取代的2H-isoindole-1-carbaldehyde与式(VI)中 N1-(2-aminoethyl)-N1-methylethane-1,2-diamine反应生成得到式(II)结构的配体;
式(V)中,R1选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、 -(CH2)3CH3、-Cl、-Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
将式(V)中取代的2H-isoindole-1-carbaldehyde与式(VI)中 N1-(2-aminoethyl)-N1-methylethane-1,2-diamine反应,在无水乙醇中回流反应 5~24小时,优选为12小时,所述的式(V)中取代的2H-isoindole-1-carbaldehyde 与式(VI)中N1-(2-aminoethyl)-N1-methylethane-1,2-diamine的摩尔比为2.0: 1~2.5:1,优选为2.2:1。
有选择的,当R为-OCH3、-OCH2CH3、-OCH2CH2CH3、-OCH(CH3)2或-OCH2Ph时,本发明提供另一种非手性铝化合物的合成方法,该合成方法是在上述式(III)结构的铝化合物合成过程的基础上继续反应,得到取代基团不同的铝化合物。该合成方法在上述步骤的基础上,还包括以下步骤:将所述式(III)结构的铝化合物与R〞H在溶剂中反应,得到式(IV)结构的铝化合物。所述溶剂为本领域技术人员熟知的有机溶剂,优选为干燥的甲苯或四氢呋喃。所述R〞H优选为CH3OH、CH3CH2OH、CH3CH2CH2OH、 (CH3)2CHOH或Ph CH2OH。
R〞为-OCH3、-OCH2CH3、-OCH2CH2CH3、-OCH(CH3)2或-OCH2Ph;
R1选自-H、-CH3、-CH2CH3、-CH(CH3)2、-C(CH3)3、-(CH2)3CH3、-Cl、 -Br、-NO2、-SiPh3、-Si(CH2CH3)3、-Si(CH3)3或金刚烷基,其中Ph为芳香烃基。
其中,所述R〞H与式(III)结构铝化合物的摩尔比优选为1:1。
所述式(III)结构铝化合物与R〞H反应的温度优选为20~110℃,更优选为70℃,反应时间优选为2~24h,更优选为10h。
本发明还提供了一种聚乳酸的合成方法,包括以下步骤:将丙交酯与式(I)结构的铝化合物在溶剂中反应,得到聚乳酸。所述溶剂为本领域技术人员熟知的有机溶剂,优选为干燥的甲苯或四氢呋喃。
其中,式(I)结构铝化合物为丙交酯聚合生成聚乳酸反应中的催化剂。该催化剂与丙交酯的摩尔比为1:30~1:500,优选的是1:30~1:250。
本发明中,丙交酯聚合反应的温度条件为0~110℃,反应时间为8~240 小时,优选24~96小时。该反应优选无水无氧的条件下进行,杜绝副产物。
为了进一步说明本发明,以下结合实施例对本发明提供一种非手性铝化合物及其合成方法和应用进行详细描述。
以下实施例中所用的试剂均为市售。
实施例1结构式为II的配体IIa的合成
IIa:R1=H
惰性气体保护下,将V式中Va(R1=H,0.319克,2.20毫摩尔)和VI 式中N1-(2-aminoethyl)-N1-methylethane-1,2-diamine(0.117克,1.00毫摩尔)的溶于25毫升无水乙醇里,加热至回流13小时.冷却到室温后,浓缩,所得粗产品用柱层析分离,洗脱剂为石油醚:乙酸乙酯(体积比为12:1),得到纯产品 IIa固体,产量为0.301克,产率为81.0%。
利用基质辅助激光解吸电离飞行时间质谱对实施例1中得到的配体 IIa进行分析,得到结果:MALDI-TOF(THF),m/z=371.20。
利用元素分析对实施例1中得到的配体IIa进行分析,得到结果:Elem. Anal.Calc.(%):C,74.36;H,6.78;N,18.85.Found:C,74.31;H,6.74;N,18.82.
实施例2结构式为II的配体IIb的合成
IIb:tBu
将V式中Vb(R1=tBu,0.443克,2.20毫摩尔)和VI式中 N1-(2-aminoethyl)-N1-methylethane-1,2-diamine(0.117克,1.00毫摩尔)的溶于 25.0毫升甲苯,加入催化量的对甲基苯磺酸,加热至回流20小时。浓缩,所得粗产品用柱层析分离,洗脱剂为石油醚:乙酸乙酯(体积比为15:1),得到纯产品IIb是黄色固体,产量为0.364,产率为75.4%。利用基质辅助激光解吸电离飞行时间质谱对实施例2中得到的配体IIb进行分析,得到结果: MALDI-TOF(THF),m/z=483.32。
利用元素分析对实施例2中得到的配体IIb进行分析,得到结果:Elem. Anal.Calc.(%):C,76.98;H,8.54;N,14.48.Found:C,76.92;H,8.50;N,14.41.
实施例3结构式为I的铝化合物Ia-1~Ia-3的合成
Ia-1:R1=H,R=-CH3;
Ia-2:R1=H,R=-OCH(CH3)2;
Ia-3:R1=H,R=-OCH2Ph。
3.1在高纯氮气保护下,将10.0毫升浓度为1.0摩尔/升的IIa甲苯溶液与10.0毫升浓度为1.0摩尔/升的AlMe3甲苯溶液混合搅拌,23摄氏度反应 12小时,经冷井减压移走挥发物,得到铝化合物Ia-1。
3.2将5.0毫摩尔3.1中得到的铝化合物Ia-1溶于甲苯中,加入5.0毫摩尔异丙醇,得到铝化合物Ia-2。
3.3将5.0毫摩尔3.1中得到的铝化合物Ia-1溶于甲苯中,加入5.0毫摩尔苄醇,得到铝化合物Ia-3。利用元素分析对实施例3中得到的铝化合物 Ia-1~Ia-3进行分析,得到它们的元素含量分别为:
Ia-1:Elem.Anal.Calc.(%):C,70.05;H,6.37;Al,6.56;N,17.02.Found: C,70.00;H,6.30;N,17.09.
Ia-2:Elem.Anal.Calc.(%):C,68.55;H,6.64;N,15.37.Found:C,68.50; H,6.61;N,15.32.
Ia-3:Elem.Anal.Calc.(%):C,71.55;H,6.00;N,13.91.Found:C,71.59; H,6.02;N,13.95.
实施例4结构式为I的铝化合物Ib-1~Ib-3
Ib-1:R1=-tBu,R=-CH3;
Ib-2:R1=-tBu,R=-OCH(CH3)2;
Ib-3:R1=-tBu,R=-OCH2Ph。
4.1铝化合物Ib-1的合成方法与Ia-1相同,其中区别在于:将IIa的甲苯溶液换为IIb的甲苯溶液。
4.2将5.0毫摩尔4.1中得到的铝化合物Ib-1溶于甲苯中,加入5.0 毫摩尔异丙醇,得到铝化合物Ib-2.
4.3将5.0毫摩尔4.1中得到的铝化合物Ib-1溶于甲苯中,加入5.0毫摩尔苄醇,得到铝化合物Ib-3.
利用元素分析对实施例4中得到的铝化合物Ib-1~Ib-3进行分析,得到它们的元素含量分别为:
Ib-1:Elem.Anal.Calc.(%):C,73.39;H,8.08;N,13.37.Found:C,73.34; H,8.02;N,13.31.
Ib-2:Elem.Anal.Calc.(%):C,71.93;H,8.17;N,12.34.Found:C,71.90; H,8.12;N,12.30.
Ib-3:Elem.Anal.Calc.(%):C,74.12;H,7.53;N,11.37.Found:C, 74.15;H,7.48;N,11.31.
实施例5
无水无氧的条件下,将2.00毫摩尔重结晶过的外消旋丙交酯,0.02 毫摩尔实施例3中得到的铝化合物Ia-1溶解到40毫升的甲苯中,70℃搅拌反应96小时,加入0摄氏度的乙醇淬灭反应得到白色聚合物,过滤,真空干燥 24小时,得到0.284克聚乳酸,单体转化率为98.7%。
以聚苯乙烯为标准参照物,用凝胶渗透色谱(GPC)对实施例5中得到的聚乳酸进行分析,得到聚乳酸的数均分子量为2.45万。
实施例6
无水无氧的条件下,将5.00毫摩尔重结晶过的外消旋丙交酯,0.05 毫摩尔实施例3中得到的铝化合物Ia-2溶解到50毫升的甲苯中,70摄氏度搅拌反应90小时,加入0摄氏度的乙醇淬灭反应得到聚合物,过滤,真空干燥 24小时,得到0.686克聚乳酸,单体转化率为95.3%。
用聚苯乙烯作为对比标准,用凝胶渗透色谱对实施例6中得到的聚乳酸进行分析,得到聚乳酸的数均分子量为2.30万。
实施例7
合成方法与实施例6相同,区别在于催化剂为实施例3中得到的铝化合物Ia-3,得到0.701克聚乳酸,单体转化率为97.3%。
以聚苯乙烯为标准参照物,用凝胶渗透色谱对实施例7中得到的聚乳酸进行分析,得到聚乳酸的数均分子量为2.40万。
实施例8
无水无氧的条件下,将2.0毫摩尔重结晶过的外消旋丙交酯、0.04毫摩尔实施例4中得到的铝化合物Ib-1与40毫升甲苯混合,70摄氏度搅拌反应92小时,加入0摄氏度的乙醇淬灭反应得到聚合物,过滤,真空干燥24 小时,得到0.259克聚乳酸,单体转化率为90.0%。
用聚苯乙烯作为对比标准,用凝胶渗透色谱对实施例8中得到的聚乳酸进行分析,得到聚乳酸的数均分子量为1.62万。
实施例9
合成方法与实施例8相同,区别在于催化剂为实施4中得到的铝化合物Ib-2,得到0.265克聚乳酸,单体转化率为92.9%。本发明的铝化合物催化外消旋丙交酯聚合的立体选择性可以通过同核去耦核磁氢谱来确认,参见图1 和图2所示,图1是异丙醇铝催化外消旋丙交酯开环聚合得到的聚乳酸的同核去耦核磁氢谱(25摄氏度,CDCl3),选择性非常差;图2是实施例16中得到的聚乳酸的同核去耦核磁氢谱(25摄氏度,CDCl3)。从图1和图2可以计算出,实施例9中得到的聚乳酸全同立构成分为88.2%,说明本发明的铝化合物催化聚乳酸具有较高的选择性,熔点为183.5℃,参见图3中的DSC曲线图(上方的)。
以聚苯乙烯为标准参照物,用凝胶渗透色谱对实施例9中得到的聚乳酸进行分析,得到聚乳酸的数均分子量为1.70万。
实施例10
合成方法与实施例8相同,区别在于催化剂为实施例4中得到的铝化合物Ib-3,得到0.271克聚乳酸,单体转化率为94.2%。
以聚苯乙烯为标准参照物,用凝胶渗透色谱对实施例10中得到的聚乳酸进行分析,得到聚乳酸的数均分子量为1.69万。
实施例11
无水无氧的条件下,将50.0毫摩尔重结晶过的外消旋丙交酯、0.10 毫摩尔实施例4中得到的铝化合物Ib-2溶解于250毫升甲苯中,110摄氏度搅拌反应144小时,加入0摄氏度的乙醇淬灭反应得到聚合物,过滤,真空干燥24小时,得到6.52克聚乳酸,单体转化率为90.5%。
用聚苯乙烯作为对比标准,用凝胶渗透色谱对实施例11中得到的聚乳酸进行分析,得到聚乳酸的数均分子量为7.72万。
实施例12
无水无氧的条件下,将3.0毫摩尔左旋丙交酯、0.10毫摩尔实施例4 中得到的铝化合物Ib-2溶解在60毫升甲苯中,50摄氏度搅拌反应98小时后,加入0摄氏度左右的乙醇中沉降后得到聚合物,过滤,真空干燥24小时,得到0.404克聚乳酸,单体转化率为93.6%。得到的聚乳酸的400兆核磁氢谱见图4,条件是CDCl3做为氘代溶剂,在25摄氏度下测试。
用聚苯乙烯作为对比标准,用凝胶渗透色谱对实施例12中得到的聚乳酸进行分析,得到聚乳酸的数均分子量为2.17万,熔点为176.4摄氏度。参见图3中的DSC曲线图(下方的)。
以上实施例的说明仅是本发明的优选实施方案及其核心思想,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!