一种高产角质酶的重组大肠杆菌工程菌及其发酵工艺的制作方法
本发明涉及一种高产角质酶的重组大肠杆菌工程菌及其发酵工艺,属于基因工程以及发酵工程技术领域。
背景技术
角质酶是一种多功能水解酶,可用于水解短链或长链脂肪酸酯和甘油三酯,也可用于降解植物的多聚体角质。
相较于脂肪酶,角质酶无盖子结构,更易于降解聚酯,因此,角质酶在农产品深加工、护理用品行业、纺织工业等方面都得到了广泛的应用,尤其在棉织物的生物精炼和人造纤维的表面改性中,角质酶有望替代传统的化学碱处理,对环境保护有重要意义。
角质酶有多种来源,其中,特异腐质霉(humicolainsolens)来源的角质酶热稳定性好,应用于棉织物精炼中时无需预处理,可有效简化工艺流程;但在实际使用中,由于此来源的角质酶在菌中的产量低下以及现有发酵工艺的制约,以此来源的角质酶进行发酵生产的成本太高,这一缺陷大大限制了其工业大规模应用。
目前,常采用构建基因工程菌(pichiapastori、escherichiacoli、fusariumvenenatum等)和优化发酵工艺(培养基和诱导条件等)等方法提升角质酶产量,这些方法也取得了一定效果。
但是,从基因工程菌的角度来说,已有的将特异腐质霉(humicolainsolens)来源的角质酶在菌中异源表达得到的基因工程菌,其角质酶产量并未有显著提高,其产出的角质酶活性也十分低下;从发酵工艺的角度来说,现在也缺乏针对角质酶自身功能特性进行发酵工艺特异性优化的策略。
因此,虽然h.insolens角质酶在工业生产中有光明的应用前景,但如何提高其产量,如何对其发酵工艺进行优化,仍需进一步研究。
技术实现要素:
为解决上述问题,本发明以特异腐质霉(humicolainsolens)来源的角质酶基因为目的基因,pet-20b(+)为表达载体,e.colibl21(de3)为表达宿主,成功构建了可表达角质酶的基因工程菌e.colibl21(de3)/pet-20b(+)/hic;同时,本发明创造性地以重组大肠杆菌基因工程菌e.colibl21(de3)/pet-20b(+)/hic为生产菌株,采用两阶段温度控制工艺、恒定溶氧控制工艺、ph控制工艺、补料分批发酵工艺、高诱导菌体浓度结合高诱导强度的诱导控制工艺相结合的生产工艺以生产角质酶,具有产量高,原料来源广泛,生产成本较低等优势。
本发明的技术方案如下:
本发明提供了一种高产角质酶的重组大肠杆菌工程菌,所述工程菌包含重组质粒和表达宿主;所述重组质粒包含目的基因以及表达载体;所述目的基因为角质酶基因;所述表达载体为pet-20b(+);所述表达宿主为e.colibl21(de3)。
在本发明的一种实施方式中,所述角质酶基因来源于特异腐质霉(humicolainsolens)。
在本发明的一种实施方式中,所述角质酶基因的核苷酸序列为seqidno.1。
在本发明的一种实施方式中,所述重组质粒是通过将角质酶基因插入表达载体pet-20b(+)的信号肽序列下游构建而成的。
在本发明的一种实施方式中,所述重组质粒的酶切位点为ncoi和hindiii。
本发明提供了一种生产角质酶的方法,所述方法为使用上述一种高产角质酶的重组大肠杆菌工程菌作为生产菌株。
在本发明的一种实施方式中,所述方法为将重组大肠杆菌工程菌菌液接入发酵培养基,通过调节搅拌转速或通入富氧空气或氧气的方式将发酵过程中的溶氧维持在25%~35%,温度控制在35℃~38℃,流加质量浓度为20%~30%的氨水控制ph为6.0~8.0,培养4h~8h,进行分批发酵;分批发酵阶段结束后待溶氧上升至80%~100%,以指数流加的方式补加补料液控制菌体以0.15h-1~0.25h-1的比生长速率生长,通过提高搅拌转速或者通入富氧空气或氧气维持溶氧在25%~35%,温度控制在35℃~38℃,流加质量浓度为20%~30%的氨水控制ph为6.0~8.0进行补料发酵;当补料发酵至菌体od600达到70~80时,将温度降为25℃~35℃,采用恒速流加的方式流加乳糖,流速控制在0.7g·l-1·h-1~0.9g·l-1·h-1,通过提高搅拌转速或者通入富氧空气或氧气维持溶氧在25%~35%,流加质量浓度为20%~30%的氨水控制ph为6.0~8.0,培养7h~9h,进行诱导发酵;
所述溶氧以发酵培养基未接种重组大肠杆菌工程菌菌液前的溶氧为100%。
在本发明的一种实施方式中,所述方法为将重组大肠杆菌工程菌菌液接入发酵培养基,通过调节搅拌转速或通入富氧空气或氧气的方式将发酵过程中的溶氧维持在30%,温度控制在37℃,流加质量浓度为25%的氨水控制ph为7.0,培养5-7h,进行分批发酵;分批发酵阶段结束后待溶氧上升至80-100%,以指数流加的方式补加补料液控制菌体以0.2h-1的比生长速率生长,通过提高搅拌转速或者通入富氧空气或氧气维持溶氧在30%,温度控制在37℃,流加质量浓度为25%的氨水控制ph为7.0进行补料发酵;当补料发酵至菌体od600达到75时,将温度降为30℃,采用恒速流加的方式流加乳糖,流速控制在0.8g·l-1·h-1,通过提高搅拌转速或者通入富氧空气或氧气维持溶氧在30%,流加质量浓度为25%的氨水控制ph为7.0,培养8小时,进行诱导发酵;
所述溶氧以发酵培养基未接种重组大肠杆菌工程菌菌液前的溶氧为100%。
在本发明的一种实施方式中,所述重组大肠杆菌工程菌菌液在发酵培养基中的接种量为8~12%
在本发明的一种实施方式中,所述重组大肠杆菌工程菌菌液在发酵培养基中的接种量为10%。
在本发明的一种实施方式中,所述重组大肠杆菌工程菌菌液为将重组大肠杆菌工程菌接入种子培养基中,使用恒温摇床进行培养,在温度37℃、转速200rpm下培养8h所得的种子液。
在本发明的一种实施方式中,所述种子培养基的成分包含10g/l的蛋白胨、5g/l的酵母粉以及10g/l的nacl。
在本发明的一种实施方式中,所述种子培养基的ph为7.10。
在本发明的一种实施方式中,所述种子培养基的成分包含浓度为100mg/l的氨苄青霉素。
在本发明的一种实施方式中,所述发酵培养基的成分包含7~9g/l的甘油、0.5~2g/l的蛋白胨、1~3g/l的酵母粉、13~14g/l的kh2po4、3~5g/l的(nh4)2hpo4、1~2g/l的柠檬酸、0.5~1g/l的mgso4以及9~11ml/l微量元素液。
在本发明的一种实施方式中,所述发酵培养基的成分包含8g/l的甘油、1g/l的蛋白胨、2g/l的酵母粉、13.5g/l的kh2po4、4g/l的(nh4)2hpo4、1.7g/l的柠檬酸、0.68g/l的mgso4以及10ml/l微量元素液。
在本发明的一种实施方式中,所述微量元素液的成分包含4~6mol/l的hcl、9~11g/l的feso4·7h2o、2~3g/l的znso4·7h2o、0.5~1.5g/l的cuso4·5h2o、0.2~0.7g/l的mnso4·4h2o、0.1~0.3g/l的na2b4o7·10h2o、1~3g/l的cacl2以及0.05~0.15g/l的(nh4)6mo7o24。
在本发明的一种实施方式中,所述微量元素液的成分包含5mol/l的hcl、10g/l的feso4·7h2o、2.25g/l的znso4·7h2o、1.0g/l的cuso4·5h2o、0.5g/l的mnso4·4h2o、0.23g/l的na2b4o7·10h2o、2.0g/l的cacl2以及0.1g/l的(nh4)6mo7o24。
在本发明的一种实施方式中,所述发酵培养基的成分包含浓度为100mg/l的氨苄青霉素。
在本发明的一种实施方式中,所述指数流加的速率由公式
其中,x和s分别为细胞和底物浓度(g/l);
μ为为比生长速率(h-1);
v为发酵液体积(l);
sf为补加底物的浓度(g/l);
yx/s为细胞对底物的得率系数(g/g);
(vx)0为培养体系的初始细胞量(g);
t为流加时间(h)。
在本发明的一种实施方式中,所述补料液的成分包含450~550g/l的甘油、15~25g/l的mgso4·7h2o、10~20g/l的蛋白胨以及30g/l酵母粉。
在本发明的一种实施方式中,所述补料液的成分包含500g/l的甘油、20g/l的mgso4·7h2o、15g/l的蛋白胨以及30g/l酵母粉。
本发明提供了上述一种高产角质酶的重组大肠杆菌工程菌或上述一种生产角质酶的方法在制备角质酶、降解角质以及制备脂肪酸方面的应用。
有益效果:
(1)本发明以humicolaisnolens来源的角质酶基因为目的基因,pet-20b(+)为表达载体,e.colibl21(de3)为表达载体,成功构建了可高效活性表达角质酶的基因工程菌e.colibl21(de3)/pet-20b(+)/hic,采用此工程菌生产角质酶,发酵上清液中的酶活可达170u/ml;
(2)本发明创造性地采用两阶段温度控制工艺、恒定溶氧控制工艺、ph控制工艺、补料分批发酵工艺、高诱导菌体浓度结合高诱导强度的诱导控制工艺相结合的生产工艺以生产角质酶,具有产量高,原料来源广泛,生产成本较低等优势,采用此方法生产角质酶,可使得最终得到的发酵上清液中的酶活高达4788u/ml。
附图说明
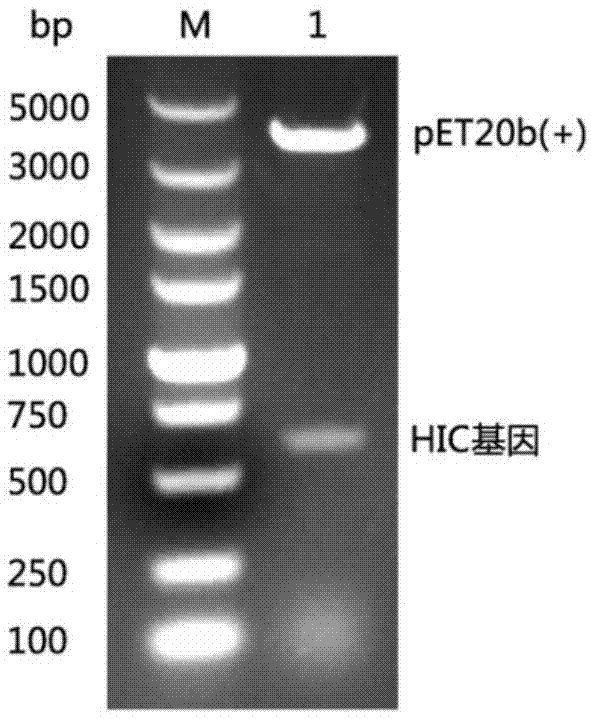
图1:重组质粒pet-20b(+)/hic双酶切凝胶电泳图;
图2:摇瓶发酵24h时发酵胞外上清液的sds-page蛋白电泳图;
图3:不同诱导时间下重组菌的生长情况;
图4:不同诱导时间下重组菌发酵过程酶活;
图5:不同诱导温度下重组菌的生长情况;
图6:不同诱导温度下重组菌发酵过程酶活;
图7:不同诱导浓度下重组菌的生长情况;
图8:不同诱导浓度下重组菌发酵过程酶活;
图9:诱导24h时发酵胞外上清液的sds-page蛋白电泳图;
图10:菌体浓度od600为75进行诱导时,不同诱导浓度下重组菌的生长情况;
图11:菌体浓度od600为75进行诱导时,为不同诱导浓度下重组菌的发酵产酶情况;
图12:诱导8h时发酵胞外上清液的sds-page蛋白电泳图;
图13:菌体浓度od600为95进行诱导时,不同诱导浓度下重组菌的生长情况;
图14:菌体浓度od600为95进行诱导时,为不同诱导浓度下重组菌的发酵产酶情况。
具体实施方式
以下实施例用于非限制性地解释本发明的技术方案。
下述实施例中涉及的培养基为:
lb固体培养基的组成为:分子级蛋白胨9-11g/l,分子级酵母粉4-6g/l,nacl9-11g/l,琼脂粉1.5-2%。
lb液体培养基的组成为:分子级蛋白胨9-11g/l,分子级酵母粉4-6g/l,nacl9-11g/l,ph6.8-7.2。
tb发酵培养基的组成为:甘油4-6g/l,工业级酵母粉23-25g/l,工业级蛋白胨11-13g/l,kh2po42.2-2.4g/l,k2hpo416-17g/l。
种子培养基:工业级蛋白胨10g/l,工业级酵母粉5g/l,nacl10g/l,100mg/l卡那霉素,ph7.00。
发酵培养基为:甘油8g/l,蛋白胨1g/l,酵母粉2g/l,(nh4)2hpo44.0g/l,kh2po413.5g/l,柠檬酸1.7g/l,mgso4·7h2o1.4g/l,微量元素液10ml/l。还可以添加100μg/ml卡那霉素。
微量元素液为:feso4·7h2o10.0g/l,znso4·7h2o5.3g/l,cuso4·5h2o3.0g/l,mnso4·4h2o0.5g/l,na2b4o7·10h2o0.23g/l,cacl22.0g/l,(nh4)6mo7o240.1g/l。
补料培养基为:蛋白胨2.4g/l,酵母粉4.8g/l,mgso4·7h2o15g/l,甘油600g/l。
下述实施例中涉及的检测方法如下:
角质酶活性测定:将发酵上清液于4℃、10000r/min离心20min除菌体,收集上清液。在37℃下,使用连续分光光度法测定酶活力。反应总体积为1.5ml,包括30μl50mmol·l-1对硝基苯丁酸酯(pnpb)的底物,30μl适当稀释的发酵上清液,和1440μltris-hcl缓冲液(ph8.0)。在405nm波长下,记录对硝基酚的增长速率,反应时间1min。一个酶活单位(u)定义为在上述条件下,每分钟将对硝基苯丁酸酯(pnpb)催化水解生成1μmol对硝基酚的酶量,即为一个酶活力单位(u)。
实施例1:e.colibl21(de3)/pet-20b(+)/hic的构建
在来源于humicolainsolens的角质酶基因两侧插入酶切稳点ncoi和hindiii,并与商品化质粒pet-20b(+)连接,位于信号肽序列下游,构建了表达载体pet-20b(+)/hic,并将其转化宿主菌e.colibl21(de3),重组菌e.colibl21(de3)/pet-20b(+)/hic构建完成。
(图1为重组质粒pet-20b(+)/hic双酶切凝胶电泳图,电泳结果显示在约500p处有一条与角质酶基因理论分子量一致的条带,4000bp处有一条与载体pet-20b(+)理论分子量一致的条带。)
实施例2:本发明重组工程菌e.colibl21(de3)/pet-20b(+)/hic的酶活检测
将实施例1所得的e.colibl21(de3)/pet-20b(+)/hic菌株转接lb培养基中36-38℃培养8-10h,后将所得培养液按4-6%的接种量接入tb发酵培养基中,36-38℃,200r/min培养1.5-2.5h后,用终浓度为0.01-0.03mm的iptg诱导,继续培养24h。测其细胞浓度,并收集发酵液,离心后测定样品发酵上清液中的酶活力。(图2为摇瓶发酵24h时发酵胞外上清液的sds-page蛋白电泳图,蛋白电泳结果显示在约20kda处有一条与理论分子量一致的条带,此时,角质酶酶活力为170u/ml。)
实施例3:不同诱导时间对本发明重组工程菌发酵产酶的影响
1、种子培养:将实施例1所得的e.colibl21(de3)/pet-20b(+)/hic菌株接入种子培养基中,使用恒温摇床进行培养,温度37℃,转速200rpm,培养8h。
2、发酵产酶:将种子液以10%接种量接入容量为3.6l的发酵罐中进行发酵,控制发酵罐中转速为300rpm,通风量为1.5vvm,使发酵液溶氧维持30%,控制温度为37℃,流加25%(v/v)的氨水控制ph在7.0,待最初的甘油消耗完后,溶氧上升至80-100%,则分批发酵培养结束;以指数流加的方式补加补料培养基进行补料发酵;发酵培养结束后,分别在菌体od600达到30、40、50、65时诱导产酶,诱导阶段降温至30℃,恒速流加0.2g·l-1·h-1的乳糖,溶氧维持在30%,ph控制在7.0左右,诱导24h左右。菌体od600达到50后开始诱导的发酵上清液中的角质酶酶活力最高,达到2233u/ml。(图3为不同诱导时间下重组菌的生长情况;图4为不同诱导时间下重组菌的发酵产酶情况。)
实施例4:不同诱导温度对本发明重组工程菌菌发酵产酶的影响
1、种子培养:将实施例1所得的e.colibl21(de3)/pet-20b(+)/hic菌株接入种子培养基中,使用恒温摇床进行培养,温度37℃,转速200rpm,培养8h。
2、发酵产酶:将种子液以10%接种量接入容量为3.6l的发酵罐中进行发酵,控制发酵罐中转速为300rpm,通风量为1.5vvm,使发酵液溶氧维持30%,控制温度为37℃,流加25%(v/v)的氨水控制ph在7.0,待最初的甘油消耗完后,溶氧上升至80-100%,则分批发酵培养结束;以指数流加的方式补加补料培养基进行补料发酵;当菌体浓度od600达到50时,恒速流加0.2g·l-1·h-1的乳糖,分别在25℃、30℃、35℃下诱导产酶,溶氧维持在30%,ph控制在7.0左右,诱导24h左右。在30℃进行诱导的发酵上清液中的角质酶酶活力最高,达到2233u/ml。(图5为不同诱导温度下重组菌的生长情况;图6为不同诱导温度下重组菌的发酵产酶情况。)
实施例5:不同诱导强度对本发明重组工程菌发酵产酶的影响
1、种子培养:将实施例1所得的e.colibl21(de3)/pet-20b(+)/hic菌株接入种子培养基中,使用恒温摇床进行培养,温度37℃,转速200rpm,培养8h。
2、发酵产酶:将种子液以10%接种量接入容量为3.6l的发酵罐中进行发酵,控制发酵罐中转速为300rpm,通风量为1.5vvm,使发酵液溶氧维持30%,控制温度为37℃,流加25%(v/v)的氨水控制ph在7.0,待最初的甘油消耗完后,溶氧上升至80-100%,则分批发酵培养结束;以指数流加的方式补加补料培养基进行补料发酵;当菌体浓度od600达到50时,降温至30℃,分别以流速0.1g·l-1·h-1、0.2g·l-1·h-1、0.4g·l-1·h-1恒速流加乳糖溶液进行诱导,溶氧维持在30%,ph控制在7.0左右,诱导24h左右。以0.2g·l-1·h-1恒速流加乳糖溶液的角质酶酶活力最高,达到2233u/ml。(图7为不同诱导浓度下重组菌的生长情况;图8为不同诱导浓度下重组菌的发酵产酶情况;图9为诱导24h时发酵胞外上清液的sds-page蛋白电泳图,蛋白电泳结果显示在约20kda处有一条与理论分子量一致的条带,此时,发酵上清液中的角质酶酶活力为2233u/ml。)
实施例6:菌体浓度od600为75进行诱导时不同诱导强度对重组菌发酵产酶的影响
1、种子培养:将实施例1所得的e.colibl21(de3)/pet-20b(+)/hic菌株接入种子培养基中,使用恒温摇床进行培养,温度37℃,转速200rpm,培养8h。
2、发酵产酶:将种子液以10%接种量接入容量为3.6l的发酵罐中进行发酵,控制发酵罐中转速为300rpm,通风量为1.5vvm,使发酵液溶氧维持30%,控制温度为37℃,流加25%(v/v)的氨水控制ph在7.0,待最初的甘油消耗完后,溶氧上升至80-100%,则分批发酵培养结束;以指数流加的方式补加补料培养基进行补料发酵;当菌体浓度od600达到75时,降温至30℃,分别以流速0.4g·l-1·h-1、0.8g·l-1·h-1、1.2g·l-1·h-1恒速流加乳糖溶液进行诱导,溶氧维持在30%,ph控制在7.0左右,诱导8h左右。以0.8g·l-1·h-1恒速流加乳糖溶液的角质酶酶活力最高,达到4788u/ml。(图10菌体浓度od600为75进行诱导时,不同诱导浓度下重组菌的生长情况;图11菌体浓度od600为75进行诱导时,为不同诱导浓度下重组菌的发酵产酶情况;图12为诱导8h时发酵胞外上清液的sds-page蛋白电泳图,蛋白电泳结果显示在约20kda处有一条与理论分子量一致的条带。此时,发酵上清液中的角质酶酶活力为4788u/ml。)
实施例7:菌体浓度od600为95进行诱导时不同诱导强度对重组菌发酵产酶的影响
1、种子培养:将实施例1所得的e.colibl21(de3)/pet-20b(+)/hic菌株接入种子培养基中,使用恒温摇床进行培养,温度37℃,转速200rpm,培养8h。
2、发酵产酶:将种子液以10%接种量接入容量为3.6l的发酵罐中进行发酵,控制发酵罐中转速为300rpm,通风量为1.5vvm,使发酵液溶氧维持30%,控制温度为37℃,流加25%(v/v)的氨水控制ph在7.0,待最初的甘油消耗完后,溶氧上升至80-100%,则分批发酵培养结束;以指数流加的方式补加补料培养基进行补料发酵;当菌体浓度od600达到95时,降温至30℃,分别以流速0.8g·l-1·h-1、1.2g·l-1·h-1、1.6g·l-1·h-1恒速流加乳糖溶液进行诱导,溶氧维持在30%,ph控制在7.0左右,诱导4h左右。以1.2g·l-1·h-1恒速流加乳糖溶液的发酵上清液中的角质酶酶活力最高,达到2077u/ml。(图13菌体浓度od600为95进行诱导时,不同诱导浓度下重组菌的生长情况;图14菌体浓度od600为95进行诱导时,为不同诱导浓度下重组菌的发酵产酶情况。)
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
序列表
<110>江南大学
<120>一种高产角质酶的重组大肠杆菌工程菌及其发酵工艺
<160>1
<170>patentinversion3.3
<210>1
<211>585
<212>dna
<213>人工序列
<400>1
caattgggtgctattgaaaacggacttgaatcaggatcagctaacgcctgtcctgatgcc60
attcttatttttgccagaggttcaactgaacctggaaacatgggaattaccgttggacca120
gctttagccaacggtttagaatctcatattcgtaacatttggattcaaggtgttggaggt180
ccatacgatgccgccttagctactaactttcttcctcgtggtacttcacaagccaacatt240
gatgaaggaaagagattatttgccttggccaaccaaaagtgtccaaacaccccagttgtt300
gcgggtggctactcacaaggggccgctttaattgctgccgccgtttccgaattatccgga360
gctgttaaggaacaagttaagggagttgccttgtttggttacactcaaaacttgcaaaac420
agaggtggtattcctaactaccctagagaaagaactaaggtattctgtaacgttggtgac480
gctgtttgtaccggaactttaattattactcctgctcatctttcatacaccattgaagcc540
cgtggagaagccgctagatttcttcgtgatcgtattcgtgcttaa585
- 还没有人留言评论。精彩留言会获得点赞!