靶向Hsp60的黄酮烷氧基氨基磷酸酯衍生物、制备及应用的制作方法
本发明涉及一类药物化合物,尤其涉及一类靶向hsp60的黄酮烷氧基氨基磷酸酯衍生物、制备及应用。
背景技术
黄酮类化合物属于一类十分重要的多酚类化合物,黄酮在水果、蔬菜中含量丰富,具有多种生理活性。黄酮类化合物对于高血压及其他心血管疾病、炎症、糖尿病、免疫系统疾病等危害人类健康的疾病具有巨大的治疗价值及潜力。此外,该类化合物在预防肝癌、前列腺癌、结肠癌以及淋巴母细胞性白血病等不同类型的癌症中具有较好的效果。其中,白杨素可以通过诱导细胞凋亡以及减少炎症抑制肿瘤细胞生长和增殖。具有“植物雌激素”之称的大豆异黄酮也是一种抗氧化剂,可以保护细胞免受在正常代谢过程中氧化产生的自由基的损伤。黄酮类化合物丰富的生理活性引起了人们极大的研究兴趣,但同时这类化合物也存在着由于自聚集作用造成的溶解性差、难以被机体吸收代谢等亟待解决的问题。氨基磷酸酯前药修饰技术改善了药物在体内的代谢动力学过程(吸收、分布、转运及代谢),该类药物的生物利用度及对于病变部位的靶向性得到有效提高、半衰期延长,毒副作用有所降低,同时核苷单磷酸化产物在胞内的释放水平增加。本发明设计、合成一系列新型具有抗肿瘤活性的黄酮烷氧基氨基磷酸酯衍生物,该类衍生物对乳腺癌细胞及肝癌细胞具有明显的抑制和杀伤作用,并对肝癌细胞及正常肝细胞具有良好的选择性,本发明开发了靶向hsp60的选择性抗肿瘤细胞增殖的黄酮烷氧基氨基磷酰胺类衍生物。
技术实现要素:
本发明提供一类靶向hsp60的选择性抗肿瘤细胞增殖的黄酮烷氧基氨基磷酰胺类衍生物及其制备方法。
本发明的技术方案:
靶向hsp60的黄酮烷氧基氨基磷酸酯衍生物的结构式如通式ⅰ或ii或iii:
其中:r1选自h、甲基、异丙基和异丁基;r2、r3、r4、r5均选自h、羟基、甲氧基和乙酰氧基,三者相同或不同;m为2~6;n为1~4;
上述通式ⅰ所示的黄酮磷酰胺衍生物的制备方法,步骤如下:
步骤1)在三乙胺试剂存在下,二氯磷酸苯酯与溴代烷基醇、氨基酸甲酯盐酸盐进行取代反应,-83~-30℃反应0.5~2h后,升至室温继续反应8~24h,得化合物ⅳ;二氯磷酸苯酯、溴代烷基醇、三乙胺与氨基酸甲酯盐酸的摩尔比为1:1~3:1~3:1~3;
步骤2)在无机碱试剂存在下,化合物ⅳ与化合物v进行取代反应,得化合物ⅰ;
所述的无机碱试剂为碳酸铯、碳酸钾、碳酸钠、氢氧化钠、氢氧化钾、氢化钠中的一种或两种以上混合。
上述通式ⅱ所示的黄酮磷酰胺衍生物的制备方法,步骤如下:
步骤1)化合物vi与四丁基氢氧化铵试剂按照摩尔比1:1~2混合反应,反应温度为15~35℃,反应时间为8~24h,得到化合物vii;
步骤2)在无机碱试剂存在下,化合物vii与溴代烷基醇按照摩尔比为1:1~10混合反应,反应温度为10~60℃,反应时间为5~30h,进行取代反应,得到化合物viii;
所述的无机碱试剂为碳酸铯、碳酸钾、碳酸钠中的一种或两种以上混合;步骤3)在无机碱试剂存在下,化合物viii与碘甲烷按照摩尔比1:1~3混合反应,反应温度10~60℃,反应时间为5~40h,得到化合物ix;步骤4)化合物ix、二氯磷酸苯酯、氨基酸甲酯盐酸盐与三乙胺的摩尔比为1:1~3:1~3:1~4,反应温度为-83~30℃,反应时间为4~40h,得到化合物ⅱ。
上述通式ⅲ所示的黄酮磷酰胺衍生物的制备方法,包括如下步骤:
步骤1)二氯磷酸苯酯、三乙胺与化合物x按照摩尔比为1:1~3:1~3混合反应,反应温度为-83~30℃,反应时间4~30h,制得化合物xi;
步骤2)化合物xi、氨基酸甲酯盐酸盐与三乙胺按照摩尔比为1:1~3:1~3混合反应,反应温度为15~50℃,反应时间4~30h,制得化合物iii。
本发明的另一方面的目的是提供上述一类黄酮磷酰胺衍生物在抗肿瘤药物中的应用。进一步地,本发明提供上述一类黄酮磷酰胺衍生物靶向hsp60的选择性抗肿瘤细胞增殖应用。
本发明的有益效果:本发明提供的黄酮烷氧基氨基磷酰胺类衍生物经仪器分析结构准确无误。本发明的黄酮烷氧基氨基磷酰胺衍生物的制备方法简单易行、成本低。该衍生物具有较好的抗肿瘤活性,对人肝癌细胞株hepg2及人乳腺癌细胞株mcf7有显著的抑制作用。该类化合物可能通过抑制hsp60的活性诱导肿瘤细胞凋亡发挥抗肿瘤作用。在制备抗肿瘤药物领域,具有很好的实用价值和应用前景。
附图说明
图1是大豆苷元-7-乙氧基丙氨酸氨基磷酸酯(14d)对hepg2细胞的凋亡影响。
图2是大豆苷元-7-乙氧基丙氨酸氨基磷酸酯(14d)对hepg2细胞caspase3的影响。
图3是大豆苷元-7-乙氧基丙氨酸氨基磷酸酯(14d)对于hsp60的抑制活性。
具体实施方式
以下通过实例对本发明作进一步的阐述,但不对本发明作任何限制。
本发明实施例中所采用的方法如果没有给出具体的操作条件或操作步骤,其相应技术是本领域普通技术人员所公知的,或者按照材料提供商所建议的条件及方法进行。
实施例1白杨素-7-乙氧基甘氨酸氨基磷酸酯的制备
实施例1-1:在250ml三口瓶中加入二氯磷酸苯酯(1.5ml,10mmol,0.4m),然后加入二氯甲烷(100ml)使其溶解,用乙酸乙酯液氮将反应体系降温至-83.5℃,用恒压滴液漏斗向反应液中逐滴加入tea(3ml,10mmol,1equiv),滴加10min。然后将2-溴乙醇(1.1ml,8mmol,0.8equiv)与二氯甲烷(5ml)混合溶液,滴加至上述反应液中,滴加完毕低温反应1h。自然升至室温反应。以tlc检测反应进度,展开剂为氯仿:甲醇=30:1。反应时间约为12h。补加无水二氯甲烷(50ml),称取甘氨酸甲酯盐酸盐(1.26g,10mmol,1equiv)加至上述反应体系,用恒压滴液漏斗向反应液中逐滴加入tea(1.5ml,20mmol,2equiv),滴加10min。滴加完毕室温反应12h。以tlc检测反应进度,展开剂为石油醚:乙酸乙酯=2:1(一滴乙酸)。反应结束后,用去离子水(3×30ml)萃取反应液,将有机层干燥,浓缩,得淡黄色油状液体,柱层析分离,柱层析条件,石油醚:乙酸乙酯=2:1,浓缩后得无色油状液体,收率为56%。化合物结构的仪器分析结果:1hnmr(400mhz,cdcl3),δ:7.34(t,2h,j=8.3hz,h-3,h-5),7.24(d,2h,j=7.7hz,h-2,h-6),7.18(t,1h,j=7.4hz,h-4),4.40(dt,2h,j=8.1,6.1hz,ch2ch2br),3.83(dd,2h,j=10.2,6.2hz,ch2nh),3.75(s,3h,ch3),3.73(dd,1h,j=11.8,6.2hz,nh),3.55(tdd,2h,j=6.2,2.4,0.6hz,ch2br);13cnmr(100mhz,cdcl3),δ:176.0,171.5,162.8,161.0,159.0,150.0,132.2,131.1,130.1,129.5,126.6,125.4,121.0,110.8,108.5,107.2,99.2,71.2,59.7,52.1,42.5;31pnmr(162mhz,cdcl3),δ:2.83。hrms(ei,m/z):c11h15brno5p[m]+计算值350.9871;实测值350.9873。
实施例1-2:在250ml三口烧瓶中加入白杨素(0.254g,1mmol,0.01m),然后加入丙酮(100ml)使其溶解,加入碳酸铯(0.488g,1.5mmol,1.5equiv),然后加入乙氧基甘氨酸氨基磷酸酯(1.840g,5mmol,5equiv),将反应置于50℃油浴中反应,tlc检测反应进程,展开剂为石油醚:乙酸乙酯=3:2,反应时间6~7d,反应结束后,停止搅拌。后处理:过滤除去不溶物,减压蒸除溶剂,得黄色油状液体,柱层析分离,柱层析条件为石油醚:乙酸乙酯=3:2,浓缩后得淡黄色固体,收率为10%。化合物结构的仪器分析结果:1hnmr(400mhz,dmso-d6),δ:12.82(s,1h,5-oh),8.10(d,2h,j=6.8hz,h-2′,h-6′),7.64(m,1h,h-4′),7.60(m,2h,j=6.8hz,h-3′,h-5′),7.35(t,2h,j=7.9hz,h-2″,h-6″),7.21(m,1h,h-4″),7.17(t,2h,j=7.9hz,h-3″,h-5″),7.05(s,1h,h-3),6.85(d,1h,j=2.1hz,h-8),6.42(d,1h,j=2.1hz,h-6),5.97(m,1h,nh),4.37(m,4h,-och2ch2o),3.69(dd,2h,j=14.1hz,7.2hz,-ch2),3.63(s,3h,-och3);13cnmr(100mhz,dmso-d6),δ:182.5,171.7,164.6,163.9,161.7,157.7,151.2,132.6,131.0,130.1,130.1,129.6,129.6,126.8,126.8,125.0,120.6,120.6,105.8,105.8,99.0,93.7,68.2,64.8,52.2,42.9;31pnmr(162mhz,cdcl3),δ:4.90。hrms(ei,m/z):c26h24bno9p[m]+计算值525.1189;实测值525.1180。
实施例2白杨素-7-乙氧基缬氨酸氨基磷酸酯的制备
合成方法同实施例1,其中步骤(1)中的甘氨酸甲酯盐酸盐以缬氨酸甲酯盐酸盐来代替,合成制得无色油状液体,收率为54%。化合物结构的仪器分析结果:1hnmr(400mhz,cdcl3),δ:7.30(m,2h,h-3,h-5),7.22(m,2h,h-2,h-6),7.14(m,1h,h-4),4.34(m,2h,-ch2o),3.85(m,1h,-nh),3.76(m,1h,-ch),3.68(2s,3h,-ch3o),3.50(m,2h,-ch2br),2.04(m,1h,-ch),0.90(m,6h,-ch(ch3)3);13cnmr(100mhz,cdcl3),δ:173.1,150.7,129.6,129.6,124.9,120.2,120.2,66.2,60.0,52.1,32.2,29.7,18.9,17.5;31pnmr(162mhz,cdcl3),δ:3.04。hrms(esi,m/z):c14h21brno5p[m+h]+计算值394.0413;实测值394.0411;最后合成制得淡黄色固体粉末,产率11%。化合物结构的仪器分析结果:1hnmr(400mhz,cdcl3),δ:12.72(s,1h,5-oh),7.89(m,2h,h-2′,h-6′),7.55(m,1h,h-3′,h-4′,h-5′),7.30(m,2h,h-2″,h-6″),7.22(m,1h,h-3″,h-5″),7.17(t,2h,j=7.9hz,h-4″),6.69(s,1h,h-3),6.50(d,1h,j=2.1hz,h-8),6.36(d,1h,j=2.1hz,h-6),4.45(m,2h,-ch2ch2o),4.27(m,2h,-ch2o),3.88(m,1h,nh),3.70(2d,3h,-och3),3.62(t,1h,-chnh),2.08(m,1h,-ch),0.92(m,6h,-(ch3)2);13cnmr(100mhz,cdcl3),δ:182.5,173.1,164.3,164.1,162.2,157.7,131.9,131.3,129.6,129.6,129.1,129.1,126.3,126.3,124.9,120.1,120.1,106.0,105.9,98.7,93.1,67.3,64.8,60.0,52.1,32.2,18.8,17.4,17.4;31pnmr(162mhz,cdcl3),δ:3.46。hrms(ei,m/z):c29h30no9p[m]+计算值567.1658;实测值567.1647。
实施例3白杨素-7-乙氧基亮氨酸氨基磷酸酯的制备
合成方法同实施例1,其中步骤(1)中的甘氨酸甲酯盐酸盐以亮氨酸甲酯盐酸来代替,合成制得无色油状液体,收率为54%;化合物结构的仪器分析结果:1hnmr(400mhz,cdcl3),δ:7.33-7.28(m,2h,h-3″,h-5″),7.23-7.19(m,2h,h-2″,h-6″),7.15-7.13(t,1h,j=7.2hz,h-4″),4.32(m,2h,-ch2ch2br),3.94(m,1h,-ch-nh),3.85(m,1h,-nh),3.66(2d,3h,-och3),3.48(m,2h,-ch2br),1.68(m,1h,-ch),1.49(m,2h,-ch2),0.87(m,6h,-ch(ch3)2);13cnmr(100mhz,cdcl3),δ:174.1,150.7,129.6,129.6,125.5,120.2,120.1,120.1,66.1,53.1,52.2,43.5,29.6,22.7,21.7;31pnmr(162mhz,cdcl3),δ:2.35。c15h23brno5p[m]+计算值407.0497;实测值407.0499。最后合成制得淡黄色固体粉末,产率11%;化合物结构的仪器分析结果:1hnmr(500mhz,dmso-d6),δ:12.80(2s,1h,5-oh),8.00(d,2h,j=7.2hz,h-2′,h-6′),7.56(m,3h,h-3′,h-4′,h-5′),7.33(t,2h,j=7.9hz,h-3″,h-5″),7.22(m,2h,j=7.9hz,h-2″,h-6″),7.15(t,1h,h-4″),7.00(s,1h,h-3),6.80(2d,1h,j=2.2hz,h-8),6.37(2d,1h,j=2.2hz,h-6),4.23(m,1h,nh),4.40(m,4h,-och2ch2o),3.86(m,1h,-ch),3.57(s,3h,7.2hz,-ch3),1.68(m,1h,-ch),1.49(m,2h,-ch2),0.87(m,6h,-ch(ch3)2);13cnmr(125mhz,dmso-d6),δ:182.0,173.6,164.2,163.5,161.2,157.3,150.7,132.1,132.1,130.6,129.5,129.5,129.1,126.4,126.4,124.5,120.1,120.1,105.4,105.1,98.6,93.3,67.7,53.1,52.2,43.5,29.6,22.7,21.7;31pnmr(202mhz,cdcl3),δ:3.23,3.43。hrms(esi,m/z):c30h32no9p[m+h]+计算值582.1876;实测值582.1887。
实施例4白杨素-7-乙氧基丙氨酸氨基磷酸酯的制备
合成方法同实施例1,其中步骤(1)中的甘氨酸甲酯盐酸盐以丙氨酸甲酯盐酸盐来代替,合成制得无色油状液体,收率为51%;化合物结构的仪器分析结果:1hnmr(400mhz,cdcl3),δ:7.31(m,2h,h-3,h-5),7.22(m,2h,h-2,h-6),7.15(t,1h,j=7.2hz,h-4),4.35(m,2h,-ch2o),4.18(2t,1h,-nh),4.04(m,1h,-ch),3.52(m,2h,-ch2br),3.69(2s,3h,-ch3o),1.38(2s,3h,-ch3);13cnmr(100mhz,cdcl3),δ:173.8,150.6,129.5,129.5,124.8,120.1,120.1,66.0,52.3,50.1,29.7,20.6;31pnmr(162mhz,cdcl3),δ:2.20。hrms(ei,m/z):c12h17brno5p[m]+计算值365.0028;实测值365.0021。最后合成制得淡黄色固体粉末,产率19%;化合物结构的仪器分析结果:1hnmr(500mhz,dmso-d6),δ:12.80(2s,1h,5-oh),8.07(d,2h,j=7.2hz,h-2′,h-6′),7.60(m,3h,h-3′,h-4′,h-5′),7.35(t,2h,j=7.9hz,h-3″,h-5″),7.22(m,2h,j=7.9hz,h-2″,h-6″),7.16(t,1h,h-4″),7.02(s,1h,h-3),6.82(2d,1h,j=2.2hz,h-8),6.40(2d,1h,j=2.2hz,h-6),6.07(m,1h,nh),4.42(m,4h,-och2ch2o),3.88(m,1h,-ch),3.59(s,3h,7.2hz,-ch3),1.24(2d,3h,-ch3);13cnmr(125mhz,dmso-d6),δ:182.0,173.6,164.2,163.5,161.2,157.3,150.7,132.1,132.1,130.6,129.5,129.5,129.1,126.4,126.4,124.5,120.1,120.1,105.4,105.1,98.6,93.3,67.7,64.3,51.8,49.7,19.6;31pnmr(202mhz,cdcl3),δ:3.79,3.54。hrms(ei,m/z):c27h26no9p[m]+计算值539.1345;实测值539.1340。
实施例5大豆苷元-4′-甲氧基-7-乙氧基甘氨酸氨基磷酸酯的制备
实施例5-1:在100ml三口瓶中加入大豆苷元(2.54g,10mmol,0.09m),然后加入无水甲醇(30ml)中,得到白色悬浊液,向反应体系中加入25%四丁基氢氧化铵水溶液(11.28ml,11mmol,1.1equiv),将反应置于25℃水浴中搅拌,白色固体逐渐消失,溶液澄清呈黄色。随着反应的进行,反应液中有黄色固体析出,反应24h后,原料转化完全,得到黄色悬浊液,停止反应进行后处理。后处理:减压抽滤,滤饼用甲醇/水(3/1,15ml)洗涤,干燥滤饼。干燥剂选用五氧化二磷。得到淡黄色固体,收率为81%。
实施例5-2:在250ml三口瓶中加入四丁基氢氧化铵大豆苷元(4.006g,8.093mmol,0.1m)于加入无水dmf(80ml),反应液为黄色悬浊液,油浴加热至50℃,加入k2co3(1.242g,9mmol,1.1equiv),再向反应液中加入2-溴乙醇(2.48ml,35mmol,4.3equiv),反应液澄清且呈黄色。薄层色谱法监测反应情况,展开条件为石油醚:丙酮=3:2,薄层色谱法检测原料无明显转化时进行后处理。后处理:将反应液转移至800ml冰盐水中,有大量白色固体析出,抽滤,并用去离子水洗涤,烘干。得到白色固体,收率为87%。化合物结构的仪器分析结果:1hnmr(400mhz,dmso-d6),δ:9.54(s,1h,4′-oh),8.36(s,1h,h-2),8.02(d,1h,j=2.2hz,h-5),7.40(d,2h,j=8.4hz,h-2′,h-6′),7.16(s,1h,h-8)7.08(d,1h,j=8.9hz,h-6),6.81(d,2h,j=8.4hz,h-3′,h-5′),4.96(t,1h,j=5.0hz,-oh),4.15(t,2h,j=4.4hz,-ch2o),3.77(m,2h,j=5.0hz,j=4.4hz,-ch2oh)。
实施例5-3:在100ml三口瓶中加入7-羟乙基大豆苷元(0.298g,1mmol,0.02m)于,加入无水丙酮(50ml),得悬浮液,称取k2co3(1.5mmol,0.207g,1.5equiv)溶于水(4ml)中,将碳酸钾的水溶液逐滴加到上述反应体系中,7-羟乙基大豆苷元逐渐溶解,滴加约10min。50℃条件下搅拌30min,加入ch3i(210μl,1.5mmol,1equiv)。薄层色谱法监测反应进程,展开条件为石油醚:丙酮=1:1。反应时间约24h,反应结束后,停止搅拌。后处理:过滤除去不溶物,滤液浓缩,加入冰水约50ml,析出大量白色固体,减压抽滤,真空干燥后得粗品。进一步柱层析分离,柱层析条件:二氯甲烷:乙酸乙酯=4:1,得白色固体,收率为86%。化合物结构的仪器分析结果:1hnmr(400mhz,dmso-d6),δ:8.42(s,1h,h-2),8.03(d,1h,j=8.88hz,h-5),7.53(d,2h,j=8.76hzh-2′,h-6′),7.17(d,1h,j=2.28hz,h-8),7.09(dd,1h,j=2.36hz,8.88hz,h-6),7.00(d,2h,h-3′,h-5′),4.98(t,1h,j=5.48hz,-oh),4.16(t,2h,j=4.68hz,-och2),3.79(s,3h,-och3),3.77(m,2h,j=5.48hz,4.68hz-ch2oh);13cnmr(100mhz,dmso-d6),δ:175.1,163.6,159.4,157.9,153.9,130.5,130.5,127.4,124.5,123.8,118.0,115.5,114.0,114.0,101.5,71.0,59.8,55.6。hrms(ei,m/z):c18h16o5[m+h]+计算值313.1071;实测值313.1067.
实施例5-4:在250ml单口瓶中加入7-羟乙基-4-甲氧基大豆苷元(0.312g,1mmol,0.0125m)于,加入无水二氯甲烷(80ml)使其溶解,用乙酸乙酯液氮将反应体系降温至-83.5℃,加入二氯磷酸苯酯(225μl,1.5mmol,1.5equiv),将tea(450μl,1.5mmol,1.5equiv)与无水二氯甲烷(2ml)的混合溶液中滴加至上述反应体系,滴加5min,滴加完毕低温反应1h。自然升至室温反应。以tlc检测反应进度,展开剂为二氯甲烷:乙酸乙酯=8:1。反约12h后,称取甘氨酸甲酯盐酸盐(0.251g,2mmol,2equiv)加至上述反应体系,取tea(300μl,2mmol,2equiv)于2ml二氯甲烷中滴加至上述反应体系,滴加5min。将反应置于39℃油浴中反应,tlc检测反应进程,展开剂为二氯甲烷:乙酸乙酯=4:1。反应时间约12h结束。后处理:去离子水(3×30ml)萃取反应液,将有机层干燥,浓缩,得淡黄色油状液体。柱层析分离,柱层析条件:二氯甲烷/乙酸乙酯(4/1),得白色固体,收率为41%。化合物结构的仪器分析结果:1hnmr(400mhz,acetone-d6),δ:8.18(s,1h,h-2),8.10(d,1h,h-5),7.56(d,2h,j=8.0hz,h-2′,h-6′),7.34(t,2h,j=8.0hz,h-3″,h-5″),7.28(d,2h,j=8.0hz,h-2″,h-6″),7.15(t,1h,j=8.0hz,h-4″),7.07(2d,1h,h-8),7.04(m,1h,h-6),6.97(d,2h,j=8hz,h-3′,h-5′),4.95(m,1h,nh),4.51(m,2h,-ch2ch2o),4.42(m,2h,-ch2ch2o),3.83(m,2h,-ch2),3.82(s,3h,-och3),3.66(s,3h,-ch3);13cnmr(400mhz,acetone-d6),δ:175.6,173.8,163.8,160.5,158.6,153.6,152.2,131.0,131.0,130.3,130.3,128.2,125.4,125.1,121.1,121.1,119.3,115.6,115.6,115.0,114.4,114.4,102.0,68.7,65.6,55.6,52.1,43.5;31pnmr(400mhz,acetone-d6),δ:4.11。hrms(ei,m/z):c27h26no9p[m]+计算值539.1345;实测值539.1346。
实施例6大豆苷元-4′-甲氧基-7-乙氧基缬氨酸氨基磷酸酯的制备
合成方法同实施例5,其中步骤(4)中的甘氨酸甲酯盐酸盐以缬氨酸甲酯盐酸盐来代替,合成制得白色固体,收率为8%;化合物结构的仪器分析结果:1hnmr(500mhz,acetone-d6),δ:8.19(s,1h,h-2),8.11(d,1h,h-5),7.56(d,2h,j=5.0hz,h-2′,h-6′),7.33(t,2h,j=5.0hz,h-3″,h-5″),7.27(t,2h,j=5.0hz,h-2″,h-6″),7.14(t,1h,j=5.0hz,h-4″),7.07(m,1h,h-8),7.04(m,1h,h-6),6.97(d,2h,j=5.0hz,h-3′,h-5′),4.86(m,1h,nh),4.49(m,2h,-ch2ch2o),4.42(m,2h,-ch2ch2o),3.84(s,3h,-och3),3.77(m,1h,-ch),3.65(2s,3h,-ch3),2.01(m,1h,-ch),0.91(m,6h,-ch(ch3)2);13cnmr(500mhz,acetone-d6),δ:175.6,173.8,163.9,160.5,158.6,153.6,152.2,131.0,131.0,130.3,130.3,128.2,125.3,125.2,121.2,121.2,119.4,115.6,114.4,114.4,102.0,68.7,65.6,61.2,55.6,52.1,32.7,19.4,18.2,18.2;31pnmr(500mhz,acetone-d6),δ:3.78。hrms(ei,m/z):c30h33no9p[m+h+]计算值582.1887;实测值582.1884。
实施例7大豆苷元-4′-甲氧基-7-乙氧基亮氨酸氨基磷酸酯的制备
合成方法同实施例5,其中步骤(4)中的甘氨酸甲酯盐酸盐以亮氨酸甲酯盐酸盐来代替,合成制得白色固体,收率为10%;化合物结构的仪器分析结果:1hnmr(400mhz,acetone-d6),δ:8.20(s,1h,h-2),8.12(d,1h,h-5),7.57(d,2h,j=8.0hz,h-2′,h-6′),7.34(t,2h,j=8.0hz,h-3″,h-5″),7.26(d,2h,j=8.0hz,h-2″,h-6″),7.16(t,1h,j=8.0hz,h-4″),7.09(2d,1h,h-8),7.06(m,1h,h-6),6.97(d,2h,j=8hz,h-3′,h-5′),4.92(m,1h,nh),4.51(m,2h,-ch2ch2o),4.43(m,2h,-ch2ch2o),3.99(m,1h,-ch),3.83(s,3h,-och3),3.65(s,3h,-ch3),1.68(m,1h,-ch),1.52(m,2h,-ch2),0.83(m,6h,-ch(ch3)2);13cnmr(100mhz,acetone-d6),δ:175.6,174.5,163.9,160.5,158.6,153.6,152.2,131.0,131.0,130.3,130.3,128.2,125.3,125.2,121.2,121.2,119.4,115.6,114.0,114.0,101.9,68.7,65.6,55.6,54.1,52.3,43.7,24.9,23.2,21.7,21.7;31pnmr(125mhz,acetone-d6),δ:3.44。hrms(ei,m/z):c31h34no9p[m]+计算值595.1971;实测值595.1961。
实施例8大豆苷元-4′-甲氧基-7-乙氧基丙氨酸氨基磷酸酯(14d)的制备
合成方法同实施例5,其中步骤(4)中的甘氨酸甲酯盐酸盐以丙氨酸甲酯盐酸盐来代替,合成制得白色固体,收率为18%;化合物结构的仪器分析结果:1hnmr(400mhz,acetone-d6),δ:8.22(s,1h,h-2),8.12(d,1h,h-5),7.58(d,2h,j=8.0hz,h-2′,h-6′),7.34(t,2h,j=8.0hz,h-3″,h-5″),7.26(d,2h,j=8.0hz,h-2″,h-6″),7.15(t,1h,j=8.0hz,h-4″),7.10(m,1h,h-8),7.08(m,1h,h-6),6.98(d,2h,j=8hz,h-3′,h-5′),4.92(m,1h,nh),4.47(m,2h,-ch2ch2o),4.43(m,2h,-ch2ch2o),4.03(m,1h,-ch),3.83(s,3h,-och3),3.65(s,3h,-ch3),1.35(2d,3h,-ch3)。13cnmr(100mhz,acetone-d6),δ:175.6,174.5,163.9,160.5,158.7,153.6,152.2,131.0,131.0,130.4,130.4,128.2,125.4,125.2,121.1,121.1,119.4,115.7,115.7,114.4,114.4,102.0,68.7,65.4,55.6,52.4,51.1,20.7。31pnmr(125mhz,acetone-d6),δ:2.91。hrms(ei,m/z):c28h28no9p[m]+计算值553.1502;实测值553.1496。
实施例9大豆苷元-7-羟乙基-4′-氨基磷酸酯衍生物的制备
实施例9-1:在250ml三口瓶中加入7-羟乙基大豆苷元(0.25m,0.298g,1mmol),然后加入dmf(4ml)溶解,滴加无水二氯甲烷(100ml)中,用乙酸乙酯/液氮将反应体系降温至-83.5℃,将tea(300μl,2mmol,2equiv)与二氯甲烷(2ml)混合溶液滴加至上述反应体系,滴加5min,滴加完毕低温反应1h。自然升至室温反应。以tlc检测反应进度,展开剂为二氯甲烷:乙酸乙酯=1:1。反应约9h后,原料转化完全,无需后处理直接进行下一步反应。
实施例9-2:称取丙氨酸甲酯盐酸盐(0.140g,1mmol,1equiv)加至上述反应体系,将tea(300μl,2mmol,2equiv)与二氯甲烷(2ml)混合溶液滴加至上述反应体系,滴加5min,加热至回流反应。以tlc监测反应进度,展开剂为二氯甲烷:乙酸乙酯=1:1。反应约12h后结束。后处理:去离子水(3×30ml)萃取反应液,将有机层干燥,浓缩,得淡黄色油状液体。柱层析分离,柱层析条件:二氯甲烷/乙酸乙酯(2/1),得白色固体,收率为30%。1hnmr(400mhz,acetone-d6),δ:8.30(s,1h,h-2),8.11(d,1h,h-5),7.66(d,2h,j=8hz,h-2′,h-6′),7.42(t,2h,j=8hz,h-3″,h-5″),7.38(t,2h,j=8hz,h-2″,h-6″),7.32(t,1h,j=8hz,h-4″),7.30(m,1h,h-8),7.21(m,1h,h-6),7.09(d,2h,j=8hz,h-3′,h-5′),5.26(t,1h,-oh),4.26(m,2h,-ch2ch2o),4.17(m,1h,nh),4.09(m,1h,-ch),3.94(m,2h,-ch2ch2o),3.63(2d,3h,-och3),1.35(2d,3h,-ch3).13cnmr(100mhz,acetone-d6),δ:174.6,173.3,163.7,157.8,153.4,151.2,130.3,130.3,129.6,129.6,129.1,127.2,124.9,123.7,120.4,120.4,120.0,120.0,118.1,115.0,115.0,100.9,70.6,60.2,51.6,50.5,19.8.31pnmr(125mhz,acetone-d6),δ:2.01。hrms(ei,m/z):c27h26no9nap[m+na]+计算值562.1237;实测值562.1244。
实施例10本发明衍生物的抗增殖活性
癌细胞株:mcf7人乳腺癌细胞株、hepg2人肝癌细胞株与l-o2正常肝细胞株,用10%胎牛血清的dmem培养基传代,在细胞培养箱中培养。
测试方法:四甲基偶氮唑盐(mtt)法
测试化合物:9种黄酮磷酰胺衍生物及2种黄酮底物(如表1)
实验方法:取对数生长期的mcf7乳腺癌细胞、hepg2人肝癌细胞与正常肝细胞,分别以3×103个/孔的密度接种于96孔板中,100μl/孔,于37℃、5%co2培养箱中孵育24小时后,每孔加入如表1所示的化合物,每个化合物各设六种浓度梯度,每个浓度设4个复孔,以培养液为阴性对照,在37℃、5%co2培养箱中继续孵育。48h后加入0.5%mtt10μl/孔,孵育4h后弃上清,加入二甲基亚砜200μl/孔。酶标检测仪测定每孔的a490值,取4孔的平均值,按如下公式计算不同浓度化合物的细胞生长抑制率,细胞生长抑制率=[a490对照-a490实验]/a490对照×100%。根据浓度-抑制率曲线,求得半数抑制剂量ic50。
表1mtt法测定部分目标化合物抑制肿瘤细胞生长实验结果
体外抗肿瘤药物筛选实验,由表1可以看出,经过修饰得到的黄酮烷氧基氨基磷酸酯衍生物对于hepg2细胞及mcf7细胞的ic50值均小于100μmol/l,说明该系列化合物对于肿瘤细胞均有不同程度的抗增殖作用,且抗增殖活性相对于其黄酮母体均有显著提高。另外,大多数化合物对l-o2细胞的细胞毒性较小,说明这些化合物在hepg2细胞及l-o2细胞之间,具有一定的选择性。
白杨素经过修饰后得到的白杨素磷酰氨基酸酯衍生物对hepg2细胞及mcf7细胞的抗肿瘤活性没有明显差异,该系列化合物ic50多数集中在30μmmol/l~50μmmol/l。其中,白杨素-7-乙氧基亮氨酸氨基磷酸酯(mcf7,ic50=22.7±2.7μm;hepg2,ic50=39.9±1.2μm;l-o2,ic50=77.4±5.2μm)抗增殖活性最好。
大豆苷元经过修饰后得到的磷酰氨基酸酯衍生物对hepg2细胞及mcf7细胞ic50多数集中在10μmmol/l~30μmmol/l,相对于白杨素烷氧基氨基磷酸酯衍生物而言,大豆苷元烷氧基氨基磷酸酯衍生物的抗癌细胞增殖活性相对较高。其中,大豆苷元-7-乙氧基丙氨酸氨基磷酸酯(mcf7,ic50=6.0±0.2μm;hepg2,ic50=2.6±0.24μm;l-o2,ic50>100μm)表现出良好的抗增殖活性。大豆苷元烷氧基氨基磷酸酯衍生物对hepg2细胞相对于l-o2细胞具有显著的选择性。
实施例11本发明衍生物的抗增殖活性机制
实施例11-1:
癌细胞株:hepg2人肝癌细胞株,用10%胎牛血清的dmem培养基传代,在细胞培养箱中培养。
测试方法:annexinv-fitc细胞凋亡检测实验
测试化合物:大豆苷元-7-乙氧基丙氨酸氨基磷酸酯
实验方法:
种板:取对数生长期的细胞,将细胞消化下来,制备成单细胞悬液,以每孔1.5×104个细胞接种到6孔板上,每孔体积1ml。置于培养箱培养;
加药:培养24h后,细胞贴壁,达到正常生长状态。采用逐级稀释法将药物储备液稀释至所需终作用浓度。然后加入至6孔板中,每孔1ml。继续置于培养箱中培养;
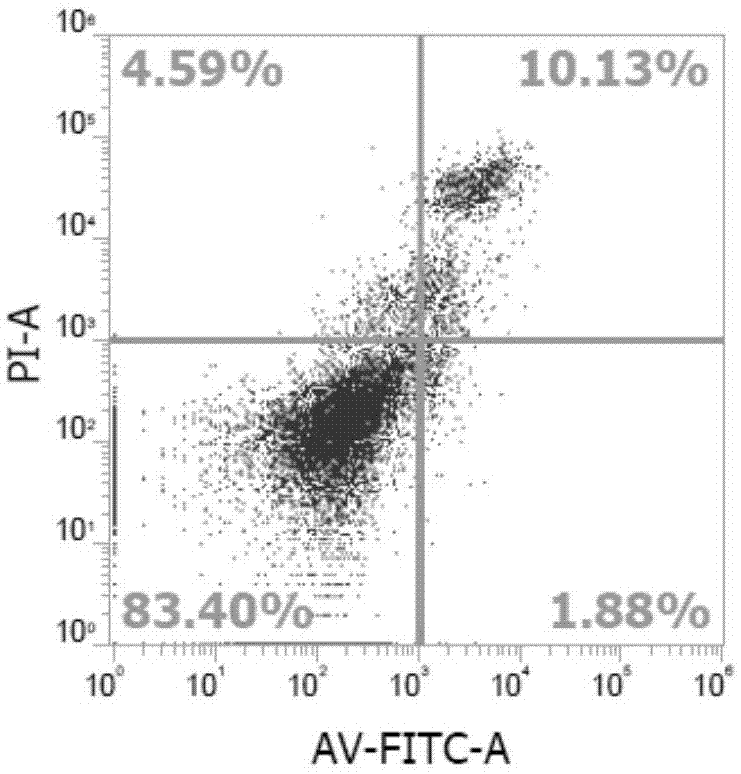
annexinv-fitc/pi实验:培养48h后,将6孔板中的培养液转移至5mlep管中。pbs洗涤,吸走,加入0.5ml胰酶消化液,消化2min。将5mlep管中相应的培养液加至6孔板中对应的孔中,吹打,收集细胞至5mlep管中,1000g离心5分钟,弃上清,加入195μlbindingbuffer,培养箱中孵育10min。加入5μlannexinv-fitc,轻轻混匀,避光孵育15min。加入10μlpi,200μlpbs稀释,流式细胞仪检测。我们可以看到化合物大豆苷元-7-乙氧基丙氨酸氨基磷酸酯诱导10.13%的hepg2细胞发生晚期凋亡,如图1化合物大豆苷元-7-乙氧基丙氨酸氨基磷酸酯对hepg2细胞的凋亡影响。
实施例11-2:
癌细胞株:hepg2人肝癌细胞株,用10%胎牛血清的dmem培养基传代,在细胞培养箱中培养。
测试方法:凋亡蛋白3(caspase3)活性检测实验
测试化合物:大豆苷元-7-乙氧基丙氨酸氨基磷酸酯
实验方法:
种板:取对数生长期的细胞,将细胞消化下来,制备成单细胞悬液,以每孔1.5×104个细胞接种到6孔板上,每孔体积1ml。置于培养箱培养。
加药:培养24h后,细胞贴壁,达到正常生长状态。采用逐级稀释法将药物储备液稀释至所需终作用浓度。然后加入至6孔板中,每孔1ml。继续置于培养箱中培养。
caspase3活性检测实验:培养48h后,将6孔板中的培养液转移至5mlep管中。pbs洗涤,吸走,加入0.5ml胰酶消化液,消化2min。将5mlep管中相应的培养液加至6孔板中对应的孔中,吹打,收集细胞至5mlep管中,1000g离心5分钟,弃上清。加入1mlpbs吹打,转移到1.5mlep管中,1000g离心5分钟,弃上清。加入70μl裂解液,冰浴裂解15min,4℃,16000~20000g离心15min。取上清液50μl于96孔板中,然后加入缓冲溶液40μl,2mmac-devd-pna溶液10μl。培养箱中孵育24h。
检测:选择405nm波长,在酶标仪上测定各孔光吸收值,记录结果。
数据处理:用测得数据计算出加药组相对于对照组的百分比,由下图,我们可以发现化合物大豆苷元-7-乙氧基丙氨酸氨基磷酸酯激活的caspase3的水平是对照组的1.24倍。如图2大豆苷元-7-乙氧基丙氨酸氨基磷酸酯对hepg2细胞caspase3的影响。
实施例11-3:
蛋白:hsp60(热休克蛋白60)、hsp10(热休克蛋白10)及mdh(苹果酸脱氢酶)。
测试方法:hsp60抑制活性检测实验
测试化合物:大豆苷元-7-乙氧基丙氨酸氨基磷酸酯
实验方法:
mdh失活:室温下,取4μlmdh(17.1μm)与12μl12.5mm稀硫酸混合,25℃孵育2小时得到失活的苹果酸脱氢酶(de-mdh)。
30℃,hsp60(4μm)和hsp10(8μm)以1:2在重组缓冲液(reconstruction)中混合孵育90min。
de-mdh恢复活性:取1μlde-mdh与hsp60和hsp10混合液混合,加入(或不加待测化合物),30℃孵育30min后在340nm检测吸光值的变化。结果表明大豆苷元-7-乙氧基丙氨酸氨基磷酸酯在浓度为58nm时对于hsp60的抑制率是34%;119nm时对于hsp60的抑制率是58%。如图3化合物大豆苷元-7-乙氧基丙氨酸氨基磷酸酯对于hsp60的抑制活性。
大豆苷元-7-乙氧基丙氨酸氨基磷酸酯可以诱导hepg2细胞的晚期凋亡,加药孵育24h后,大豆苷元-7-乙氧基丙氨酸氨基磷酸酯诱导10.13%的hepg2细胞发生晚期凋亡。大豆苷元-7-乙氧基丙氨酸氨基磷酸酯组的激活的caspase3的水平是对照组的1.24倍,同样也说明了其诱导了hepg2细胞发生凋亡。因此推测大豆苷元-7-乙氧基丙氨酸氨基磷酸酯可能通过抑制hsp60的活性,实现诱导肿瘤细胞凋亡。
- 还没有人留言评论。精彩留言会获得点赞!
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法